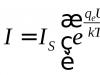Raspored elektrona na energetskim ljuskama ili nivoima je zapisan korišćenjem elektronskih formula hemijskih elemenata. Elektronske formule ili konfiguracije pomažu u predstavljanju atomske strukture elementa.
Atomska struktura
Atomi svih elemenata sastoje se od pozitivno nabijenog jezgra i negativno nabijenih elektrona, koji se nalaze oko jezgre.
Elektroni se nalaze na različitim nivoima energije. Što je elektron udaljeniji od jezgra, to ima više energije. Veličina energetskog nivoa određena je veličinom atomske orbitale ili orbitalnog oblaka. Ovo je prostor u kojem se elektron kreće.

Rice. 1. Opća struktura atom.
Orbitale mogu imati različite geometrijske konfiguracije:
- s-orbitale- sferni;
- p-, d- i f-orbitale- u obliku bučice, ležeći u različitim ravnima.
Na prvom energetskom nivou svakog atoma uvijek postoji s-orbitala sa dva elektrona (izuzetak je vodonik). Počevši od drugog nivoa, s- i p-orbitale su na istom nivou.

Rice. 2. s-, p-, d i f-orbitale.
Orbitale postoje bez obzira na prisustvo elektrona u njima i mogu biti popunjene ili prazne.
Pisanje formule
Elektronske konfiguracije atoma hemijskih elemenata pišu se prema sljedećim principima:
- svaki energetski nivo odgovara serijski broj, označeno arapskim brojem;
- iza broja slijedi slovo koje označava orbitalu;
- Iznad slova je napisan superskript, koji odgovara broju elektrona u orbitali.
Primjeri snimanja:
- kalcijum -
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 ;
- kiseonik -
1s 2 2s 2 2p 4 ;
- ugljenik -
1s 2 2s 2 2p 2 .
Periodni sistem vam pomaže da zapišete elektronsku formulu. Broj energetskih nivoa odgovara broju perioda. Naboj atoma i broj elektrona označeni su atomskim brojem elementa. Broj grupe pokazuje koliko je valentnih elektrona na vanjskom nivou.
Uzmimo Na kao primjer. Natrijum je u prvoj grupi, u trećem periodu, na broju 11. To znači da atom natrijuma ima pozitivno nabijeno jezgro (sadrži 11 protona), oko kojeg se nalazi 11 elektrona na tri energetska nivoa. Na vanjskom nivou nalazi se jedan elektron.
Podsjetimo to prvo nivo energije sadrži s orbitalu sa dva elektrona, a druga sadrži s i p orbitale. Ostaje samo da popunite nivoe i dobijete punu evidenciju:
11 Na) 2) 8) 1 ili 1s 2 2s 2 2p 6 3s 1 .
Radi praktičnosti, kreirane su posebne tablice elektronskih formula elementa. Za dugo periodni sistem formule su takođe naznačene u svakoj ćeliji elementa.

Rice. 3. Tabela elektronskih formula.
Radi kratkoće, elementi napisani u uglastim zagradama su elektronska formulašto se poklapa sa početkom formule elementa. Na primjer, elektronska formula magnezijuma je 3s 2, neona je 1s 2 2s 2 2p 6. dakle, kompletna formula magnezijum - 1s 2 2s 2 2p 6 3s 2. 4.6. Ukupno primljenih ocjena: 195.
Hemikalije su ono od čega je sačinjen svijet oko nas.
Osobine svake hemijske supstance dele se na dve vrste: hemijske, koje karakterišu njenu sposobnost stvaranja drugih supstanci, i fizičke, koje se objektivno posmatraju i mogu se posmatrati odvojeno od hemijskih transformacija. Na primjer, fizička svojstva tvari su njeno agregacijsko stanje (čvrsto, tekuće ili plinovito), toplinska provodljivost, toplinski kapacitet, topljivost u različitim medijima (voda, alkohol, itd.), gustina, boja, okus itd.
Transformacije nekih hemikalije u drugim supstancama se nazivaju hemijske pojave ili hemijske reakcije. Treba napomenuti da postoje i fizičke pojave koje su očigledno praćene promjenama nekih fizička svojstva tvari bez pretvaranja u druge tvari. Fizičke pojave, na primjer, uključuju otapanje leda, smrzavanje ili isparavanje vode, itd.
Činjenica da se hemijski fenomen javlja tokom bilo kojeg procesa može se zaključiti posmatranjem karakteristične karakteristike hemijske reakcije, kao što su promjena boje, sedimentacija, evolucija plina, toplina i/ili svjetlost.
Na primjer, zaključak o pojavi kemijskih reakcija može se donijeti promatranjem:
Formiranje sedimenta prilikom ključanja vode, koji se u svakodnevnom životu naziva kamenac;
Oslobađanje topline i svjetlosti kada vatra gori;
Promjena boje reza svježe jabuke na zraku;
Formiranje gasnih mehurića tokom fermentacije testa itd.
Najmanje čestice tvari koje se gotovo ne mijenjaju tijekom kemijskih reakcija, već se samo spajaju jedna s drugom na nov način, nazivaju se atomi.
Sama ideja o postojanju takvih jedinica materije nastala je još u prošlosti antičke Grčke u umovima antičkih filozofa, što zapravo objašnjava porijeklo pojma "atom", budući da "atomos" u doslovnom prijevodu s grčkog znači "nedjeljiv".
Međutim, suprotno ideji starogrčkih filozofa, atomi nisu apsolutni minimum materije, tj. oni sami imaju složenu strukturu.
Svaki atom se sastoji od takozvanih subatomskih čestica - protona, neutrona i elektrona, označenih simbolima p +, n o i e -. Gornji indeks u korištenoj notaciji označava da proton ima jedinični pozitivan naboj, elektron ima jedinični negativan naboj, a neutron nema naboj.
Što se tiče kvalitativne strukture atoma, u svakom atomu svi protoni i neutroni su koncentrisani u takozvanom jezgru, oko kojeg elektroni formiraju elektronsku ljusku.
Proton i neutron imaju skoro iste mase, tj. m p ≈ m n, a masa elektrona je skoro 2000 puta manja od mase svakog od njih, tj. m p / m e ≈ m n / m e ≈ 2000.
Budući da je osnovno svojstvo atoma njegova električna neutralnost, a naboj jednog elektrona jednak je naboju jednog protona, iz ovoga možemo zaključiti da je broj elektrona u bilo kojem atomu jednak broju protona.
Na primjer, donja tabela prikazuje mogući sastav atoma:
Vrsta atoma sa istim nuklearnim nabojem, tj. sa istim brojem protona u jezgrima naziva se hemijski element. Dakle, iz gornje tabele možemo zaključiti da atom1 i atom2 pripadaju jednom hemijskom elementu, a atom3 i atom4 drugom hemijskom elementu.
Svaki hemijski element ima svoje ime i pojedinačni simbol koji se čita na određeni način. Tako, na primjer, najjednostavniji hemijski element, čiji atomi sadrže samo jedan proton u jezgru, naziva se "vodik" i označava se simbolom "H", koji se čita kao "pepeo", a hemijski element sa nuklearni naboj od +7 (tj. koji sadrži 7 protona) - "dušik", ima simbol "N", koji se čita kao "en".
Kao što se može vidjeti iz gornje tabele, atomi jednog hemijski element mogu se razlikovati u broju neutrona u jezgrima.
Atomi koji pripadaju istom kemijskom elementu, ali imaju različit broj neutrona i, kao rezultat, masu, nazivaju se izotopi.
Na primjer, hemijski element vodonik ima tri izotopa - 1 H, 2 H i 3 H. Indeksi 1, 2 i 3 iznad simbola H označavaju ukupan broj neutrona i protona. One. Znajući da je vodonik hemijski element, koji se odlikuje činjenicom da se u jezgrima njegovih atoma nalazi jedan proton, možemo zaključiti da u izotopu 1 H uopće nema neutrona (1-1 = 0), u izotop 2 H - 1 neutron (2-1=1) i u izotopu 3 H - dva neutrona (3-1=2). Budući da, kao što je već spomenuto, neutron i proton imaju iste mase, a masa elektrona je zanemarljivo mala u odnosu na njih, to znači da je izotop 2 H skoro dvostruko teži od izotopa 1 H, a izotop 3 H izotop je čak tri puta teži. Zbog tako velikog raspršenosti u masama izotopa vodika, izotopima 2 H i 3 H su čak dodijeljena posebna pojedinačna imena i simboli, što nije tipično ni za jedan drugi kemijski element. Izotop 2H je nazvan deuterijum i dobio je simbol D, a 3H izotop je dobio ime tricijum i dobio simbol T.
Ako uzmemo masu protona i neutrona kao jedno, a zanemarimo masu elektrona, u stvari gornji lijevi indeks, pored ukupnog broja protona i neutrona u atomu, može se smatrati njegovom masom, a stoga se ovaj indeks zove maseni broj i označeni su simbolom A. Budući da su protoni odgovorni za naboj jezgra bilo kojeg atoma, a naboj svakog protona se konvencionalno smatra jednakim +1, broj protona u jezgru naziva se broj naboja (Z ). Označavanjem broja neutrona u atomu kao N, odnos između masenog broja, broja naboja i broja neutrona može se matematički izraziti kao:
Prema modernim konceptima, elektron ima dualnu prirodu (čestica-talas). Ima svojstva i čestice i talasa. Poput čestice, elektron ima masu i naboj, ali u isto vrijeme, tok elektrona, poput vala, karakterizira sposobnost difrakcije.
Za opisivanje stanja elektrona u atomu koriste se koncepti kvantne mehanike, prema kojima elektron nema određenu putanju kretanja i može se nalaziti u bilo kojoj tački u prostoru, ali s različitim vjerovatnoćama.
Područje prostora oko jezgra gdje je najvjerovatnije da će se naći elektron naziva se atomska orbitala.
Atomska orbitala može imati raznih oblika, veličina i orijentacija. Atomska orbitala se još naziva i oblak elektrona.
Grafički, jedna atomska orbitala obično se označava kao kvadratna ćelija:
Kvantna mehanika ima izuzetno složen matematički aparat, pa se u okviru školskog kursa hemije razmatraju samo posledice kvantnomehaničke teorije.
Prema ovim posljedicama, svaka atomska orbitala i elektron koji se u njoj nalazi u potpunosti karakteriziraju 4 kvantna broja.
- Glavni kvantni broj, n, određuje ukupnu energiju elektrona u datoj orbitali. Raspon vrijednosti glavnog kvantnog broja - sve prirodni brojevi, tj. n = 1,2,3,4, 5, itd.
- Orbitalni kvantni broj - l - karakterizira oblik atomske orbitale i može uzeti bilo koju cjelobrojnu vrijednost od 0 do n-1, gdje je n, podsjetimo, glavni kvantni broj.
Orbitale sa l = 0 se nazivaju s-orbitale. s-orbitale su sfernog oblika i nemaju usmjerenost u prostoru:
Orbitale sa l = 1 se nazivaju str-orbitale. Ove orbitale imaju oblik trodimenzionalne osmice, tj. oblik koji se dobija rotiranjem osmice oko ose simetrije, a spolja podseća na bučicu:
Orbitale sa l = 2 se nazivaju d-orbitale, i sa l = 3 – f-orbitale. Njihova struktura je mnogo složenija.
3) Magnetski kvantni broj – m l – određuje prostornu orijentaciju određene atomske orbitale i izražava projekciju ugaonog momenta orbite na smjer magnetno polje. Magnetski kvantni broj m l odgovara orijentaciji orbitale u odnosu na smjer vektora jakosti vanjskog magnetskog polja i može imati bilo koje cjelobrojne vrijednosti od –l do +l, uključujući 0, tj. ukupna količina moguće vrijednosti jednako (2l+1). Tako, na primjer, za l = 0 m l = 0 (jedna vrijednost), za l = 1 m l = -1, 0, +1 (tri vrijednosti), za l = 2 m l = -2, -1, 0, + 1 , +2 (pet vrijednosti magnetnog kvantnog broja) itd.
Tako, na primjer, p-orbitale, tj. orbitale sa orbitalnim kvantnim brojem l = 1, koje imaju oblik "trodimenzionalne osmice", odgovaraju tri vrijednosti magnetskog kvantnog broja (-1, 0, +1), koje zauzvrat odgovaraju tri pravca okomita jedan na drugi u prostoru.
4) Spin kvantni broj (ili jednostavno spin) – m s – može se uslovno smatrati odgovornim za smjer rotacije elektrona u atomu; Elektroni s različitim spinovima su označeni vertikalnim strelicama usmjerenim u različitim smjerovima: ↓ i .
Skup svih orbitala u atomu koje imaju isti glavni kvantni broj naziva se energetski nivo ili elektronska ljuska. Bilo koji proizvoljni energetski nivo sa nekim brojem n sastoji se od n 2 orbitala.
Skup orbitala sa istim vrijednostima glavnog kvantnog broja i orbitalnog kvantnog broja predstavlja energetski podnivo.
Svaki energetski nivo, koji odgovara glavnom kvantnom broju n, sadrži n podnivoa. Zauzvrat, svaki energetski podnivo sa orbitalnim kvantnim brojem l sastoji se od (2l+1) orbitala. Dakle, s podnivo se sastoji od jedne s orbitale, p podnivo se sastoji od tri p orbitale, d podnivo se sastoji od pet d orbitala, a f podnivo se sastoji od sedam f orbitala. Budući da se, kao što je već spomenuto, jedna atomska orbitala često označava jednom kvadratnom ćelijom, s-, p-, d- i f-podnivoi se mogu grafički prikazati na sljedeći način:
Svaka orbitala odgovara pojedinačnom striktno definisanom skupu od tri kvantna broja n, l i m l.
Raspodjela elektrona među orbitalama naziva se konfiguracija elektrona.
Punjenje atomskih orbitala elektronima odvija se u skladu sa tri uslova:
- Princip minimalne energije: Elektroni ispunjavaju orbitale počevši od najnižeg energetskog podnivoa. Redoslijed podnivoa po redoslijedu povećanja njihove energije je sljedeći: 1s<2s<2p<3s<3p<4s≤3d<4p<5s≤4d<5p<6s…;
Da biste lakše zapamtili ovaj slijed popunjavanja elektronskih podnivoa, vrlo je zgodna sljedeća grafička ilustracija:
- Paulijev princip: Svaka orbitala ne može sadržavati više od dva elektrona.
Ako postoji jedan elektron u orbitali, onda se naziva nesparen, a ako su dva, onda se nazivaju elektronski par.
- Hundovo pravilo: najstabilnije stanje atoma je ono u kojem, unutar jednog podnivoa, atom ima najveći mogući broj nesparenih elektrona. Ovo najstabilnije stanje atoma naziva se osnovno stanje.
U stvari, gore navedeno znači da će, na primjer, postavljanje 1., 2., 3. i 4. elektrona u tri orbitale p-podnivoa biti izvedeno na sljedeći način:
Punjenje atomskih orbitala od vodika, koji ima broj naelektrisanja 1, u kripton (Kr), sa brojem naelektrisanja 36, izvršiće se na sledeći način:
Takav prikaz reda punjenja atomskih orbitala naziva se energetski dijagram. Na osnovu elektronskih dijagrama pojedinih elemenata moguće je zapisati njihove takozvane elektronske formule (konfiguracije). Tako, na primjer, element sa 15 protona i, kao posljedicu, 15 elektrona, tj. fosfor (P) će imati sljedeći energetski dijagram:
Kada se pretvori u elektronsku formulu, atom fosfora će poprimiti oblik:
15 P = 1s 2 2s 2 2p 6 3s 2 3p 3
Brojevi normalne veličine lijevo od simbola podnivoa pokazuju broj energetskog nivoa, a superskripti desno od simbola podnivoa pokazuju broj elektrona u odgovarajućem podnivou.
Ispod su elektronske formule prvih 36 elemenata periodnog sistema D.I. Mendeljejev.
| period | Artikal br. | simbol | Ime | elektronska formula |
| I | 1 | H | vodonik | 1s 1 |
| 2 | On | helijum | 1s 2 | |
| II | 3 | Li | litijum | 1s 2 2s 1 |
| 4 | Budi | berilijum | 1s 2 2s 2 | |
| 5 | B | bor | 1s 2 2s 2 2p 1 | |
| 6 | C | ugljenik | 1s 2 2s 2 2p 2 | |
| 7 | N | azot | 1s 2 2s 2 2p 3 | |
| 8 | O | kiseonik | 1s 2 2s 2 2p 4 | |
| 9 | F | fluor | 1s 2 2s 2 2p 5 | |
| 10 | Ne | neon | 1s 2 2s 2 2p 6 | |
| III | 11 | Na | natrijum | 1s 2 2s 2 2p 6 3s 1 |
| 12 | Mg | magnezijum | 1s 2 2s 2 2p 6 3s 2 | |
| 13 | Al | aluminijum | 1s 2 2s 2 2p 6 3s 2 3p 1 | |
| 14 | Si | silicijum | 1s 2 2s 2 2p 6 3s 2 3p 2 | |
| 15 | P | fosfor | 1s 2 2s 2 2p 6 3s 2 3p 3 | |
| 16 | S | sumpor | 1s 2 2s 2 2p 6 3s 2 3p 4 | |
| 17 | Cl | hlor | 1s 2 2s 2 2p 6 3s 2 3p 5 | |
| 18 | Ar | argon | 1s 2 2s 2 2p 6 3s 2 3p 6 | |
| IV | 19 | K | kalijum | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 |
| 20 | Ca | kalcijum | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 | |
| 21 | Sc | skandij | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 | |
| 22 | Ti | titanijum | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 | |
| 23 | V | vanadij | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3 | |
| 24 | Cr | hrom | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 ovdje posmatramo skok jednog elektrona sa s on d podnivo | |
| 25 | Mn | mangan | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 | |
| 26 | Fe | gvožđe | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 | |
| 27 | Co | kobalt | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 7 | |
| 28 | Ni | nikla | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 8 | |
| 29 | Cu | bakar | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 ovdje posmatramo skok jednog elektrona sa s on d podnivo | |
| 30 | Zn | cink | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 | |
| 31 | Ga | galijum | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 1 | |
| 32 | Ge | germanijum | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 2 | |
| 33 | As | arsenik | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 3 | |
| 34 | Se | selen | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 4 | |
| 35 | Br | brom | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 | |
| 36 | Kr | kripton | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 |
Kao što je već spomenuto, u svom osnovnom stanju, elektroni u atomskim orbitalama nalaze se po principu najmanje energije. Međutim, u prisustvu praznih p-orbitala u osnovnom stanju atoma, često, davanjem viška energije na njega, atom se može prevesti u takozvano pobuđeno stanje. Na primjer, atom bora u svom osnovnom stanju ima elektronsku konfiguraciju i energetski dijagram sljedećeg oblika:
5 B = 1s 2 2s 2 2p 1
I u pobuđenom stanju (*), tj. Kada se atomu bora prenese neka energija, njegova elektronska konfiguracija i energetski dijagram će izgledati ovako:
5 B* = 1s 2 2s 1 2p 2
U zavisnosti od toga koji je podnivo u atomu zadnji popunjen, hemijski elementi se dele na s, p, d ili f.
Pronalaženje s, p, d i f elemenata u tabeli D.I. Mendeljejev:
- S-elementi imaju zadnji s-podnivo koji treba popuniti. Ovi elementi uključuju elemente glavnih (lijevo u ćeliji tabele) podgrupa grupa I i II.
- Za p-elemente, p-podnivo je popunjen. P-elementi obuhvataju poslednjih šest elemenata svakog perioda, osim prvog i sedmog, kao i elemente glavnih podgrupa grupa III-VIII.
- d-elementi se nalaze između s- i p-elemenata u velikim periodima.
- f-elementi se nazivaju lantanidi i aktinidi. Oni su navedeni na dnu tabele D.I. Mendeljejev.
Sastav atoma.
Atom se sastoji od atomsko jezgro I elektronska školjka.
Jezgro atoma sastoji se od protona ( p+) i neutroni ( n 0). Većina atoma vodika ima jezgro koje se sastoji od jednog protona.
Broj protona N(p+) jednak je nuklearnom naboju ( Z) i redni broj elementa u prirodnom nizu elemenata (i u periodnom sistemu elemenata).
N(str +) = Z
Zbir neutrona N(n 0), označen jednostavno slovom N, i broj protona Z pozvao maseni broj i označava se slovom A.
A = Z + N
Elektronski omotač atoma sastoji se od elektrona koji se kreću oko jezgra ( e -).
Broj elektrona N(e-) u elektronskoj ljusci neutralnog atoma jednak je broju protona Z u svojoj srži.
Masa protona je približno jednaka masi neutrona i 1840 puta masi elektrona, tako da je masa atoma skoro jednaka masi jezgra.
Oblik atoma je sferičan. Poluprečnik jezgra je približno 100.000 puta manji od radijusa atoma.
Hemijski element- vrsta atoma (kolekcija atoma) sa istim nuklearnim nabojem (sa istim brojem protona u jezgru).
Izotop- skup atoma istog elementa sa istim brojem neutrona u jezgru (ili vrsta atoma sa istim brojem protona i istim brojem neutrona u jezgru).
Različiti izotopi se međusobno razlikuju po broju neutrona u jezgri svojih atoma.
Oznaka pojedinačnog atoma ili izotopa: (E - simbol elementa), na primjer: .
Struktura elektronske ljuske atoma
Atomska orbitala- stanje elektrona u atomu. Simbol za orbitalu je . Svaka orbitala ima odgovarajući elektronski oblak.
Orbitale stvarnih atoma u osnovnom (nepobuđenom) stanju su četiri tipa: s, str, d I f.
Elektronski oblak- dio prostora u kojem se elektron može naći sa vjerovatnoćom od 90 (ili više) posto.
Napomena: ponekad se pojmovi "atomska orbitala" i "elektronski oblak" ne razlikuju, nazivajući oba "atomska orbitala".
Elektronska ljuska atoma je slojevita. Elektronski sloj formirani od elektronskih oblaka iste veličine. Formiraju se orbitale jednog sloja elektronski („energetski“) nivo, njihove energije su iste za atom vodonika, ali različite za druge atome.
Orbitale istog tipa su grupisane u elektronski (energija) podnivoi:
s-podnivo (sastoji se od jednog s-orbitale), simbol - .
str-podnivo (sastoji se od tri str
d-podnivo (sastoji se od pet d-orbitale), simbol - .
f-podnivo (sastoji se od sedam f-orbitale), simbol - .
Energije orbitala istog podnivoa su iste.
Prilikom označavanja podnivoa, simbolu podnivoa dodaje se broj sloja (elektronskog nivoa), na primjer: 2 s, 3str, 5d znači s-podnivo drugog nivoa, str-podnivo trećeg nivoa, d-podnivo petog nivoa.
Ukupan broj podnivoa na jednom nivou jednak je broju nivoa n. Ukupan broj orbitala na jednom nivou je jednak n 2. Shodno tome, ukupan broj oblaka u jednom sloju je takođe jednak n 2 .
Oznake: - slobodna orbitala (bez elektrona), - orbitala sa nesparenim elektronom, - orbitala sa elektronskim parom (sa dva elektrona).
Redosled kojim elektroni ispunjavaju orbitale atoma određen je sa tri zakona prirode (formulacije su date pojednostavljeno):
1. Princip najmanje energije - elektroni popunjavaju orbitale po rastućoj energiji orbitala.
2. Paulijev princip - ne može biti više od dva elektrona u jednoj orbitali.
3. Hundovo pravilo - unutar podnivoa elektroni prvo popunjavaju prazne orbitale (jednu po jednu), a tek nakon toga formiraju elektronske parove.
Ukupan broj elektrona u elektronskom nivou (ili elektronskom sloju) je 2 n 2 .
Distribucija podnivoa po energiji se izražava na sljedeći način (redom povećanja energije):
1s, 2s, 2str, 3s, 3str, 4s, 3d, 4str, 5s, 4d, 5str, 6s, 4f, 5d, 6str, 7s, 5f, 6d, 7str ...
Ovaj niz je jasno izražen energetskim dijagramom:

Raspodjela elektrona atoma po nivoima, podnivoima i orbitalama (elektronska konfiguracija atoma) može se prikazati kao formula elektrona, energetski dijagram ili, jednostavnije, kao dijagram elektronskih slojeva („elektronski dijagram“).
Primjeri elektronske strukture atoma:










Valentni elektroni- elektroni atoma koji mogu učestvovati u formiranju hemijskih veza. Za bilo koji atom, to su svi vanjski elektroni plus oni predspoljašnji elektroni čija je energija veća od one vanjskih. Na primjer: atom Ca ima 4 vanjska elektrona s 2, oni su također valentni; atom Fe ima 4 vanjska elektrona s 2 ali on ima 3 d 6, dakle atom gvožđa ima 8 valentnih elektrona. Valentna elektronska formula atoma kalcija je 4 s 2, a atomi gvožđa - 4 s 2 3d 6 .
Periodni sistem hemijskih elemenata D. I. Mendeljejeva
(prirodni sistem hemijskih elemenata)
Periodični zakon hemijskih elemenata(moderna formulacija): svojstva hemijskih elemenata, kao i jednostavnih i složenih supstanci koje oni formiraju, periodično zavise od vrednosti naboja atomskih jezgara.
Periodni sistem- grafički izraz periodnog zakona.
Prirodni niz hemijskih elemenata- niz hemijskih elemenata raspoređenih prema rastućem broju protona u jezgrama njihovih atoma, ili, što je isto, prema rastućem naboju jezgara ovih atoma. Atomski broj elementa u ovoj seriji jednak je broju protona u jezgri bilo kojeg atoma ovog elementa.
Tabela hemijskih elemenata konstruisana je tako što se „seče“ prirodni niz hemijskih elemenata periodi(horizontalni redovi tabele) i grupisanja (vertikalne kolone tabele) elemenata sa sličnom elektronskom strukturom atoma.
U zavisnosti od načina na koji kombinujete elemente u grupe, tabela može biti dugog perioda(elementi sa istim brojem i vrstom valentnih elektrona skupljaju se u grupe) i kratak period(elementi sa istim brojem valentnih elektrona skupljaju se u grupe).
Grupe tablica kratkog perioda podijeljene su u podgrupe ( main I strana), koji se podudara sa grupama dugoperiodične tablice.
Svi atomi elemenata istog perioda imaju isti broj elektronskih slojeva, jednak broju perioda.
Broj elemenata u periodima: 2, 8, 8, 18, 18, 32, 32. Većina elemenata osmog perioda je dobijena umjetno, posljednji elementi ovog perioda još nisu sintetizirani. Svi periodi osim prvog počinju elementom koji stvara alkalni metal (Li, Na, K, itd.) i završava se elementom koji stvara plemeniti gas (He, Ne, Ar, Kr, itd.).
U tabeli kratkog perioda ima osam grupa, od kojih je svaka podeljena u dve podgrupe (glavnu i sekundarnu), u tabeli dugog perioda ima šesnaest grupa koje su numerisane rimskim brojevima slovima A ili B, za primjer: IA, IIIB, VIA, VIIB. Grupa IA tabele dugog perioda odgovara glavnoj podgrupi prve grupe tabele kratkog perioda; grupa VIIB - sekundarna podgrupa sedme grupe: ostali - slično.
Karakteristike hemijskih elemenata se prirodno menjaju u grupama i periodima.
U periodima (sa povećanjem serijskog broja)
- nuklearno punjenje se povećava
- povećava se broj vanjskih elektrona,
- radijus atoma se smanjuje,
- povećava se snaga veze između elektrona i jezgra (jonizacijska energija),
- povećava se elektronegativnost,
- pojačavaju se oksidacijska svojstva jednostavnih supstanci ("nemetaličnost"),
- redukujuća svojstva jednostavnih supstanci slabe ("metaličnost"),
- slabi osnovni karakter hidroksida i odgovarajućih oksida,
- povećava se kiseli karakter hidroksida i odgovarajućih oksida.
U grupama (sa povećanjem serijskog broja)
- nuklearno punjenje se povećava
- radijus atoma se povećava (samo u A-grupama),
- jačina veze između elektrona i jezgra se smanjuje (energija jonizacije; samo u A-grupama),
- smanjuje se elektronegativnost (samo u A-grupama),
- slabe oksidaciona svojstva jednostavnih supstanci ("nemetaličnost"; samo u A-grupama),
- pojačavaju se redukciona svojstva jednostavnih supstanci ("metaličnost"; samo u A-grupama),
- povećava se osnovni karakter hidroksida i odgovarajućih oksida (samo u A-grupama),
- slabi kiseli karakter hidroksida i odgovarajućih oksida (samo u A-grupi),
- smanjuje se stabilnost vodikovih spojeva (povećava se njihova redukujuća aktivnost; samo u A-grupama).
Zadaci i testovi na temu "Tema 9. "Struktura atoma. Periodični zakon i periodični sistem hemijskih elemenata D. I. Mendeljejeva (PSHE) "."
- Periodični zakon - Periodični zakon i struktura atoma 8–9 razredi
Morate znati: zakone punjenja orbitala elektronima (princip najmanje energije, Paulijev princip, Hundovo pravilo), strukturu periodnog sistema elemenata.Morate biti u stanju da: odredite sastav atoma na osnovu položaja elementa u periodnom sistemu, i obrnuto, da pronađete element u periodnom sistemu, znajući njegov sastav; prikazati dijagram strukture, elektronsku konfiguraciju atoma, jona i, obrnuto, odrediti položaj kemijskog elementa u PSCE iz dijagrama i elektronske konfiguracije; okarakterizirati element i tvari koje on formira prema njegovom položaju u PSCE-u; određuju promjene poluprečnika atoma, svojstva hemijskih elemenata i supstanci koje oni formiraju unutar jednog perioda i jedne glavne podgrupe periodnog sistema.
Primjer 1. Odredite broj orbitala na trećem nivou elektrona. Koje su to orbitale?
Za određivanje broja orbitala koristimo formulu N orbitale = n 2 gdje n- broj nivoa. N orbitale = 3 2 = 9. Jedan 3 s-, tri 3 str- i pet 3 d-orbitale.Primjer 2. Odredite koji atom atoma ima elektronsku formulu 1 s 2 2s 2 2str 6 3s 2 3str 1 .
Da biste odredili o kojem se elementu radi, morate saznati njegov atomski broj, koji je jednak ukupnom broju elektrona atoma. U ovom slučaju: 2 + 2 + 6 + 2 + 1 = 13. Ovo je aluminijum.Nakon što se uvjerite da ste naučili sve što vam je potrebno, nastavite s izvršavanjem zadataka. Želimo vam uspjeh.
Preporučeno čitanje:- O. S. Gabrielyan i drugi Hemija 11. razred. M., Drfa, 2002;
- G. E. Rudzitis, F. G. Feldman. Hemija 11. razred. M., Obrazovanje, 2001.
- Prvo zapisujemo hemijski znak. element, pri čemu u donjem lijevom dijelu znaka označavamo njegov serijski broj.
- Zatim, po broju perioda (iz kojeg je element) odredimo broj energetskih nivoa i povučemo toliki broj lukova pored znaka hemijskog elementa.
- Zatim, prema broju grupe, broj elektrona na vanjskom nivou je upisan ispod luka.
- Na 1. nivou, maksimalno moguće je 2, na drugom ih je već 8, na trećem - čak 18. Počinjemo stavljati brojeve pod odgovarajuće lukove.
- Broj elektrona na pretposljednjem nivou mora se izračunati na sljedeći način: broj elektrona koji su već dodijeljeni oduzima se od serijskog broja elementa.
- Ostaje da naš dijagram pretvorimo u elektronsku formulu:
- Zapisujemo hemijski element i njegov serijski broj. Broj pokazuje broj elektrona u atomu.
- Hajde da napravimo formulu. Da biste to uradili, morate saznati broj energetskih nivoa; osnova za određivanje je broj perioda elementa.
- Nivoe dijelimo na podnivoe.
U nastavku možete vidjeti primjer kako pravilno sastaviti elektronske formule hemijskih elemenata.
- prvo popunjavamo s-podnivo, a zatim p-, d- b f-podnivo;
- prema pravilu Klečkovskog, elektroni ispunjavaju orbitale po redu porasta energije ovih orbitala;
- prema Hundovom pravilu, elektroni unutar jednog podnivoa zauzimaju slobodne orbitale jednu po jednu, a zatim formiraju parove;
- Prema Paulijevom principu, u jednoj orbitali nema više od 2 elektrona.
Elektronska formula hemijskog elementa pokazuje koliko elektronskih slojeva i koliko elektrona je sadržano u atomu i kako su raspoređeni među slojevima.
Da biste sastavili elektronsku formulu hemijskog elementa, morate pogledati periodni sistem i koristiti informacije dobijene za ovaj element. Atomski broj elementa u periodnom sistemu odgovara broju elektrona u atomu. Broj elektronskih slojeva odgovara broju perioda, broj elektrona u poslednjem elektronskom sloju odgovara broju grupe.
Mora se imati na umu da prvi sloj sadrži najviše 2 elektrona 1s2, drugi - maksimalno 8 (dva s i šest p: 2s2 2p6), treći - maksimalno 18 (dva s, šest p i deset d: 3s2 3p6 3d10).
Na primjer, elektronska formula ugljika: C 1s2 2s2 2p2 (redni broj 6, period broj 2, grupa broj 4).
Elektronska formula za natrijum: Na 1s2 2s2 2p6 3s1 (redni broj 11, period broj 3, grupa broj 1).
Da biste provjerili da li je elektronska formula ispravno napisana, možete pogledati web stranicu www.alhimikov.net.
Na prvi pogled, sastavljanje elektronske formule za hemijske elemente može izgledati kao prilično kompliciran zadatak, ali sve će postati jasno ako se pridržavate sljedeće sheme:
- prvo pišemo orbitale
- Ispred orbitala ubacujemo brojeve koji označavaju broj energetskog nivoa. Ne zaboravite formulu za određivanje maksimalnog broja elektrona na energetskom nivou: N=2n2
Kako možete saznati broj energetskih nivoa? Pogledajte samo periodni sistem: ovaj broj je jednak broju perioda u kojem se element nalazi.
- Iznad ikone orbite pišemo broj koji označava broj elektrona koji se nalaze u ovoj orbitali.
Na primjer, elektronska formula za skandij će izgledati ovako.
Zadatak sastavljanja elektronske formule za hemijski element nije najlakši.
Dakle, algoritam za sastavljanje elektronskih formula elemenata je sljedeći:
Evo elektronskih formula nekih hemijskih elemenata:
Trebate kreirati elektronske formule kemijskih elemenata na ovaj način: trebate pogledati broj elementa u periodnom sistemu i tako saznati koliko elektrona ima. Zatim morate saznati broj nivoa, koji je jednak periodu. Zatim se pišu i popunjavaju podnivoi:
Prije svega, morate odrediti broj atoma prema periodnom sistemu.

Da biste sastavili elektronsku formulu, trebat će vam periodični sistem Mendeljejeva. Pronađite tamo svoj hemijski element i pogledajte period - on će biti jednak broju energetskih nivoa. Broj grupe će numerički odgovarati broju elektrona na posljednjem nivou. Broj elementa će biti kvantitativno jednak broju njegovih elektrona. Takođe morate znati da prvi nivo ima najviše 2 elektrona, drugi - 8, a treći - 18.
Ovo su glavne tačke. Osim toga, na internetu (uključujući i našu web stranicu) možete pronaći informacije sa gotovom elektronskom formulom za svaki element, tako da možete sami testirati.
Sastavljanje elektronskih formula hemijskih elemenata je veoma složen proces, ne možete to učiniti bez posebnih tabela, a potrebno je da koristite čitav niz formula. Ukratko, za kompajliranje morate proći kroz ove faze:
Potrebno je sastaviti orbitalni dijagram u kojem će postojati koncept kako se elektroni međusobno razlikuju. Dijagram naglašava orbitale i elektrone.
Elektroni su ispunjeni u nivoima, odozdo prema gore, i imaju nekoliko podnivoa.
Dakle, prvo saznajemo ukupan broj elektrona datog atoma.
Popunjavamo formulu prema određenoj shemi i zapisujemo je - to će biti elektronska formula.

Na primjer, za dušik ova formula izgleda ovako, prvo se pozabavimo elektronima:

I zapišite formulu:

Da razumem princip sastavljanja elektronske formule hemijskog elementa, prvo morate odrediti ukupan broj elektrona u atomu prema broju u periodnom sistemu. Nakon toga morate odrediti broj energetskih nivoa, uzimajući kao osnovu broj perioda u kojem se element nalazi.
Nivoi se zatim razlažu na podnivoe, koji su ispunjeni elektronima na osnovu principa najmanje energije.
Ispravnost svog razmišljanja možete provjeriti gledajući, na primjer, ovdje.
Sastavljanjem elektronske formule hemijskog elementa možete saznati koliko elektrona i elektronskih slojeva ima u određenom atomu, kao i redosled njihove distribucije među slojevima.
Prvo, odredimo atomski broj elementa prema periodičnoj tablici, on odgovara broju elektrona. Broj elektronskih slojeva označava broj perioda, a broj elektrona u posljednjem sloju atoma odgovara broju grupe.
Konvencionalni prikaz distribucije elektrona u oblaku elektrona po nivoima, podnivoima i orbitalama naziva se elektronska formula atoma.
Pravila zasnovana na|na osnovu| koji|koji| našminkati|predati| elektronske formule
1. Princip minimalne energije: što manje energije ima sistem, to je stabilniji.
2. Vladavina Klečkovskog: distribucija elektrona između nivoa i podnivoa elektronskog oblaka odvija se u rastućem redosledu vrednosti zbira glavnog i orbitalnog kvantnog broja (n + 1). Ako su vrijednosti jednake (n + 1), prvi se popunjava podnivo koji ima manju vrijednost n.
1 s 2 s p 3 s p d 4 s p d f 5 s p d f 6 s p d f 7 s p d f Broj nivoa n 1 2 2 3 3 3 4 4 4 4 5 5 5 5 6 6 6 6 7 7 7 7 Orbital 1* 0 1 2 2 3 0 1 2 3 0 1 2 3 0 1 2 3 kvantni broj
n+1|
1 2 3 3 4 5 4 5 6 7 5 6 7 8 6 7 8 9 7 8 9 10
Serija Klečkovskog
3. 1* - vidi tabelu br. 2. Hundovo pravilo
: pri popunjavanju orbitala jednog podnivoa, postavljanje elektrona sa paralelnim spinovima odgovara najnižem energetskom nivou.
Kompilacija|prolazi| elektronske formule
Potencijalni niz: 1 s 2 s p 3 s p d 4 s p d f 5 s p d f 6 s p d f 7 s p d f
1 2 3 3 4 5 4 5 6 7 5 6 7 8 6 7 8 9 7 8 9 10
Redoslijed punjenja Elektronika 1s 2 2s 2 p 6 3s 2 p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 ..
(n+l|) 1 2 3 3 4 4 5 5 5 6 6 6 7 7 7 7 8.
Elektronska formula 1s 2 2s 2 p 6 3s 2 p 6 d 10 4s 2 p 6 d 10 f 14 5s 2 p 6 d 10 f 14 6s 2 p 6 d 10 f 14 7s 2 p 6 d 10 f 14 8...
(n+1|) 1 2 3 3 4 5 4 5 6 7 5 6 7 8 6 7 8 9 7 8 9 10
Informativni sadržaj elektronskih formula
1. Položaj elementa u periodičnoj|periodici| sistem.
2. Mogući stepeni| oksidacija elementa.
3. Hemijski karakter elementa.
4. Sastav|magacin| i svojstva veza elemenata.
Položaj elementa u periodičnom periodu|periodično|Sistem D.I. Mendeljejeva:
A) broj perioda, u kojem se element nalazi, odgovara broju nivoa na kojima se nalaze elektroni;
b) broj grupe, kojem pripada dati element, jednak je zbiru valentnih elektrona. Valentni elektroni za atome s- i p-elemenata su elektroni vanjskog nivoa; za d – elemente to su elektroni spoljašnjeg nivoa i nepopunjeni podnivo prethodnog nivoa.
V) elektronska porodica određen simbolom podnivoa na koji stiže posljednji elektron (s-, p-, d-, f-).
G) podgrupa određena pripadanjem elektronskoj porodici: s - i p - elementi zauzimaju glavne podgrupe, a d - elementi - sekundarne, f - elementi zauzimaju odvojene dijelove u donjem dijelu periodnog sistema (aktinidi i lantanidi).
2. Mogući stepeni| oksidacija elemenata.
Oksidacijsko stanje je naboj koji atom dobija kada odustane ili dobije elektrone.
Atomi koji daju elektrone dobijaju pozitivan naboj, koji je jednak broju predatih elektrona (naboj elektrona (-1)
Z E 0 – ne Z E + n
Atom koji je dao elektrone pretvara se u kation(pozitivno naelektrisani jon). Proces uklanjanja elektrona iz atoma naziva se proces jonizacije. Energija potrebna za izvođenje ovog procesa naziva se energija jonizacije ( Eion, eV).
Prvi koji se odvajaju od atoma su elektroni vanjskog nivoa, koji nemaju par u orbiti – nespareni. U prisustvu slobodnih orbitala unutar jednog nivoa, pod uticajem vanjske energije, elektroni koji su formirali parove na ovom nivou se ne uparuju, a zatim se svi zajedno razdvajaju. Proces rasparivanja, koji nastaje kao rezultat apsorpcije dijela energije od strane jednog od elektrona para i njegovog prijelaza na viši podnivo, naziva se proces ekscitacije.
Najveći broj elektrona koji atom može donirati jednak je broju valentnih elektrona i odgovara broju grupe u kojoj se element nalazi. Naboj koji atom dobije nakon što izgubi sve svoje valentne elektrone naziva se najviše oksidaciono stanje atom.
Nakon otpuštanja|otpuštanja| valentni nivo vanjski postaje|postaje| nivo koji|šta| prethodila valentnosti. Ovo je nivo potpuno ispunjen elektronima, i stoga|i stoga| energetski stabilan.
Atomi elemenata koji imaju od 4 do 7 elektrona na vanjskom nivou postižu energetski stabilno stanje ne samo doniranjem elektrona, već i njihovim dodavanjem. Kao rezultat, formira se nivo (.ns 2 p 6) - stabilno stanje inertnog gasa.
Atom koji je dodao elektrone dobija negativanstepenoksidacija– negativni naboj, koji je jednak broju prihvaćenih elektrona.
Z E 0 + ne Z E - n
Broj elektrona koje atom može dodati jednak je broju (8 –N|), gdje je N broj grupe u kojoj|koja| lociran element (ili broj valentnih elektrona).
Proces dodavanja elektrona atomu je praćen oslobađanjem energije, što se naziva afinitet prema elektronu (Esaffinity,eB).