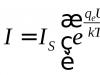Avak Avakyan

Javljam hemijske “vijesti”. Moji protivnici, pokušavajući da stvore “razorna opovrgavanja” mojih drokinskih geoloških otkrića, u svojim opusima navode da koncentrovana sumporna kiselina navodno ne reaguje sa krečnjacima i mramorima, pa sam, dakle, toliko “neobrazovan” i “generalno lud” da “ u cjelini” ja ne znam ovu “opšte poznatu istinu”. Kao opravdanje navode ideju da, navodno, sumporna kiselina stvara gips, koji, kao nerastvorljivo jedinjenje, prekriva krečnjak ili mermer filmom koji ga štiti od dalje akcije kiseline i stoga "trenutačno blokira" ovu reakciju. Ovaj „biser“ prvi je izrazio Dmitrij Lvovič Brizgalov (vaspitač u vrtiću; na internetu mi anonimno piše „slop“); zatim je istu ideju objavio Boris Mihajlovič Lobastov (student geologa iz Krasnojarska), formulišući je sa posebnim patosom: „u geologiji se studije o prisutnosti karbonata provode pomoću hlorovodonične kiseline, čija koncentracija ne prelazi 10%. Zašto ne koristiti sumpornu kiselinu, posebno u visokoj koncentraciji, jer je jača? Stvar je u tome da reakcija sumporne kiseline i kalcita (kalcijum karbonata) proizvodi vrlo slabo rastvorljivo jedinjenje - kalcijum sulfat (aka gips), koji trenutno potpuno prekriva površinu karbonata i zaustavlja samim tim i reakcija." (riječ " zaustavlja“, istakao je podebljanim).
Sva frka je zbog činjenice da sam koristio sumpornu kiselinu od 93% koncentracije (“akumulatorsku kiselinu”) da testiram Drokino stijene na prisustvo karbonata (prvenstveno kalcita), iako su “prema uputama” zvanični geolozi “propisani » Za ovaj test koristite 10% hlorovodonične kiseline. Vidjevši da radim testove sa pogrešnom kiselinom, moji kritičari su me napali pokušavajući da dokažu da kiselina koju sam koristio navodno nije reagovala sa kalcitom i da sam zbog toga neznalica, a svi moji geološki rezultati u okolini Drokina - glupost od šarlatana.
U pravilu sam jednostavno previše lijen da odgovorim na ovakve "bisere": na kraju krajeva, ne govorimo o složenim hemijskim egzotikama, već o banalnim osnovama iz školskog udžbenika. Ali pošto su moji nesretni kritičari počeli vatreno umnožavati ovaj "biser" i strasno ga "repostirati" sa ciljem da diskredituju sav moj rad u svim oblastima, našao sam vremena, CAPTURED ovu hemijsku reakciju na VIDEO i objavio ovo VIDEO na nekoliko servera; ovdje kliknite na izbor (na prvom linku - DOWNLOAD ):
Trajanje - malo više od tri minuta. Prvo, prikazana je varijanta ove reakcije pipetiranjem kiseline na uglačanu mramornu površinu; zatim se ista reakcija prikazuje u epruveti (komad ovog mermera se stavlja u epruvetu sa kiselinom). Za mermer - HVALA Igoru Jurijeviču Tabakajevu (ovo je bitka, odnosno fragment, sa groblja Badalyk; ne bojte se: niko nije počinio vandalizam na groblju, ovo je upravo bitka). Mramor (pravi, grobljanski) je najinertniji oblik kalcita (sa kredom ova reakcija ide još brže). Dakle - evo video činjenice: ova reakcija DOLAZI (uprkos Bryzgalovu i Lobastovu)! Samo što moji navodno "visokoobrazovani" protivnici "u oči" ne znaju da, prvo, gips i čista voda iako je slabo, vidljivo je rastvorljiv; i drugo, može da reaguje sa sumpornom kiselinom, prvo da formira kalcijum HIDROSULFAT Ca(HSO 4) 2, a zatim i asocirani CaSO 4 × 3H 2 SO 4, a oba ova jedinjenja su RASTVARNA (vidi, na primer, „Analitička hemija kalcijum; strana 11"; ili "Kurs analitička hemija. Tom jedan. Kvalitativna analiza; F.P. Treadwell, W.T. Goll; 1946; str. 292") i formiraju se što je veća koncentracija kiseline. Dakle, u višku koncentrirane sumporne kiseline “mỳti” CaSO 4 NEĆETE vidjeti: ispostaviće se bistro rešenje Ca(HSO 4) 2 i CaSO 4 × 3H 2 SO 4.
P.S. Iznenađujuća je „bezobraznost“ i takvih kritičara i čitalaca koji se s njima slažu. Pa, zar je zaista tako teško uzeti i provjeriti? Uostalom, ni mramor ni sumporna kiselina 93% nisu ni nedostatak ni zabranjeni proizvodi.
"Hemija. 8. razred." O.S. Gabrielyan (GDZ)
Praktični rad br. 4 (4) | Znakovi hemijskih reakcija. Reakcije razmjene
Eksperiment 1. “Kalcinacija bakarne žice i interakcija bakar (II) oksida sa sumpornom kiselinom”
Obavljanje posla:
Bakarnu žicu uvodimo u plamen plamenika, bakar se zagrijava i oksidira na zraku:
Dogodila se hemijska reakcija (nastao talog) koja je rezultirala stvaranjem crne prevlake - bakrenog (II) oksida.
Očistite sve naslage koje su nastale na listu papira. Ponovimo eksperiment nekoliko puta. Dobiveni plak stavite u epruvetu i u nju ulijte otopinu sumporne kiseline, zagrijte smjesu. Sav prah će se otopiti, otopina će postati plava:
Došlo je do hemijske reakcije (talog se rastvorio, boja sistema se promenila) i nastao je bakar (II) sulfat.
Eksperiment 2. “Interakcija mramora sa kiselinom”
Obavljanje posla:
Stavili su komad mramora u čašu i ulili hlorovodoničnu kiselinu u čašu, tek toliko da pokrije komad; Posmatramo oslobađanje mjehurića plina:
Dogodila se hemijska reakcija (oslobađanje gasa), mermer se rastvorio i CO 2 je oslobođen. U staklo su unijeli upaljenu krhotinu i ona se ugasila jer CO 2 ne podržava sagorijevanje.
Eksperiment 3. “Interakcija gvožđe(III) hlorida sa kalijum tiocijanatom.”
Obavljanje posla:
U epruvetu se sipa 2 ml rastvora željeznog hlorida, a zatim nekoliko kapi rastvora kalijum tiocijanata, rastvor postaje svetlo crven:
Došlo je do hemijske reakcije (boja se promenila sistemi).
Eksperiment 4. “Interakcija natrijum sulfata sa barijum hloridom.”
Obavljanje posla:
U epruvetu je sipano 2 ml rastvora natrijum sulfata, zatim je dodato nekoliko kapi barijum hlorida. Promatramo taloženje bijelog finokristalnog taloga:
Došlo je do hemijske reakcije (formira se talog).
Zaključak: Znaci reakcija razmene: 1) promena boje reakcionog sistema; 2) taloženje u reakcionom sistemu; 3) ispuštanje gasa ureakcioni sistem.
Praktični rad uključuje četiri eksperimenta.
Iskustvo 1
Kalcinacija bakarne žice i interakcija bakar (II) oksida sa sumpornom kiselinom
Upalite alkoholnu lampu (plinski gorionik). Uzmite bakrenu žicu kleštima za lončić i stavite je u vatru. Nakon nekog vremena skinite žicu sa plamena i očistite sve crne naslage koje su se stvorile na njoj na listu papira. Ponovite eksperiment nekoliko puta. Dobijeni crni talog stavite u epruvetu i u nju ulijte rastvor sumporne kiseline. Zagrijte smjesu. Šta posmatraš?
Da li je nova supstanca nastala kada je bakar zagrejan? Zapišite jednačinu hemijske reakcije i odredite njen tip na osnovu broja i sastava početne
tvari i produkti reakcije. Koje ste znakove hemijske reakcije uočili? Je li nastala nova tvar kada je bakrov (II) oksid reagirao sa sumpornom kiselinom? Odredite vrstu reakcije na osnovu broja i sastava polaznih materijala i produkta reakcije i zapišite njenu jednačinu.
1. Prilikom kalcinacije bakarne žice, bakar će oksidirati:

i nastaje crni bakar(II) oksid. Ovo je složena reakcija.
2. Rezultirajući bakar (II) oksid se rastvara u sumpornoj kiselini, rastvor postaje plava boja, formira se bakar (II) sulfat:
Ovo je reakcija razmjene.
Interakcija mramora sa kiselinom
Stavite 1-2 komada mramora u malu čašu. Sipajte dovoljno hlorovodonične kiseline u čašu da prekrije komade. Zapalite iver i unesite ga u čašu.
Da li se nove supstance stvaraju kada mermer reaguje sa kiselinom? Koji su znakovi hemijske reakcije jesi li gledao Zapišite jednačinu kemijske reakcije i navedite njen tip na osnovu broja i sastava polaznih supstanci i produkta reakcije.
1. Mramor otopljen u hlorovodoničnoj kiselini, došlo je do hemijske reakcije:

Iskustvo 3
Reakcija gvožđe (III) hlorida sa kalijum tiocijanatom
U epruvetu sipajte 2 ml rastvora gvožđe (III) hlorida, a zatim nekoliko kapi rastvora kalijum tiocijanata KSCN - soli kiseline HSCN, sa kiselim ostatkom SCN -.
Koji znaci prate ovu reakciju? Zapišite njegovu jednadžbu i vrstu reakcije na osnovu broja i sastava polaznih materijala i produkta reakcije.
Praktični rad br. 4. Hemija 8. razred (na udžbenik Gabrielyan O.S.)
Znakovi hemijskih reakcija
Cilj: proučavati znakove hemijskih reakcija, konsolidovati znanja o vrstama hemijskih reakcija.Oprema : epruvete, stalak za epruvete, grijač, šibice, držač epruvete, čaša od 50 ml, klešta za lonce, bakarna žica, iver, list papira, lopatica.
reagensi: rastvori sumporne kiseline, gvožđe (III) hlorida, kalijum tiocijanata, kalijum karbonata, kalcijum hlorida; mermer, hlorovodonična kiselina.
Iskustvo 1.
Kalcinacija bakrene žice i interakcija bakar (II) oksida sa sumpornom kiselinom.
Radni nalog:
1) Upalite grijač
Uzmite bakrenu žicu pomoću klešta za lonce i stavite je u vatru.
Nakon nekog vremena skinite žicu sa plamena i očistite sve crne naslage koje su se stvorile na njoj na listu papira.
Ponavljamo eksperiment nekoliko puta.
Uočljive pojave:
Tokom procesa zagrijavanja, crvena bakarna žica postaje prekrivena crnim premazom, tj. formira se nova supstanca.
Jednačina reakcije:
2Cu + O 2 = 2CuO
Ovo je složena reakcija.
zaključak:
2) Dobijeni crni premaz stavite u epruvetu.
Dodajte mu otopinu sumporne kiseline i pažljivo zagrijte.
Uočljive pojave:
Crni prah se rastvara, rastvor postaje zelenkasto-plav, tj. nastaju nove supstance.
Jednačina reakcije:
2CuO + H 2 SO 4 = CuSO 4 + H 2 O
Ovo je reakcija razmjene.
zaključak:
promena boje je znak hemijske reakcije.
Iskustvo 2.
Interakcija mramora sa kiselinom.
Stavite 1-2 komada mermera u čašu.
U čašu dodajte hlorovodoničnu kiselinu tako da komadi budu prekriveni njom.
Uočljive pojave:
dolazi do brzog oslobađanja bezbojnog plina, "ključanja" otopine.
Upalimo baklju i unesemo je u čašu.
Uočljive pojave:
svjetlo se gasi.
To znači da je nova tvar ugljični dioksid.
Jednačina reakcije:
Ovo je reakcija razmjene.
zaključak:
Oslobađanje gasa je znak hemijske reakcije.
Iskustvo 3.
U epruvetu sipajte 2 ml rastvora gvožđe (III) hlorida FeCl 3, a zatim nekoliko kapi rastvora kalijum tiocijanata KSCN.
Uočljive pojave:
rastvor postaje krvavo crven.
Jednačina reakcije:
Ovo je reakcija razmjene.
zaključak:
promena boje je znak hemijske reakcije.
Iskustvo 4.
Reakcija natrijum karbonata sa kalcijum hloridom.
Radni nalog:
U epruvetu sipajte 2 ml rastvora natrijum karbonata Na 2 CO 3 .
Dodajte nekoliko kapi rastvora kalcijum hlorida CaCl2.
Uočljive pojave:
formira se bijeli talog.
Jednačina reakcije:
Ovo je reakcija razmjene.
zaključak:
Padavine su znak hemijske reakcije.
Opšti zaključak o radu: Prilikom izvođenja praktičnog rada proučavani su znaci hemijskih reakcija i konsolidovana znanja o vrstama hemijskih reakcija.