LABORATORNÍ EXPERIMENTY NA TÉMA: „GENETICKÝ VZTAH MEZI UHLOVODÍKY, ALKOHOLY, ALDEHYDY A KYSELINAMI“
Nasycené uhlovodíky
Z nasycených uhlovodíků škola podrobně studuje metan jako látku složením a strukturou nejjednodušší, pro praktické seznámení nejdostupnější a jako chemická surovina a palivo velký ekonomický význam.
Experimenty s prvním studovaným v organická chemie látky, musí být dodávány v dostatečném množství a se zvláštní péčí z metodologického hlediska, protože musí ukázat nové aspekty experimentu ve studiu organické chemie. Zde bude možné experimentálně stanovit složení a molekulární vzorec látek, což je první krok při určování strukturních vzorců organické sloučeniny.
METAN.
Pořadí experimentů s metanem může být různé. V zásadě bude určeno tím, zda učitel zahájí téma získáváním metanu a poté provede experimenty ke studiu jeho vlastností s využitím látky získané v hodině, nebo použije předem připravený metan, aby jasně dodržel posloupnost studia metanu. otázky - nejprve zvažte fyzikální vlastnosti látky tedy Chemické vlastnosti, aplikaci látky a její konečné získání. V druhém případě budou zkušenosti s výrobou metanu uvedeny až na konci tématu.
První způsob studia tématu, a tedy i konstrukce experimentu, je metodologicky složitější, ale časově úspornější. Druhá metoda si vyžádá více času, ale je metodicky jednodušší a je cenná i tím, že vám umožní konečně si zopakovat a upevnit znalosti základních pokusů s látkou při jejím osvojení v hodině.
Při studiu metanu není potřeba laboratorních experimentů. V podstatě by se zde mohly zredukovat pouze na produkci metanu a jeho spalování. Ale výrobu metanu z octanu sodného a jeho spalování lze snadno demonstrovat na demonstračním stole.
Po prostudování celého tématu „Uhlovodíky“ by bylo vhodnější provést speciální praktickou lekci. V této lekci budou studenti reprodukovat zkušenosti s výrobou metanu a budou schopni ověřit, že metan nezbarvuje bromovou vodu a roztok manganistanu draselného.
Výroba metanu v laboratoři. Nejvhodnější laboratorní metodou pro výrobu metanu je interakce octanu sodného se sodným vápnem.
Interakce solí karboxylových kyselin s alkálií je obecným způsobem získávání uhlovodíků. Reakce v obecný pohled reprezentováno rovnicí:
jestliže R = CH3, pak se tvoří methan.
Protože louh sodný je hygroskopická látka a přítomnost vlhkosti ruší úspěšné dokončení reakce, pak se k ní přidá oxid vápenatý. Směs hydroxidu sodného a oxidu vápenatého se nazývá sodné vápno.
Aby reakce proběhla úspěšně, je zapotřebí poměrně vysoké zahřívání, avšak nadměrné přehřívání směsi vede k vedlejším procesům a tvorbě nežádoucích produktů, jako je aceton:
Octan sodný musí být před experimentem dehydratován. Sodné vápno by mělo být také před přípravou směsi kalcinováno. Pokud není hotové sodné vápno, připraví se následovně. Do železného nebo porcelánového hrnku nalijte dobře vypálené drcené vápno CaO s polovičním množstvím nasyceného vodného roztoku alkalického NaOH. Směs se odpaří do sucha, kalcinuje a rozdrtí. Látky jsou skladovány v exsikátoru.
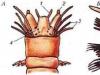
Pro demonstraci výroby metanu je nejlepší použít malou baňku s výstupní trubicí, a to praktická lekce-- zkumavka (obr. 1 a 2).
Sestavte zařízení, jak je znázorněno na obr. 1 nebo 2. Do mycí láhve se nalije alkalický roztok k zachycení nečistot (obr. I). Směs octanu sodného a sodného vápna se umístí do reakční baňky nebo zkumavky. K tomu se důkladně promísí jemně mleté látky v objemovém poměru 1:3, tzn. se značným přebytkem vápna, aby se octan sodný přinutil k co nejúplnější reakci.

Rýže.

Baňka se zahřívá hořákem přes azbestovou síťku a zkumavka se zahřívá na otevřeném plameni. Metan se shromažďuje ve zkumavce vytěsněním vody. Pro kontrolu čistoty výsledného plynu vyjměte zkumavku z vody a zapalte plyn, aniž byste ji převrátili.
Protože je nepraktické přerušit proces výroby metanu a není možné dokončit všechny další experimenty v průběhu reakce, doporučuje se shromažďovat plyn pro následující experimenty v několika lahvích (zkumavky) nebo v plynoměru.
Naplněné válečky se nechají chvíli v lázni nebo se přikryjí pod vodou skleněnou deskou (zátkou) a položí se dnem vzhůru na stůl.
Metan je lehčí než vzduch. Aby se učitel seznámil s fyzikálními vlastnostmi metanu, předvede láhev se zachyceným plynem. Žáci pozorují, že metan je bezbarvý plyn. Shromažďování metanu metodou vytěsňování vody naznačuje, že tento plyn je zjevně nerozpustný ve vodě. Učitel tento závěr potvrzuje.
Na vahách jsou vyváženy dvě stejné baňky o největší možné kapacitě. Jedna z baněk je zavěšena dnem vzhůru (obr. 3). Do této baňky je nějakou dobu přiváděn metan ze zařízení. Váhy se zvednou. Aby si studenti nemysleli, že ke změně hmotnosti dochází vlivem tlaku proudu plynu na dno baňky, dbejte na to, aby nerovnováha zůstala i po zastavení průchodu metanu.
Po uvedení vah do rovnováhy (k tomu otočte láhev s metanem na chvíli dnem vzhůru), pro srovnání a přesvědčivější závěry se metan přepustí do baňky normálně stojící na váze. Rovnováha vah není narušena.

Poté, co učitel ukázal, že metan je lehčí než vzduch, řekne, kolik váží normální podmínky litr metanu. Tyto informace budou potřebné později při odvozování molekulárního vzorce látky.
Spalování metanu. Po zvážení fyzikálních vlastností metanu lze vznést otázku, jaký je molekulární vzorec metanu. Učitel uvádí, že pro objasnění této problematiky bude nutné se nejprve seznámit s jednou z chemických vlastností metanu - spalováním.
Spalování metanu lze znázornit dvěma způsoby.
1. Skleněný válec (o objemu např. 250 ml) naplněný metanem se položí na stůl, vyjme se z něj talíř nebo se otevře korek a plyn se ihned zapálí třískou. Jak metan hoří, plamen klesá do válce.

Aby plamen zůstal po celou dobu nad tlakovou lahví a byl pro studenty dobře viditelný, lze do tlakové lahve s hořícím metanem postupně přilévat vodu a tím plyn vytlačit (obr. 4).
2. Metan se zapálí přímo na výstupní trubce zařízení za účelem výroby plynu nebo plynoměru (v obou případech je nutná kontrola čistoty!). Velikost plamene je v prvním případě řízena intenzitou ohřevu a ve druhém případě výškou sloupce vytěsňovací kapaliny. Pokud je metan bez nečistot, hoří téměř bezbarvým plamenem. Aby se eliminovala určitá svítivost plamene (žlutá barva) způsobená sodnými solemi ve skle zkumavky, lze na konec zkumavky připevnit kovový hrot.
ALDEHYDY A KETONY
Při studiu aldehydů se studenti pomocí experimentů seznámí s postupnou povahou oxidace. organická hmota, s chemií důležité výrobní procesy a s principem získávání syntetických pryskyřic.
Aby bylo studentům jasné, jaké místo mají aldehydy v řadě produktů oxidace uhlovodíků, neměli by se při sestavování chemických rovnic vyhýbat používání názvů a vzorců kyselin, na které se aldehydy přeměňují. Vzorce kyselin mohou být dány dogmaticky předem; V budoucnu pro ně studenti získají experimentální zdůvodnění.
Při studiu aldehydů se většina experimentů provádí s formaldehydem jako látkou, která je školám nejdostupnější a má velký průmyslový význam. V souladu s tím má formaldehyd v této kapitole hlavní místo. U acetaldehydu se berou v úvahu pouze preparační reakce. Ketony se ve škole konkrétně nevyučují; proto se zde bere pouze jeden jejich zástupce - aceton a experimenty s ním jsou dány hlavně pro mimoškolní aktivity studentů.
FORMALDEHYD (METANAL)
Je vhodné sestavit plán studia této látky tak, aby studenti ihned po seznámení se s fyzikálními vlastnostmi aldehydů studovali způsoby jejího získávání, následně chemické vlastnosti atd. O něco víc brzký úvod s metodami výroby aldehydu umožní dále při studiu chemických vlastností (oxidačních reakcí) považovat aldehydy za článek v řetězci oxidace uhlovodíků.
Když se seznámíte s vlastnostmi formaldehydu, můžete jako vzorek použít formaldehyd. V tomto případě byste měli okamžitě zajistit, aby studenti jasně pochopili rozdíl mezi formaldehydem a formaldehydem.
Formaldehydový zápach. Z fyzikálních vlastností formaldehydu je v praxi nejdostupnější vůně. Za tímto účelem jsou studentům distribuovány zkumavky s 0,5-1 ml formaldehydu. Jakmile se studenti seznámí se zápachem, lze formaldehyd shromáždit a použít pro další experimenty. Seznámení s vůní formaldehydu umožní žákům detekovat tuto látku v dalších experimentech.
Hořlavost formaldehydu. Zahřejte formaldehyd ve zkumavce a zapalte uvolněné páry; hoří téměř bezbarvým plamenem. Plamen je vidět, když v něm zapálíte třísku nebo kus papíru. Experiment se provádí v digestoři.
Získání formaldehydu. Vzhledem k tomu, že formaldehyd lze zjistit pouze čichem, než se seznámíte s jeho chemickými vlastnostmi, měla by být první zkušenost s jeho získáváním provedena ve formě laboratorních prací.
1. Do zkumavky se nalije několik kapek metanolu. V plameni hořáku se zahřeje malý kousek měděného pletiva nebo spirála měděného drátu svinutého do trubičky a rychle se spustí do metanolu.
Při kalcinaci měď oxiduje a pokrývá se černým povlakem oxidu měďnatého; v alkoholu se opět redukuje a zčervená:

Je detekován štiplavý zápach aldehydu. Pokud se oxidační proces opakuje 2-3krát, lze získat významnou koncentraci formaldehydu a roztok lze použít pro následující experimenty.
2. Kromě oxidu měďnatého lze k výrobě formaldehydu použít i jiná studentům známá oxidační činidla.
Ke slabému roztoku manganistanu draselného v demonstrační zkumavce se přidá 0,5 ml methanolu a směs se zahřeje k varu. Objeví se zápach formaldehydu a fialová barva manganistanu zmizí.
Do zkumavky se nalijí 2-3 ml nasyceného roztoku dichromanu draselného K 2 Cr 2 O 7 a stejný objem koncentrované kyseliny sírové. Po kapkách přidávejte metanol a velmi opatrně směs zahřívejte (otvor zkumavky směřuje do strany!). Reakce pak pokračuje za uvolňování tepla. Žlutá barva směsi chromu zmizí a objeví se zelená barva síranu chromitého

Reakční rovnici není třeba se studenty probírat. Stejně jako v předchozím případě jsou pouze informováni, že dichroman draselný oxiduje methylalkohol na aldehyd, čímž se mění na sůl trojmocného chrómu Cr 2 (SO 4) 3.
Reakce formaldehydu s oxidem stříbrným(reakce stříbrného zrcadla). Tato zkušenost musí být studentům prokázána tak, aby zároveň sloužila jako instruktáž pro následnou praktickou hodinu.
Příprava fenolformaldehydových pryskyřic. Převážná část formaldehydu produkovaného v průmyslu se používá pro syntézu fenolformaldehydu a dalších pryskyřic nezbytných pro výrobu plastů. Výroba fenolformaldehydových pryskyřic je založena na polykondenzační reakci.
Syntéza fenolformaldehydové pryskyřice je nejdostupnější ve školních podmínkách. Studenti v této době již znají obě výchozí látky pro výrobu pryskyřice - fenol a formaldehyd; experiment je poměrně jednoduchý a probíhá hladce; chemie procesu nepředstavuje pro studenty žádné zvláštní potíže, pokud je znázorněna takto:

V závislosti na kvantitativním poměru fenolu a formaldehydu a také na použitém katalyzátoru (kyselém nebo alkalickém) lze získat novolak nebo rezolovou pryskyřici. První z nich je termoplastický a má lineární strukturu znázorněnou výše. Druhý je termoreaktivní, protože jeho lineární molekuly obsahují volné alkoholové skupiny - CH 2 OH, které mohou reagovat s pohyblivými atomy vodíku jiných molekul, což vede k vytvoření trojrozměrné struktury.
ACETALDEHYD (ETANAL)
Po podrobném přehledu vlastností formaldehydu v této části tématu nejvyšší hodnotu získat experimenty související s výrobou acetaldehydu. Tyto experimenty lze provádět s cílem: a) ukázat, že všechny aldehydy lze získat oxidací odpovídajících jednosytných alkoholů, b) ukázat, jak lze experimentálně doložit strukturu aldehydů, c) představit chemii průmyslové metody. pro výrobu acetaldehydu podle Kuchsrova.
Příprava acetaldehydu oxidací ethanolu. Oxid měďnatý (II) může být považován za oxidační činidlo pro alkohol. Reakce probíhá podobně jako oxidace methanolu:
- 1. Do zkumavky se nalije ne více než 0,5 ml ethylalkoholu a ponoří se horký měděný drát. Je detekován ovocný zápach acetaldehydu a je pozorována redukce mědi. Pokud se oxidace alkoholu provádí 2-3krát, pokaždé, když se měď zahřívá, dokud se nevytvoří oxid měďnatý, pak po shromáždění roztoků získaných studenty do zkumavek bude možné použít aldehyd pro experimenty s ním. .
- 2. Do malé baňky s výstupní trubicí dejte 5 g drceného dichromanu draselného K2Cr2O7, zalijte 20 ml zředěné kyseliny sírové (1:5) a poté 4 ml ethylalkoholu. K baňce je připojena lednička a zahřívána na malém plameni přes azbestovou síťku. Zásobník destilátu je umístěn v ledová voda nebo sníh. Do přijímače se nalije trochu vody a konec chladničky se spustí do vody. To se provádí za účelem snížení těkání par acetaldehydu (bod varu 21 °C). Spolu s etanalem je do jímače destilováno určité množství vody a vzniklého nezreagovaného alkoholu. octová kyselina a další vedlejší produkty reakce. Není však potřeba izolovat čistý acetaldehyd, protože výsledný produkt dobře reaguje s běžnými aldehydovými reakcemi. Přítomnost aldehydu se určuje čichem a reakcí stříbrného zrcadla.
Pozornost studentů je upoutána na změnu barvy v baňce. Zelená barva výsledného síranu chromitého Cr 2 (SO 4) 3 se stane zvláště zřetelnou, pokud se obsah baňky po experimentu zředí vodou. Je třeba poznamenat, že ke změně barvy bichromanu draselného došlo v důsledku jeho oxidace alkoholu.
Příprava acetaldehydu hydratací acetylenu. Pozoruhodný objev ruského chemika M.G.Kučerova - přidání vody do acetylenu v přítomnosti solí rtuti vytvořilo základ pro široce rozšířenou průmyslovou metodu výroby acetaldehydu.
I přes velká důležitost a dostupnost pro školu se tato metoda v hodinách chemie prokazuje jen zřídka.
V průmyslu se proces provádí přiváděním acetylenu do vody obsahující soli dvojmocné rtuti a kyselinu sírovou při teplotě 70 °C. Výsledný acetaldehyd se za těchto podmínek oddestiluje a kondenzuje, načež vstupuje do speciálních věží pro oxidaci na kyselinu octovou. Acetylen se získává z karbidu vápníku běžným způsobem a čistí se od nečistot.
Potřeba čištění acetylenu a udržování teploty v reakční nádobě na jedné straně a nejistota získání požadovaného produktu na straně druhé obvykle snižují zájem o tento experiment. Experiment lze přitom provádět zcela jednoduše a spolehlivě jak ve zjednodušené formě, tak v podmínkách blížících se průmyslovým.
1. Experiment, který do určité míry odráží podmínky reakce při výrobě a umožňuje získat dostatečně koncentrovaný roztok aldehydu, lze provést v zařízení na Obr. 29.

První fází je výroba acetylenu. Do baňky se vloží kousky karbidu vápníku a z kapací nálevky se pomalu přidává voda nebo nasycený roztok kuchyňské soli. Rychlost stáčení je nastavena tak, aby byl zajištěn plynulý tok acetylenu, přibližně jedna bublina za 1-2 s. Acetylen se čistí v pračce roztokem síranu měďnatého:
CuSO4 + H2S H2SO4
Po vyčištění se plyn převede do baňky s roztokem katalyzátoru (15-20 ml vody, 6-7 ml koncentrované kyseliny sírové a asi 0,5 g oxidu rtuťnatého. Baňka, kde probíhá hydratace acetylenu, se zahřívá hořákem (lihovou lampou) a vzniklý acetaldehyd v plynné formě vstupuje do zkumavek s vodou, kde se absorbuje.
Po 5-7 minutách ve zkumavce je možné získat roztok etanalu významné koncentrace. Pro dokončení experimentu nejprve zastavte přívod vody do karbidu vápníku, poté odpojte zařízení a bez dodatečné destilace aldehydu z reakční baňky použijte výsledné roztoky ve zkumavkách pro odpovídající experimenty.
2. Ve své nejjednodušší podobě lze reakci M.G. Kucherova provést následovně.
Do malé baňky s kulatým dnem nalijte 30 ml vody a 15 ml konc. kyselina sírová. Směs se ochladí a přidá se k ní trochu oxidu rtuťnatého (na špičce špachtle). Směs se opatrně zahřívá přes azbestovou síť, dokud se nevře a oxid rtuťnatý se změní na síran rtuťnatý (II).
Možnost 1
1. Napište reakční rovnice, kterými lze provést následující přeměny: methan → chlor-methan → metanol → formaldehyd → kyselina mravenčí. Specifikujte reakční podmínky.
2. Napište strukturní vzorec látky o složení C₃H₆O₂, je-li známo, že vodní roztok mění barvu methyloranže na červenou, s chlorem tato látka tvoří sloučeninu C3H5ClO2 a při zahřívání sodná sůl Ethan se tvoří s hydroxidem sodným. Pojmenujte látku. 
3. Vypočítejte hmotnost látky (v gramech) a látkové množství (v molech) každého produktu při těchto přeměnách: bromethan → ethanol → kyselina ethanová. Bromethan byl odebrán s hmotností 218 g. 
Možnost 2
1. Napište reakční rovnice, kterými lze provést následující přeměny: acetylen → etylen → ethanol → acetaldehyd → kyselina octová. Specifikujte reakční podmínky. 
2. Napište strukturní vzorec látky o složení C₄H₈O, je-li známo, že reaguje s hydroxidem měďnatým a při oxidaci tvoří kyselinu 2-methylpropanovou. Pojmenujte tuto látku. 
3. Vypočítejte hmotnost látky (v gramech) a látkové množství (v molech) každého produktu při těchto přeměnách: propan → 2-chlorpropan → 2-propanol. Propan byl odebrán s hmotností 22 g. 
Možnost 3
1. Napište reakční rovnice, kterými lze provést následující přeměny: methan → acetylen → acetaldehyd → ethylalkohol → kyselina ethanová. Specifikujte reakční podmínky. 
2. Napište strukturní vzorec látky o složení C₅H₁₀O, je-li známo, že přidává vodík za přítomnosti katalyzátoru a při zahřívání s čerstvě připraveným hydroxidem měďnatým tvoří červenou sraženinu. Pojmenujte tuto látku. 
3. Vypočítejte hmotnost látky (v gramech) a látkové množství (v molech) každého produktu při těchto přeměnách: benzen → chlorbenzen → fenol. Benzen byl odebrán s hmotností 156 g. 
Možnost 4
1. Napište reakční rovnice, kterými lze provést následující přeměny: methan → formaldehyd → metanol → kyselina mravenčí → kyselina uhličitá. Specifikujte reakční podmínky. 
2. Napište strukturní vzorec látky o složení C₂H₆O₂, je-li známo, že reaguje se sodíkem za uvolňování vodíku a s hydroxidem měďnatým tvoří světle modrou látku. Pojmenujte tuto látku. 
3. Vypočítejte hmotnost látky (v gramech) a látkové množství (v molech) každého produktu při těchto přeměnách: chlormethan → methanol → kyselina methanová. Chlormethan byl odebrán s hmotností 202 g. 
Tazhibaeva Asemgul Isintaevna
Učitel ve společnosti Kamennobrod Secondary School
Hodina chemie v 11. třídě
Téma lekce: Genetické spojení mezi uhlovodíky, alkoholy, aldehydy, alkoholy, karboxylovými kyselinami.
Typ lekce: lekce zobecnění znalostí.
Cíle lekce: konsolidovat, zobecňovat a systematizovat znalosti o organických sloučeninách obsahujících kyslík, a to i na základě genetických souvislostí mezi třídami těchto látek. Posílit schopnost předvídat chemické vlastnosti neznámých organických látek na základě znalostí funkční skupiny. Rozvíjet u studentů demonstrativní řeč, schopnost používat chemickou terminologii, provádět, pozorovat a popisovat chemický experiment. Pěstovat potřebu znalostí o látkách, se kterými přicházíme v životě do styku.
Metody: verbální, vizuální, praktické, hledání problémů, kontrola znalostí.
Činidla: kyselina acetylsalicylová(aspirin), voda, chlorid železitý, roztok glukózy, univerzální indikátor, roztok síranu měďnatého, roztok hydroxidu sodného, vaječný bílek, ethanol, 1-butanol, kyselina octová, kyselina stearová.
Zařízení: počítač, plátno, projektor, tabulka „Klasifikace organických látek obsahujících kyslík“, doprovodná poznámka „Funkční skupina určuje vlastnosti látky“, hmoždíř a palička, skleněná tyčinka, lihová lampa, držák na zkumavku, nálevka, filtr, sklenice, stojan se zkumavkami, pipeta, odměrný válec na 10 ml.
I. Organizační moment.
Dnes ve třídě:
1) Posílíte schopnost předvídat chemické vlastnosti neznámých organických látek na základě znalosti funkčních skupin.
2) Zjistíte, jaké funkční skupiny znáte, jsou součástí nejznámějšího léku proti horečce.
3) Funkční skupiny najdete v látce se sladkou chutí, která se používá v lékařství jako živina a složka tekutin nahrazujících krev.
4) Uvidíte, jak můžete získat čisté stříbro.
5) Budeme si povídat fyziologické účinky ethylalkohol.
6) Probereme důsledky pití alkoholických nápojů těhotnými ženami.
7) Budete příjemně překvapeni: ukáže se, že už toho tolik víte!
II. Opakování a zobecnění nabytých znalostí studentů.
1. Klasifikace organických sloučenin obsahujících kyslík.
Zobecnění materiálu začínáme klasifikací organických látek obsahujících kyslík. K tomu použijeme tabulku „Klasifikace organických sloučenin obsahujících kyslík“. Při frontální práci zopakujeme funkční skupiny obsahující kyslík.
V organické chemii existují tři nejdůležitější funkční skupiny, včetně atomů kyslíku:hydroxyl, karbonyl Akarboxyl. To druhé lze považovat za kombinaci předchozích dvou. Podle toho, se kterými atomy nebo skupinami atomů jsou tyto funkční skupiny spojeny, se látky obsahující kyslík dělí na alkoholy, fenoly, aldehydy, ketony a karboxylové kyseliny.
Uvažujme tyto funkční skupiny a jejich vliv na fyzikální a chemické vlastnosti látek.
Prohlížení videoklipu.
Už víte, že to není jediná věc možné znamení klasifikace. V molekule může být několik stejných funkčních skupin a věnujte pozornost odpovídajícímu řádku tabulky.
Další řádek odráží klasifikaci látek podle typu radikálu spojeného s funkční skupinou. Rád bych upozornil na skutečnost, že na rozdíl od alkoholů, aldehydů, ketonů a karboxylových kyselin jsou hydroxyareny řazeny do samostatné třídy sloučenin - fenolů.
Počet funkčních skupin a struktura radikálu určují obecný molekulární vzorec látek. V této tabulce jsou uvedeny pouze pro omezující zástupce tříd s jednou funkční skupinou.
Všechny třídy sloučenin, které se „vejdou“ do tabulky, jsoumonofunkční, tj. mají pouze jednu funkci obsahující kyslík.
Pro upevnění látky o klasifikaci a názvosloví látek obsahujících kyslík uvádím několik vzorců sloučenin a žádám studenty, aby určili „své místo“ v dané klasifikaci a uvedli název.
název | Třída látky | |
Kyselina propinová | Nenasycená, jednosytná kyselina |
|
| Butandiol-1,4 | Limit, dvojsytný alkohol |
| 1,3-dihydroxybenzen | Diatomický fenol |
| 3-methylbutanal | Nasycený aldehyd |
| Buten-3-1-2 | Nenasycený keton |
| 2-Methylbutanol-2 | Limit, jednosytný alkohol |
Vztah mezi strukturou a vlastnostmi sloučenin obsahujících kyslík.
Povaha funkční skupiny má významný vliv na fyzikální vlastnosti látek této třídy a do značné míry určuje její chemické vlastnosti.
Pojem „fyzikální vlastnosti“ zahrnuje stav agregace látek.
Souhrnný stav lineárních spojů různých tříd:
Alkoholy | Aldehydy | Karboxylové kyseliny | |
1 | a. | G. | a. |
2 | a. | a. | a. |
3 | a. | a. | a. |
4 | a. | a. | a. |
5 | a. | a. | a. |
Homologní řada aldehydů začíná plynnou látkou při pokojové teplotě - formaldehydem a mezi jednosytnými alkoholy a karboxylovými kyselinami nejsou žádné plyny. S čím to souvisí?
Molekuly alkoholů a kyselin jsou navíc vzájemně spojeny vodíkovými vazbami.
Učitel požádá studenty, aby formulovali definici „vodíkové vazby“(jedná se o mezimolekulární vazbu mezi kyslíkem jedné molekuly a hydroxylovým vodíkem jiné molekuly) , opraví a případně nadiktuje pro zápis: chemická vazba mezi elektronově deficitním atomem vodíku a elektronově bohatým atomem prvku s vysokou elektronegativitou (F , Ó , N ) je nazývánvodík.
Nyní porovnejte teploty varu (°C) prvních pěti homologů látek tří tříd.
Alkoholy | Aldehydy | Karboxylové kyseliny | |
1 | +64,7 | -19 | +101 |
2 | +78,3 | +21 | +118 |
3 | +97,2 | +50 | +141 |
4 | +117,7 | +75 | +163 |
5 | +137,8 | +120 | +186 |
Co můžete říci po zhlédnutí tabulek?
V homologní řadě alkoholů a karboxylových kyselin nejsou žádné plynné látky a teploty varu látek jsou vysoké. To je způsobeno přítomností vodíkových vazeb mezi molekulami. Vlivem vodíkových vazeb se molekuly spojují (jakoby zesíťují), proto, aby se molekuly uvolnily a získaly těkavost, je nutné vynaložit další energii na rozbití těchto vazeb.
Co lze říci o rozpustnosti alkoholů, aldehydů a karboxylových kyselin ve vodě? (Ukázka rozpustnosti alkoholů - ethyl, propyl, butyl a kyselin - mravenčí, octové, propionové, máselné a stearové ve vodě. Dále je prokázán roztok mravenčího aldehydu ve vodě.)
Při odpovídání se používá schéma tvorby vodíkových vazeb mezi molekulami kyseliny a vody, alkoholů a kyselin.


Je třeba si uvědomit, že s rostoucí molekulovou hmotností klesá rozpustnost alkoholů a kyselin ve vodě. Čím větší je uhlovodíkový radikál v molekule alkoholu nebo kyseliny, tím obtížnější je pro OH skupinu udržet molekulu v roztoku kvůli tvorbě slabých vodíkových vazeb.
3. Genetický vztah mezi různými třídami sloučenin obsahujících kyslík.
Nakreslím na tabuli vzorce řady sloučenin obsahujících jeden atom uhlíku:
CH 4 →CH 3 OH → HCOH → HCOOH → CO 2
Proč se v kurzu organické chemie studují v tomto pořadí?
Jak se změní oxidační stav atomu uhlíku?
Studenti diktují řádek: -4, -2, 0, +2, +4
Nyní je jasné, že každá následující sloučenina je stále více oxidovanou formou předchozí. Odtud je zřejmé, že bychom se měli pohybovat po genetické řadě zleva doprava pomocí oxidačních reakcí a v opačném směru pomocí redukčních procesů.
Vypadnou ketony z tohoto „kruhu příbuzných“? Samozřejmě že ne. Jejich předchůdci jsou sekundární alkoholy.
Chemické vlastnosti každé třídy látek byly podrobně diskutovány v odpovídajících lekcích. Abych tento materiál shrnul, navrhl jsem jako domácí práceúkoly na vzájemné proměny v poněkud neobvyklé podobě.
1. Sloučenina s molekulovým vzorcemC 3 H 8 Ó podrobeny dehydrogenaci, což vede k produktu s kompozicíC 3 H 6 Ó . Tato látka prochází reakcí „stříbrného zrcadla“ a tvoří sloučeninuC 3 H 6 Ó 2 . Zpracováním posledně uvedené látky hydroxidem vápenatým byla získána látka, která byla použita jako přísady do jídla pod kódem E 282. Zabraňuje růstu plísní v pečivu a cukrářských výrobcích a nachází se také v potravinách, jako je švýcarský sýr. Určete vzorec přísady E 282, napište rovnice pro uvedené reakce a pojmenujte všechny organické látky.
Řešení :
CH 3 – CH 2 – CH 2 –OH → CH 3 – CH 2 - COH + H 2 ( kočka. – Cu, 200-300 °C)
CH 3 – CH 2 – COH + Ag 2 O → CH 3 – CH 2 – COOH + 2Ag (zjednodušená rovnice, čpavkový roztok oxidu stříbrného)
2CH 3 – CH 2 -COOH+Sa(OH) 2 → (CH 3 – CH 2 – provozní ředitel) 2 Ca+2H 2 Ó.
Odpověď: propionát vápenatý.
2. Kompoziční sloučeninaC 4 H 8 Cl 2 s rovnou uhlíkovou kostrou zahřátou vodným roztokemNaOH a získal organickou látku, která po oxidaciCu(OH) 2 proměnilC 4 H 8 Ó 2 . Určete strukturu původní sloučeniny.
Řešení: pokud jsou 2 atomy chloru umístěny na různých atomech uhlíku, pak při zpracování alkálií bychom získali dvojsytný alkohol, který by neoxidovalCu(OH) 2 . Pokud by 2 atomy chloru byly umístěny na jednom atomu uhlíku uprostřed řetězce, pak by při zpracování alkálií získal keton, který neoxidujeCu(OH) 2. Potom je požadované připojení1,1-dichlorbutan.
CH 3 – CH 2 – CH 2 – CHCl 2 + 2NaOH → CH 3 – CH 2 – CH 2 – COH + 2NaCl + H 2 Ó
CH 3 – CH 2 – CH 2 – COH + 2 Cu(OH) 2 →CH 3 – CH 2 – CH 2 – COOH + Cu 2 0+2H 2 Ó
3. Při zahřívání 19,2 g sodné soli nasycené jednosytné kyseliny s hydroxidem sodným vzniklo 21,2 g uhličitanu sodného. Pojmenujte kyselinu.
Řešení:
Při zahřívání dochází k dekarboxylaci:
R-COONa + NaOH → RH + Na 2 CO 3
υ (Na 2 CO 3 ) = 21,2 / 106 = 0,2 krtek
υ (R-COONa) = 0,2krtek
M(R-COONa) = 19,2 / 0,2 = 96G/ krtek
M(R-COOH) =M(R-COONa) –M(Na) + M(H) = 96-23 + 1 = 74G/ krtek
V souladu s obecný vzorec nasycených jednosytných karboxylových kyselin je pro určení počtu atomů uhlíku nutné vyřešit rovnici:
12n + 2n + 32= 74
n=3
Odpověď: kyselina propionová.
Pro upevnění znalostí o chemických vlastnostech organických látek obsahujících kyslík provedeme test.
1 možnost
Následující vzorce odpovídají nasyceným jednosytným alkoholům:
A)
CH
2
Ó
b)
C
4
H
10
Ó
V)
C
2
H
6
Ó
G)
CH
4
Ó
D)
C
2
H
4
Ó
2
Obsahuje kombinaci dvou principů,
Jeden je u zrodu zrcadel.
Samozřejmě ne k zamyšlení,
A pro vědu o porozumění.
...A v království lesa je nalezena,
Malí bratři jsou zde její přátelé,
Jejich srdce jsou jim zcela dána...
možnosti:
A) kyselina pikrová
B) kyselina mravenčí
B) kyselina octová
D) karboxylová skupina
D) kyselina benzoová
Ethanol reaguje s látkami:
A)
NaOH
b)
Na
V)
HCl
G)
CH
3
COOH
D)
FeCl
3
Kvalitativní reakce na fenoly je reakce s
A)
NaOH
b)
Cu(OH)
2
V)
CuO
G)
FeCl
3
D)
HNO
3
Ethanal reaguje s látkami
A) methanol
B) vodík
B) roztok amoniaku oxidu stříbrného
D) hydroxid měďnatý (II).
D) chlorovodík
Možnost 2
Aldehydy lze získat
A) oxidace alkenů
B) oxidace alkoholů
B) hydratace alkynů
D) při zahřívání vápenatých solí karboxylových kyselin
D) hydratace alkenů
Funkční skupina alkoholů je
A)
COH
b)
ACH
V)
COOH
G)
N.H.
2
D)
NE
2
2-methylbutanol-2
A) nenasycený alkohol
B) omezení alkoholu
B) jednosytný alkohol
D) terciární alkohol
D) aldehyd
Pozoroval jsi reakci?
A) pro vícesytné alkoholy
B) oxidace alkoholu
B) interakce fenolu s chloridem železitým
D) "stříbrné zrcadlo"
D) "měděné zrcadlo"
Kyselina octová reaguje s látkami
A) vodík
B) chlór
B) propanol
D) hydroxid sodný
D) metanalem
Studenti vyplní své odpovědi do tabulky:
A | b | PROTI | G | d | |
1 | + | + | + | ||
2 | + | ||||
3 | + | + | + | ||
4 | + | ||||
5 | + | + | + |
Spojíte-li správné odpovědi plnou čarou, dostanete číslo „5“.
Skupinová práce studentů.
Úkol pro skupinu 1

cíle:
Reagencie a vybavení: kyselina acetylsalicylová (aspirin), voda, chlorid železitý; hmoždíř a palička, skleněná tyčinka, lihová lampa, držák na zkumavku, nálevka, filtr, sklenice, stojan se zkumavkami, pipeta, odměrný válec 10 ml.
Pokus 1. Důkaz nepřítomnosti fenolického hydroxylu v kyselině acetylsalicylové (aspirinu).
2-3 zrnka acetylu se umístí do zkumavky kyselina salicylová, přidejte 1 ml vody a důkladně protřepejte. Do výsledného roztoku přidejte 1-2 kapky roztoku chloridu železitého. co pozoruješ? Vyvodit závěry.
Žádná fialová barva se neobjeví. Proto v kyselině acetylsalicylovéNOOS-S 6 N 4 -O-CO-CH 3 neexistuje žádná volná fenolová skupina, protože tato látka je ester tvořený kyselinou octovou a salicylovou.
Pokus 2. Hydrolýza kyseliny acetylsalicylové.
Rozdrcená tableta kyseliny acetylsalicylové se vloží do zkumavky a přidá se 10 ml vody. Obsah zkumavky přiveďte k varu a vařte 0,5-1 minuty. Roztok přefiltrujte. Poté se k výslednému filtrátu přidají 1-2 kapky roztoku chloridu železitého. co pozoruješ? Vyvodit závěry.
Napište rovnici reakce:

Dokončete práci vyplněním tabulky, která obsahuje následující sloupce: provedená operace, činidlo, pozorování, závěr.
Objeví se fialové zbarvení indikující uvolňování kyseliny salicylové obsahující volnou fenolovou skupinu. Kyselina acetylsalicylová se jako ester snadno hydrolyzuje, když se vaří s vodou.
Úkol pro skupinu 2
1. Zvažte strukturní vzorce látek, pojmenujte funkční skupiny.

2. Dělejte laboratorní práce„Detekce funkčních skupin v molekule glukózy“.
cíle: upevnit znalosti studentů o kvalitativních reakcích organických sloučenin, rozvíjet dovednosti v experimentálním určování funkčních skupin.
Reagencie a vybavení: řešení glukóza, univerzální indikátor, roztok síranu měďnatého, roztok hydroxidu sodného, lihová lampa, držák na zkumavku, zápalky, odměrný válec 10 ml.
2.1. Nalijte 2 ml roztoku glukózy do zkumavky. Pomocí univerzálního indikátoru udělejte závěr o přítomnosti nebo nepřítomnosti karboxylové skupiny.
2.2. Připravte hydroxid měďnatý (II): nalijte 1 ml síranu měďnatého do zkumavky a přidejte do ní hydroxid sodný. Ke vzniklé sraženině přidejte 1 ml glukózy a protřepejte. co pozoruješ? Pro jaké funkční skupiny je typický? tato reakce?
2.3. Směs získanou v pokusu č. 2 zahřejte. Všimněte si změn. Pro jakou funkční skupinu je tato reakce typická?
2.4. Dokončete práci vyplněním tabulky, která obsahuje následující sloupce: provedená operace, činidlo, pozorování, závěr.
Demonstrační zkušenost. Interakce roztoku glukózy s roztokem amoniaku oxidu stříbrného.
Výsledky práce:
- není zde žádná karboxylová skupina, protože roztok má neutrální reakci na indikátor;
- sraženina hydroxidu měďnatého (II) se rozpustí a objeví se jasně modrá barva, charakteristická pro vícesytné alkoholy;
- při zahřívání tohoto roztoku se vysráží žlutá sraženina hydroxidu měďnatého, která dalším zahříváním zčervená, což ukazuje na přítomnost aldehydové skupiny.
Závěr. Molekula glukózy tedy obsahuje karbonylové a několik hydroxylových skupin a je to aldehydalkohol.
Úkol pro skupinu 3
Fyziologický účinek etanolu
1. Jaký vliv má etanol na živé organismy?
2. Pomocí zařízení a činidel dostupných na stole demonstrujte účinek etanolu na živé organismy. Komentujte, co vidíte.
Účel zážitku: přesvědčit studenty, že alkohol denaturuje bílkoviny a nevratně narušuje jejich strukturu a vlastnosti.
Vybavení a činidla: stojan se zkumavkami, pipeta, odměrný válec 10 ml, vaječný bílek, etanol, voda.
Průběh experimentu: Do 2 zkumavek nalijte 2 ml vaječného bílku. Do jedné přidejte 8 ml vody a do druhé stejné množství ethanolu.
V první zkumavce se protein rozpustí a je tělem dobře absorbován. V druhé zkumavce se tvoří hustá bílá sraženina - bílkoviny se v alkoholu nerozpouštějí, alkohol bílkovinám vodu odebírá. V důsledku toho dochází k narušení struktury a vlastností proteinu a jeho funkcí.
3. Řekněte nám o vlivu ethylalkoholu na různé orgány a systémy lidských orgánů.
Vysvětlete těhotným ženám následky pití alkoholu.
Studentská vystoupení.
Od pradávna zná člověk velké množství toxických látek, které se všechny liší silou účinku na organismus. Mezi nimi vyniká látka, která je v medicíně známá jako silný protoplazmatický jed – ethylalkohol. Úmrtnost na alkoholismus převyšuje počet úmrtí způsobených všemi infekční choroby vzato dohromady.
Popálení sliznice dutiny ústní, hltanu, jícnu, vstupuje gastrointestinální trakt. Na rozdíl od mnoha jiných látek se alkohol v žaludku rychle a úplně vstřebá. Snadno prochází biologickými membránami, asi po hodině dosahuje maximální koncentrace v krvi.
Molekuly alkoholu rychle pronikají biologickými membránami do krve ve srovnání s molekulami vody. Molekuly ethylalkoholu mohou snadno procházet biologickými membránami díky své malé velikosti, slabé polarizaci, tvorbě vodíkových vazeb s molekulami vody a dobré rozpustnosti alkoholu v tucích.
Alkohol se rychle vstřebává do krve a dobře se rozpouští v mezibuněčné tekutině a vstupuje do všech buněk těla. Vědci zjistili, že narušením funkcí buněk způsobuje jejich smrt: při pití 100 g piva odumře asi 3000 mozkových buněk, 100 g vína - 500, 100 g vodky - 7500, kontakt červených krvinek s molekul alkoholu vede ke srážení krvinek.
Játra neutralizují toxické látky, které se dostávají do krve. Lékaři tento orgán nazývají cílem alkoholu, protože je v něm neutralizováno 90 % etanolu. Vyskytují se v játrech chemické procesy oxidace ethylalkoholu.
Připomínáme se studenty fáze procesu oxidace alkoholu:

Ethylalkohol se oxiduje na konečné produkty rozkladu pouze v případě, že denní spotřeba etanolu nepřesáhne 20 g. Při překročení dávky se pak v těle hromadí meziprodukty rozkladu.
To vede k řadě negativních vedlejších účinků: zvýšená tvorba tuku a jeho hromadění v jaterních buňkách; hromadění peroxidových sloučenin, které mohou ničit buněčné membrány, v důsledku čehož obsah buněk vytéká vytvořenými póry; velmi nežádoucí jevy, jejichž kombinace vede k destrukci jater - cirhóze.
Acetaldehyd je 30krát toxičtější než ethylalkohol. Navíc v důsledku různých bio chemické reakce v tkáních a orgánech včetně mozku je možná tvorba tetrahydropapaverolinu, který svou strukturou a vlastnostmi připomíná známá psychofarmaka – morfin a kanabinol. Lékaři prokázali, že právě acetaldehyd způsobuje mutace a různé deformace embryí.
Kyselina octová zvyšuje syntézu mastné kyseliny a vede k tukové degeneraci jater.
Při studiu fyzikálních vlastností alkoholů jsme se zabývali otázkou změn jejich toxicity u homologní řady jednosytných alkoholů. S rostoucí molekulovou hmotností molekul látek se zvyšují jejich narkotické vlastnosti. Pokud porovnáme ethyl a pentylalkoholy, jejich molekulová hmotnost je 2krát větší a jejich toxicita je 20krát větší. Alkoholy obsahující tři až pět atomů uhlíku tvoří tzv. fuselové oleje, jejichž přítomnost v alkoholických nápojích zvyšuje jejich toxické vlastnosti.
V této sérii je výjimkou metanol – nejsilnější jed. Když se 1-2 lžičky dostanou do těla, je to ovlivněno zrakový nerv, což vede k úplné slepotě a konzumace 30-100 ml vede k fatální výsledek. Nebezpečí zvyšují podobnosti methylalkohol S ethylalkohol podle vlastností, vzhled, vůně.
Společně se studenty se snažíme najít příčinu tohoto jevu. Předkládají různé hypotézy. Pozastavíme se nad tím, že mezi faktory, které zvyšují toxicitu metylalkoholu, patří malá velikost molekul ( vysoká rychlost distribuce), stejně jako skutečnost, že meziprodukty jeho oxidace – mravenčí aldehyd a kyselina mravenčí – jsou silné jedy.
Alkohol, který není neutralizován játry a toxické produkty jeho rozkladu se znovu dostávají do krevního oběhu a jsou distribuovány po celém těle a zůstávají v něm po dlouhou dobu. Například alkohol se v mozku nachází v nezměněné podobě 20 dní po jeho požití.
Žáky upozorňujeme na to, jak se alkohol a produkty jeho rozkladu z těla vylučují.
10 % nezměněno přes plíce, ledviny a kůži | ||
90 % ve formě CO 2 A N 2 O přes plíce a ledviny |
Bohužel v Nedávno Konzumace alkoholu, stejně jako kouření, je u žen běžná. Vliv alkoholu na potomky jde dvěma směry.
Za prvé, konzumace alkoholu je doprovázena hlubokými změnami v sexuální sféře mužů i žen. Alkohol a jeho produkty rozkladu mohou ovlivnit ženské i mužské reprodukční buňky ještě před oplodněním - mění se jejich genetická informace (viz obr. „Zdravé (1) a patologické (2) spermie“).

Pokud je konzumace alkoholu prodloužena, činnost reprodukčního systému je narušena, začíná produkovat defektní zárodečné buňky.
Za druhé, alkohol přímo ovlivňuje embryo. Neustálá konzumace 75-80 g vodky, koňaku nebo 120-150 g slabších alkoholických nápojů (piva) může způsobit fetální alkoholový syndrom. Přes placentu se do vod obklopujících plod dostává nejen alkohol, ale i produkty jeho rozkladu, zejména acetaldehyd, který je desetkrát nebezpečnější než samotný alkohol.
Intoxikace alkoholem má škodlivý vliv na plod, protože jeho játra, kam se dostává především krev z placenty, ještě nemají speciální enzym, který rozkládá alkohol, a ten se nezneutralizovaný šíří po těle a způsobuje nevratné změny. Alkohol je nebezpečný zejména v 7. – 11. týdnu těhotenství, kdy se začínají rozvíjet vnitřní orgány. Negativně ovlivňuje jejich vývoj, způsobuje poruchy a změny. Postižený je zejména mozek. V důsledku působení alkoholu, demence, epilepsie, neurózy, srdce a ledvinové poruchy jsou poškozeny vnější i vnitřní pohlavní orgány.
Někdy jsou poškození psychiky a intelektu pozorována již v raném dětství, ale nejčastěji jsou zjištěna, když děti začínají studovat. Takové dítě je intelektuálně oslabené a agresivní. Alkohol působí na dětský organismus mnohem silněji než na tělo dospělého. Obzvláště citlivé a snadno zranitelné nervový systém a mozek dítěte.
Podívejme se tedy na tabulku „Vliv alkoholu na dědičnost a zdraví dětí“ a vyvodíme závěry .
V rodinách pijících rodičů | V rodinách rodičů, kteří nepijí | |
Zemřel v prvních měsících života | 44% | 8% |
Ukázalo se, že je méněcenný, nemocný | 39% | 10% |
Zdravý fyzicky i psychicky | 17% | 82% |
Dlouhodobá konzumace alkoholických nápojů vede ke změkčení kůry. Jsou pozorovány četné bodové krvácení; přenos vzruchu z jedn nervová buňka jinému. Nezapomeňte na lakonická varovná slova V. V. Majakovského:
Nepijte alkohol.
Pro ty, kteří ho pijí, je to jed, pro jeho okolí je to mučení.
Tím jste si upevnili schopnost předpovídat chemické vlastnosti neznámých organických látek, opírali se o znalost funkčních skupin, zopakovali jste si fyzikální a chemické vlastnosti organických látek obsahujících kyslík a upevnili jste schopnost určit příslušnost organických sloučenin do tříd látek.
III. Domácí práce.
1. Proveďte transformace:

2. Prozkoumejte možné důvody znečištění životní prostředí v blízkosti výroby: methanol, fenol, formaldehyd, kyselina octová. Analyzujte vliv těchto látek na přírodní objekty: atmosféru, vodní zdroje, půdu, rostliny, zvířata a člověka. Popište opatření první pomoci při otravě
Tsepkova E.I.,
učitel chemie
MAOU "SSOSH č. 2"
chemie
Stupeň 10
UMK.Chemie.10. ročník Učebnice pro všeobecně vzdělávací organizace: zákl
level/G.E.Rudzitiis, F.G.Feldman - 2. vydání - M.: Education, 2012.
Úroveň výcviku je základní.
Téma lekce:Genetický vztah nasycených jednosytných alkoholů s uhlovodíky.
Celkový hodiny vyhrazené na prostudování tématu: 6 hodin.
Místo lekce - 4. lekce na téma
Typ lekce: lekce zobecnění znalostí.
Cíle lekce: konsolidovat, zobecňovat a systematizovat znalosti o organických sloučeninách obsahujících kyslík, a to i na základě genetických souvislostí mezi třídami těchto látek.
úkoly:
vzdělávací: zopakovat si základní pojmy a pojmy k tématu, upevnit znalosti o složení, struktuře a vlastnostech alkoholů;
rozvíjení: schopnost analyzovat, porovnávat, vytvářet souvislosti mezi strukturou a vlastnostmi sloučenin, rozvíjet tvůrčí schopnosti studentů a kognitivní zájem o chemii;
výchovný: dáti Speciální pozornost věci, které v životě používáme.
Metody: verbální, vizuální, hledání problémů, kontrola znalostí.
Zařízení: počítač, plátno, projektor, tabulka „Klasifikace organických látek obsahujících kyslík“, podpůrné shrnutí „Funkční skupina určuje vlastnosti látky“.
Plánované výsledky učení
Předmět. Znát vztah mezi složením, strukturou a vlastnostmi látek. Umět uvést příklady a sestavit rovnice chemických reakcí, které odhalí
genetické souvislosti mezi alkoholy a uhlovodíky. Procvičte si schopnost provádět výpočty pomocí chemické rovnice pokud se jedna z reaktantů odebere v přebytku.
Metasubjekt. Umět organizovat vzdělávací spolupráci a společné aktivity s učitelem a vrstevníky, pracovat samostatně i ve skupině (viz společné rozhodnutí a řešit konflikty na základě koordinace pozic a zohlednění zájmů), formulovat, argumentovat a obhajovat své názory.
Osobní. Vytvořit holistický pohled na svět, který odpovídá moderní úrovni rozvoje vědy, založený na představách o genetickém spojení mezi různými
třídy organických látek. Rozvíjet komunikační kompetence.
Během vyučování.
I. Organizační moment.
II. Chlapi, dnes v lekci budeme řešit genetické problémy, na kterých si upevníme znalosti získané při studiu témat.
Vlastnosti uhlovodíků závisí na chemické, prostorové, elektronická struktura molekul a povaha chemických vazeb.
Studium struktury, chemických vlastností a způsobů výroby uhlovodíků různé skupiny ukazuje, že jsou všichni geneticky příbuzné mezi sebou, tzn. přeměna některých uhlovodíků na jiné je možná:
To umožňuje cílenou syntézu specifikovaných sloučenin pomocí řady nezbytných chemických reakcí (řetězec transformací).
Úkol 1. Pojmenujte meziprodukty v transformačním schématu:
Ethylalkohol H 2 SO 4 (k), t X HBr Y Na Z Cr 2 O 3 Al 2 O 3 butadien-1,3
Řešení. V tomto řetězci transformací, včetně 4 reakcí, z ethylalkoholu S 2
N 5
ON musí být získán butadien-1,3 CH 2
=CH–CH=CH 2
.
1. Při zahřívání alkoholů s koncentrovanou kyselinou sírovou
Dochází k H 2 SO 4 (činidlo odstraňující vodu). dehydratace s tvorbou alkenu.Odstranění vody z ethylalkoholu vede ke vzniku ethylenu:
2. Ethylen je zástupcem alkenů. Jelikož se jedná o nenasycenou sloučeninu, je schopna vstupovat do adičních reakcí. Jako výsledek hydrobromace ethylen:
3.Při zahřívání bromethanu v přítomnosti kovový sodík (Wurtzova reakce vzniká n-butan (látka Z):
4.Dehydrogenace n-butan v přítomnosti katalyzátoru je jednou z metod výroby butadienu-1,3 CH 2
=CH–CH=CH 2
(Oddíl 5.4. Příprava alkadienů).
Odpovědět: 
1. Proveďte transformace:

Provádění cvičení k upevnění znalostí.
Žáci plní úkoly ve svých pracovních sešitech.
Uveďte pomocí schématu genetického spojení, ze kterých látek, jejichž vzorce jsou uvedeny v úloze, lze v jedné fázi získat alkoholy? Zapište rovnice pro odpovídající reakce. Pojmenujte výchozí látky a produkty reakce. U přípon v názvech uhlovodíků a halogenovaných uhlovodíků podtrhněte odpovídajícím způsobem násobnost vazby.
Pojmenujte třídu látek a vytvořte genetický vztah (ukažte to šipkami).
Proveďte transformace:
CaC2 → A → B → H3C-CH2-Cl → B → H3C-CH2-O-C3H7
CaC2 + 2H20 → HC≡CH + Ca(OH)2A
2) HC≡CH + 2H2 → H3C-CH3B
3) H3C-CH3 + C12 → H3C-CH2-C1 + HC1
4) H3C-CH2-C1 + KOH (aq.) → H3C-CH2-OH + KS1 B
5) H3C-CH2-OH + HO-C3H7 → H3C-CH2-O-C3H7 + H20
Nyní si náš úkol trochu zkomplikujeme. . Vytvořte řetězec transformací z navrhovaná spojení. Mezi vzorci látek jsou „extra“. Jaký je tento úkol v porovnání s předchozím?
A ) C 6H5- ACH, b) C4H8, c) C 6H5- Br, d) C5Hn-Cl, e) C 6H6, f) C3H6, g )HC≡CH, h)H2C =CH2i) CH 4 .
CH4 → HC≡CH → C6H6 → C6H5-Br → C6H5-OH
2CH4 → HC=CH + 3H 2
3HC≡CH -> C6H6
3. C6H6 + Br2 -> C6H5Br + HBr
4. C6H5-Br + KOH -> C6H5-OH + KBr
Posilování vlastností uhlovodíků formou hry „Ne-ano“»
1. Můžete získat alkohol z ethenu? (Ano)
2. Nachází se etanol v listech rostlin? (Ne)
3. Fermentací cukernatých látek vzniká metanol? (Ne)
4. Od dřevěné hobliny Je možné vyrobit etanol fermentací? (Ne)
5. Pokud zmrazíte brambory, můžete získat ethylalkohol? (Ano)
.Reflexní test:
1. To se mi bude v životě hodit.
2. Během hodiny bylo o čem přemýšlet.
3. Dostal jsem odpovědi na všechny otázky, které jsem měl.
4. Během hodiny jsem pracoval svědomitě.
Domácí práce. Pov.§20-21, transformační schémata cvičení 14,15*,
Proveďte transformace:
C2H5OH-C2H5CL-C2H5OH-C2H5OC2H5
CO2
Bibliografie
Chemie.Organická chemie.10. ročník: učebnice. pro všeobecné vzdělání instituce: základní úroveň G.E. Rudzitis, F.G. Feldman. – 13. vyd.-M.: Vzdělávání, 2009.
Chemie 8-11 třída ( tématické plánování podle učebnice G.E. Rudzitise, F.G. Feldmana) / komp. Breiger L.M.-Volgograd: Učitel-AST, 1999
Chemie. Velká příručka pro přípravu na jednotnou státní zkoušku: vzdělávací Toolkit/ Edited by V.N. Doronkina. - 2. vydání, přepracované - Rostov n/D: Legion, 2016.
Surovtseva R.P. a další.Chemie.10-11 ročníků: Metodická příručka.- M.: Drop, 2000.
Tazhibaeva Asemgul Isintaevna
Učitel ve společnosti Kamennobrod Secondary School
Hodina chemie v 11. třídě
Téma lekce: Genetické vztahy mezi uhlovodíky, alkoholy, aldehydy, alkoholy, karboxylovými kyselinami.
Typ lekce: lekce zobecnění znalostí.
Cíle lekce: konsolidovat, zobecňovat a systematizovat znalosti o organických sloučeninách obsahujících kyslík, a to i na základě genetických souvislostí mezi třídami těchto látek. Posílit schopnost předpovídat chemické vlastnosti neznámých organických látek na základě znalosti funkčních skupin. Rozvíjet u studentů demonstrativní řeč, schopnost používat chemickou terminologii, provádět, pozorovat a popisovat chemický experiment. Pěstovat potřebu znalostí o látkách, se kterými přicházíme v životě do styku.
Metody: verbální, vizuální, praktické, hledání problémů, kontrola znalostí.
Činidla: kyselina acetylsalicylová (aspirin), voda, chlorid železitý (III), roztok glukózy, univerzální indikátor, roztok síranu měďnatého, roztok hydroxidu sodného, vaječný bílek, ethanol, 1-butanol, kyselina octová, kyselina stearová.
Zařízení: počítač, plátno, projektor, tabulka „Klasifikace organických látek obsahujících kyslík“, doprovodná poznámka „Funkční skupina určuje vlastnosti látky“, hmoždíř a palička, skleněná tyčinka, lihová lampa, držák na zkumavku, nálevka, filtr, sklenice, stojan se zkumavkami, pipeta, odměrný válec na 10 ml.
I. Organizační moment.
Dnes ve třídě:
1) Posílíte schopnost předvídat chemické vlastnosti neznámých organických látek na základě znalosti funkčních skupin.
2) Zjistíte, jaké funkční skupiny znáte, jsou součástí nejznámějšího léku proti horečce.
3) Funkční skupiny najdete v látce sladké chuti, která se používá v lékařství jako živina a složka tekutin nahrazujících krev.
4) Uvidíte, jak můžete získat čisté stříbro.
5) Budeme mluvit o fyziologických účincích ethylalkoholu.
6) Probereme důsledky pití alkoholických nápojů těhotnými ženami.
7) Budete příjemně překvapeni: ukáže se, že už toho tolik víte!
II. Opakování a zobecnění nabytých znalostí studentů.
1. Klasifikace organických sloučenin obsahujících kyslík.
Zobecnění materiálu začínáme klasifikací organických látek obsahujících kyslík. K tomu použijeme tabulku „Klasifikace organických sloučenin obsahujících kyslík“. Při frontální práci zopakujeme funkční skupiny obsahující kyslík.
V organické chemii existují tři nejdůležitější funkční skupiny, včetně atomů kyslíku:hydroxyl, karbonyl Akarboxyl. To druhé lze považovat za kombinaci předchozích dvou. Podle toho, se kterými atomy nebo skupinami atomů jsou tyto funkční skupiny spojeny, se látky obsahující kyslík dělí na alkoholy, fenoly, aldehydy, ketony a karboxylové kyseliny.
Uvažujme tyto funkční skupiny a jejich vliv na fyzikální a chemické vlastnosti látek.
Prohlížení videoklipu.
Už víte, že to není jediný možný klasifikační znak. V molekule může být několik stejných funkčních skupin a věnujte pozornost odpovídajícímu řádku tabulky.
Další řádek odráží klasifikaci látek podle typu radikálu spojeného s funkční skupinou. Rád bych upozornil na skutečnost, že na rozdíl od alkoholů, aldehydů, ketonů a karboxylových kyselin jsou hydroxyareny řazeny do samostatné třídy sloučenin - fenolů.
Počet funkčních skupin a struktura radikálu určují obecný molekulární vzorec látek. V této tabulce jsou uvedeny pouze pro omezující zástupce tříd s jednou funkční skupinou.
Všechny třídy sloučenin, které se „vejdou“ do tabulky, jsoumonofunkční, tj. mají pouze jednu funkci obsahující kyslík.
Pro upevnění látky o klasifikaci a názvosloví látek obsahujících kyslík uvádím několik vzorců sloučenin a žádám studenty, aby určili „své místo“ v dané klasifikaci a uvedli název.
vzorec
Vztah mezi strukturou a vlastnostmi sloučenin obsahujících kyslík.
Povaha funkční skupiny má významný vliv na fyzikální vlastnosti látek této třídy a do značné míry určuje její chemické vlastnosti.
Pojem „fyzikální vlastnosti“ zahrnuje stav agregace látek.
Souhrnný stav lineárních spojů různých tříd:
Počet atomů C v molekule
Homologní řada aldehydů začíná plynnou látkou při pokojové teplotě - formaldehydem a mezi jednosytnými alkoholy a karboxylovými kyselinami nejsou žádné plyny. S čím to souvisí?
Molekuly alkoholů a kyselin jsou navíc vzájemně spojeny vodíkovými vazbami.
Učitel požádá studenty, aby formulovali definici „vodíkové vazby“ (jedná se o mezimolekulární vazbu mezi kyslíkem jedné molekuly a hydroxylovým vodíkem jiné molekuly), opraví a případně nadiktuje pro zápis: chemická vazba mezi elektronově deficitním atomem vodíku a elektronově bohatým atomem prvku s vysokou elektronegativitou (F , Ó , N ) je nazývánvodík.
Nyní porovnejte teploty varu (°C) prvních pěti homologů látek tří tříd.
Počet atomů C v molekule
Co můžete říci po zhlédnutí tabulek?
V homologní řadě alkoholů a karboxylových kyselin nejsou žádné plynné látky a teploty varu látek jsou vysoké. To je způsobeno přítomností vodíkových vazeb mezi molekulami. Vlivem vodíkových vazeb se molekuly spojují (jakoby zesíťují), proto, aby se molekuly uvolnily a získaly těkavost, je nutné vynaložit další energii na rozbití těchto vazeb.
Co lze říci o rozpustnosti alkoholů, aldehydů a karboxylových kyselin ve vodě? (Ukázka rozpustnosti alkoholů - ethyl, propyl, butyl a kyselin - mravenčí, octové, propionové, máselné a stearové ve vodě. Dále je prokázán roztok mravenčího aldehydu ve vodě.)
Při odpovídání se používá schéma tvorby vodíkových vazeb mezi molekulami kyseliny a vody, alkoholů a kyselin.


Je třeba si uvědomit, že s rostoucí molekulovou hmotností klesá rozpustnost alkoholů a kyselin ve vodě. Čím větší je uhlovodíkový radikál v molekule alkoholu nebo kyseliny, tím obtížnější je pro OH skupinu udržet molekulu v roztoku kvůli tvorbě slabých vodíkových vazeb.
3. Genetický vztah mezi různými třídami sloučenin obsahujících kyslík.
Nakreslím na tabuli vzorce řady sloučenin obsahujících jeden atom uhlíku:
CH 4 →CH 3 OH → HCOH → HCOOH → CO 2
Proč se v kurzu organické chemie studují v tomto pořadí?
Jak se změní oxidační stav atomu uhlíku?
Studenti diktují řádek: -4, -2, 0, +2, +4
Nyní je jasné, že každá následující sloučenina je stále více oxidovanou formou předchozí. Odtud je zřejmé, že bychom se měli pohybovat po genetické řadě zleva doprava pomocí oxidačních reakcí a v opačném směru pomocí redukčních procesů.
Vypadnou ketony z tohoto „kruhu příbuzných“? Samozřejmě že ne. Jejich předchůdci jsou sekundární alkoholy.
Chemické vlastnosti každé třídy látek byly podrobně diskutovány v odpovídajících lekcích. Abych tento materiál shrnul, nabídl jsem domácí úkoly o interkonverzích v poněkud neobvyklé formě.
1. Sloučenina s molekulovým vzorcemC 3 H 8 Ó podrobeny dehydrogenaci, což vede k produktu s kompozicíC 3 H 6 Ó . Tato látka prochází reakcí „stříbrného zrcadla“ a tvoří sloučeninuC 3 H 6 Ó 2 . Úpravou posledně jmenované látky hydroxidem vápenatým byla získána látka, která se používá jako potravinářská přísada pod kódem E 282. Zabraňuje růstu plísní v pekařských a cukrářských výrobcích a kromě toho se vyskytuje ve výrobcích, jako je švýcarský sýr . Určete vzorec přísady E 282, napište rovnice pro uvedené reakce a pojmenujte všechny organické látky.
Řešení :
CH 3 – CH 2 – CH 2 –OH → CH 3 – CH 2 - COH + H 2 ( kočka. – Cu, 200-300 °C)
CH 3 – CH 2 – COH + Ag 2 O → CH 3 – CH 2 – COOH + 2Ag (zjednodušená rovnice, čpavkový roztok oxidu stříbrného)
2CH 3 – CH 2 -COOH+Sa(OH) 2 → (CH 3 – CH 2 – provozní ředitel) 2 Ca+2H 2 Ó.
Odpověď: propionát vápenatý.
2. Kompoziční sloučeninaC 4 H 8 Cl 2 s rovnou uhlíkovou kostrou zahřátou vodným roztokemNaOH a získal organickou látku, která po oxidaciCu(OH) 2 proměnilC 4 H 8 Ó 2 . Určete strukturu původní sloučeniny.
Řešení: pokud jsou 2 atomy chloru umístěny na různých atomech uhlíku, pak při zpracování alkálií bychom získali dvojsytný alkohol, který by neoxidovalCu(OH) 2 . Pokud by 2 atomy chloru byly umístěny na jednom atomu uhlíku uprostřed řetězce, pak by při zpracování alkálií získal keton, který neoxidujeCu(OH) 2. Potom je požadované připojení1,1-dichlorbutan.
CH 3 – CH 2 – CH 2 – CHCl 2 + 2NaOH → CH 3 – CH 2 – CH 2 – COH + 2NaCl + H 2 Ó
CH 3 – CH 2 – CH 2 – COH + 2 Cu(OH) 2 →CH 3 – CH 2 – CH 2 – COOH + Cu 2 0+2H 2 Ó
3. Při zahřívání 19,2 g sodné soli nasycené jednosytné kyseliny s hydroxidem sodným vzniklo 21,2 g uhličitanu sodného. Pojmenujte kyselinu.
Řešení:
Při zahřívání dochází k dekarboxylaci:
R-COONa + NaOH → RH + Na 2 CO 3
υ (Na 2 CO 3 ) = 21,2 / 106 = 0,2 krtek
υ (R-COONa) = 0,2 krtek
M(R-COONa) = 19,2 / 0,2 = 96 G/ krtek
M(R-COOH) = M(R-COONa) –M(Na) + M(H) = 96-23 + 1 = 74G/ krtek
V souladu s obecným vzorcem pro nasycené jednosytné karboxylové kyseliny je pro určení počtu atomů uhlíku nutné vyřešit rovnici:
12n + 2n + 32= 74
n=3
Odpověď: kyselina propionová.
Pro upevnění znalostí o chemických vlastnostech organických látek obsahujících kyslík provedeme test.
1 možnost
Následující vzorce odpovídají nasyceným jednosytným alkoholům:
A)
CH
2
Ó
b)
C
4
H
10
Ó
V)
C
2
H
6
Ó
G)
CH
4
Ó
D)
C
2
H
4
Ó
2
Obsahuje kombinaci dvou principů,
Jeden je u zrodu zrcadel.
Samozřejmě ne k zamyšlení,
A pro vědu o porozumění.
...A v království lesa je nalezena,
Malí bratři jsou zde její přátelé,
Jejich srdce jsou jim zcela dána...
možnosti:
A) kyselina pikrová
B) kyselina mravenčí
B) kyselina octová
D) karboxylová skupina
D) kyselina benzoová
Ethanol reaguje s látkami:
A)
NaOH
b)
Na
V)
HCl
G)
CH
3
COOH
D)
FeCl
3
Kvalitativní reakce na fenoly je reakce s
A)
NaOH
b)
Cu(OH)
2
V)
CuO
G)
FeCl
3
D)
HNO
3
Ethanal reaguje s látkami
A) methanol
B) vodík
B) roztok amoniaku oxidu stříbrného
D) hydroxid měďnatý (II).
D) chlorovodík
Možnost 2
Aldehydy lze získat
A) oxidace alkenů
B) oxidace alkoholů
B) hydratace alkynů
D) při zahřívání vápenatých solí karboxylových kyselin
D) hydratace alkenů
Funkční skupina alkoholů je
A)
COH
b)
ACH
V)
COOH
G)
N.H.
2
D)
NE
2
2-methylbutanol-2
A) nenasycený alkohol
B) omezení alkoholu
B) jednosytný alkohol
D) terciární alkohol
D) aldehyd
Pozoroval jsi reakci?
A) pro vícesytné alkoholy
B) oxidace alkoholu
B) interakce fenolu s chloridem železitým
D) "stříbrné zrcadlo"
D) "měděné zrcadlo"
Kyselina octová reaguje s látkami
A) vodík
B) chlór
B) propanol
D) hydroxid sodný
D) metanalem
Studenti vyplní své odpovědi do tabulky:
1, 2 var.
Spojíte-li správné odpovědi plnou čarou, dostanete číslo „5“.
Skupinová práce studentů.
Úkol pro skupinu 1

cíle:
Reagencie a vybavení: kyselina acetylsalicylová (aspirin), voda, chlorid železitý; hmoždíř a palička, skleněná tyčinka, lihová lampa, držák na zkumavku, nálevka, filtr, sklenice, stojan se zkumavkami, pipeta, odměrný válec 10 ml.
Pokus 1. Důkaz nepřítomnosti fenolického hydroxylu v kyselině acetylsalicylové (aspirinu).
Vložte 2-3 zrnka kyseliny acetylsalicylové do zkumavky, přidejte 1 ml vody a důkladně protřepejte. Do výsledného roztoku přidejte 1-2 kapky roztoku chloridu železitého. co pozoruješ? Vyvodit závěry.
Žádná fialová barva se neobjeví. Proto v kyselině acetylsalicylovéNOOS-S 6 N 4 -O-CO-CH 3 neexistuje žádná volná fenolová skupina, protože tato látka je ester tvořený kyselinou octovou a salicylovou.
Pokus 2. Hydrolýza kyseliny acetylsalicylové.
Rozdrcená tableta kyseliny acetylsalicylové se vloží do zkumavky a přidá se 10 ml vody. Obsah zkumavky přiveďte k varu a vařte 0,5-1 minuty. Roztok přefiltrujte. Poté se k výslednému filtrátu přidají 1-2 kapky roztoku chloridu železitého. co pozoruješ? Vyvodit závěry.
Napište rovnici reakce:

Dokončete práci vyplněním tabulky, která obsahuje následující sloupce: provedená operace, činidlo, pozorování, závěr.
Objeví se fialové zbarvení indikující uvolňování kyseliny salicylové obsahující volnou fenolovou skupinu. Kyselina acetylsalicylová se jako ester snadno hydrolyzuje, když se vaří s vodou.
Úkol pro skupinu 2
1. Zvažte strukturní vzorce látek, pojmenujte funkční skupiny.

2. Dělejte laboratorní práce„Detekce funkčních skupin v molekule glukózy“.
cíle: upevnit znalosti studentů o kvalitativních reakcích organických sloučenin, rozvíjet dovednosti v experimentálním určování funkčních skupin.
Reagencie a vybavení: řešení glukóza, univerzální indikátor, roztok síranu měďnatého, roztok hydroxidu sodného, lihová lampa, držák na zkumavku, zápalky, odměrný válec 10 ml.
2.1. Nalijte 2 ml roztoku glukózy do zkumavky. Pomocí univerzálního indikátoru udělejte závěr o přítomnosti nebo nepřítomnosti karboxylové skupiny.
2.2. Připravte hydroxid měďnatý (II): nalijte 1 ml síranu měďnatého do zkumavky a přidejte do ní hydroxid sodný. Ke vzniklé sraženině přidejte 1 ml glukózy a protřepejte. co pozoruješ? Pro jaké funkční skupiny je tato reakce typická?
2.3. Směs získanou v pokusu č. 2 zahřejte. Všimněte si změn. Pro jakou funkční skupinu je tato reakce typická?
2.4. Dokončete práci vyplněním tabulky, která obsahuje následující sloupce: provedená operace, činidlo, pozorování, závěr.
Demonstrační zkušenost. Interakce roztoku glukózy s roztokem amoniaku oxidu stříbrného.
Výsledky práce:
- není zde žádná karboxylová skupina, protože roztok má neutrální reakci na indikátor;
- sraženina hydroxidu měďnatého (II) se rozpustí a objeví se jasně modrá barva, charakteristická pro vícesytné alkoholy;
- při zahřívání tohoto roztoku se vysráží žlutá sraženina hydroxidu měďnatého, která dalším zahříváním zčervená, což ukazuje na přítomnost aldehydové skupiny.
Závěr. Molekula glukózy tedy obsahuje karbonylové a několik hydroxylových skupin a je to aldehydalkohol.
Úkol pro skupinu 3
Fyziologický účinek etanolu
1. Jaký vliv má etanol na živé organismy?
2. Pomocí zařízení a činidel dostupných na stole demonstrujte účinek etanolu na živé organismy. Komentujte, co vidíte.
Účel zážitku: přesvědčit studenty, že alkohol denaturuje bílkoviny a nevratně narušuje jejich strukturu a vlastnosti.
Vybavení a činidla: stojan se zkumavkami, pipeta, odměrný válec 10 ml, vaječný bílek, etanol, voda.
Průběh experimentu: Do 2 zkumavek nalijte 2 ml vaječného bílku. Do jedné přidejte 8 ml vody a do druhé stejné množství ethanolu.
V první zkumavce se protein rozpustí a je tělem dobře absorbován. V druhé zkumavce se tvoří hustá bílá sraženina - bílkoviny se v alkoholu nerozpouštějí, alkohol bílkovinám vodu odebírá. V důsledku toho dochází k narušení struktury a vlastností proteinu a jeho funkcí.
3. Řekněte nám o vlivu ethylalkoholu na různé lidské orgány a orgánové systémy.
Vysvětlete těhotným ženám následky pití alkoholu.
Studentská vystoupení.
Od pradávna zná člověk velké množství toxických látek, které se všechny liší silou účinku na organismus. Mezi nimi vyniká látka, která je v medicíně známá jako silný protoplazmatický jed – ethylalkohol. Úmrtnost na alkoholismus převyšuje počet úmrtí způsobených všemi infekčními nemocemi dohromady.
Popálením sliznice úst, hltanu a jícnu se dostává do gastrointestinálního traktu. Na rozdíl od mnoha jiných látek se alkohol v žaludku rychle a úplně vstřebá. Snadno prochází biologickými membránami, asi po hodině dosahuje maximální koncentrace v krvi.
Molekuly alkoholu rychle pronikají biologickými membránami do krve ve srovnání s molekulami vody. Molekuly ethylalkoholu mohou snadno procházet biologickými membránami díky své malé velikosti, slabé polarizaci, tvorbě vodíkových vazeb s molekulami vody a dobré rozpustnosti alkoholu v tucích.
Alkohol se rychle vstřebává do krve a dobře se rozpouští v mezibuněčné tekutině a vstupuje do všech buněk těla. Vědci zjistili, že narušením funkcí buněk způsobuje jejich smrt: při pití 100 g piva odumře asi 3000 mozkových buněk, 100 g vína - 500, 100 g vodky - 7500, kontakt červených krvinek s molekul alkoholu vede ke srážení krvinek.
Játra neutralizují toxické látky, které se dostávají do krve. Lékaři tento orgán nazývají cílem alkoholu, protože je v něm neutralizováno 90 % etanolu. Chemické procesy oxidace ethylalkoholu probíhají v játrech.
Připomínáme se studenty fáze procesu oxidace alkoholu:

Ethylalkohol se oxiduje na konečné produkty rozkladu pouze v případě, že denní spotřeba etanolu nepřesáhne 20 g. Při překročení dávky se pak v těle hromadí meziprodukty rozkladu.
To vede k řadě negativních vedlejších účinků: zvýšená tvorba tuku a jeho hromadění v jaterních buňkách; akumulace peroxidových sloučenin, které mohou zničit buněčné membrány, což má za následek únik obsahu buněk ven vytvořenými póry; velmi nežádoucí jevy, jejichž kombinace vede k destrukci jater - cirhóze.
Acetaldehyd je 30krát toxičtější než ethylalkohol. Navíc je v důsledku různých biochemických reakcí v tkáních a orgánech včetně mozku možný vznik tetrahydropapaverolinu, který svou strukturou a vlastnostmi připomíná známá psychofarmaka – morfin a kanabinol. Lékaři prokázali, že právě acetaldehyd způsobuje mutace a různé deformace embryí.
Kyselina octová zvyšuje syntézu mastných kyselin a vede k tukové degeneraci jater.
Při studiu fyzikálních vlastností alkoholů jsme se zabývali otázkou změn jejich toxicity u homologní řady jednosytných alkoholů. S rostoucí molekulovou hmotností molekul látek se zvyšují jejich narkotické vlastnosti. Pokud porovnáme ethyl a pentylalkoholy, jejich molekulová hmotnost je 2krát větší a jejich toxicita je 20krát větší. Alkoholy obsahující tři až pět atomů uhlíku tvoří tzv. fuselové oleje, jejichž přítomnost v alkoholických nápojích zvyšuje jejich toxické vlastnosti.
V této sérii je výjimkou metanol – nejsilnější jed. Při vstupu 1-2 lžičky do těla dochází k postižení zrakového nervu, což vede k úplné slepotě a konzumace 30-100 ml vede ke smrti. Nebezpečí zvyšuje podobnost metylalkoholu s ethylalkoholem ve vlastnostech, vzhledu a vůni.
Společně se studenty se snažíme najít příčinu tohoto jevu. Předkládají různé hypotézy. Pozastavíme se nad tím, že mezi faktory zvyšující toxicitu metylalkoholu patří malá velikost molekul (vysoká rychlost distribuce), stejně jako skutečnost, že meziprodukty jeho oxidace – aldehyd mravenčí a kyselina mravenčí – jsou silné jedy.
Alkohol, který není neutralizován játry a toxické produkty jeho rozkladu se znovu dostávají do krevního oběhu a jsou distribuovány po celém těle a zůstávají v něm po dlouhou dobu. Například alkohol se v mozku nachází v nezměněné podobě 20 dní po jeho požití.
Žáky upozorňujeme na to, jak se alkohol a produkty jeho rozkladu z těla vylučují.
C 2 H 5 ACH
Bohužel v poslední době se konzumace alkoholu, stejně jako kouření, mezi ženami rozšířila. Vliv alkoholu na potomky jde dvěma směry.
Za prvé, konzumace alkoholu je doprovázena hlubokými změnami v sexuální sféře mužů i žen. Alkohol a jeho produkty rozkladu mohou ovlivnit ženské i mužské reprodukční buňky ještě před oplodněním - mění se jejich genetická informace (viz obr. „Zdravé (1) a patologické (2) spermie“).

Pokud je konzumace alkoholu prodloužena, činnost reprodukčního systému je narušena, začíná produkovat defektní zárodečné buňky.
Za druhé, alkohol přímo ovlivňuje embryo. Neustálá konzumace 75-80 g vodky, koňaku nebo 120-150 g slabších alkoholických nápojů (piva) může způsobit fetální alkoholový syndrom. Přes placentu se do vod obklopujících plod dostává nejen alkohol, ale i produkty jeho rozkladu, zejména acetaldehyd, který je desetkrát nebezpečnější než samotný alkohol.
Intoxikace alkoholem má škodlivý vliv na plod, protože jeho játra, kam se dostává především krev z placenty, ještě nemají speciální enzym, který alkohol rozkládá, a ten se nezneutralizovaný šíří po těle a způsobuje nevratné změny. Alkohol je nebezpečný zejména v 7. – 11. týdnu těhotenství, kdy se začínají vyvíjet vnitřní orgány. Negativně ovlivňuje jejich vývoj, způsobuje poruchy a změny. Postižený je zejména mozek. Vlivem alkoholu se může rozvinout demence, epilepsie, neurózy, poruchy srdce a ledvin, může dojít k poškození vnějších i vnitřních pohlavních orgánů.
Někdy jsou poškození psychiky a intelektu pozorována již v raném dětství, ale nejčastěji jsou zjištěna, když děti začínají studovat. Takové dítě je intelektuálně oslabené a agresivní. Alkohol působí na dětský organismus mnohem silněji než na tělo dospělého. Nervový systém a mozek dítěte jsou obzvláště citlivé a zranitelné.
Podívejme se tedy na tabulku „Vliv alkoholu na dědičnost a zdraví dětí“ a vyvodíme závěry .
Dětské osudy
Dlouhodobá konzumace alkoholických nápojů vede ke změkčení kůry. Jsou pozorovány četné bodové krvácení; je narušen přenos vzruchu z jedné nervové buňky na druhou. Nezapomeňte na lakonická varovná slova V. V. Majakovského:
Nepijte alkohol.
Pro ty, kteří ho pijí, je to jed, pro jeho okolí je to mučení.
Tím jste si upevnili schopnost předpovídat chemické vlastnosti neznámých organických látek, opírali se o znalost funkčních skupin, zopakovali jste si fyzikální a chemické vlastnosti organických látek obsahujících kyslík a upevnili jste schopnost určit příslušnost organických sloučenin do tříd látek.
III. Domácí práce.
1. Proveďte transformace:

2. Studujte možné příčiny znečištění životního prostředí v blízkosti výroby: metanol, fenol, formaldehyd, kyselina octová. Analyzujte vliv těchto látek na přírodní objekty: atmosféru, vodní zdroje, půdu, rostliny, zvířata a člověka. Popište opatření první pomoci při otravě