Hemogramma
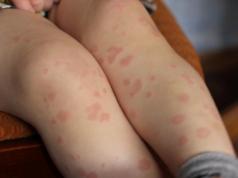
Hemogramma(grieķu haimas asinis + grama apzīmējums) – klīniskā asins analīze. Ietver datus par visu asins šūnu skaitu, to morfoloģiskajām iezīmēm, ESR, hemoglobīna saturu, krāsu indeksu, hematokrīta skaitli, attiecību dažādi veidi leikocīti utt.
Asinis pētniecībai ņem 1 stundu pēc plaušu dūriena no pirksta (auss ļipiņas vai papēža jaundzimušajiem un maziem bērniem). Punkcijas vietu apstrādā ar vates tamponu, kas samitrināts ar 70% etilspirtu. Āda tiek caurdurta ar standarta vienreizējās lietošanas skarifikatora šķēpu. Asinīm vajadzētu brīvi plūst. Jūs varat izmantot asinis, kas ņemtas no vēnas.
Asins sabiezēšanas gadījumā hemoglobīna koncentrācija var palielināties; palielinoties asins plazmas tilpumam, var rasties samazināšanās.
Asins šūnu skaita noteikšana tiek veikta Gorjajeva skaitīšanas kamerā. Kameras augstums, režģa laukums un tā sadalījums, kā arī testēšanai ņemto asiņu atšķaidījums ļauj noteikt izveidoto elementu skaitu noteiktā asins tilpumā. Gorjajeva kameru var aizstāt ar automātiskiem skaitītājiem. To darbības princips ir balstīts uz šķidrumā esošo suspendēto daļiņu atšķirīgo elektrovadītspēju.
Normāls sarkano asins šūnu skaits 1 litrā asiņu
|
4,0–5,0 × 10 12 |
|
|
3,7–4,7 × 10 12 |
Sarkano asins šūnu skaita samazināšanās (eritrocitopēnija) ir raksturīga anēmijai: pieaugums tiek novērots ar hipoksiju, iedzimtiem sirds defektiem, sirds un asinsvadu mazspēju, eritrēmiju utt.
Trombocītu skaits tiek skaitīts, izmantojot dažādas metodes (asins uztriepes, Gorjajeva kamerā, izmantojot automātiskos skaitītājus). Pieaugušajiem trombocītu skaits ir 180,0–320,0 × 10 9 /l. Trombocītu skaita palielināšanās tiek novērota ļaundabīgo audzēju, hroniskas mieloleikozes, osteomielofibrozes u.c. Samazināts saturs trombocītu skaits var būt dažādu slimību simptoms, piemēram, trombocitopēniskā purpura. Klīniskajā praksē visbiežāk sastopama imūnā trombocitopēnija. Retikulocītu skaits tiek skaitīts asins uztriepes vai Gorjajeva kamerā. Pieaugušajiem to saturs ir 2–10 ‰.
Normāls balto asinsķermenīšu skaits pieaugušajiem svārstās no 4,0 pirms tam 9,0 × 10 9 /l. Bērniem tas ir nedaudz lielāks. Leikocītu skaits ir mazāks 4,0 × 10 9 /l apzīmē ar terminu “leikopēnija”, vairāk 10,0 × 10 9 /l- termins "leikocitoze". Veselam cilvēkam leikocītu skaits nav nemainīgs un dienas laikā var būtiski svārstīties (diennakts bioritmi). Svārstību amplitūda ir atkarīga no vecuma, dzimuma, konstitucionālajām īpašībām, dzīves apstākļiem, fiziskās aktivitātes uc Leikopēnijas attīstību izraisa vairāki mehānismi, piemēram, leikocītu ražošanas samazināšanās kaulu smadzenēs, kas rodas hipoplastikas gadījumā. un dzelzs deficīta anēmija. Leikocitoze parasti ir saistīta ar neitrofilu skaita palielināšanos, kas biežāk ir saistīta ar leikocītu ražošanas palielināšanos vai to pārdali asinsvadu gultne; novēro daudzos ķermeņa stāvokļos, piemēram, ar emocionālu vai fizisku stresu, ar vairākām infekcijas slimībām, intoksikācijām utt. Parasti pieauguša cilvēka asinīs ir leikocīti. dažādas formas, kas tiek izplatīti krāsainos preparātos šādās attiecībās:
Kvantitatīvās attiecības noteikšana starp atsevišķām leikocītu formām (leikocītu formula) ir klīniski nozīmīga. Visbiežāk tiek novērota tā sauktā leikocītu formulas nobīde pa kreisi. To raksturo nenobriedušu leikocītu formu parādīšanās (joslas šūnas, metamielocīti, mielocīti, blasti utt.). Novērots, kad iekaisuma procesi dažādas etioloģijas, leikēmija.
Izveidoto elementu morfoloģiskā aina tiek pārbaudīta krāsotās asins uztriepes zem mikroskopa. Ir vairāki veidi, kā iekrāsot asins uztriepes, pamatojoties uz šūnu elementu ķīmisko afinitāti pret noteiktām anilīna krāsām. Tādējādi citoplazmas ieslēgumi tiek metahromātiski iekrāsoti ar organisko krāsvielu debeszilā spilgti purpursarkanā krāsā (azurophilia). Krāsotās asins uztriepes nosaka leikocītu, limfocītu, eritrocītu (mikrocītu, makrocītu un megalocītu) lielumu, to formu, krāsu, piemēram, eritrocīta piesātinājumu ar hemoglobīnu (krāsu indikators), leikocītu citoplazmas krāsu, limfocītu , ir noteikti. Zems krāsu indekss norāda uz hipohromiju, to novēro anēmijas gadījumā, ko izraisa dzelzs deficīts eritrocītos vai tā neizmantošana hemoglobīna sintēzei. Augsts krāsu indekss norāda uz hiperhromiju anēmijas gadījumā, ko izraisa vitamīnu trūkums IN 12 un (vai) folijskābe, hemolīze.
Eritrocītu sedimentācijas ātrumu (ESR) nosaka ar Pančenkova metodi, kuras pamatā ir sarkano asinsķermenīšu īpašība nosēsties, kad nekoagulētas asinis ievieto vertikālā pipetē. ESR ir atkarīgs no sarkano asins šūnu skaita un to lieluma. Apjoms un spēja veidot aglomerātus, uz apkārtējās vides temperatūru, asins plazmas olbaltumvielu daudzumu un to frakciju attiecību. Palielināts ESR var rasties infekcijas, imūnpatoloģisku, iekaisuma, nekrotisku un audzēju procesu laikā. Vislielākais ESR pieaugums tiek novērots patoloģiskā proteīna sintēzes laikā, kas raksturīgs mielomai, Valdenstrēma makroglobulinēmijai, vieglo un smago ķēžu slimībai, kā arī hiperfibrinogēnēmijai. Jāpatur prātā, ka fibrinogēna satura samazināšanās asinīs var kompensēt albumīna un globulīnu attiecības izmaiņas, kā rezultātā ESR paliek normāls vai palēninās. Akūtu infekcijas slimību gadījumā (piemēram, gripa, iekaisis kakls) augstākais ESR ir iespējams pazeminātas ķermeņa temperatūras periodā, procesam apgriezti attīstoties. Lēna ESR ir daudz retāk sastopama, piemēram, ar eritrēmiju, sekundāru eritrocitozi, paaugstinātu žultsskābju un žults pigmentu koncentrāciju asinīs, hemolīzi, asiņošanu utt.
Hematokrīta skaitlis - izveidoto asins un plazmas elementu tilpuma attiecība - sniedz priekšstatu par sarkano asins šūnu kopējo tilpumu.
Normāls hematokrīta skaitlis
To nosaka, izmantojot hematokrītu, kas ir divi īsi stikla graduēti kapilāri speciālā sprauslā. Hematokrīta skaitlis ir atkarīgs no sarkano asins šūnu daudzuma asinsritē, asins viskozitātes, asins plūsmas ātruma un citiem faktoriem. Tas palielinās ar dehidratāciju, tirotoksikozi, cukura diabētu, zarnu aizsprostojumu, grūtniecību utt. Zems hematokrīta skaitlis tiek novērots ar asiņošanu, sirds un nieru mazspēju, badošanos un sepsi.
Hemogrammas indikatori parasti ļauj orientēties patoloģiskā procesa īpatnībās. Tādējādi ar vieglu infekcijas slimību gaitu un strutainiem procesiem ir iespējama neliela neitrofila leikocitoze; pasliktināšanos norāda neitrofīlā hiperleikocitoze. Šīs hemogrammas tiek izmantotas, lai uzraudzītu noteiktu zāļu iedarbību. Tādējādi regulāri jānosaka hemoglobīna saturs eritrocītos, lai izveidotu dzelzs preparātu lietošanas režīmu pacientiem ar dzelzs deficīta anēmiju, kā arī leikocītu un trombocītu skaitu leikēmijas ārstēšanā ar citostatiskiem līdzekļiem.
Hemoglobīna struktūra un funkcijas
Hemoglobīns– galvenā sastāvdaļa eritrocīts un galvenais elpceļu pigments, nodrošina skābekļa pārnesi ( PAR 2 ) no plaušām uz audiem un oglekļa dioksīdu ( CO 2 ) no audiem uz plaušām. Turklāt tam ir nozīmīga loma asins skābju-bāzes līdzsvara uzturēšanā. Tiek lēsts, ka viena sarkanā asins šūna satur ~ 340 000 000 hemoglobīna molekulu, no kurām katra sastāv no aptuveni 103 atomiem. Vidēji cilvēka asinīs ir ~750 g hemoglobīna.
Hemoglobīns ir komplekss proteīns, kas pieder pie hemoproteīnu grupas, kura proteīna komponentu attēlo globīns, bet neolbaltumvielu komponentu - četri identiski dzelzs porfirīna savienojumi, ko sauc par hemiem. Dzelzs (II) atoms, kas atrodas hema centrā, piešķir asinīm raksturīgo sarkano krāsu ( skatīt att. 1). Hemoglobīna raksturīgākā īpašība ir atgriezeniska gāzu pievienošana PAR 2 , CO 2 un utt.
Rīsi. 1. Hemoglobīna struktūra
Tika konstatēts, ka hēms iegūst transportēšanas spēju PAR 2 tikai tad, ja to ieskauj un aizsargā specifisks proteīns – globīns (pats hēms nesaista skābekli). Parasti savienojuma laikā PAR 2 ar dzelzi ( Fe) viens vai vairāki elektroni tiek neatgriezeniski pārvietoti no atomiem Fe uz atomiem PAR 2 . Citiem vārdiem sakot, notiek ķīmiska reakcija. Ir eksperimentāli pierādīts, ka mioglobīnam un hemoglobīnam ir unikāla spēja atgriezeniski saistīties O 2 bez hema oksidācijas Fe 2+ in Fe 3+ .
Tādējādi elpošanas process, kas no pirmā acu uzmetiena šķiet tik vienkāršs, faktiski tiek veikts, mijiedarbojoties daudzu veidu atomiem ārkārtīgi sarežģītās milzīgās molekulās.
Asinīs hemoglobīns pastāv vismaz četrās formās: oksihemoglobīns, deoksihemoglobīns, karboksihemoglobīns un methemoglobīns. Eritrocītos hemoglobīna molekulārās formas spēj savstarpēji pārveidoties, to attiecību nosaka organisma individuālās īpašības.
Tāpat kā jebkuram citam proteīnam, hemoglobīnam ir noteikts īpašību kopums, pēc kura to var atšķirt no citām olbaltumvielām un neolbaltumvielām šķīdumā. Šādas īpašības ietver molekulmasu, aminoskābju sastāvu, elektrisko lādiņu un ķīmiskās īpašības.
Praksē visbiežāk tiek izmantotas hemoglobīna elektrolītu īpašības (uz to balstās vadošās tā izpētes metodes) un hema spēju piesaistīt dažādas ķīmiskās grupas, kas izraisa valences izmaiņas. Fe un šķīdumu krāsošana (kalorimetriskās metodes). Tomēr daudzi pētījumi ir parādījuši, ka hemoglobīna noteikšanas vadošo metožu rezultāts ir atkarīgs no asins elektrolītu sastāva, kas apgrūtina šāda pētījuma izmantošanu neatliekamās medicīniskās palīdzības medicīnā.
Kaulu smadzeņu uzbūve un funkcijas
Kaulu smadzenes(medulla ossium) ir centrālais hematopoēzes orgāns, kas atrodas kaulu un kaulu smadzeņu dobumu sūkļveida vielā. Tā pilda arī organisma bioloģiskās aizsardzības un kaulu veidošanās funkcijas.
Cilvēkiem kaulu smadzenes (KM) pirmo reizi parādās 2. embrioģenēzes mēnesī atslēgas kaulā, 3. mēnesī - lāpstiņās, ribās, krūšu kaulā, skriemeļos utt. 5. embrioģenēzes mēnesī kaulu smadzenes darbojas kā galvenais hematopoētiskais orgāns, kas nodrošina diferencētu kaulu smadzeņu asinsradi ar granulocītu, eritrocītu un megakarciocītu sērijas elementiem.
Pieauguša cilvēka organismā izšķir sarkano BM, ko attēlo aktīvi asinsrades audi, un dzelteno, kas sastāv no tauku šūnām. Sarkanā CM aizpilda atstarpes starp plakano kaulu porainās vielas kaulu trabekulām un garo kaulu epifīzēm. Tam ir tumši sarkana krāsa un pusšķidra konsistence, tas sastāv no stromas un hematopoētisko audu šūnām. Stromu veido retikulāri audi, to pārstāv fibroblasti un endotēlija šūnas; satur lielu skaitu asinsvadu, galvenokārt platus plānsienu sinusoidālos kapilārus. Stroma piedalās kaula attīstībā un funkcionēšanā. Telpās starp stromas struktūrām atrodas hematopoēzes procesos iesaistītās šūnas: cilmes šūnas, cilmes šūnas, eritroblasti, mieloblasti, monoblasti, megakarioblasti, promielocīti, mielocīti, metamielocīti, megakariocīti, makrofāgi un nobriedušas asins šūnas.
Sarkanajā BM veidojošās asins šūnas ir sakārtotas salu veidā. Šajā gadījumā eritroblasti ieskauj makrofāgu, kas satur dzelzi, kas nepieciešama hemoglobīna hemīna daļas uzbūvei. Nogatavināšanas procesā granulētie leikocīti (granulocīti) tiek nogulsnēti sarkanajā BM, tāpēc to saturs ir 3 reizes lielāks nekā eritrokariocītos. Megakariocīti ir cieši saistīti ar sinusoidālajiem kapilāriem; daļa to citoplazmas iekļūst asinsvada lūmenā. Atdalītie citoplazmas fragmenti trombocītu veidā nonāk asinsritē. Limfocītu veidošanās cieši ieskauj asinsvadus. Limfocītu prekursori un B limfocīti attīstās sarkanajās kaulu smadzenēs. Parasti tikai nobriedušas asins šūnas iekļūst kaulu smadzeņu asinsvadu sieniņās, tāpēc nenobriedušu formu parādīšanās asinsritē liecina par funkciju izmaiņām vai kaulu smadzeņu barjeras bojājumiem. CM ieņem vienu no pirmajām vietām organismā savu reproduktīvo īpašību ziņā. Vidēji cilvēks ražo:
Bērnībā (pēc 4 gadiem) sarkano KM pakāpeniski aizstāj ar tauku šūnām. Līdz 25 gadu vecumam cauruļveida kaulu diafīzes ir pilnībā piepildītas ar dzeltenām smadzenēm, plakanajos kaulos tas aizņem apmēram 50% no KM tilpuma. Dzeltenais CM parasti neveic hematopoētisko funkciju, bet ar lieliem asins zudumiem tajā parādās hematopoēzes perēkļi. Ar vecumu mainās KM apjoms un masa. Ja jaundzimušajiem tas veido aptuveni 1,4% no ķermeņa svara, tad pieaugušajam tas ir 4,6%.
Kaulu smadzenes ir iesaistītas arī sarkano asins šūnu iznīcināšanā, dzelzs atkārtotā izmantošanā, hemoglobīna sintēzē un kalpo kā vieta rezerves lipīdu uzkrāšanai. Tā kā tas satur limfocītus un mononukleāros fagocītus, tas piedalās imūnreakcijā.
CM kā pašregulējošas sistēmas darbību kontrolē atgriezeniskās saites princips (skaitlis nobriedušas šūnas asinis ietekmē to veidošanās intensitāti). Šo regulējumu nodrošina komplekss starpšūnu un humorālo (poetīnu, limfokīnu un monokīnu) ietekmju kopums. Tiek pieņemts, ka galvenais faktors, kas regulē šūnu homeostāzi, ir asins šūnu skaits. Parasti, šūnām novecojot, tās tiek noņemtas, un to vietu ieņem citi. Ekstrēmos apstākļos (piemēram, asiņošana, hemolīze) mainās šūnu koncentrācija un tiek iedarbināta atgriezeniskā saite; nākotnē process ir atkarīgs no sistēmas dinamiskās stabilitātes un kaitīgo faktoru ietekmes stipruma.
Endogēnu un eksogēno faktoru ietekmē tiek traucēta KM hematopoētiskā funkcija. Bieži vien KM patoloģiskas izmaiņas, īpaši slimības sākumā, neietekmē asins stāvokli raksturojošos rādītājus. Iespējama BM šūnu elementu skaita samazināšanās (hipoplāzija) vai palielināšanās (hiperplāzija). Ar BM hipoplāziju samazinās mielokariocītu skaits, tiek novērota citopēnija, un bieži vien taukaudi dominē pār mieloīdiem audiem. Hematopoēzes hipoplāzija var būt neatkarīga slimība (piemēram, aplastiskā anēmija). Retos gadījumos tas pavada tādas slimības kā hronisks hepatīts, ļaundabīgi audzēji, kā arī dažu veidu mielofibroze, marmora slimība un autoimūnas slimības. Dažās slimībās samazinās vienas sērijas šūnu skaits, piemēram, sarkano (daļēja sarkano šūnu aplāzija) vai granulocītu sērijas (agranulocitoze) šūnu skaits. Vairākos patoloģiskos stāvokļos papildus hematopoēzes hipoplāzijai ir iespējama neefektīva hematopoēze, ko raksturo traucēta asinsrades šūnu nobriešana un izdalīšanās asinīs un to intramedulāra nāve.
CM hiperplāzija rodas dažādu leikēmiju gadījumā. Tādējādi akūtas leikēmijas gadījumā parādās nenobriedušas (blastu) šūnas; hroniskas leikēmijas gadījumā palielinās morfoloģiski nobriedušu šūnu skaits, piemēram, limfocītu skaits limfoleikozē, eritrocīti eritrēmijas gadījumā, granulocīti hroniskas mieloleikozes gadījumā. Ir raksturīga arī eritrocītu šūnu hiperplāzija hemolītiskās anēmijas,IN 12 - deficīta anēmija.
Hemoglobīns- molekula, kas sastāv no globīna proteīna (2a- un 2β-ķēdes) un 4 pigmentu grupām (hēms), kas spēj atgriezeniski saistīt molekulāro skābekli. Viena sarkanā asins šūna satur vidēji 400 miljonus hemoglobīna molekulu. Ar skābekli saistīto hemoglobīnu sauc oksiheluglobīns(piešķir asinīm košu sarkanu krāsu). Tā saistīšanās ar skābekli procesu sauc oksigenācija, un tā atgriešanās pie oke un hemoglobīna - deoksigenācija. Hemoglobīnu, kas nav saistīts ar skābekli, sauc deoksiheluglobīns. Hemoglobīns spēj saistīties ar oglekļa dioksīdu (karbaminghemoglobīns) un oglekļa monoksīdu (karboksihemoglobīns). Turklāt NO, mijiedarbojoties ar šo proteīnu, veido dažādas NO formas: methemoglobīns, nitrozilhemoglobīns(HbFe 2+ NO) un S-nitrozohemoglobīns(SNO-Hb), kas spēlē sava veida hemoglobīna funkcionālās aktivitātes allosteriskā regulatora lomu.
Hemoglobīna norma un funkcijas
Hemoglobīna daudzums vīriešiem ir 130-160 g/l, sievietēm - 120-140 g/l. Skābekļa un oglekļa dioksīda transportēšana ir hemoglobīna funkcija. Hemoglobīns ir sarežģīts ķīmiskais savienojums, kas sastāv no globīna proteīna un četrām hēma molekulām.
Rīsi. Normāls hemoglobīna līmenis vīriešiem un sievietēm
Galvenās funkcijas ir saistītas ar to, ka to sastāvā ir īpašs hromoproteīna proteīns - hemoglobīns. Cilvēka hemoglobīna molekulmasa ir 68 800. Hemoglobīns ir elpceļu enzīms, kas atrodams sarkanajās asins šūnās, nevis plazmā, jo:
- nodrošina asins viskozitātes samazināšanos (vienāda hemoglobīna daudzuma izšķīdināšana plazmā palielinātu asins viskozitāti vairākas reizes un apgrūtinātu sirds darbu un asinsriti);
- samazina plazmas onkotisko spiedienu, novēršot audu dehidratāciju;
- neļauj organismam zaudēt hemoglobīnu, jo tas filtrējas nieru glomerulos un izdalās ar urīnu.
Galvenais hemoglobīna mērķis- skābekļa un oglekļa dioksīda transportēšana. Turklāt hemoglobīnam piemīt bufera īpašības, kā arī spēja saistīt toksiskas vielas.

Rīsi. Hemoglobīna mijiedarbība ar skābekli. k ir reakcijas ātruma konstante
Hemoglobīns sastāv no proteīna daļas (globīna) un neolbaltumvielas dzelzs daļas (hēma). Katrā globīna molekulā ir četras hema molekulas. Dzelzs, kas ir daļa no hema, spēj piesaistīt un atbrīvot skābekli. Šajā gadījumā dzelzs valence nemainās, t.i. tas paliek divvērtīgs. Dzelzs ir daļa no visiem elpošanas enzīmiem.
Vesela cilvēka asinīs hemoglobīna saturs ir 120-165 g/l (sievietēm 120-150 g/l, vīriešiem 130-160 g/l).
Parasti hemoglobīns ir trīs fizioloģisku savienojumu veidā: reducēts, oksihemoglobīns un karboksihemoglobīns. Hemoglobīns, kuram ir pievienots skābeklis, pārvēršas par oksihemoglobīns -НbО2,. Tas ir spilgti sarkans savienojums, kas nosaka arteriālo asiņu krāsu. Viens grams hemoglobīna spēj piesaistīt 1,34 ml skābekļa.
Oksihemoglobīnu, kas ir atteicies no skābekļa, sauc par samazinātu hemoglobīnu (Hb). Tas ir atrodams venozajās asinīs, kurām ir tumša ķiršu krāsa. Turklāt venozās asinis satur hemoglobīna savienojumu ar oglekļa dioksīdu - karbohemoglobīns(HbCO 2), kas transportē oglekļa dioksīdu no audiem uz plaušām.
Hemoglobīnam ir spēja veidot patoloģiskus savienojumus. Viens no tiem ir karboksihemoglobīns - hemoglobīna savienojums ar oglekļa monoksīds(HbCO). Dzelzs hemoglobīna afinitāte pret oglekļa monoksīdu pārsniedz afinitāti pret skābekli, tāpēc pat 0,1% oglekļa monoksīda gaisā noved pie 80% hemoglobīna pārvēršanās par karboksihemoglobīnu, kas nespēj piesaistīt skābekli, kas apdraud dzīvību. Viegla saindēšanās ar oglekļa monoksīdu ir atgriezenisks process. Ieelpojot svaigu gaisu, izdalās oglekļa monoksīds. Ieelpošana tīrs skābeklis palielina HbCO sadalīšanās ātrumu 20 reizes.
Tabula. Hemoglobīna īpašības

Methemoglobīns(MetHb) arī ir patoloģisks savienojums, tas ir oksidēts hemoglobīns, kurā spēcīgu oksidētāju (feracianīda, kālija permanganāta, ūdeņraža peroksīda, anilīna u.c.) ietekmē hēma dzelzs no divvērtīgā pārvēršas par trīsvērtīgo. Kad asinīs uzkrājas liels daudzums methemoglobīna, tiek traucēta skābekļa transportēšana pa audiem un var rasties nāve.
Miokards satur muskuļu hemoglobīnu, ko sauc mioglobīns. Tās neolbaltumvielu daļa ir līdzīga asins hemoglobīnam, un proteīna daļai - globīnam - ir mazāka molekulmasa. Cilvēka mioglobīns saistās 14% kopējais skaits skābeklis organismā. Šim īpašumam ir svarīga loma strādājošo muskuļu apgādē. Kad muskuļi saraujas, to asins kapilāri tiek saspiesti un asins plūsma samazinās vai apstājas. Tomēr, pateicoties mioglobīnam piesaistītā skābekļa klātbūtnei, muskuļu šķiedru piegāde ar skābekli tiek saglabāta kādu laiku.
HEMOGLOBĪNS, Hb (hemoglobīns; grieķu valoda haimas asinis + lats. globus ball), ir hemoproteīns, komplekss proteīns, kas pieder pie hēmu saturošiem hromoproteīniem; veic skābekļa pārnešanu no plaušām uz audiem un piedalās oglekļa dioksīda pārnešanā no audiem uz elpošanas orgāniem. Hemoglobīns ir atrodams visu mugurkaulnieku un dažu bezmugurkaulnieku (tārpu, mīkstmiešu, posmkāju, adatādaiņu) sarkanajās asins šūnās, kā arī dažu pākšaugu sakņu mezgliņos. Mol. cilvēka eritrocītu hemoglobīna svars (masa) ir 64 458; Viens eritrocīts satur apm. 400 miljoni hemoglobīna molekulu. Hemoglobīns labi šķīst ūdenī, nešķīst spirtā, hloroformā, ēterī un labi kristalizējas (hemoglobīna kristālu forma dažādiem dzīvniekiem ir atšķirīga).
Hemoglobīns satur vienkāršu proteīnu – globīnu un dzelzi saturošu protēžu (neproteīnu) grupu – hēmu (attiecīgi 96 un 4% no molekulas masas). Ja pH ir zemāks par 2,0, hemoglobīna molekula tiek sadalīta hēmā un globīnā.
Heme
Hēms (C 34 H 32 O 4 N 4) ir dzelzs protoporfirīns – protoporfirīna IX komplekss savienojums ar divvērtīgo dzelzi. Dzelzs atrodas protoporfirīna serdes centrā un ir savienots ar četriem pirola serdeņu slāpekļa atomiem (1. att.): divām koordinācijas saitēm un divām ūdeņraža aizvietošanas saitēm.

Tā kā dzelzs koordinācijas skaitlis ir 6, tad divas valences paliek neizmantotas, viena no tām tiek realizēta, hēmam saistoties ar globīnu, bet otrai pievienojas skābeklis vai citi ligandi - CO, F +, azīdi, ūdens (2. att.). utt.
Protoporfīna IX kompleksu ar Fe 3+ sauc par hematīnu. Hematīna sālsskābes sāls (hlorhemīns, hemīns) viegli izdalās. kristāliskā forma (tā sauktie Teihmaņa kristāli). Hēmam ir spēja veidot kompleksus savienojumus ar slāpekļa savienojumiem (amonjaks, piridīns, hidrazīns, amīni, aminoskābes, olbaltumvielas utt.), tādējādi pārvēršoties hemohromogēnos (sk.). Tā kā hēms ir vienāds visām dzīvnieku sugām, hemoglobīna īpašību atšķirības ir saistītas ar hemoglobīna molekulas proteīna daļas - globīna - strukturālajām iezīmēm.
Globīns
Globīns ir albumīna tipa proteīns, kura molekulā ir četras polipeptīdu ķēdes: divas alfa ķēdes (katra satur 141 aminoskābes atlikumu) un divas beta ķēdes, kas satur 146 aminoskābju atlikumus. Tādējādi G. molekulas proteīna komponents ir veidots no 574 dažādu aminoskābju atlikumiem. Primārā struktūra, t.i., ģenētiski noteiktā aminoskābju secība globīna polipeptīdu ķēdēs cilvēkiem un vairākiem dzīvniekiem, ir pilnībā izpētīta. Cilvēka globīna atšķirīgā iezīme ir aminoskābju izoleicīna un cistīna trūkums tā sastāvā. N-gala atlikumi alfa un beta ķēdēs ir valīna atliekas. Alfa ķēžu C-gala atlikumus attēlo arginīna atlikumi, bet beta ķēdes - histidīna atlikumus. Priekšpēdējo pozīciju katrā ķēdē aizņem tirozīna atliekas.
Kristālu rentgena strukturālā analīze ļāva identificēt tās molekulas telpiskās struktūras galvenās iezīmes [M. Perutz]. Izrādījās, ka alfa un beta ķēdēs ir dažāda garuma spirālveida segmenti, kas veidoti pēc alfa spirāļu principa (sekundārā struktūra); Alfa ķēdei ir 7, bet beta ķēdei ir 8 spirālveida segmenti, kas savienoti ar nespirālveida sekcijām. Spirālveida segmenti, kas sākas no N-gala, ir apzīmēti ar burtiem Latīņu alfabēts(A, B, C, D, E, F, G, H), un spirālveida sekcijas vai griešanās leņķi ir attiecīgi apzīmēti (AB, BC, CD, DE utt.). Nespirālveida apgabali globīna ķēdes amīna (N) vai karboksil (C) galā tiek apzīmēti attiecīgi ar NA vai HC. Aminoskābju atlikumi ir numurēti katrā segmentā, turklāt iekavās ir norādīta šī atlikuma numerācija no ķēdes N-gala.
Spirālveida un nespirālveida posmi ir izkārtoti noteiktā veidā telpā, kas nosaka globīna ķēžu terciāro struktūru. Pēdējais ir gandrīz identisks G. alfa un beta ķēdēs, neskatoties uz būtiskām atšķirībām to primārajā struktūrā. Tas ir saistīts ar specifisko aminoskābju polāro un hidrofobo grupu izvietojumu, kas izraisa nepolāru grupu uzkrāšanos globulas iekšējā daļā, veidojot hidrofobu kodolu. Olbaltumvielu polārās grupas saskaras ar ūdens vidi, saskaroties ar to. Katras globīna ķēdes iekšpusē, netālu no virsmas, atrodas hidrofobs dobums (“hēma kabata”), kurā atrodas hēms, kas ir orientēts tā, lai tā nepolārie aizvietotāji tiktu novirzīti molekulas iekšpusē, kļūstot par hidrofobā kodola daļu. Rezultāts ir apm. 60 nepolāri kontakti starp hēmu un globīnu un viens vai divi polāri (jonu) hēma kontakti ar alfa un beta ķēdēm, kas ietver hēma propionskābes atlikumus, kas izplūst no hidrofobās “kabatas”. Hēma atrašanās globīna hidrofobajā dobumā nodrošina iespēju atgriezeniski pievienot skābekli hēmam Fe 2+, neoksidējot pēdējo līdz Fe 3+, un tas ir raksturīgs dažādu dzīvnieku sugu hemoglobīniem. To apstiprina G. ārkārtējā jutība pret jebkādām izmaiņām nepolārajos kontaktos hema tuvumā. Tādējādi hematopofirīna hēma aizstāšana ar hematoporfirīnu izraisa asu hēma īpašību pārkāpumu.
Daži aminoskābju atlikumi, kas ieskauj hēmu hidrofobajā dobumā, ir starp nemainīgajām aminoskābēm, t.i., aminoskābēm, kas ir vienādas dažādām dzīvnieku sugām un ir būtiskas G funkcijai. Starp nemainīgajām aminoskābēm liela nozīme iedalīti trīs: histidīna atlikumi, t.s. proksimālie histidīni (87. pozīcija a- un 92. pozīcija P-ķēdēs), distālie histidīni (58. pozīcija a- un 63. pozīcija (5-ķēdes), kā arī valīna atlikums E-11 (62. pozīcija alfa ķēdē). ķēde un 67. pozīcija beta ķēdē).
Saikne starp t.s proksimālais histidīns un hema dzelzs ir vienīgā ķīmiskā viela. saiti starp tām (tiek realizēta hēma Fe 2+ atoma piektā koordinācijas saite) un tieši ietekmē skābekļa pievienošanu hēmam. “Distālais” histidīns nav tieši saistīts ar hēmu un nepiedalās skābekļa fiksācijā. Tās nozīme ir Fe 2+ atoma stabilizācija pret neatgriezenisku oksidēšanos (acīmredzot ūdeņraža saites veidošanās dēļ starp skābekli un slāpekli). Valīna atlikums (E-11) ir sava veida skābekļa pievienošanas ātruma regulators hēmām: beta ķēdēs tas atrodas steriski tā, lai tas aizņemtu vietu, kur vajadzētu pievienoties skābeklim, kā rezultātā oksigenācija sākas ar flakonu ķēdēm. .
Molekulas proteīna daļai un protezēšanas grupai ir spēcīga ietekme viena uz otru. Globīns maina daudzas hema īpašības, dodot tam spēju saistīt skābekli. Hēms nodrošina globīna rezistenci pret darbība, karsēšana, gremošana ar fermentiem un nosaka G kristalizācijas īpašību īpašības.
Polipeptīdu ķēdes ar tām piesaistītām hēma molekulām veido četras galvenās daļas - hēma molekulas apakšvienības, kuru savstarpējās savienošanās (uzklāšanas) raksturu un izvietojumu telpā nosaka hēma kvartārās struktūras pazīmes: a- un P-ķēdes atrodas tetraedra stūros ap simetrijas asi, turklāt alfa ķēdes atrodas virs p-ķēdēm un, šķiet, ir saspiestas starp tām, un visas četras hemas ir tālu viena no otras (att. . 3). Kopumā veidojas tetramēra sferoīda daļiņa ar izmēriem 6,4 x 5,5 x 5,0 nm. Kvartāro struktūru stabilizē sāls saites starp α-α un β-β ķēdēm un divu veidu kontakti starp α un β ķēdēm (α1-β1 un α2-β2). α1-β1 kontakti ir visplašākie, ietverot 34 aminoskābju atlikumus, un lielākā daļa mijiedarbību ir nepolāras. α1-β2 kontakts sastāv no 19 aminoskābju atlikumiem, lielākā daļa saišu arī ir nepolāras, izņemot dažas ūdeņraža saites. Visas šajā kontaktā esošās atliekas ir vienādas visās pētītajās dzīvnieku sugās, savukārt 1/3 no atliekām α1-β1 kontaktos atšķiras.
Cilvēka dziedzeris ir neviendabīgs, un tas ir saistīts ar atšķirībām polipeptīdu ķēdēs, kas veido tā sastāvu. Tādējādi pieauguša cilvēka glikozes līmenis asinīs, kas veido 95-98% no glikozes līmeņa asinīs (HbA), satur divas α- un divas β-ķēdes; mazā G. frakcija (HbA2), sasniedzot maksimālo saturu 2,0-2,5%, satur divas α- un divas σ-ķēdes; Augļa hemoglobīns (HbF) jeb augļa hemoglobīns, kas pieauguša cilvēka asinīs veido 0,1-2%, sastāv no divām α- un divām γ-ķēdēm.
Augļa G. pirmajos mēnešos pēc dzimšanas tiek aizstāts ar HbA. To raksturo ievērojama izturība pret termisko denaturāciju, uz kuras balstās metodes tā satura noteikšanai asinīs.
Atkarībā no polipeptīdu ķēžu sastāva uzskaitītie G. veidi tiek apzīmēti šādi: HbA - kā Hbα2β2, HbA2 - kā Hbα2σ2 un HbF - kā Hbα2γ. Ar iedzimtām anomālijām un hematopoētiskā aparāta slimībām parādās patoloģiski hematopoēzes veidi, piemēram, ar sirpjveida šūnu anēmiju (sk.), talasēmiju (sk.), iedzimtu neenzimātiskas izcelsmes methemoglobinēmiju (sk. Methemoglobinēmija) u.c. Visizplatītākā aizstāšana vienas aminoskābes vienā polipeptīdu ķēžu pārī.
Atkarībā no hēma dzelzs atoma valences un liganda veida hema molekulā, pēdējam var būt vairākas formas. Reducētajam ūdeņradim (deoksi-Hb) ir Fe 2+ ar brīvu sesto valenci, pievienojot O 2, veidojas ūdeņraža forma ar skābekli (HbO 2). Kad HbO 2 tiek pakļauts vairākiem oksidētājiem (kālija fericianīds, nitrīti, hinoni utt.), Fe 2+ tiek oksidēts līdz Fe 3+, veidojot methemoglobīnu, kas nespēj pārnest O 2 . Atkarībā no barotnes pH vērtības izšķir skābās un sārmainās methemoglobīna formas, kas satur H 2 O vai OH grupu kā sesto ligandu. Veselu cilvēku asinīs methemoglobīna koncentrācija ir 0,83 + 0,42%.
Methemoglobīnam ir spēja stingri saistīt ūdeņraža fluorīdu, ciānūdeņradi un citas vielas. Šo īpašību izmanto medū. prakse cilvēku glābšanai, kas saindējušies ar ciānūdeņradi. Dažādi G. atvasinājumi atšķiras pēc absorbcijas spektra (tabula).
|
Hemoglobīna atvasinājums |
Viļņa garums (pie maksimālās absorbcijas), nm |
Miliekvivalentais gaismas absorbcijas koeficients, E |
|
Deoksihemoglobīns |
||
|
Oksihemoglobīns (HbO2) |
||
|
Karboksihemoglobīns (HbCO) |
||
|
Methemoglobīns (met-Hb; pH 7,0–7,4) |
||
|
Ciāna-methemoglobīns (CN-meth-Hb) |
||
Hemoglobīna funkcionālās īpašības. G. galvenā biol loma ir līdzdalība gāzu apmaiņā starp ķermeni un ārējā vide. G. nodrošina skābekļa pārnešanu ar asinīm no plaušām uz audiem un oglekļa dioksīda transportēšanu no audiem uz plaušām (sk. Gāzu apmaiņa). Ne mazāk svarīgas ir hemoglobīna buferīpašības, kas veido spēcīgas hemoglobīna un oksihemoglobīna bufersistēmas asinīs, tādējādi veicinot skābju-bāzes līdzsvara uzturēšanu organismā (sk. Bufersistēmas, Skābju-bāzes līdzsvars).
HbO 2 skābekļa kapacitāte ir 1,39 ml O 2 uz 1 g HbO 2. G. spēju saistīt un atbrīvot skābekli atspoguļo tā skābekļa disociācijas līkne (ODC), kas raksturo G. piesātinājuma procentuālo daudzumu ar skābekli atkarībā no O 2 parciālā spiediena (pO 2).

Skābekļa tetrameriskajām molekulām ir S-veida CDK, kas norāda, ka skābeklis nodrošina optimālu skābekļa saistīšanos ar relatīvi zemu parciālo spiedienu plaušās un izdalīšanos pie relatīvi augsta skābekļa parciālā spiediena audos (4. att.). Maksimālā skābekļa piegāde audiem tiek apvienota ar augsta parciālā spiediena saglabāšanu asinīs, kas nodrošina skābekļa iekļūšanu dziļi audos. Skābekļa daļējā spiediena vērtība mm Hg. Art., kad 50% gāzes ir piesātināti ar skābekli, ir gāzes afinitātes pret skābekli mērs, un to apzīmē ar P50.
Skābekļa pievienošana četrām G. hēmām notiek secīgi. G. CDK S-veida raksturs norāda, ka pirmā skābekļa molekula savienojas ar G. ļoti lēni, tas ir, tās afinitāte pret G. ir zema, jo ir nepieciešams pārtraukt sāls kontaktus deoksihemoglobīna molekulā. Tomēr pirmās skābekļa molekulas pievienošana palielina atlikušo trīs hēmu afinitāti pret to, un turpmākā hēma skābekļa pieplūde notiek daudz ātrāk (ceturtā hēma skābekļa pieplūde notiek 500 reizes ātrāk nekā pirmā). Līdz ar to notiek kooperatīva mijiedarbība starp skābekļa saistīšanas centriem. Oglekļa monoksīda (CO) reakcijas modeļi ir tādi paši kā skābeklim, bet oglekļa monoksīda afinitāte pret CO ir gandrīz 300 reizes augstāka nekā O2, kas padara oglekļa monoksīdu ļoti toksisku. Tādējādi, ja CO koncentrācija gaisā ir vienāda ar 0,1%, vairāk nekā puse no asins gāzes ir saistīta nevis ar skābekli, bet ar oglekļa monoksīdu. Šajā gadījumā veidojas karboksihemoglobīns, kas nespēj transportēt skābekli.
Hemoglobīna oksigenācijas procesa regulatori. Oksigenācijas un deoksigenācijas procesus lielā mērā ietekmē ūdeņraža joni, organiskie fosfāti, neorganiskie sāļi, temperatūra, oglekļa dioksīds un dažas citas vielas, kas regulē ūdeņraža afinitāti pret skābekli saskaņā ar fiziolu. ķermeņa pieprasījumi. Skābekļa afinitātes pret skābekli atkarību no barotnes pH vērtības sauc par Bora efektu (skat. Verigo efektu). Ir “skābi” (pH<6) и «щелочной» эффект Бора (pH>6). Lielākais fiziols. Svarīgs ir "sārmains" Bora efekts. Tās molekulārais mehānisms ir saistīts ar vairāku pozitīvi lādētu elementu klātbūtni molekulā funkcionālās grupas, kuras disociācijas konstantes ir ievērojami augstākas deoksihemoglobīnā, jo veidojas sāls tilti starp blakus esošo proteīnu ķēžu negatīvi lādētām grupām G molekulas iekšienē Oksigenācijas laikā G molekulā notiekošo konformācijas izmaiņu dēļ tiek iznīcināti sāls tilti, negatīvi lādētu grupu pH mainās un šķīdumā izdalās protoni . Līdz ar to oksigenācija noved pie protona (H +) atslāņošanās no gāzes molekulas un, otrādi, vides pH vērtības, t.i., netieši H + jonu koncentrācijas izmaiņas ietekmē skābekļa pievienošanu gāzei. Tādējādi H + kļūst par ligandu, kas galvenokārt saistās ar deoksihemoglobīnu un tādējādi samazina tā afinitāti pret skābekli, t.i., pH izmaiņas uz skābo pusi izraisa CDC nobīdi pa labi. Oksgenācijas process ir endotermisks, un temperatūras paaugstināšanās veicina skābekļa sadalīšanos no G molekulas, līdz ar to paaugstināta orgānu aktivitāte un asins temperatūras paaugstināšanās izraisīs CDC nobīdi pa labi un skābekļa piegādi. uz audiem palielināsies.
Unikālu skābekļa procesa regulēšanu veic eritrocītos lokalizētie organiskie fosfāti. Jo īpaši 2,3-difosfoglicerāts (DPG) ievērojami samazina G. afinitāti pret skābekli, veicinot O 2 izvadīšanu no oksihemoglobīna. DPG ietekme uz G. palielinās līdz ar pH vērtības samazināšanos (fiziolā, reģionā), tāpēc tās ietekme uz G. CDK vairāk izpaužas pie zemām pH vērtībām. DPG pārsvarā saistās ar deoksihemoglobīnu molārā attiecībā 1:1, iekļūstot tās molekulas iekšējā dobumā un veidojot 4 sāls tiltus ar divām beta ķēžu valīna atlieku alfa-NH2 grupām un, acīmredzot, ar divām histidīnu H- imidazola grupām. 21 (143) beta ķēdes. DPG ietekme samazinās, palielinoties temperatūrai, t.i., DPG saistīšanās process ar G molekulu ir eksotermisks. Tas noved pie tā, ka DPG klātbūtnē oksigenācijas procesa atkarība no temperatūras lielā mērā izzūd. Līdz ar to normāla skābekļa izdalīšanās ar asinīm ir iespējama plašā temperatūras diapazonā. Līdzīgu efektu, kaut arī mazākā mērā, ievieš ATP, piridoksāla fosfāts un citi organiskie fosfāti. Tādējādi organisko fosfātu koncentrācija eritrocītos būtiski ietekmē G. elpošanas funkciju, ātri pielāgojot to dažādiem fizioliem un patoliem, apstākļiem, kas saistīti ar traucētu oksigenāciju * (skābekļa satura izmaiņas atmosfērā, asins zudums, regulēšana). skābekļa transportēšana no mātes uz augli caur placentu utt.). Tādējādi ar anēmiju un hipoksiju palielinās DPG saturs eritrocītos, kas novirza CDC pa labi un izraisa lielāku skābekļa izdalīšanos audos. Daudzi neitrālie sāļi (acetāti, fosfāti, kālijs un nātrija hlorīdi) arī samazina G afinitāti pret skābekli. Šis efekts ir atkarīgs no vielas īpašībām un ir līdzīgs organisko fosfātu iedarbībai. Augstas sāls koncentrācijas klātbūtnē G. afinitāte pret skābekli sasniedz minimumu – vienādā mērā dažādiem sāļiem un DPG, t.i., gan sāļi, gan DPG konkurē savā starpā par vieniem un tiem pašiem saistīšanās centriem G molekulā. Tā, piemēram, DPG ietekme uz G. afinitāti pret skābekli pazūd 0,5 M nātrija hlorīda klātbūtnē.
Tālajā 1904. gadā Č.Bors u.c. uzrādīja G. afinitātes pret skābekli samazināšanos, palielinoties oglekļa dioksīda daļējam spiedienam asinīs.
Oglekļa dioksīda satura palielināšanās galvenokārt izraisa vides pH izmaiņas, bet P50 vērtība samazinās lielākā mērā, nekā tas būtu sagaidāms pie šādas vērtības samazināšanās.
pH vērtības. Tas ir saistīts ar oglekļa dioksīda īpašo saistību ar neuzlādētām alfa ķēžu alfa-NH2 grupām un, iespējams, gāzes beta ķēdēm, veidojot karbamātus (karbhemoglobīnu) saskaņā ar šādu shēmu:
HbNH 3+<->HbNH2+H+
HbNH 2 + CO 2<->HbNHCOO - + H +
Deoksihemoglobīns saista vairāk oglekļa dioksīda nekā HbO 2 . Eritrocītos DPG klātbūtne konkurējoši kavē karbamātu veidošanos. Ar karbamāta mehānisma palīdzību no veseliem cilvēkiem miera stāvoklī tiek izvadīts līdz 15% oglekļa dioksīda. Vairāk nekā 70% no asiņu bufera kapacitātes nodrošina tajās esošā gāze, kas arī izraisa ievērojamu netiešu gāzes līdzdalību oglekļa dioksīda pārnesē. Asinīm plūstot cauri audiem, HbO 2 pārvēršas deoksihemoglobīnā, vienlaikus saistot H+ jonus un tādējādi pārvēršot H 2 CO 3 par HCO 3 -. Tādējādi ar tiešu un netiešu G. līdzdalību vairāk nekā 90% oglekļa dioksīda, kas nāk no audiem asinīs, tiek saistīts un pārnests uz plaušām.
Ir svarīgi, lai visi šie CDC maiņas regulatori (H +, DPG, CO 2) būtu savstarpēji saistīti, kas ir ļoti svarīgi vairākos jaunos patolu apstākļos. Tādējādi DPG koncentrācijas palielināšanās eritrocītos ir sarežģītu to metabolisma izmaiņu rezultāts, kurā galvenais nosacījums ir pH vērtības palielināšanās. Acidozes un alkalozes gadījumā arī H + un DPG attiecības dēļ P50 vērtība izlīdzinās.
Hemoglobīna metabolisms
G. biosintēze notiek jaunās eritrocītu formās (eritroblastos, normoblastos, retikulocītos), kur iekļūst G. sastāvā ietilpstošie dzelzs atomi. Porfirīna gredzena sintēzē piedalās glicīns un dzintarskābe, veidojot δ- aminolevulīnskābe. Divas pēdējās molekulas tiek pārveidotas par pirola atvasinājumu - porfirīna prekursoru. Globīns veidojas no aminoskābēm, t.i., parastajā olbaltumvielu sintēzes ceļā. G. sabrukšana sākas eritrocītos, pabeidzot to dzīves ciklu. Hēms tiek oksidēts caur alfa-metīna tiltu, pārtraucot saikni starp atbilstošajiem pirola gredzeniem.
Iegūto G. atvasinājumu sauc par verdoglobīnu (zaļo pigmentu). Tas ir ļoti nestabils un viegli sadalās dzelzs jonos (Fe 3+), denaturētajā globīnā un biliverdīnā.
Haptoglobīna-hemoglobīna kompleksam (Hp-Hb) ir liela nozīme G. katabolismā. Izejot no eritrocīta asinsritē, G. neatgriezeniski saistās ar haptoglobīnu (sk.) Hp-Hb kompleksā. Pēc visa Hp daudzuma izsīkšanas plazmā G. uzsūcas proksimālajās nieru kanāliņos. Lielākā daļa globīna sadalās nierēs 1 stundas laikā.
Hēma katabolismu Hp-Hb kompleksā veic aknu, kaulu smadzeņu un liesas retikuloendotēlija šūnas, veidojot žults pigmentus (sk.). Šajā procesā izdalītā dzelzs ļoti ātri nonāk vielmaiņas baseinā un tiek izmantota jaunu dzelzs molekulu sintēzē.
Hemoglobīna koncentrācijas noteikšanas metodes. Ķīļos, praksē G. parasti nosaka ar kolorimetrisko metodi, izmantojot Sali hemometru, pamatojoties uz hemīna daudzuma mērīšanu, kas veidojas no G. (sk. Hemoglobinometriju). Taču atkarībā no bilirubīna un methemoglobīna satura asinīs, kā arī dažos patola apstākļos metodes kļūda sasniedz +30%. Spektrofotometriskās izpētes metodes ir precīzākas (skat. Spektrofotometrija).
Lai noteiktu kopējo hemoglobīna līmeni asinīs, tiek izmantota ciānmethemoglobīna metode, kuras pamatā ir visu hemoglobīna atvasinājumu (deoksi-Hb, HbO 2, HbCO, met-Hb uc) pārvēršana ciān-met-Hb un optiskā blīvuma mērīšana. šķīduma pie 540 nm. Tam pašam mērķim tiek izmantota piridīna-hemohromogēnā metode. HbO 2 koncentrāciju parasti nosaka ar gaismas absorbciju pie 542 nm vai ar gasometrisko metodi (pēc saistītā skābekļa daudzuma).
Hemoglobīns klīniskajā praksē
G. kvantitatīvā satura un kvalitatīvā sastāva noteikšanu izmanto kombinācijā ar citu hematolu. indikatori (hematokrīts, sarkano asins šūnu skaits, to morfoloģija u.c.) vairāku patolu, sarkano asins stāvokļu (anēmijas, eritrēmijas un sekundārās eritrocitozes) diagnosticēšanai, asins zuduma pakāpes novērtēšanai, asins sabiezēšanai ķermeņa dehidratācijas laikā. ķermeņa un apdegumi utt.), lai novērtētu hemo -transfūziju efektivitāti terapijas laikā utt.
Parasti G. saturs asinīs ir vidēji 14,5 + 0,06 g% vīriešiem (variācijas 13,0-16,0 g%) un sievietēm 12,9 + 0,07 g% (12,0-14,0 g%), liecina L. E. Yarustovskaya et al. (1969); svārstības ir atkarīgas no ķermeņa vecuma un konstitucionālajām īpašībām, fiziskās. aktivitāte, uzturs, klimats, skābekļa daļējais spiediens apkārtējā gaisā. G. koncentrācija asinīs ir relatīva vērtība, kas ir atkarīga ne tikai no kopējā G. absolūtā daudzuma asinīs, bet arī no plazmas tilpuma. Plazmas tilpuma palielināšanās ar nemainīgu G. daudzumu asinīs var sniegt nepietiekami novērtētus skaitļus, nosakot G. un imitēt anēmiju.
Pilnīgākam G. satura novērtējumam tiek izmantoti arī netiešie indikatori: krāsas indikatora noteikšana, vidējā G. satura noteikšana vienā sarkanajā asins šūnā, vidējā šūnu G. koncentrācija attiecībā pret hematokrīta indeksu u.c.
Notiek, kad smagas formas anēmija, G. koncentrācijas pazemināšanās asinīs līdz noteiktai kritiskajai vērtībai - 2-3 g% un zemāk (hemoglobinopēnija, oligohromēmija) - parasti izraisa nāvi, tomēr ar dažiem hroniskas anēmijas veidiem atsevišķi pacienti, sakarā ar kompensācijas mehānismu attīstībai, pielāgoties šādai koncentrācijai.
Patolā stāvokļi, G. saturs un sarkano asins šūnu skaits ne vienmēr mainās paralēli, kas atspoguļojas anēmijas klasifikācijā (izšķir anēmijas parastās, hipo- un hiperhromās formas); Eritrēmiju un sekundāro eritrocitozi raksturo paaugstināta G. koncentrācija (hiperhromēmija) un vienlaikus palielināts sarkano asins šūnu skaits.
Gandrīz viss glikozes līmenis asinīs ir atrodams sarkano asins šūnu iekšpusē; daļa no tā atrodas plazmā Hp-Hb kompleksa veidā. Brīvā glikoze plazmā parasti ir 0,02-2,5 mg% (saskaņā ar G.V. Derviz un N.K. Byalko). Brīvās hemolīzes saturs plazmā palielinās dažu hemolītisko anēmiju gadījumā, kas galvenokārt rodas intravaskulāras hemolīzes gadījumā (skatīt Hemoglobinēmija).
Sakarā ar vairāku normālu hemoglobīna veidu klātbūtni, kā arī dažu dažādu izcelsmes patoloģisku hemoglobīnu slimību parādīšanos asinīs (skatīt Hemoglobinopātijas) liela uzmanība tiek dota hemoglobīna eritrocītu kvalitatīvā sastāva noteikšanai (“hemoglobīna formula”). Tādējādi G. tipa HbF un HbA2 palielināta daudzuma noteikšana parasti ir raksturīga dažām beta talasēmijas formām.
HbF satura palielināšanās tika novērota arī ar citu hematolu. slimības ( akūta leikēmija, aplastiskā anēmija, paroksizmāla nakts hemoglobinūrija u.c.), kā arī ar infekciozo hepatītu, ar asimptomātisku iedzimtu augļa hemoglobīna noturību un grūtniecību. HbA2 frakcijas koncentrācija asinīs palielinās noteiktu nestabilu gāzu un intoksikāciju klātbūtnē un samazinās dzelzs deficīta anēmijas gadījumā.
Ontoģenēzes laikā cilvēkiem notiek dažāda veida normālo hemoglobīnu maiņa.Auglim (līdz 18 nedēļām), primārais, jeb primitīvais tiek noteikts hemoglobīns P (primitīvs); tās šķirnes ir apzīmētas ar to pašu kā Hb Gower1 un Hb Gower2.
Primārās hematopoēzes pārsvars atbilst vitelīna hematopoēzes periodam, un sekojošajā aknu hematopoēzes periodā pārsvarā tiek sintezēts HbF.
“Pieaugušo” HbA sintēze strauji pastiprinās kaulu smadzeņu hematopoēzes periodā; HbF saturs jaundzimušam bērnam ir līdz 70-90% no kopējā G. daudzuma (pārējie 10-30% ietilpst HbA frakcijā). Līdz pirmā dzīves gada beigām HbF koncentrācija parasti samazinās līdz 1-2%, un attiecīgi palielinās HbA saturs.
Ir zināms, ka Sv. 200 patoloģiski (patoloģiski vai neparasti) G. varianti, kuru parādīšanos izraisa dažādi iedzimti defekti globīna polipeptīdu ķēžu veidošanā.
L. Paulinga, Itano (N. A. Itano) u.c. atklājums. 1949. gadā patols, hemoglobīns S (angļu: sirpjveida šūnu sirpjveida šūna) lika pamatus molekulāro slimību izpētei. Patoloģisku asins šūnu klātbūtne sarkanajās asins šūnās parasti (bet ne vienmēr) izraisa iedzimtas hemolītiskās anēmijas sindroma attīstību (skatīt).
Lielākā daļa aprakstīto hemoglobīna variantu jāuzskata nevis par patoloģiskām, bet gan par retām neparastām G.S medus formām. hemoglobīni S, C, D, E, Bart, H, M un liela grupa(aptuveni 60) nestabils G. Nestabils G. tiek saukts par G. patoloģiskiem variantiem, kuros vienas no aminoskābēm aizvietošanas rezultātā molekula kļūst nestabila pret oksidētāju, karsēšanas un virkni citu. faktoriem. ĢM grupas rodas aminoskābju aizstāšanas rezultātā polipeptīdu ķēdēs hēma-globīna kontaktu zonā, kas izraisa ne tikai molekulas nestabilitāti, bet arī paaugstinātu tendenci uz methemoglobīna veidošanos. M-hemoglobinopātija bieži ir iedzimtas methemoglobinēmijas cēlonis (sk.).
G. klasifikācija sākotnēji balstījās uz to attēlošanu atvēršanas secībā ar latīņu alfabēta burtiem; izņēmums ir normālam “pieaugušajam” G., kas apzīmēts ar burtu A, un augļa G. (HbF). Burts S norāda uz patoloģisku sirpjveida šūnu G. (sinonīms vārdam HbB). Tādējādi latīņu alfabēta burti no A līdz S tika uzskatīti par vispārpieņemtiem G apzīmējumiem. Saskaņā ar X International Hematol pieņemto. Kongress (Stokholma, 1964) G. nomenklatūra turpmāk nav ieteicams izmantot atlikušos alfabēta burtus jaunu variantu apzīmēšanai.
Tagad ir pieņemts jaunatklātās G. formas nosaukt pēc atklāšanas vietas, izmantojot tās pilsētas (reģiona), slimnīcas vai laboratorijas nosaukumu, kurā jaunais G. pirmo reizi tika atklāts, un norādot (iekavās) tā bioķīmisko formulu, atrašanās vietu. un aminoskābju aizstāšanas raksturs ietekmētajā ķēdē. Piemēram, Hb Koln (alfa 2 beta 2 98 val->met) nozīmē, ka hemoglobīnā Koln 98. pozīcijā viena no aminoskābes valīna beta polipeptīdu ķēdēm tika aizstāta ar metionīnu.
Visas G. šķirnes atšķiras viena no otras pēc fizikālajām un ķīmiskajām īpašībām. un fizisko īpašībām, un dažas arī pēc funkcionālajām īpašībām, uz kurām balstās metodes dažādu G. variantu noteikšanai klīnikā. Ir atklāta jauna neparastu gāzu klase ar mainītu afinitāti pret skābekli. G. tipizēšana tiek veikta, izmantojot elektroforēzi un vairākas citas laboratorijas metodes (sārmu izturības un termiskās denaturācijas testi, spektrofotometrija utt.).
Pamatojoties uz to elektroforētisko mobilitāti, G. iedala ātri kustīgos, lēnos un normālos (ar tādu pašu mobilitāti kā HbA). Tomēr aminoskābju atlikumu aizstāšana ne vienmēr izraisa izmaiņas molekulas lādiņā, tāpēc dažus variantus nevar noteikt, izmantojot elektroforēzi.
Hemoglobīns tiesu medicīnā
G. un tā atvasinājumi tiesu medicīnā ir noteikti, lai konstatētu asins klātbūtni uz lietiskajiem pierādījumiem vai jebkādos šķidrumos, diagnosticējot saindēšanos ar vielām, kas izraisa izmaiņas G., lai atšķirtu augļa vai jaundzimušā asinis no pieauguša cilvēka asinīm. . Ir pierādījumi par iedzimtības pazīmju izmantošanu strīdīgās paternitātes, maternitātes un bērnu aizstāšanas pārbaudē, kā arī asins individualizēšanas nolūkos uz lietiskajiem pierādījumiem.
Imunizējot dzīvniekus ar cilvēka hemoglobīnu, tika iegūti hemoglobīnu nogulsnējoši serumi. Ar šo serumu palīdzību var konstatēt cilvēka asiņu klātbūtni traipā, kas pārbaudīts uz G.
Lai noteiktu asiņu klātbūtni traipos, tiek izmantota mikrospektrālā analīze un mikrokristāliskās reakcijas. Pirmajā gadījumā hemohromogēnu ar sārmu un reducētāju pārvērš hemohromogēnā, kam ir raksturīgs absorbcijas spektrs (sk. Hemohromogēnu), vai arī hemohromogēnu iedarbojas koncentrēta sērskābe, kas izraisa hematoporfirīna veidošanos. tipisks absorbcijas spektrs redzamajā spektra daļā .
No mikrokristāliskajām reakcijām asins klātbūtnes noteikšanai visbiežāk izmanto testus, kuru pamatā ir hemohromogēna un hemīna hidrohlorīda kristālu ražošana. Lai iegūtu hemīna kristālus no audiem ar traipu, kas pārbaudīts uz G., paņemiet diegu un novietojiet to uz stikla priekšmetstikliņa, pievienojiet vairākus nātrija hlorīda kristālus un dažus pilienus koncentrētas etiķskābes (Teichmann reaģents). Karsējot (asins klātbūtnē), no G. veidojas hemīna hidrohlorīda kristāli (Teihmaņa kristāli) - brūni slīpi paralelogrami, dažreiz tiek izmantotas reakcijas, lai no G. iegūtu joda-hemīna kristālus - mazus melnus kristālus rombveida prizmas.
G. atvasinājumi tiek konstatēti spektroskopiski asinīs noteiktu saindēšanos laikā. Piemēram, saindēšanās gadījumā ar tvana gāzi cietušo asinīs tiek konstatēts karboksihemoglobīns, saindēšanās gadījumā ar methemoglobīnu veidojošām vielām – methemoglobīns.
Zīdaiņu slepkavības gadījumos var būt nepieciešams noteikt jaundzimušā vai augļa asiņu klātbūtni, izmantojot dažādus lietiskus pierādījumus. Tā kā augļa un jaundzimušā asinīs ir augsts HbF saturs un pieauguša cilvēka asinīs ir augsts HbA saturs, tie atšķiras ar fizikālajām un ķīmiskajām īpašībām. īpašības, jaundzimušā (augļa) un pieaugušā G. var viegli atšķirt.
Praksē visbiežāk tiek izmantota sārmaina denaturācija, jo augļa dziedzeris ir izturīgāks pret sārmu iedarbību nekā pieaugušā dziedzeris. G. izmaiņas nosaka spektroskopiski, spektrofotometriski vai fotometriski.
Polipeptīdu ķēžu sintēze tiek veikta strukturālo un (iespējams) regulējošo gēnu kontrolē. Strukturālie gēni nosaka polipeptīdu ķēžu specifisko aminoskābju secību, savukārt regulējošie gēni nosaka to sintēzes ātrumu (skat. Gēnu).
Esošos 6 veidu normālos g ķēdes (Hbα, Hbβ, Hbγ, Hbδ, Hbε, Hbζ) cilvēkiem attiecīgi kodē 6 gēnu loki (α, β, γ, δ, ε, ζ). Tiek uzskatīts, ka α ķēdēm var būt divi loki. Turklāt tika atklātas 5 dažādas γ ķēdes, kuras kodē dažādi loki. Tādējādi kopumā cilvēkam var būt no 7 līdz 10 pāriem strukturālu gēnu, kas kontrolē G sintēzi.
Attīstības stadiju izpēte ir parādījusi, ka cilvēkiem ir skaidra un līdzsvarota dažādu G sintēzes ģenētiskā regulēšana.Cilvēka dzemdes dzīves pirmajā pusē Gl. arr. lokusu α, γ, ζ, ε-ķēdes (pēdējās tikai īsu laiku, in agrīnais periods embrionālā dzīve). Pēc piedzimšanas vienlaikus ar gamma ķēdes lokusa izslēgšanu tiek aktivizēti β un δ ķēdes loki. Šīs pārslēgšanas rezultātā augļa hemoglobīns (HbF) tiek aizstāts ar pieaugušo hemoglobīnu - HbA ar nelielu HbA2 daļu.
Paliek neskaidri jautājumi: gēnu lokusu atrašanās vieta, kas nosaka G. sintēzi hromosomās, to saikne, ar ontoģenēzes periodiem saistīto G. strukturālo gēnu specifiskās aktivācijas un represiju atkarība no regulējošo gēnu darbības, humorālo faktoru (piemēram, hormonu) ietekme utt.
Globīna ķēžu sintēze ir īpašs olbaltumvielu sintēzes piemērs šūnā.
Lai gan joprojām ir daudz neskaidra G. sintēzes regulēšanā, šķiet, ka galvenie mehānismi ir tie, kas kontrolē mRNS (Ziņnesis RNS) transkripcijas ātrumu no DNS. Precīzs DNS raksturojums, kas ir īpaši atbildīgs par globīna sintēzi, nav iegūts. Tomēr 1972. gadā vairākām laboratorijām vienlaikus izdevās sintezēt gēnu, kas regulē G sintēzi. Tas tika darīts, izmantojot enzīmu reverso transkriptāzi (sk. Gēnu inženierija).
Hēma molekulas hēma daļa tiek sintezēta atsevišķi, izmantojot virkni enzīmu reakciju, sākot ar aktīvo sukcinātu (sukcinātu) no Krebsa cikla un beidzot ar sarežģītu protoporfirīna gredzenu ar dzelzs atomu centrā.
Olbaltumvielu sintēzes procesā globīna ķēdes iegūst sev raksturīgo konfigurāciju, un hēms tiek “iesprausts” īpašā kabatā. Pēc tam notiek pabeigtu ķēžu kombinācija, veidojot tetramēru.
Specifiskas DNS sintēze notiek eritrocītu prekursoros tikai līdz ortohroma normoblastu stadijai. Šajā periodā tiek izveidots galīgais globīna polipeptīdu ķēžu komplekts, tas tiek apvienots ar hēmu, un veidojas visa veida RNS un nepieciešamie fermenti.
Iedzimtus G. sintēzes traucējumus iedala divās lielās grupās:
1) ts hemoglobīna primārās struktūras strukturālie varianti vai anomālijas - “kvalitatīvas” hemoglobinopātijas, piemēram, Hb, S, C, D, E, M, kā arī slimības, ko izraisa nestabils hemoglobīns un hemoglobinopātijas ar paaugstinātu afinitāti pret O 2 (skatīt Hemoglobinopātijas),
2) stāvokļi, kas rodas vienas no globīna polipeptīdu ķēdēm traucētas sintēzes ātruma rezultātā - “kvantitatīvās” hemoglobinopātijas vai talasēmija (sk.).
Ar strukturāliem variantiem var mainīties G molekulas stabilitāte un funkcija.Talasēmijas gadījumā globīna struktūra var būt normāla. Tā kā abi ģenētisko defektu veidi ir izplatīti daudzās cilvēku populācijās, bieži tiek novēroti indivīdi, kuri vienlaikus ir heterozigoti attiecībā uz G. strukturālo variantu un talasēmiju. Dažādu gēnu kombinācijas veido ļoti sarežģītu hemoglobinopātijas spektru. Dažos gadījumos mutācijas var ietekmēt G. sintēzes pārslēgšanas mehānismus, kas, piemēram, noved pie augļa G. sintēzes turpināšanās pieaugušajiem. Šos apstākļus kopā sauc par iedzimtu augļa hemoglobīna noturību.
Fusion varianti ietver Hb Lepore, anti-Lepore un Kenijas mutantus. Visticamāk šīs strukturālas novirzes G. radās nevienlīdzīgas nehomologas meiotiskas krustošanās rezultātā starp cieši saistītiem G gēniem, kā rezultātā, piemēram, Hb Lepore α-ķēdes ir normālas, un citas polipeptīdu ķēdes satur daļu no δ- un daļa no β-polipeptīdu ķēžu secības.
Tā kā mutācijas var rasties jebkurā no gēniem, kas nosaka gēnu sintēzi, var rasties vairākas situācijas, kurās indivīdi būs homozigoti, heterozigoti vai dubultheterozigoti patoloģisku gēnu alēlēm vienā vai vairākos lokos.

Ir zināmi vairāk nekā 200 G. strukturālo variantu, vairāk nekā 120 no tiem ir raksturoti, un daudzos gadījumos ir izdevies saistīt G. strukturālās izmaiņas ar tās anomālo funkciju. Vienkāršāko mehānismu jauna G. varianta rašanās punktveida mutācijas rezultātā (vienas bāzes aizstāšana ģenētiskajā kodā) var demonstrēt, izmantojot HbS piemēru (shēma).
Aminoskābju aizvietošanas ietekme uz fizikāli ķīmisko. G. molekulas īpašības, stabilitāte un funkcija ir atkarīga no aminoskābes veida, kas aizstāja iepriekšējo, un tās atrašanās vietas molekulā. Vairākas mutācijas (bet ne visas) būtiski maina hemoglobīna molekulas funkciju un stabilitāti (HbM, nestabili hemoglobīni, hemoglobīni ar mainītu afinitāti pret O 2) vai tās konfigurāciju un virkni fizikāli ķīmisko faktoru. īpašības (HbS un HbC).
Hemoglobīns ir nestabils
Nestabils hemoglobīns ir patoloģisku hemoglobīnu grupa, kas ir īpaši jutīga pret oksidētāju iedarbību, siltumu un vairākiem citiem faktoriem, kas izskaidrojams ar ģenētiski noteiktu dažu aminoskābju atlikumu aizvietošanu to molekulās ar citām; šādu hemoglobīnu pārvadāšana bieži izpaužas kā hemoglobinopātija (sk.).
To cilvēku eritrocītos, kuri ir nestabilas G. nesēji, tā sauktās. Heinca ķermeņi, kas ir nestabilu asins šūnu denaturētu molekulu uzkrāšanās (iedzimta hemolītiskā anēmija ar Heinca ķermeņiem). 1952. gadā I. A. Cathie ierosināja, ka šī slimība ir iedzimta. Friks (P. Frick), Gitzig (W. H. Hitzig) un Vetke (K. Betke) 1962. gadā pirmo reizi, izmantojot Hb Cīrihes piemēru, pierādīja, ka hemolītiskā anēmija ar Heinca ķermeņiem ir saistīta ar nestabilu hemoglobīnu klātbūtni. Kerels (R. W. Carrell) un G. Lēmans 1969. gadā ierosināja jaunu nosaukumu šādām hemoglobinopātijām - hemolītisko anēmiju, ko izraisa nestabila G.
Hēma molekulu nestabilitāti var izraisīt aminoskābju atlikumu aizstāšana saskarē ar hēmu; nepolāro aminoskābju atlikumu aizstāšana ar polāru; molekulas sekundārās struktūras pārkāpums, ko izraisa jebkura aminoskābes atlikuma aizstāšana ar prolīna atlikumu; aminoskābju atlikumu aizstāšana α1β1 un α2β2 kontaktu zonā, kas var izraisīt hemoglobīna molekulas disociāciju monomēros un dimēros; dažu aminoskābju atlikumu dzēšana (zaudēšana); apakšvienību pagarināšanās, piemēram, diviem nestabiliem hemoglobīniem - Hb Cranston un Hb Tak ir iegarenas beta ķēdes, salīdzinot ar parasto hemoglobīnu, jo to C-galam pievienots hidrofobs segments.
Nestabilo gāzu klasifikācija, ko ierosināja J. V. Dacie un modificēja Ju. N. Tokarevs un V. M. Belostockis, balstās uz to molekulas izmaiņu raksturu, kas padara gāzi nestabilu.
Aprakstīts apm. 90 nestabilu G., un varianti ar aminoskābju atlikumu aizstāšanu G. molekulas beta ķēdēs ir sastopami aptuveni 4 reizes biežāk nekā ar šādu atlieku aizvietošanu alfa ķēdēs.
Nestabila G. nēsāšana tiek mantota autosomāli dominējošā veidā, un nesēji ir heterozigoti. Dažos gadījumos nestabila G. pārvadāšana ir spontānas mutācijas rezultāts. G. stabilitātes samazināšanās izraisa ne tikai vieglu nokrišņu veidošanos, bet dažos gadījumos arī hema zudumu. Aminoskābju atlikumu aizstāšana hemoglobīna molekulas alfa un beta ķēžu saskares vietās var ietekmēt molekulas afinitāti pret skābekli, hēmu mijiedarbību un līdzsvaru starp hemoglobīna tetramēriem, dimēriem un monomēriem. Cilvēkiem, kuri ir heterozigoti attiecībā uz nestabilo gēnu, tiek sintezēts gan normāls, gan patoloģisks, nestabils proteīns, bet pēdējais ātri denaturējas un kļūst funkcionāli neaktīvs.
Smagu hemolītisko anēmiju parasti novēro pacientiem, kuri ir nestabilas G. nesēji ar augstu molekulārās nestabilitātes pakāpi.
Pārnēsājot citu nestabilu G. ķīli, izpausmes parasti ir vidēji smagas vai pilnīgi nenozīmīgas. Dažos gadījumos (Hb Riverdale-Bronx, Hb Cīrihe uc) nestabila G. pārvadāšana izpaužas kā hemolītiskas krīzes pēc noteiktu medikamentu (sulfonamīdu, pretsāpju līdzekļu uc) lietošanas vai infekciju iedarbības. Dažiem pacientiem, piemēram, Hb Hammersmith, Hb Bristol, Hb Sidnejas uc nesējiem, rodas ādas cianoze, ko izraisa pastiprināta met- un sulfhemoglobīnu veidošanās. Hemoglobinopātijas, ko izraisa nestabila G. pārnēsāšana, ir jānošķir no citas etioloģijas hemolītiskām un hipohromiskām anēmijām un, pirmkārt, ar dzelzs deficītu un hemolītisko anēmiju, kas saistītas ar ģenētiski noteiktu pentozes-fosfāta cikla enzīmu deficītu, glikolīzi utt.
Lielākajai daļai cilvēku, kas ir nestabilas G. nēsātāji, nav nepieciešama īpaša attieksme. Hemolīzes gadījumā ir noderīga atjaunojoša terapija. Visiem nestabilā G. nesējiem ieteicams atturēties no oksidējošām zālēm, kas provocē hemolīzi (sulfonamīdiem, sulfoniem, pretsāpju līdzekļiem utt.). Asins pārliešana ir norādīta tikai ar dziļas anēmijas attīstību. Smagas hemolīzes gadījumā ar pastiprinātu sarkano asins šūnu sekvestrāciju ar liesu un hipersplenismu, ir indicēta splenektomija (sk.). Tomēr splenektomiju bērniem (līdz 6 gadu vecumam) parasti neveic septicēmijas attīstības riska dēļ.
Nestabila hemoglobīna noteikšanas metodes
Hemoglobīna termolabilitātes izpēte ir vissvarīgākais tests tā nestabilitātes noteikšanai. To ierosināja A. G. Grimes un A. Meisler 1962. gadā un Dacey 1964. gadā, un tas sastāv no hemolizātu, kas atšķaidīts ar 0,1 M fosfāta vai Tris-HCl buferšķīdumu, pH 7,4, inkubāciju 50–60 ° temperatūrā stundu. Šajā gadījumā nestabilie glikozīdi tiek denaturēti un izgulsnējas, un šķīdumā atlikušo termostabilā hidroksīda daudzumu nosaka spektrofotometriski pie 541 nm un aprēķina pēc formulas:
/ * 100 = = termostabils hemoglobīns (procentos),
kur E ir ekstinkcijas vērtība pie viļņa garuma 541 nm.
Termolabīlā G. relatīvais saturs ir vienāds ar 100% - termostabila G. daudzums (procentos).
Carrell un Kay (R. Kau) 1972. gadā ierosināja inkubēt hemolizātus 17% izopropanola šķīduma-Tris buferšķīduma, pH 7,4, maisījumā 37 ° temperatūrā 30 minūtes.
Eritrocītu hemolīzi var izraisīt ūdens, jo oglekļa tetrahlorīda vai hloroforma izmantošana šim nolūkam izraisa nestabilu asins šūnu daļēju denaturāciju un iegūto datu izkropļojumus.
Visizplatītākā nestabilā G. noteikšanas metode ir histoķīmiskā, Heinca ķermeņu noteikšanas metode. Šajā gadījumā sarkanās asins šūnas tiek iekrāsotas ar kristālvioleti, metilvioleti vai tiek izmantota reakcija ar acetilfenilhidrazīnu. Asinis sākotnēji tiek turētas 24 stundas 37° temperatūrā. Jāpatur prātā, ka Heinca ķermeņus var atrast arī citu hemolītisko anēmiju, talasēmijas, saindēšanās ar methemoglobīnu veidojošiem līdzekļiem un dažu enzimopātiju gadījumā.
Hemolizātu elektroforētiskā atdalīšana uz papīra vai celulozes acetāta bieži nedod rezultātus, jo daudzos nestabilos hemolizātos aminoskābju atlikumu nomaiņa molekulā nemaina molekulas elektroforētiskās īpašības. Informatīvāka šajā ziņā ir elektroforēze poliakrilamīda un cietes gēlos (sk. Elektroforēze) vai izoelektriskā fokusēšana.
Daudziem pacientiem, kuri ir nestabila G. nēsātāji, urīns pastāvīgi vai reizēm iegūst tumšu krāsu dipirolu veidošanās dēļ, kas kalpo kā diezgan precīza nestabila G. klātbūtnes pazīme eritrocītos.
Bibliogrāfija: Vladimirovs G. E. un Panteleeva N. S. Funkcionālā bioķīmija, L., 1965;
Koržujevs P. A. Hemoglobīns, M., 1964, bibliogr.; Kušakovskis M. S. Hemoglobīna bojājumu klīniskās formas, L., 1968; Perutz M. Hemoglobīna molekula, grāmatā: Molecules and Cells, ed. G. M. Frenks, tulk. no angļu valodas, lpp. 7, M., 1966; Tumanovs A.K. Lietisko pierādījumu tiesu medicīniskās ekspertīzes pamati, M., 1975, bibliogr.; Uspenskaya V.D. Par haptoglobīna sintēzes un katabolisma vietu un tās lomu hemoglobīna metabolismā, Vopr. medus. ķīmija, 16. sēj., 3. nr., 3. lpp. 227, 1970, bibliogr.; Hariss G. Cilvēka bioķīmiskās ģenētikas pamati, trans. no angļu valodas, lpp. 15, M., 1973; Šaronovs Ju.A. un Šaronova N.A. Hemoglobīna struktūra un funkcijas, Molecular Biol., 9. v., Nr.1, lpp. 145, 1975, bibliogr.; Charache S. Hemoglobīni ar mainītu skābekļa afinitāti, Clin. Haemat., v. 3. lpp. 357, 1974, bibliogr.; Giblet E. R. Ģenētiskie marķieri cilvēka asinīs, Filadelfija, 1969; Hemoglobīna un eritrocītu struktūra un funkcija, ed. G. J. Brewer, N. Y.-L., 1972; HuehnsE. R. Hemoglobīna alfa-ķēdes sintēzes ģenētiskā kontrole, Haematologia, v. 8. lpp. 61, 1974, bibliogr.; Lehmann H. a. Huntsman R. G. Man's hemoglobins, Filadelfija, 1974; Perutz M. F. The krooniskā lekcija, 1968, Hemoglobīna molekula, Proc, Roy, Soc. V., v. 173. lpp. 113, 1969; Perutz M. F. a. Lehmann H. Cilvēka hemoglobīna molekulārā patoloģija, Daba (Lond.), v. 219. lpp. 902, 1968; RoughtonF. J. Daži jaunākie darbi par skābekļa, oglekļa dioksīda un hemoglobīna mijiedarbību, Biochem. J., v. 117. lpp. 801, 1970; Stamatoyannoponlos G. a. NuteP. E. Hemoglobīnu ģenētiskā kontrole, Clin. Haemat., v. 3. lpp. 251, 1974, bibliogr.; Van Assendelft O. W. Hemoglobīna atvasinājumu spektrofotometrija, Assen, 1970; Weatherall D. J. Dažu hemoglobīna traucējumu molekulārais pamats, Brit, med. J., v. 4. lpp. 451, 516, 1974; Weatherall D. J. a. Clegg J. B. Talasēmijas molekulārais pamats, Brit. J. Haemat., v. 31, pielikums, 1. lpp. 133, 1975; Wintro-b e M. M. Clinical hematology, Filadelfija, 1974.
Hemoglobīns ir nestabils- Didkovskis N.A. et al. Hemoglobīns Volga 27 (B9) alanīns->asparagīnskābe (jauns patoloģisks hemoglobīns ar smagu nestabilitāti), Problēmas, hematols un pārplūde, asinis, 22. sēj., 4. sēj., 4. lpp. 30, 1977, bibliogr.; Idelsons L. I., Didkovskis N. A. un Ermiļčenko G. V. Hemolītiskā anēmija, M., 1975, bibliogr.; ВunnH. F., aizmirsti B. G. a. Ranney H. M. Human hemoglobins, Philadelphia, 1977, bibliogr.; Lehmann H. a. Kynoch P. A. Cilvēka hemoglobīna varianti un to īpašības, Amsterdama, 1976.
A.P. Andrejeva; Yu. N. Tokarev (dārgakmens un gēns.), A. K. Tumanovs (tiesa); Ju. N. Tokarevs, V. M. Belostockis.
Hemoglobīni ir sarežģītas struktūras dzelzi saturoši asins proteīni, kas ir atbildīgi par gāzu apmaiņu un stabila vielmaiņas uzturēšanu. Asinsrites sistēmā hemoglobīns darbojas kā savdabīgs starpnieks starp audiem un plaušām oglekļa dioksīda un skābekļa apmaiņas procesā.
Pieļaujamais hemoglobīna līmenis mainās līdz ar vecumu, taču ir iespējamas nelielas normas novirzes. Nelīdzsvarotība noved pie attīstības nopietnas slimības, un dažiem no tiem ir neatgriezenisks patoloģisks process.
Novirze no šī proteīna normas jebkurā gadījumā tiks papildināta ar atbilstošu klīniskā aina Tādēļ, ja Jums ir kādi citi simptomi, nekavējoties jāmeklē medicīniskā palīdzība, nevis jāārstē pašam. Efektīvu ārstēšanu var noteikt tikai pēc asins analīzes hemoglobīna noteikšanai.
Funkcijas
Hemoglobīna funkcijas ir nodrošināt elpošanas procesu organismā, kas tiek veikts trīs posmos:
- šūnu elpošana - šūnas ir piesātinātas ar skābekli;
- ārējā elpošana - skābeklis nonāk plaušās, un organisms izdala oglekļa dioksīdu;
- iekšējā elpošana - plaušās skābeklis uztver hemoglobīnu, tie tiek pārveidoti par oksihemoglobīnu un izplatīti visās šūnās.
Tāpēc šī proteīna nelīdzsvarotība var izraisīt ārkārtīgi negatīvas sekas un dažos gadījumos pat nāvi.
Veidi
Cilvēka asinis satur dažādi veidi hemoglobīns:
- auglis vai auglis - šāda veida olbaltumvielas ir atrodamas jaundzimušā asinīs un līdz bērna piektajam dzīves mēnesim samazinās līdz 1% no kopējā hemoglobīna daudzuma organismā;
- oksihemoglobīns - atrodams arteriālās asins šūnās un saistīts ar skābekļa molekulām;
- karboksihemoglobīns - atrodams venozās asinīs un saistīts ar oglekļa dioksīda molekulām, ar kurām tas tiek transportēts uz plaušām;
- glikēts - olbaltumvielu un glikozes savienojums, kas cirkulē asinīs. Šāda veida olbaltumvielas tiek atklātas cukura testos;
- methemoglobīns - saistīts ar ķīmiskām vielām, tā augšana asinīs var liecināt par ķermeņa saindēšanos;
- sulfhemoglobīns - šī hemoglobīna molekula parādās asinīs tikai tad, ja lietojat noteiktus medikamentus. Šāda veida hemoglobīna pieļaujamais līmenis ir ne vairāk kā 10%.
Hemoglobīna veidus, kā arī noteikt, cik daudz tas ir asinīs, nosaka tikai ar laboratorijas diagnostiku.
Normas
Hemoglobīna formula nozīmē nesaraujamu saikni ar sarkano asins šūnu skaitu, uz kuras pamata tiek apkopoti normāli rādītāji. Vidēji optimālais rādītājsšī proteīna līmenis pieaugušajam:
- vīriešiem – 125-145 g/l;
- hemoglobīns sievietēm ir 115-135 g/l.
Turklāt to arī izmanto krāsu indekss lai noteiktu šī proteīna normu asinīs. Optimālā piesātinājuma pakāpe ir 0,8-1,1. Turklāt katras sarkanās asins šūnas piesātinājuma pakāpi ar hemoglobīnu nosaka atsevišķi, vidējā norma ir 28-32 piktogrammas.

Pārkāpumi struktūrā
Hemoglobīna struktūra ir nestabila, un visi tajā sastopamie traucējumi izraisa noteiktu patoloģisku procesu attīstību. Dažu ietekmes rezultātā etioloģiskie faktori var rasties:
- olbaltumvielu patoloģisku formu veidošanās - uz Šis brīdis Klīniski ir konstatētas tikai 300 formas;
- stabila, skābekli necaurlaidīga savienojuma karbohemoglobīna veidošanās saindēšanās laikā ar oglekļa dioksīdu;
- asins sabiezēšana;
- hemoglobīna līmeņa pazemināšanās, kas izraisa noteiktas pakāpes anēmijas attīstību.
Proteīna palielināšanās ir iespējama šādu etioloģisku faktoru dēļ:
- patoloģisks sarkano asins šūnu skaita pieaugums onkoloģisko procesu laikā;
- palielināta asins viskozitāte;
- sirds defekti;
- apdegumi;
- zarnu aizsprostojums;
- plaušu sirds mazspēja.
Tajā pašā laikā jāatzīmē, ka kalnu iedzīvotāju vidū hemoglobīna līmenis asinīs pastāvīgi ir paaugstināts, kas ir normāls fizioloģisks rādītājs. Tāpat šī proteīna normas ir pārvērtētas cilvēkiem, kuri ilgu laiku pavada svaigā gaisā – pilotiem, alpīnistiem, augstkalnu strādniekiem.
Hemoglobīna līmeņa pazemināšanās asinīs var būt saistīta ar šādus faktorus ietekmes:
- liela daudzuma plazmas pārliešana;
- akūts asins zudums;
- hroniskas mikroasiņošanas: ar hemoroīdiem, smaganu un dzemdes asiņošanu;
- hemolīze, kas izraisa sarkano asins šūnu iznīcināšanu;
- dzelzs un B12 vitamīna trūkums;
- patoloģiskos procesos kaulu smadzenēs.
Turklāt šī proteīna samazināšanās vai palielināšanās var būt saistīta ar nepareizu uzturu - ja organismā ir nepietiekams daudzums vai, gluži pretēji, pārmērīgs daudzums noteiktu produktu ar atbilstošu ķīmisko sastāvu.

Iespējamā klīniskā aina
Ar zemu hemoglobīna līmeni var rasties šādi simptomi:
- ātra noguruma spēja;
- sausa āda un gļotādas;
- vājums, vispārējs savārgums;
- biežs reibonis;
- aizkavēta garīgā un fiziskā attīstība bērniem;
- paaugstināta uzņēmība pret infekcijas slimībām;
- miega cikla traucējumi;
- slikta apetīte vai tās trūkums.
Jāpiebilst, ka pazemināts līmenis vāvere ir visbīstamākā bērniem, jo tā noved pie attīstības aizkavēšanās.
Paaugstināts šī proteīna līmenis organismā negatīvi ietekmē arī cilvēka veselību, kas izpaudīsies šādā klīniskajā attēlā:
- dzelte āda un gļotādas, mēle;
- bāla āda;
- nepietiekams svars;
- aknu palielināšanās;
- pieaugošs vājums;
- pigmentācija uz plaukstām un veco rētu zonā.
Gan pirmais, gan otrais var radīt ārkārtīgi negatīvas sekas.
Analīzes veikšana
Asins paraugu ņemšana, lai noteiktu, cik sarkano asins šūnu ir iekļauta hemoglobīnā, kā arī citus laboratorijas datus, tiek veikta saskaņā ar ārsta norādījumiem. Hemoglobīna tests tiek veikts no rīta tukšā dūšā. Tāpat dienu pirms asins nodošanas ir jāatsakās no alkohola un zālēm, kas ietekmē asinsrades sistēmu. Asinis tiek ņemtas no pirksta. Metožu sarakstā ir šādas:
- kolorimetrija;
- gāzes mērīšana;
- dzelzs noteikšana.
Tikai kvalificēts speciālists var pareizi interpretēt šo vai citu apzīmējumu. Tāpēc pēc izmeklējumu rezultātu saņemšanas tie jānogādā pie ārsta – viņš noteiks hemoglobīna līmeni un nozīmēs turpmākos terapeitiskos pasākumus.
Globuss - bumba) ir sarežģīta proteīna molekula sarkano asins šūnu - eritrocītu iekšpusē (cilvēkiem un mugurkaulniekiem). Hemoglobīns veido aptuveni 98% no visu sarkano asins šūnu proteīnu masas. Pateicoties savai struktūrai, hemoglobīns ir iesaistīts skābekļa pārnešanā no plaušām uz audiem un oglekļa monoksīda atpakaļ.
Hemoglobīna struktūra
Hemoglobīns sastāv no divām alfa tipa globīna ķēdēm un divām cita veida ķēdēm (beta, gamma vai sigma), kas savienotas ar četrām hema molekulām, kas satur dzelzi. Hemoglobīna struktūra ir rakstīta ar grieķu alfabēta burtiem: α2γ2.
Hemoglobīna apmaiņa
Hemoglobīnu veido sarkanās asins šūnas sarkanajās kaulu smadzenēs un cirkulē kopā ar šūnām visu mūžu – 120 dienas. Kad vecās šūnas tiek noņemtas ar liesu, hemoglobīna komponenti tiek izņemti no ķermeņa vai izdalīti atpakaļ asinsritē, lai iekļautos jaunās šūnās.
Hemoglobīna veidi
UZ normāli tipi hemoglobīns ietver hemoglobīnu A vai HbA (no pieaugušā - pieaugušā), kam ir struktūra α2β2, HbA2 (mazsvarīgs pieaugušā hemoglobīns ar struktūru α2σ2 un augļa hemoglobīns (HbF, α2γ2. Hemoglobīns F - augļa hemoglobīns. Aizstāt ar pieauguša hemoglobīnu pilnībā notiek ar 4 -6 mēneši (augļa hemoglobīna līmenis šajā vecumā ir mazāks par 1%).Embrionālais hemoglobīns veidojas 2 nedēļas pēc apaugļošanas, vēlāk, pēc augļa aknu veidošanās, to aizstāj ar augļa hemoglobīnu.
Ir vairāk nekā 300 patoloģisku hemoglobīnu, tie ir nosaukti pēc atklāšanas vietas.
Hemoglobīna funkcija
Hemoglobīna galvenā funkcija ir piegādāt skābekli no plaušām uz audiem un oglekļa dioksīdu atpakaļ.
Hemoglobīna formas
- Oksihemoglobīns- hemoglobīna kombinācija ar skābekli. Arteriālajās asinīs, kas iet no plaušām uz audiem, dominē oksihemoglobīns. Oksihemoglobīna satura dēļ arteriālajām asinīm ir sarkana krāsa.
- Samazināts hemoglobīns vai deoksihemoglobīns(HbH) - hemoglobīns, kas nodrošina audiem skābekli
- Karboksihemoglobīns- hemoglobīna kombinācija ar oglekļa dioksīdu. Tas ir atrodams venozajās asinīs un piešķir tam tumšu ķiršu krāsu.
Bora efekts
Šo efektu aprakstīja dāņu fiziologs Kristians Bors http://en.wikipedia.org/wiki/Christian_Bohr (slavenā fiziķa Nīla Bora tēvs).
Kristians Bors paziņoja, ka ar lielāku skābumu (vairāk zema vērtība pH, piemēram, audos) hemoglobīns mazāk saistīsies ar skābekli, kas ļaus tam izdalīties.
Plaušās skābekļa pārpalikuma apstākļos tas savienojas ar sarkano asins šūnu hemoglobīnu. Sarkanās asins šūnas pārvadā skābekli caur asinsriti uz visiem orgāniem un audiem. Oksidācijas reakcijas notiek ķermeņa audos, piedaloties ienākošajam skābeklim. Šo reakciju rezultātā veidojas sadalīšanās produkti, tostarp oglekļa dioksīds. Oglekļa dioksīds no audiem tiek pārnests uz sarkanajām asins šūnām, kā rezultātā samazinās afinitāte pret skābekli, skābeklis izdalās audos.
Bora efekts ir liela nozīme ķermeņa funkcionēšanā. Galu galā, ja šūnas strādā intensīvi un izdala vairāk CO2, sarkanās asins šūnas var piegādāt tām vairāk skābekļa, novēršot skābekļa badu. Tāpēc šīs šūnas var turpināt strādāt ar lielu ātrumu.
 Kāds ir normāls hemoglobīna līmenis?
Kāds ir normāls hemoglobīna līmenis?
Katrā mililitrā asiņu ir aptuveni 150 mg hemoglobīna! Hemoglobīna līmenis mainās līdz ar vecumu un ir atkarīgs no dzimuma. Tādējādi hemoglobīns jaundzimušajiem ir ievērojami augstāks nekā pieaugušajiem, un vīriešiem tas ir augstāks nekā sievietēm.
Kas vēl ietekmē hemoglobīna līmeni?
Daži citi apstākļi ietekmē arī hemoglobīna līmeni, piemēram, pakļaušana augstumam, smēķēšana un grūtniecība.
Slimības, kas saistītas ar hemoglobīna daudzuma vai struktūras izmaiņām
- Hemoglobīna līmeņa paaugstināšanās tiek novērota ar eritrocitozi un dehidratāciju.
- Hemoglobīna līmeņa pazemināšanās tiek novērota dažādu anēmiju gadījumā.
- Saindēšanās ar oglekļa monoksīdu gadījumā veidojas karbhemoglobīns (nejaukt ar karboksihemoglobīnu!), kas nevar piesaistīt skābekli.
- Atsevišķu vielu ietekmē veidojas methemoglobīns.
- Hemoglobīna struktūras izmaiņas sauc par hemoglobinopātiju. Slavenākās un izplatītākās šīs grupas slimības ir sirpjveida šūnu anēmija, beta talasēmija un augļa hemoglobīna noturība. Skatiet hemoglobinopātijas Pasaules Veselības organizācijas tīmekļa vietnē http://www.who.int/mediacentre/factsheets/fs308/ru/index.html
Vai tu zināji?

Citi raksti šajā sadaļā
Izplatīts infekcijas izraisītājs elpceļi(faringīts, sinusīts, otitis, bronhīts un pneimonija). Antivielu testus izmanto, lai diagnosticētu infekciju...
Mycoplasma pneumoniae ir cilvēka pneimonijas, akūtu elpceļu infekciju (ARI), augšējo elpceļu slimību (faringīts, bronhīts), kā arī dažu ar elpceļu nesaistītu slimību izraisītājs.
Azoospermija - spermas trūkums ejakulātā
Vienšūnas mikroorganismi, no kuriem daži var izraisīt slimības.
Mycoplasma pneumoniae (mycoplasma pneumoniae), Chlamydophila pneumoniae (chlamydophila pneumoniae, agrāk saukta par Chlamydia pneumoniae)