Vaxigrip- inaktivēta dalītā vakcīna gripas profilaksei. STRAINS 2019./2020.
Reģistrācijas apliecība: P NO1449З/01
Tirdzniecības nosaukums: Vaxigrip
Grupas nosaukums: gripas vakcīna
Devas forma: suspensija intramuskulārai un subkutānai ievadīšanai
Ražotājvalsts: Sanofi Pasteur, Francija
Izpētes aptauja: nav nepieciešams
Vakcīnas izmaksas: 2400 rubļi.
Piemērojams: Pieaugušajiem un bērniem no 6 mēnešiem.
Nosacījumi izsniegšanai no aptiekām:Šļirces - pēc receptes, ampulas - Medicīnas iestādēm
Vakcīnas pieejamība: noliktavā
Šīs vakcīnas analogi:
Vakcīna "Influvac" (pieaugušajiem un bērniem no 6 mēnešiem.)
Vakcīna "Ultrix quadri" (Ultrix) (pieaugušajiem 18+)
ZĀĻU APRAKSTS
Izskats: Nedaudz opalescējošs, nedaudz bālgans šķidrums.
Imunobioloģiskās īpašības
Vaxigrip veido specifisku imunitāti pret epidēmiski nozīmīgiem A un B tipa gripas vīrusa celmiem, ko satur šī vakcīna. Imunitāte veidojas no 2. līdz 3. nedēļai pēc vakcinācijas un saglabājas no 6 līdz 12 mēnešiem.
SAVIENOTS
0,5 ml suspensijas satur:
Aktīvās sastāvdaļas:
Inaktivēti sadalīti gripas vīrusi, kas kultivēti uz vistu embrijiem, ko pārstāv celmi, kas līdzvērtīgi šādiem:
- A/Brisbane/02/2018, IVR-190 līdzīgs A/Brisbane/02/2018(H1N1) pdm09- 15 μg GA;
- A/Kansas/14/2017 NYMC X-327, līdzīgi kā A/Kansas/14/2017(H3N2) - 15 μg GA;
- B/Maryland/15/2016 NYMC BX-69A, līdzīgi kā B/Colorado/06/2017 — 15 mcg GA.
Palīgkomponenti:
- buferšķīdums (nātrija hlorīds, kālija hlorīds, nātrija hidrogēnfosfāta dihidrāts, kālija dihidrogēnfosfāts, ūdens injekcijām) - līdz 0,5 ml;
- Vakcīnas celma sastāvs atbilst PVO rekomendācijām ziemeļu puslodei un ES lēmumam par gripas vakcīnu sastāvu 2019./2020.gada sezonai. Vaxigrip vienā devā var saturēt ne vairāk kā 0,05 mikrogramus ovalbumīna.
LIETOŠANAS INDIKĀCIJAS
Gripas profilakse pieaugušajiem un bērniem no 6 mēnešu vecuma. Vakcinācija ir īpaši indicēta personām, kurām ir paaugstināts pēcgripas komplikāciju attīstības risks.
KONTRINDIKĀCIJAS
- Paaugstināta jutība pret kādu no vakcīnas sastāvdaļām, kā arī vistas gaļas vai vistas olu sastāvdaļām, neomicīnu, formaldehīdu un oktoksinolu-9;
- Slimībām, ko pavada ķermeņa temperatūras paaugstināšanās, kā arī akūtu vai hronisku slimību saasināšanās gadījumā vakcinācija jāatliek līdz atveseļošanai;
LIETOŠANA GRŪTNIECĪBAS UN ZĪDĪŠANAS LAIKĀ
Pieejamie dati par vakcīnas lietošanu grūtniecēm neliecina par iespējamu vakcinācijas negatīvo ietekmi uz augli un sievietes ķermeni.
Vakcināciju var veikt, sākot no otrā grūtniecības trimestra. Medicīnisku iemeslu dēļ, ja ir paaugstināts pēcgripas komplikāciju attīstības risks, šo vakcīnu ieteicams lietot neatkarīgi no grūtniecības stadijas.
Vakcīnu var lietot zīdīšanas laikā.
LIETOŠANAS METODE UN DEVAS
Vakcīnu ievada intramuskulāri vai dziļi subkutāni. Neievadīt intravenozi! Vakcīna pirms lietošanas jāuzglabā istabas temperatūrā un jāsakrata.
- Bērniem vecākiem par 36 mēnešiem un pieaugušajiem - 0,5 ml vienu reizi;
- Bērniem vecumā no 6 mēnešiem līdz 35 mēnešiem ieskaitot - 0,25 ml vienu reizi;
- Bērniem līdz 9 gadu vecumam, kuri pirmo reizi tiek vakcinēti pret gripu, ir indicētas divas Vaxigrip devas ar 4 nedēļu intervālu.
Lietojot šļirci, kas satur 0,5 ml vakcīnas, lai imunizētu bērnus, kuriem indicēta 0,25 ml deva, ir nepieciešams izņemt pusi no satura, nospiežot virzuli līdz īpašajai atzīmei. Injicējiet pacientam atlikušo vakcīnas daudzumu.
Lietojot ampulu, kas satur 0,5 ml vakcīnas, lai imunizētu bērnus, kuriem ir indicēta 0,25 ml deva, tā jāizvelk, izmantojot atbilstoši graduētu šļirci. Atlikusī vakcīnas daļa ampulā nekavējoties jāiznīcina.
BLAKUS EFEKTI
Vispārējas reakcijas
- Paaugstināta ķermeņa temperatūra;
- savārgums;
- Drebuļi;
- Jūsties nogurušam;
- Galvassāpes;
- Svīšana;
- Muskuļu sāpes (mialģija);
- Locītavu sāpes (artralģija).
Vietējās reakcijas
- Apsārtums;
- Pietūkums;
- Sāpīgums;
- Zilumi (ekhimoze);
- Izaugums injekcijas vietā.
Šīs reakcijas parasti izzūd 1-2 dienu laikā, un tām nav nepieciešama īpaša ārstēšana.
Masveidā lietojot Vaxigrip, ļoti retos gadījumos radās šādas blakusparādības:
- pārejoša trombocitopēnija;
- Limfadenopātija;
- Vaskulīts ar iespējamu īslaicīgu nieru iesaistīšanos (atsevišķos gadījumos);
- Parestēzija;
- Guillain-Barre sindroms;
- Neirīts;
- neiralģija;
- Krampji;
- encefalomielīts;
- Nātrene;
- Izsitumi uz ādas;
- Aizdusa;
- angioneirotiskā tūska;
SPECIĀLAS INSTRUKCIJAS
- Sakarā ar to, ka saslimstība ar gripu ir sezonāla, vakcinēties ieteicams katru gadu rudens-ziemas periodā, kad gripas risks ir vislielākais;
- Vakcīna izraisa imunitātes veidošanos tikai pret 3 gripas vīrusa celmiem, ko satur zāles, vai pret celmiem, kas līdzīgi norādītajiem. Vaxigrip nenodrošina imunitāti pret gripu, vakcinējoties slimības inkubācijas periodā, kā arī pret gripu, ko izraisa citi vīrusa celmi. Vaxigrip neveido imunitāti pret slimībām, kas pēc simptomiem ir līdzīgas gripai, bet ko izraisa citi patogēni. Vakcinācija pret gripu, kas veikta iepriekšējā epidēmijas sezonā, nevar nodrošināt drošu aizsardzību nākamajai sezonai, jo Katrai epidēmijas sezonai ir savi visizplatītākie gripas vīrusa celmi;
- Ārsts jāinformē, ja pacientam ir imūndeficīts, alerģija vai neparasta reakcija uz iepriekšējo vakcināciju, kā arī par jebkuru ārstēšanu, kas sakrita ar vakcināciju vai bija pirms tās. Vakcīnu nedrīkst lietot, ja suspensijai ir neraksturīga krāsa vai ja tajā ir svešas daļiņas;
- Šīs vakcīnas lietošana neietekmē spēju vadīt automašīnu vai citu aprīkojumu;
- Ārsts jāinformē par visiem blakusparādību gadījumiem, ne tikai tiem, kas uzskaitīti šajā instrukcijā;
- Dažu dienu laikā pēc vakcinācijas var rasties kļūdaini pozitīvi rezultāti, nosakot antivielas pret HIV-1, C hepatīta vīrusu un, jo īpaši, cilvēka T-limfotropā vīrusa 1. tipu, izmantojot enzīmu imūnsorbcijas testu (ELISA). Šajos gadījumos ELISA iegūto rezultātu novērtē, izmantojot Western blot metodi;
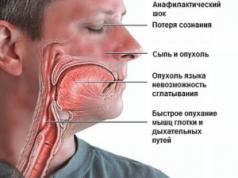
- Veicot vakcināciju, ir jābūt pieejamiem medikamentiem, kas nepieciešami neatliekamās palīdzības sniegšanai anafilaktiskas reakcijas gadījumā;
MIJIEDARBĪBA AR CITĀM ZĀLĒM
Vaxigrip var lietot vienlaikus (tajā pašā dienā) ar citām vakcīnām.Šajā gadījumā zāles jāinjicē dažādās ķermeņa daļās, izmantojot dažādas šļirces. Vakcīnu nevar sajaukt ar citām zālēm vienā šļircē.
Pacientiem, kuriem tiek veikta imūnsupresīva terapija (kortikosteroīdi, citotoksiskas vai radioaktīvas zāles), imūnreakcija pēc vakcinācijas var būt nepietiekama.
IZLASES FORMA
- 0,5 ml vakcīnas šļircē, 1 šļirce slēgtā šūnu iepakojumā, 1 slēgto šūnu iepakojums ar lietošanas instrukciju kartona kastītē;
- 0,5 ml vakcīnas ampulā, 10 ampulas blisteriepakojumā, 2 blisteriepakojumi (20 ampulas) ar lietošanas instrukciju kartona kastītē.
LABĀK PIRMS DATUMA
susp. intramuskulārai un subkutānai ievadīšanai 0,5 ml/1 deva: šļirces 1 gab., amp. 20 gab.Reg. Nr.: 4150/99/04/08/13, datums 25/07/2013 - Derīgs
Suspensija intramuskulārai un subkutānai ievadīšanai nedaudz bālgans, nedaudz opalescējošs.
Palīgvielas: buferšķīdums - nātrija hlorīds, kālija hlorīds, nātrija hidrogēnfosfāta dihidrāts, kālija dihidrogēnfosfāts, ūdens (līdz 0,5 ml).
0,5 ml - šļirces (1) - kontūršūnu iepakojums (1) - kartona iepakojumi.
0,5 ml - ampulas (10) - kontūršūnu iepakojums (2) - kartona iepakojumi.
* - kultivēts uz vistu embrijiem.
** - celma sastāvs atbilst PVO rekomendācijām Ziemeļu puslodei un ES lēmumam par gripas vakcīnu sastāvu kārtējai epidēmijas sezonai.
*** - hemaglutinīns.
Vakcīna vienā devā nedrīkst saturēt vairāk kā 0,05 mikrogramus ovalbumīna.
Zāļu apraksts VAXIGRIP pamatojoties uz oficiāli apstiprinātām zāļu lietošanas instrukcijām un izgatavotas 2009. gadā. Atjaunināšanas datums: 23.08.2010
Vakcīna gripas profilaksei. Vaxigrip veido specifisku imunitāti pret epidēmiski nozīmīgiem A un B tipa gripas vīrusa celmiem, ko satur šī vakcīna. Imunitāte veidojas no 2. līdz 3. nedēļai pēc vakcinācijas un saglabājas no 6 līdz 12 mēnešiem.
Vakcīnu ievada intramuskulāri vai dziļi subkutāni. Neievadīt IV! Vakcīna pirms lietošanas jāuzglabā istabas temperatūrā un jāsakrata.
Priekš bērni vecāki par 36 mēnešiem un pieaugušie - 0,5 ml vienu reizi, par bērni vecumā no 6 mēnešiem līdz 35 mēnešiem ieskaitot - 0,25 ml vienu reizi.
Bērni līdz 9 gadu vecumam, kuri pirmo reizi tiek vakcinēti pret gripu, ir indicēta dubultā Vaxigrip deva ar 4 nedēļu intervālu.
Izmantojot šļirci, kas satur 0,5 ml vakcīnas, lai imunizētu bērnus, kuriem indicēta 0,25 ml deva, ir nepieciešams izņemt pusi no satura, nospiežot virzuli līdz īpašai atzīmei. Injicējiet pacientam atlikušo vakcīnas daudzumu.
Lietojot ampulu, kas satur 0,5 ml vakcīnas, lai imunizētu bērnus, kuriem ir indicēta 0,25 ml deva, tā jāizvelk, izmantojot šļirci ar atbilstošu iedalījumu. Atlikusī vakcīnas daļa ampulā nekavējoties jāiznīcina.
Klīnisko pētījumu laikā tie parasti tika novēroti (ar biežumu no 1/100 līdz 1/10).
Vispārējas reakcijas: paaugstināta ķermeņa temperatūra, savārgums, drebuļi, noguruma sajūta, galvassāpes, svīšana, mialģija, artralģija.
Vietējās reakcijas: apsārtums, pietūkums, sāpes, zilumi (ekhimoze), sacietēšana injekcijas vietā.
Šīs reakcijas parasti izzūd 1-2 dienu laikā, un tām nav nepieciešama īpaša ārstēšana.
Masveidā lietojot Vaxigrip, ļoti retos gadījumos radās šādas blakusparādības.
No hematopoētiskās sistēmas: pārejoša trombocitopēnija, limfadenopātija, vaskulīts ar iespējamu īslaicīgu nieru bojājumu (atsevišķos gadījumos)
No nervu sistēmas: parestēzija, Guillain-Barré sindroms, neirīts, neiralģija, krampji, encefalomielīts.
Alerģiskas reakcijas: nātrene, nieze, izsitumi uz ādas, elpas trūkums, angioneirotiskā tūska, šoks.
- paaugstināta jutība pret kādu no vakcīnas sastāvdaļām, kā arī vistas gaļas vai vistas olu sastāvdaļām, neomicīnu, formaldehīdu un oktoksinolu-9;
Slimībām, ko pavada ķermeņa temperatūras paaugstināšanās, kā arī akūtu vai hronisku slimību saasināšanās gadījumā vakcinācija jāatliek līdz atveseļošanai.
Lietojiet grūtniecības un zīdīšanas laikā
Pieejamie dati par vakcīnas lietošanu grūtniecēm neliecina par iespējamu vakcinācijas negatīvo ietekmi uz augli un sievietes ķermeni. Vakcināciju ar šīm zālēm var veikt, sākot no otrā grūtniecības trimestra. Medicīnisku iemeslu dēļ, ja ir paaugstināts pēcgripas komplikāciju attīstības risks, šo vakcīnu ieteicams lietot neatkarīgi no grūtniecības stadijas.
Vakcīnu var lietot zīdīšanas laikā.
Ņemot vērā to, ka saslimstība ar gripu ir sezonāla, vakcinēties ieteicams katru gadu rudens-ziemas periodā, kad gripas risks ir vislielākais.
Vakcīna izraisa imunitātes veidošanos tikai pret 3 gripas vīrusa celmiem, ko satur zāles, vai pret celmiem, kas līdzīgi norādītajiem.
Vaxigrip nenodrošina imunitāti pret gripu, vakcinējoties slimības inkubācijas periodā, kā arī pret gripu, ko izraisa citi vīrusa celmi. Vaxigrip neveido imunitāti pret slimībām, kas pēc simptomiem ir līdzīgas gripai, bet ko izraisa citi patogēni.
Vakcinācija pret gripu, kas veikta iepriekšējā epidēmijas sezonā, nevar nodrošināt drošu aizsardzību nākamajai sezonai, jo Katrai epidēmijas sezonai ir savi visizplatītākie gripas vīrusa celmi.
Ārsts jāinformē, ja pacientam ir imūndeficīts, alerģija vai neparasta reakcija uz iepriekšējo vakcināciju, kā arī par jebkuru ārstēšanu, kas sakrita ar vakcināciju vai bija pirms tās.
Vakcīnu nedrīkst lietot, ja suspensijai ir neraksturīga krāsa vai ja tajā ir svešas daļiņas.
Ārsts jāinformē par visiem blakusparādību gadījumiem, ne tikai tiem, kas uzskaitīti šajā instrukcijā.
Dažu dienu laikā pēc vakcinācijas var rasties kļūdaini pozitīvi rezultāti, nosakot antivielas pret HIV-1, C hepatīta vīrusu un jo īpaši cilvēka T-limfotropā vīrusa 1. tipu.
enzīmu imūnanalīzes (ELISA) metode. Šādos gadījumos ELISA iegūto rezultātu novērtē, izmantojot Western blot metodi.
Veicot vakcināciju, ir nepieciešami medikamenti, kas nepieciešami neatliekamās palīdzības sniegšanai anafilaktiskas reakcijas gadījumā.
Ietekme uz spēju vadīt transportlīdzekļus un apkalpot mehānismus
Šīs vakcīnas lietošana neietekmē spēju vadīt automašīnu vai citu aprīkojumu.
Vaxigrip var lietot vienlaikus (tajā pašā dienā) ar citām vakcīnām. Šajā gadījumā zāles jāinjicē dažādās ķermeņa daļās, izmantojot dažādas šļirces.
Vakcīnu nevar sajaukt ar citām zālēm vienā šļircē.
Pacientiem, kuriem tiek veikta imūnsupresīva terapija (kortikosteroīdi, citotoksiskas vai radioaktīvas zāles), imūnreakcija pēc vakcinācijas var būt nepietiekama.
Derīguma termiņš - 12 mēneši. Par derīguma termiņu tiek uzskatīta uz iepakojuma norādītā mēneša pēdējā diena.
Nelietot pēc derīguma termiņa beigām, kas norādīts uz iepakojuma.
SANOFI PASTER S.A., pārstāvniecība, (Francija)
Oficiāli pilnvarots izplatītājs
Baltkrievijas Republikas teritorijā VAS "Medvax"
Gripas profilaksei, inaktivēta (sadalīta) (gripas vakcīna (šķelts virions), inaktivēta)
Zāļu sastāvs un izdalīšanās forma
Suspensija intramuskulārai un subkutānai ievadīšanai nedaudz bālgans, nedaudz opalescējošs.
Palīgvielas: buferšķīdums (kālija hlorīds, nātrija hidrogēnfosfāta dihidrāts, kālija dihidrofosfāts, ūdens injekcijām) - līdz 0,25 ml.
Nesatur adjuvantus vai konservantus.
Rūpnieciskie piemaisījumi (saturs 1 devā): formaldehīds - ne vairāk kā 15 mikrogrami, oktoksinols-9 - ne vairāk kā 100 mikrogrami, - ne vairāk kā 10 pkg, ovalbumīns - ne vairāk kā 0,025 mikrogrami.
0,25 ml - šļirces (1) - slēgto šūnu iepakojums (1) - kartona iepakojumi.
Vakcīnas celmu sastāvs atbilst PVO rekomendācijām ziemeļu puslodei un ES lēmumam par vakcīnu sastāvu pašreizējai epidēmiskās gripas sezonai.
farmakoloģiskā iedarbība
Inaktivēta attīrīta dalīta gripas vakcīna. Novērš slimības, ko izraisa A un B tipa gripas vīruss.
Izraisa humorālo antivielu veidošanos pret hemaglutinīniem, neitralizējot gripas vīrusus. Seroprotektīvo antivielu līmenis parasti tiek sasniegts 7-10 dienu laikā pēc vakcīnas ievadīšanas. Pēcvakcinācijas imunitātes ilgums pret homologiem vai radniecīgiem celmiem svārstās no 6 līdz 12 mēnešiem.
Indikācijas
Gripas profilakse.
Kontrindikācijas
Akūtas infekcijas slimības, hronisku slimību saasinājumi, paaugstināta jutība pret vakcīnas aktīvajām vai palīgkomponentēm; paaugstināta jutība pret tehnoloģiskajā procesā izmantotajiem sulfātiem, formaldehīdu, mertiolātu, nātrija deoksiholātu, olu un vistas baltumiem.
Dozēšana
Dažādām vecuma kategorijām jāizmanto atbilstoši vakcīnu preparāti, ņemot vērā kontrindikācijas.
Vakcinācija jāveic pirms epidēmiskās gripas sezonas sākuma vai ņemot vērā epidēmisko situāciju.
Vakcīnu ievada intramuskulāri vai dziļi subkutāni. Pacientiem ar trombocitopēniju un citām koagulācijas sistēmas slimībām vakcīna jāievada subkutāni. Vakcīnu nekādā gadījumā nedrīkst ievadīt intravenozi.
Blakus efekti
Sistēmiskas reakcijas: iespējams - neliela īslaicīga ķermeņa temperatūras paaugstināšanās, drudzis, vispārējs savārgums (šīs parādības izzūd pašas 1-2 dienu laikā); ārkārtīgi reti - neiralģija, parestēzija, krampji, pārejoša trombocitopēnija, neiroloģiski traucējumi, vaskulīts.
Alerģiskas reakcijas: pacientiem ar zināmu jutību pret atsevišķām vakcīnas sastāvdaļām - ādas nieze, nātrene, izsitumi; ārkārtīgi reti – smagas alerģiskas reakcijas, piemēram,.
Vietējās reakcijas: sāpīgums, apsārtums un pietūkums injekcijas vietā.
Zāļu mijiedarbība
Imunizācijas efektivitāte var samazināties vienlaicīgas imūnsupresīvas terapijas dēļ, kā arī imūndeficīta klātbūtnē.
Speciālas instrukcijas
Šī vakcīna novērš gripas vīrusa izraisītas slimības un nenovērš augšējo elpceļu infekcijas, ko izraisa citi patogēni.
Vieglas formas ARVI un akūtu zarnu slimību gadījumā vakcinācija tiek veikta tūlīt pēc temperatūras normalizēšanās.
Lietojot vakcīnu, vienmēr ir jābūt līdzi piederumiem, kas var būt nepieciešami retu anafilaktisku reakciju gadījumā pēc ievadīšanas. Šī iemesla dēļ vakcinētajam 30 minūtes pēc imunizācijas jāatrodas medicīniskā uzraudzībā.
Pēc vakcinācijas pret gripu ir ziņots par viltus pozitīviem seroloģisko ELISA testu rezultātiem, lai noteiktu antivielas pret HIV 1 un jo īpaši cilvēka T-limfotropo vīrusu 1 (HTLV 1), kas var būt saistīts ar imūnreakciju (IgM veidošanos) pret vakcināciju. .
Grūtniecība un laktācija
Pašlaik nav pietiekami daudz datu par šīs vakcīnas embriotoksicitāti un teratogenitāti.
Ārsts individuāli izlemj, vai lietot vakcīnu zīdīšanas laikā.
Devas forma: suspensija intramuskulārai un subkutānai ievadīšanai Savienojums:Aktīvā sastāvdaļa
Inaktivēti sadalīti gripas vīrusi, kas kultivēti uz vistu embrijiem, ko pārstāv celmi:
| Deva 0,2 5 ml | Deva 0,5 ml |
|
| A/ (H3N2) * | 7,5 mikrogrami hemaglutinīna | 15 mikrogrami hemaglutinīna |
| A/ (H1N1)* | 7,5 mikrogrami hemaglutinīna | 15 mikrogrami hemaglutinīna |
| 7,5 mikrogrami hemaglutinīna | 15 mikrogrami hemaglutinīna |
Palīgkomponents (šķīdinātājs)
Nesatur adjuvantus vai konservantus.
Rūpnieciskie piemaisījumi (saturs vienā devā):
| Deva 0,25 ml | Deva 0,5 ml |
|
| Formaldehīds | ne vairāk kā 15 mcg | ne vairāk kā 30 mcg |
| Oktoksinols-9 | ne vairāk kā 100 mcg | ne vairāk kā 200 mcg |
| Neomicīns | ne vairāk kā 10 pikogrami | ne vairāk kā 20 pikogrami |
| Ovalbumīns | ne vairāk kā 0,025 mcg | ne vairāk kā 0,050 mkg |
Nedaudz opalescējošs, nedaudz bālgans šķidrums.
Farmakoterapeitiskā grupa: MIBP — ATX vakcīna:J.07.B.B.01 Gripas vīruss – inaktivēts vesels vīruss
J.07.B.B Vakcīna gripas profilaksei
Farmakodinamika:Vaxigrip vakcīna ir izgatavota no trim gripas vīrusa celmiem, kultivēta, attīrīta un pēc tam inaktivēta ar formaldehīdu.
Vaxigrip vakcīna veido specifisku imunitāti pret epidēmiski nozīmīgiem A un B tipa gripas vīrusa celmiem, ko satur šī vakcīna.
Imunitāte veidojas no 2. līdz 3. nedēļai pēc vakcinācijas un saglabājas no 6 līdz 12 mēnešiem.
Indikācijas:Gripas profilakse pieaugušajiem un bērniem no 6 mēnešu vecuma.
Vakcinācija ir īpaši indicēta personām, kurām ir paaugstināts pēcgripas komplikāciju attīstības risks.
Kontrindikācijas:Paaugstināta jutība pret kādu no vakcīnas sastāvdaļām, kā arī vistas gaļas vai vistas olu sastāvdaļām, neomicīnu, formaldehīdu un oktoksinolu-9;
Smagas alerģiskas reakcijas pēc iepriekšējas vakcīnas vai vakcīnas, kas satur tās pašas sastāvdaļas, ievadīšanas;
Smaga reakcija (temperatūra virs 40 °C, pietūkums un hiperēmija injekcijas vietā, kura diametrs pārsniedz 8 cm) vai komplikācija pēc iepriekšējās zāļu lietošanas;
Akūtas infekcijas vai neinfekcijas slimības, hronisku slimību saasināšanās - vakcinācijas tiek veiktas 2-4 nedēļas pēc atveseļošanās vai remisijas. Vieglas ARVI un akūtu zarnu slimību gadījumā vakcinācija tiek veikta pēc temperatūras normalizēšanās.
Uzmanīgi:Jāizmanto Vaxigrip vakcīna uzmanīgi personām ar trombocitopēniju vai ar asinsreces sistēmas traucējumiem sakarā ar asiņošanas iespējamību pēc intramuskulāras injekcijas.
Grūtniecība un laktācija:Pieejamie dati par vakcīnas lietošanu grūtniecēm neliecina par iespējamu vakcinācijas negatīvo ietekmi uz augli un sievietes ķermeni.
Vakcināciju ar Vaxigrip var veikt, sākot no otrā grūtniecības trimestra. Medicīnisku iemeslu dēļ, ja ir paaugstināts pēcgripas komplikāciju attīstības risks, šo vakcīnu ieteicams lietot neatkarīgi no grūtniecības stadijas.
Vakcīnu var lietot zīdīšanas laikā.
Lietošanas un devas norādījumi:Vakcīnu ievada intramuskulāri vai dziļi subkutāni. Neievadīt intravenozi! Pirms lietošanas vakcīna jāuzglabā istabas temperatūrā un jāsakrata, līdz veidojas viendabīgs šķīdums.
Dozēšana:
-bērniem no 6 līdz 35 mēnešiem- 0,25 ml vienu reizi;
- bērni vecāki par 36 mēnešiem un pieaugušie- 0,5 ml vienu reizi;
- bērniem līdz 6 mēnešiem- Vaxigrip vakcīnas drošība un efektivitāte bērniem līdz 6 mēnešu vecumam nav pētīta.
- bērniem no 6 līdz 11 mēnešiem, augšstilba anterolaterālā virsma;
-bērniem no 12 mēnešiem līdz 35 mēnešiem- augšstilba vai deltveida muskuļa zonas anterolaterālā virsma;
-bērniem no 36 mēnešiem un pieaugušajiem- deltveida muskuļa laukums.
Bērniem līdz 9 gadu vecumam, kuri tiek vakcinēti pret gripu pirmo reizi, ieteicamas divas Vaxigrip vakcīnas devas ar 4 nedēļu intervālu.
Lietojot šļirci, kas satur 0,5 ml vakcīnas, lai imunizētu bērnus, kuriem ir indicēta 0,25 ml deva, jāizņem puse no 0,5 ml šļirces tilpuma. Šļirce jātur vertikālā stāvoklī un gājiena apturēšana jāpavirza uz priekšu, līdz tā sasniedz tievo melno līniju, kas uzdrukāta uz šļirces. Ievadiet atlikušo 0,25 ml tilpumu.
Visas šļircē atlikušās vakcīnas nekavējoties jāiznīcina.
Blakus efekti:Informācija par blakusparādībām tika iegūta no klīniskajiem pētījumiem un zāļu pēcreģistrācijas lietošanas laikā dažādās pasaules valstīs.
Dati iegūti klīniskajos pētījumos
Sakarā ar ikgadējām gripas vakcīnas celmu sastāva izmaiņām un atbilstoši Eiropas prasībām, katru gadu tiek veikti Vaxigrip vakcīnas drošuma un imunogenitātes klīniskie pētījumi, kuros piedalās vismaz 50 pieaugušie vecumā no 18-60 gadiem un vismaz 50 vecāka gadagājuma cilvēki. vecumā > 60 gadiem.
Apvienotā drošības analīze ietvēra klīniskos datus no 36 pētījumiem. Kopā ar Vaxigrip intramuskulāri vakcinēti 10 880 cilvēki (54 bērni vecumā no 6 līdz 35 mēnešiem, 460 bērni vecumā no 3 līdz 8 gadiem, 72 bērni vecumā no 9 līdz 17 gadiem, 4775 pieaugušie vecumā no 18 līdz 60 gadiem un 5519 pieaugušie vecāki par ). Lielākā daļa blakusparādību bija vieglas vai vidēji smagas, parasti attīstījās vakcinācijas dienā un izzuda nākamo 3 dienu laikā.
Tālāk ir norādīts blakusparādību biežums (ar diapazoniem, kas atbilst atsevišķiem pētījumiem), par kuriem ziņots 3 un 7 novērošanas dienu laikā pēc imunizācijas.
Visbiežāk novērotā lokālā reakcija 7 dienu novērošanas periodā pēc vakcīnas ievadīšanas visās populācijās, izņemot bērnus vecumā no 6 līdz 35 mēnešiem, bija sāpes injekcijas vietā.
Bērniem vecumā no 6 līdz 35 mēnešiem 7 dienu novērošanas periodā pēc vakcīnas ievadīšanas visbiežāk tika konstatēti garīgi traucējumi aizkaitināmības veidā.
No vispārējiem traucējumiem visbiežāk novērotā reakcija 7 dienu laikā pēc vakcīnas ievadīšanas pieaugušajiem, gados vecākiem cilvēkiem un bērniem vecumā no 9 līdz 17 gadiem bija galvassāpes. Bērniem vecumā no 3 līdz 8 gadiem visbiežāk ziņots par savārgumu.
Tālāk norādītās nevēlamās blakusparādības ir uzskaitītas atbilstoši sistēmisko orgānu klasēm un sastopamības biežumam. Biežums tika noteikts, pamatojoties uz šādiem kritērijiem: ļoti bieži (≥10%), bieži (≥1% pirms<10%), нечасто (≥0,1% до <1%), редко (≥0,01% до <0,1%), очень редко (<0,01%), частота неизвестна (нельзя оценить по имеющимся данным).
Blakusparādības, par kurām ziņots 3 dienu laikā pēc imunizācijas
Vielmaiņas un uztura traucējumi
*Ļoti bieži: apetītes zudums 1
Bieži: bezmiegs 1.
Ļoti bieži: galvassāpes 2,3,4,5, miegainība 1.
No kuņģa-zarnu trakta*
Ļoti bieži: caureja 1.
Bieži: vemšana 1.
No ādas un zemādas audiem*
Bieži: pastiprināta svīšana 4.5.
Ļoti bieži: mialģija *2,3,4.
Bieži: artralģija *4, 5, mialģija 5.
Vispārēji traucējumi un traucējumi ievadīšanas vietā*
Ļoti bieži: sāpes 1,2, 3, 4, 5, apsārtums 1,2, 3, 4,5, sacietējums 4,5, pietūkums 2,3, 4,5 injekcijas vietā, astēnija 4, drudzis >
Bieži: pietūkums 1, sacietējums 2,3, hematoma 1,2, 3, 4,5, nieze 1,2, 4,5 injekcijas vietā, astēnija 5, temperatūras paaugstināšanās >38 °C (mērot mutes dobumā) 2, 3, 4, 5, drebuļi 2, 4, 5, savārgums 5.
Bērniem vecumā no 9 līdz 17 gadiem sāpes un apsārtums injekcijas vietā, galvassāpes un mialģija visbiežāk tika novērotas 3 dienu laikā pēc injekcijas.
Bērniem vecumā no 3 līdz 8 gadiem sāpes un apsārtums injekcijas vietā un savārgums visbiežāk tika novērotas 3 dienu laikā pēc injekcijas.
Bērniem vecumā no 6 līdz 35 mēnešiem sāpes injekcijas vietā, aizkaitināmība un patoloģiska raudāšana visbiežāk tika novērota 3 dienu laikā pēc injekcijas.
Blakusparādības, kas reģistrētas 7 dienu novērošanas periodā pēc imunizācijas
Vielmaiņas un uztura traucējumi*
Ļoti bieži: apetītes zudums 1.
Garīgi traucējumi*
Ļoti bieži: aizkaitināmība 1, patoloģiska raudāšana 1.
Nervu sistēmas traucējumi
Ļoti bieži: galvassāpes 2, 3, 4, 5, miegainība* 1.
No kuņģa-zarnu trakta*
Bieži: vemšana 1.
No ādas un zemādas audiem
Bieži: pastiprināta svīšana 4.5
No balsta un kustību aparāta un saistaudu puses
Ļoti bieži: mialģija 2, 3, 4, 5
Bieži: artralģija * 4.5
Ļoti bieži: sāpes 1,2,3,4,5, apsārtums 1,2,3,4,5, cietība 1,2,3,4,5, pietūkums 1,2,3,4,5, nieze* 4 injekcijas vietā, astēnija* 4, drudzis >38 °C (mērot mutes dobumā) 1, drebuļi 3, savārgums 2,3,4.
Bieži: blīvējums 3, hematoma 2, 3, 4, 5, nieze* 5 injekcijas vietā, astēnija* 5, drudzis >38 °C (mērot mutes dobumā) 2, 3, 4, 5, drebuļi 2, 3,4,5, savārgums 5.
Iepriekš minētās nevēlamās blakusparādības biežāk tika novērotas pieaugušajiem, kas vecāki par 60 gadiem, nekā pieaugušajiem vecumā no 18 līdz 59 gadiem. Kopumā Vaxigrip drošības profils 3 vai 7 novērošanas dienu laikā pēc injekcijas ir identisks abās vecuma grupās.
Bērniem vecumā no 9 līdz 17 gadiem 7 dienu novērošanas periodā pēc injekcijas visbiežāk tika novērotas sāpes un apsārtums injekcijas vietā, galvassāpes un mialģija.
Bērniem vecumā no 3 līdz 8 gadiem 7 dienu novērošanas periodā pēc injekcijas visbiežāk tika novērotas sāpes un apsārtums injekcijas vietā, savārgums un mialģija.
Bērniem vecumā no 6 līdz 35 mēnešiem 7 dienu novērošanas periodā pēc injekcijas visbiežāk tika novērota aizkaitināmība, drudzis >38 °C, samazināta ēstgriba un patoloģiska raudāšana.
Tālāk ir norādīts nevēlamo blakusparādību biežums (diapazons, kas atbilst 7 klīniskajos pētījumos iegūtajiem rādītājiem), par kuriem ziņots brīvprātīgi 21 dienas laikā pēc imunizācijas. Šajos pētījumos kopumā piedalījās 7680 cilvēki, tostarp 20 bērni vecumā no 6 līdz 35 mēnešiem, 384 bērni vecumā no 3 līdz 8 gadiem, 72 bērni vecumā no 9 līdz 17 gadiem, 2607 pieaugušie vecumā no 18 līdz 59 gadiem un 4597 pieaugušie vecumā virs 60 gadiem. vecums.
Blakusparādības, kas reģistrētas novērošanas periodā 21 dienu pēc imunizācijas
Asins un limfātiskās sistēmas traucējumi*
Retāk: limfadenopātija 2.4.
Reti: limfadenopātija 5.
No imūnsistēmas*
Retāk: nātrene 2.
Reti: nieze 4, 5, ģeneralizēta nieze 4, eritēma 4, 5, ģeneralizēta eritēma 4, izsitumi 4, 5, nātrene 4, sejas pietūkums 4.
No nervu sistēmas*
Bieži: reibonis 3.
Retāk: miegainība 4, reibonis 5.
Reti: parestēzija 4'5, hipoestēzija 4, neiralģija 5, brahiālais radikulīts 5.
No kuņģa-zarnu trakta*
Retāk: caureja 2, 4, 5, slikta dūša 4.
Vispārēji un ievadīšanas vietas traucējumi*
Bieži: diskomforts 3, nieze 3, paaugstināta temperatūra 3 injekcijas vietā.
Retāk: diskomforts 4, sāpes 4, 5, nieze 4, 5, sacietējums 4, asiņošana 2, drudzis 2, 4 injekcijas vietā, gripai līdzīgs sindroms 4.
Ierobežotā datu bāze bērniem vecumā no 6 līdz 35 mēnešiem, kā arī vecumam specifiskie drošības kritēriji neļauj tieši salīdzināt drošības profilu šajā vecuma grupā ar drošības profilu pieaugušajiem.
Dati, kas iegūti pēcreģistrācijas uzraudzības laikā
Tā kā spontāni ziņojumi par blakusparādībām zāļu komerciālās lietošanas laikā tika saņemti ļoti reti un no populācijas ar nezināmu pacientu skaitu, to biežums tika klasificēts kā "biežums nav zināms".
Asins un limfātiskās sistēmas traucējumi
Pārejoša trombocitopēnija, limfadenopātija
No imūnsistēmas
Alerģiskas reakcijas (nieze, eritematozi ādas izsitumi, nātrene, aizdusa, angioneirotiskā tūska vai šoks)
No nervu sistēmas
Parestēzija, Guillain-Barré sindroms, neirīts, neiralģija, krampji, encefalomielīts
No asinsvadu puses
Vaskulīts, īpaši Henoha-Šēnleina purpura, dažos gadījumos ar pārejošu nieru bojājumu
Īpašas pacientu grupas
Lai gan tika iekļauts tikai ierobežots skaits personu ar pamatslimībām, pētījumi, kas veikti ar nieru transplantācijas pacientiem, pacientiem ar astmu vai bērniem vecumā no 6 mēnešiem līdz 3 gadiem un kuriem ir īpaši augsts ar gripu saistītu nopietnu komplikāciju risks, neuzrādīja. būtiskas atšķirības Vaxigrip vakcīnas drošības profilā šajās pacientu grupās.
*Nav ziņots visos klīniskajos pētījumos vai visās vecuma grupās.
1 Bērni (6-35 mēneši).
2 bērni (3-8 gadi).
3 bērni (9-17 gadi).
4 pieaugušie (18-59 gadi).
5 pieaugušie (vecāki par 60 gadiem).
Pārdozēšana:Reģistrētās nevēlamās blakusparādības Vaxigrip vakcīnas pārdozēšanas gadījumā atbilst zāļu drošības profilam, kas aprakstīts sadaļā “Blakusparādības”.
Mijiedarbība:Vaxigrip vakcīnu var lietot vienlaikus (tajā pašā dienā) ar citām vakcīnām. Šajā gadījumā zāles jāinjicē dažādās ķermeņa daļās, izmantojot dažādas šļirces.
Lai gan pēc vakcinācijas pret gripu tika novērota fenitoīna, teofilīna un varfarīna aknu klīrensa inhibīcija, turpmākajos pētījumos nav konstatēta ar šo parādību saistīta negatīva ietekme.
Ja Vaxigrip vakcīnu ievada personām, kurām tiek veikta imūnsupresīva terapija (kortikosteroīdi, citotoksiskas vai radioaktīvas zāles), imūnreakcija pēc vakcinācijas var samazināties.
Speciālas instrukcijas:Ņemot vērā to, ka saslimstība ar gripu ir sezonāla, vakcinēties ieteicams katru gadu rudens-ziemas periodā, kad gripas risks ir vislielākais.
Vakcīna izraisa imunitātes veidošanos tikai pret 3 gripas vīrusa celmiem, ko satur zāles, vai pret celmiem, kas līdzīgi norādītajiem. Vaxigrip vakcīna nenodrošina imunitāti pret gripu, vakcinējoties slimības inkubācijas periodā, kā arī pret gripu, ko izraisa citi vīrusa celmi.
Vaxigrip vakcīna neveido imunitāti pret slimībām, kuru simptomi ir līdzīgi gripai, bet ko izraisa citi patogēni.
Vakcinācija pret gripu, kas veikta iepriekšējā epidēmijas sezonā, nevar nodrošināt drošu aizsardzību nākamajai sezonai, jo katrai epidēmijas sezonai ir savi visizplatītākie gripas vīrusa celmi.
Ja Vaxigrip vakcīnu ievada personām ar samazinātu spēju ražot antivielas ģenētiska defekta, imūndeficīta dēļ, kā arī personām, kurām tiek veikta imūnsupresīva terapija, imūnreakcija pēc vakcinācijas var samazināties. Dažu dienu laikā pēc vakcinācijas var rasties kļūdaini pozitīvi rezultāti, nosakot antivielas pret HIV-1, C hepatīta vīrusu un, jo īpaši, cilvēka T-limfotropā vīrusa 1. tipu, izmantojot enzīmu imūnsorbcijas testu (ELISA). Viltus pozitīvs rezultāts var būt saistīts ar IgM veidošanos, reaģējot uz vakcīnu. Šādos gadījumos ELISA iegūto rezultātu novērtē, izmantojot Western blot metodi.
Ārsts jāinformē, ja pacientam ir imūndeficīts, alerģija vai neparasta reakcija uz iepriekšējo vakcināciju, kā arī par jebkuru ārstēšanu, kas sakrīt ar vakcināciju vai ir pirms tās. Ārsts jāinformē par visiem blakusparādību gadījumiem, ne tikai tiem, kas uzskaitīti šajā instrukcijā.
Vakcīnu nedrīkst lietot, ja suspensijai ir neraksturīga krāsa vai ja tajā ir svešas daļiņas.
Vakcīnu nevar sajaukt ar citām zālēm vienā šļircē.
Veselības aprūpes darbinieka rīcībā jābūt medikamentiem un aprīkojumam, kas nepieciešams, lai nodrošinātu medicīnisko aprūpi retu anafilaktisku reakciju gadījumā, ko izraisa vakcīnas ievadīšana.
Ietekme uz spēju vadīt transportlīdzekļus. Trešd un kažokādas.:Nav veikti pētījumi, lai pētītu Vaxigrip vakcīnas ietekmi uz spēju vadīt automašīnas un iesaistīties citās potenciāli bīstamās darbībās (darbs ar kustīgiem mehānismiem, darbs par dispečeru un operatoru utt.).
Izdalīšanas forma/deva:Suspensija intramuskulārai un subkutānai ievadīšanai, 0,25 ml/devā vai 0,5 ml/devā. Iepakojums:0,25 ml vai 0,5 ml vakcīnas šļircē, 1 šļirce slēgtā šūnu iepakojumā.
1 slēgts šūnu iepakojums ar lietošanas instrukciju kartona kastē.
Uzglabāšanas nosacījumi:Uzglabāt temperatūrā no 2 līdz 8 °C, sargāt no gaismas.
Nesasaldēt.
Uzglabāt bērniem nepieejamā vietā.
Pārvadāšanas nosacījumi
Temperatūrā no 2 līdz 8 °C. Nesasaldēt.
Labākais pirms datums:12 mēneši.
Par derīguma termiņu tiek uzskatīta uz iepakojuma norādītā mēneša pēdējā diena. Nelietot pēc derīguma termiņa beigām, kas norādīts uz iepakojuma.
Nosacījumi izsniegšanai no aptiekām: Pēc receptes Reģistrācijas numurs: P N014493/01 Reģistrācijas datums: 26.05.2008 / 03.04.2018 Derīguma termiņš: Nenoteikts Reģistrācijas apliecības īpašnieks:Sanofi Pasteur S.A. Francija Ražotājs: Pārstāvniecība: Sanofi Pasteur S.A. Informācijas atjaunināšanas datums: 08.12.2018 Ilustrētas instrukcijas