સિલિકોનની શોધ 1823 માં સ્વીડિશ રસાયણશાસ્ત્રી જેન્સ જેકબ બર્ઝેલિયસ દ્વારા કરવામાં આવી હતી.
ઓક્સિજન (દળ દ્વારા 27.6%) પછી પૃથ્વીના પોપડામાં બીજું સૌથી વધુ વિપુલ તત્વ. સંયોજનોમાં જોવા મળે છે.
|
જમીનની સ્થિતિમાં સિલિકોન અણુનું માળખું 1s 2 2s 2 2p 6 3s 2 3p 2 |
ઉત્તેજિત સ્થિતિમાં સિલિકોન અણુનું માળખું 1s 2 2s 2 2p 6 3s 1 3p 3 ઓક્સિડેશન જણાવે છે: +4, -4. |
સિલિકોનની એલોટ્રોપી
આકારહીન અને સ્ફટિકીય સિલિકોન જાણીતા છે.
પોલીક્રિસ્ટલાઇન સિલિકોન
ક્રિસ્ટલ - ધાતુની ચમક, ઉચ્ચ કઠિનતા, નાજુક, સેમિકન્ડક્ટર સાથે ઘેરો રાખોડી પદાર્થ; ρ = 2.33 g/cm 3, t°pl. =1415°C; t° ઉકાળો. = 2680°C.
તે હીરા જેવું માળખું ધરાવે છે અને મજબૂત સહસંયોજક બોન્ડ બનાવે છે. જડ.
આકારહીન - બ્રાઉન પાવડર, હાઇગ્રોસ્કોપિક, હીરા જેવું માળખું, ρ = 2 g/cm 3, વધુ પ્રતિક્રિયાશીલ.
સિલિકોન મેળવી રહ્યા છીએ
1) ઉદ્યોગ - રેતી સાથે કોલસો ગરમ કરો:
2C + SiO 2 t ˚ → Si + 2CO
2) લેબોરેટરી - મેગ્નેશિયમ સાથે રેતી ગરમ કરો:
2Mg + SiO 2 t ˚ → Si + 2MgO પ્રયોગ
રાસાયણિક ગુણધર્મો
એક લાક્ષણિક બિન-ધાતુ, જડ.
ઘટાડનાર એજન્ટ તરીકે:
1) ઓક્સિજન સાથે
Si 0 + O 2 t ˚ → Si +4 O 2
2) ફ્લોરિન સાથે (ગરમી વિના)
Si 0 + 2F 2 →SiF 4
3) કાર્બન સાથે
Si 0 + C t ˚ → Si +4 C
(SiC - carborundum - હાર્ડ; પોઇન્ટિંગ અને ગ્રાઇન્ડીંગ માટે વપરાય છે)
4) હાઇડ્રોજન સાથે ક્રિયાપ્રતિક્રિયા કરતું નથી.
સિલેન (SiH 4) એસિડ સાથે મેટલ સિલિસાઇડ્સના વિઘટન દ્વારા મેળવવામાં આવે છે:
Mg 2 Si + 2H 2 SO 4 → SiH 4 + 2MgSO 4
5) એસિડ સાથે પ્રતિક્રિયા કરતું નથી (ટીમાત્ર હાઇડ્રોફ્લોરિક એસિડ સાથે સિ+4 એચએફ= SiF 4 +2 એચ 2 )
માત્ર નાઈટ્રિક અને હાઈડ્રોફ્લોરિક એસિડના મિશ્રણમાં ઓગળી જાય છે:
3Si + 4HNO3 + 18HF →3H2 + 4NO + 8H2O
6) આલ્કલીસ સાથે (જ્યારે ગરમ થાય છે):
ઓક્સિડાઇઝિંગ એજન્ટ તરીકે:
7) ધાતુઓ સાથે (સિલિસાઈડ્સ રચાય છે):
Si 0 + 2Mg t ˚ →Mg 2 Si -4
સિલિકોનનો ઉપયોગ સેમિકન્ડક્ટર તરીકે ઇલેક્ટ્રોનિક્સમાં વ્યાપકપણે થાય છે. એલોયમાં સિલિકોનનો ઉમેરો તેમના કાટ પ્રતિકારને વધારે છે. સિલિકેટ્સ, એલ્યુમિનોસિલિકેટ્સ અને સિલિકા કાચ અને સિરામિક્સના ઉત્પાદન માટે તેમજ બાંધકામ ઉદ્યોગ માટે મુખ્ય કાચો માલ છે.ટેકનોલોજીમાં સિલિકોન
સિલિકોન અને તેના સંયોજનોનો ઉપયોગ
સિલેન - SiH 4
ભૌતિક ગુણધર્મો: રંગહીન ગેસ, ઝેરી, mp. = -185°C, t° ઉકાળો. = -112°C
સિલિકિક એસિડની તૈયારી
સિલિકેટ્સ પર મજબૂત એસિડની અસર - Na 2 SiO 3 + 2HCl → 2NaCl + H 2 SiO 3 ↓
રાસાયણિક ગુણધર્મો:
જ્યારે ગરમ થાય છે, ત્યારે તે વિઘટિત થાય છે: H 2 SiO 3 t ˚ → H 2 O + SiO 2
સિલિકિક એસિડ ક્ષાર - સિલિકેટ.
1) એસિડ સાથે
Na 2 SiO 3 +H 2 O+CO 2 =Na 2 CO 3 +H 2 SiO 3

2) ક્ષાર સાથે
Na 2 SiO 3 +CaCl 2 =2NaCl+CaSiO 3 ↓
3) સિલિકેટ જે ખનિજો બનાવે છે તે કુદરતી પરિસ્થિતિઓમાં પાણી અને કાર્બન મોનોક્સાઇડ (IV) ના પ્રભાવ હેઠળ નાશ પામે છે - ખડકોનું હવામાન:
(K 2 O Al 2 O 3 6SiO 2)(ફેલ્ડસ્પાર) + CO 2 + 2H 2 O → (Al 2 O 3 2SiO 2 2H 2 O)(કાઓલિનાઇટ (માટી)) + 4SiO 2 (સિલિકા (રેતી)) + K2CO3
સિલિકોન સંયોજનોનો ઉપયોગ

કુદરતી સિલિકોન સંયોજનો - રેતી (SiO 2) અને સિલિકેટ્સનો ઉપયોગ સિરામિક્સ, કાચ અને સિમેન્ટના ઉત્પાદન માટે થાય છે.

|
સિરામિક્સ |
|
|
પોર્સેલિન= કાઓલિન + માટી + ક્વાર્ટઝ + ફેલ્ડસ્પાર. પોર્સેલેઇનનું જન્મસ્થળ ચીન છે, જ્યાં પોર્સેલેઇન 220 માં પહેલેથી જ જાણીતું હતું. 1746 માં, રશિયામાં પોર્સેલિન ઉત્પાદનની સ્થાપના કરવામાં આવી હતી.
|
ફેઇન્સ -ઇટાલિયન શહેર ફેન્ઝાના નામ પરથી. જ્યાં 14મી અને 15મી સદીમાં સિરામિક કારીગરીનો વિકાસ થયો હતો. માટીના વાસણો પોર્સેલેઇન કરતાં તેની ઊંચી માટીની સામગ્રી (85%) અને નીચલા ફાયરિંગ તાપમાનમાં અલગ પડે છે. |
વિષય: સિલિકોન ઓક્સાઇડ (VI). સિલિકિક એસિડ.
લક્ષ્ય: વિદ્યાર્થીઓએ સિલિકોન(VI) ઓક્સાઇડના ગુણધર્મો શીખવા જોઈએ અને
કાર્બન અને તેના સંયોજનો સાથે સામ્યતા દ્વારા સિલિકિક એસિડ,
ખાતરી કરો કે તેમની મિલકતો પદાર્થની રચનાનું પરિણામ છે;
સાધનો: Na2SiO3, HCl, સંગ્રહ "ખનિજ અને ખડકો", PSHE.
વર્ગો દરમિયાન.
આઈ . ઓ સંસ્થાકીય ક્ષણ.
II .હોમવર્ક તપાસી રહ્યું છે.
ગાય્સ! છેલ્લા પાઠમાં આપણે સિલિકોનનો અભ્યાસ કર્યો, તેને રાસાયણિક તત્વ અને એક સરળ પદાર્થ તરીકેની લાક્ષણિકતાઓ આપી. યાદ રાખો કે પ્રકૃતિમાં સિલિકોન ક્યાં જોવા મળે છે? સિલિકોન એ પૃથ્વીના પોપડાના સૌથી સામાન્ય તત્વોમાંનું એક છે, જે ઓક્સિજન (26-27%) પછી બીજા ક્રમે છે. સિલિકોન એ ખડકોના સામ્રાજ્યમાં મુખ્ય તત્વ છે. સિલિકા SiO2 – રેતીનો મુખ્ય ભાગ, Al2O3 2SiO2 2H2O – કાઓલિનાઈટ, માટીનો મુખ્ય ભાગ,
K2O Al2O3 6SiO2 – ફેલ્ડસ્પાર (ઓર્થોક્લેઝ). મોટાભાગના જીવોમાં સિલિકોનનું પ્રમાણ ઓછું હોય છે. જો કે, કેટલાક સીવીડ મોટા પ્રમાણમાં સિલિકોન એકઠા કરે છે - આ ડાયટોમ્સ છે; પ્રાણીઓમાં, સિલિકોન સ્પોન્જમાં ઘણો સિલિકોન હોય છે.
ગાય્સ! સિલિકોનના ભૌતિક ગુણધર્મો શું છે?
આકારહીન અને સ્ફટિકીય સિલિકોન જાણીતા છે. સ્ફટિકીય સિલિકોનમાં ધાતુની ચમક હોય છે, તે પ્રત્યાવર્તનશીલ હોય છે, ખૂબ જ સખત હોય છે, તેમાં અણુ ક્રિસ્ટલ જાળી હોય છે અને તેમાં નગણ્ય વિદ્યુત વાહકતા હોય છે. (ઓરડાના તાપમાને 1000 વખત< чем у ртути). Температура плавления 14200С, температура кипения 26200С.
સિલિકોનના ઉપયોગના ક્ષેત્રોને નામ આપો. (મોટાભાગે Si નો ઉપયોગ સિલિકોન સ્ટીલ્સના ઉત્પાદનમાં થાય છે, જેમાં ઉચ્ચ ગરમી પ્રતિકાર અને એસિડ પ્રતિકાર હોય છે. સિલિકોન સ્ફટિકો સેમિકન્ડક્ટર છે, તેથી તેનો ઉપયોગ ફોટોસેલમાં રેક્ટિફાયર અને વર્તમાન એમ્પ્લીફાયર તરીકે થાય છે.)
હવે કાગળની શીટ્સ પર સિલિકોનના રાસાયણિક ગુણધર્મો અને પ્રયોગશાળામાં અને ઉદ્યોગમાં તેના ઉત્પાદનનું પુનઃઉત્પાદન કરો.
III . નવી સામગ્રી શીખવી.
1. SiO2 ક્રિસ્ટલ જાળીનું માળખું.
2. પ્રકૃતિમાં હોવું.
3. ભૌતિક ગુણધર્મો.
4. રાસાયણિક ગુણધર્મો.
5.એપ્લિકેશન.
6.સિલીક એસિડ.
1). સ્ફટિક જાળીનું માળખુંSiO2 .
SiO2 એ કાર્બનનું એનાલોગ છે. તેમના ઉચ્ચ ઓક્સાઇડ CO2 અને SiO2 છે. CO2 એ ગેસ છે, ગલન તાપમાન 56.60C છે, એક પરમાણુ સ્ફટિક જાળી છે, તેમાં વ્યક્તિગત પરમાણુઓ એકબીજા સાથે અનબાઉન્ડ છે, અને SiO2 એક નક્કર પદાર્થ છે, જેનું ઉચ્ચ ગલનબિંદુ = 17280C છે, એક અણુ સ્ફટિક જાળી જેમાં દરેક સિલિકોન અણુ ચાર અણુ ઓક્સિજન સાથે જોડાયેલ છે.
તેથી, સિલિકોન ઓક્સાઇડમાં એક વિશાળ પરમાણુ (SiO2)n હોય છે, પરંતુ સંકેતની સરળતા માટે આપણે SiO2 લખીએ છીએ.
2) પ્રકૃતિમાં હોવું.
એક સ્થિર સિલિકોન સંયોજન સિલિકોન(VI) ઓક્સાઇડ છે, જેને સિલિકા કહેવાય છે. તે સ્ફટિકીય, ક્રિપ્ટોક્રિસ્ટલાઇન અને આકારહીન અવસ્થામાં થાય છે. સ્ફટિકીય સ્થિતિમાં વધુ SiO2.
SiO2 - સિલિકા
સ્ફટિકીય ક્રિપ્ટોક્રિસ્ટલાઇન આકારહીન
(ખનિજ - ક્વાર્ટઝ) (ઓપલ, જાસ્પર, એગેટ, ફ્લિન્ટ) (ત્રપાઈ)
ક્રિસ્ટલ - ખનિજ ક્વાર્ટઝના સ્વરૂપમાં પ્રકૃતિમાં જોવા મળે છે. ક્વાર્ટઝ પણ ખડકોનો એક ભાગ છે - ગ્રેનાઈટ અને જીનીસ. સામાન્ય રેતીમાં ક્વાર્ટઝના નાના દાણા હોય છે. શુદ્ધ રેતી સફેદ હોય છે, તેને ક્વાર્ટઝ રેતી કહેવામાં આવે છે, અને સામાન્ય નદીની રેતીમાં આયર્નની અશુદ્ધિઓ હોય છે અને તેથી તે પીળી હોય છે. પારદર્શક વ્યક્તિગત ક્વાર્ટઝ સ્ફટિકો રોક ક્રિસ્ટલ છે. અશુદ્ધિઓ દ્વારા રોક ક્રિસ્ટલ રંગીન લીલાકને એમિથિસ્ટ કહેવામાં આવે છે, અને ભૂરા રંગના - સ્મોકી પોખરાજ. તેઓ ઘરેણાં છે. જ્યારે ઠંડુ થાય છે ત્યારે પીગળેલા ક્વાર્ટઝ સ્પષ્ટ કાચમાં ફેરવાય છે. ક્વાર્ટઝ ગ્લાસ અલ્ટ્રાવાયોલેટ કિરણોને પ્રસારિત કરતું નથી.
ક્રિપ્ટોક્રિસ્ટાલિન સિલિકા સંયોજનોમાં ઓપલ, જાસ્પર, એગેટ અને ફ્લિન્ટનો સમાવેશ થાય છે. ઓપલ અને એગેટ સુંદર રંગો ધરાવે છે. તેઓ મોસ્કો મેટ્રોને સુશોભિત કરવા માટે ઉપયોગમાં લેવાતા હતા. ફ્લિન્ટ એ સખત ખનિજ છે જે જ્યારે ત્રાટકવામાં આવે ત્યારે તીક્ષ્ણ ધારવાળા ટુકડાઓમાં તૂટી જાય છે અને આણે માનવ સમાજના ઐતિહાસિક વિકાસમાં મુખ્ય ભૂમિકા ભજવી છે. આ ખનિજનો ઉપયોગ સાધનો બનાવવા માટે થતો હતો.
આકારહીન SiO2 પ્રકૃતિમાં ઓછું સામાન્ય છે. કેટલાક ડાયટોમના શેલો આકારહીન SiO2 થી બનેલા હોય છે અને આ શેલોના સંચયથી સ્થાનો પર મોટા પ્રમાણમાં થાપણો રચાય છે, તેને ઇન્ફ્યુસર માટી અથવા ટ્રિપોલી (ડાયટોમાઇટ) કહેવામાં આવે છે.
3) ભૌતિક ગુણધર્મો.
SiO2 એ સ્ફટિકીય ઘન છે.
4) રાસાયણિક ગુણધર્મો.
સામાન્ય છે:
a) તાપમાન પર આલ્કલીસ સાથે પ્રતિક્રિયા આપે છે.
SiO2 + 2NaOH = Na2SiO3 + H2O
b) તાપમાન પર મૂળભૂત ઓક્સાઇડ સાથે પ્રતિક્રિયા આપે છે
SiO2 + CaO = CaSiO3
ચોક્કસ.
એ) પાણી સાથે ક્રિયાપ્રતિક્રિયા કરતું નથી.
b) વધતા તાપમાન સાથે, તે ક્ષારમાંથી વધુ અસ્થિર ઓક્સાઇડને વિસ્થાપિત કરે છે.
CaCO3 + SiO2 = CaSiO3 + CO2
c) હાઇડ્રોફ્લોરિક એસિડ સાથે પ્રતિક્રિયા આપે છે
SiO2 + 4HF = SiF4 + 2H2O
ટેટ્રાફ્લોરાઇડ
5) અરજી.
1.ક્વાર્ટઝ - કાચનું ઉત્પાદન, રાસાયણિક કાચનાં વાસણો.
2.Trepel - બાંધકામમાં, હીટ ઇન્સ્યુલેટર અને સાઉન્ડ-ડેમ્પિંગ સામગ્રી તરીકે.
3. સજાવટ.
4. રેતી-ચૂનો ઈંટનું ઉત્પાદન.
5.સિરામિક ઉત્પાદનો.
6) સિલિકિક એસિડ.
દ્રાવ્યતા કોષ્ટક મુજબ, H2SiO3 એ એક અદ્રાવ્ય એસિડ છે.
તે એસિડ સાથે તેના ક્ષારના ઉકેલો પર પ્રતિક્રિયા કરીને મેળવી શકાય છે.
Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓
વિદ્યાર્થી કાંપ
2Na++ SiO32- + 2H+ + 2Cl- = 2Na+ + 2Cl-+ H2SiO3↓
2H+ + SiO32- = H2SiO3↓
પાણી સાથે, સિલિકિક એસિડ કોલોઇડલ ઉકેલો બનાવે છે. તે એક નબળું એસિડ છે, કાર્બોનિક એસિડ કરતાં પણ નબળું, નાજુક અને જ્યારે ગરમ થાય છે ત્યારે ધીમે ધીમે વિઘટન થાય છે.
H2SiO3 = H2O + SiO2
VI. એકીકરણ.ફિલ્મ "સિલિકોન (VI) ઓક્સાઇડ" નો ભાગ I જોઈ રહ્યા છીએ
વી. હોમવર્ક સોંપણી- સારાંશ, §35,36.
સમસ્યા 1 પંક્તિ.
જ્યારે સોડિયમ કાર્બોનેટ 62 ગ્રામ સિલિકામાં આયર્ન સંયોજનોની 3% અશુદ્ધિઓ ધરાવતા હોય ત્યારે કાર્બન મોનોક્સાઇડ (VI) છોડવામાં આવશે (લિટરમાં).
આપેલ: 1 મોલ x
m (SiO2) = 62g. Na2CO3+ SiO2= Na2SiO3 + CO2
Ѡ(આશરે) – 3% 1 મોલ 2 મોલ
V(CO2) - ? M (SiO2) = 28 + 32 = 60 ગ્રામ/મોલ
mch વી. = Ѡ mcolor / 100% = 97 62/100% = 60.14
υ(SiO2) = m/M = 60.14/60 = 1 મોલ
υ(СО2) = 1 મોલ
V(CO2) = Vm· υ = 22.4 ·1 = 22.4 l.
સમસ્યા II પંક્તિ.
6.1 ગ્રામ સોડિયમ સિલિકેટ મેળવવા માટે કેટલા Si(IV) ઓક્સાઇડની અશુદ્ધિઓના 0.2 સમૂહ અપૂર્ણાંકની જરૂર છે?
આપેલ: x 0.05
m (Na2SiO3) = 6.1 ગ્રામ. SiO2 + 2NaOH = Na2SiO3 + H2O
Ѡ(અંદાજે) =20% 1 મોલ 1 મોલ
m (SiO2) - ? M (SiO2) = 60 ગ્રામ/મોલ
M (Na2SiO3) = 122 ગ્રામ/મોલ
υ (Na2SiO3) = m / M = 6.1 / 122 = 0.05 mol
υ (SiO2) = 0.05 mol
m = M · υ = 60 · 0.05 = 3 ગ્રામ.
100% - 20% = 80%
mts વી. =.mch. વી. / Ѡ · 100% = 30 / 80 · 100 = 3.75 ગ્રામ.
સમસ્યા III પંક્તિ.
જ્યારે SiO2 નું 120 ગ્રામ Na2CO3 ના 106 ગ્રામ સાથે ક્રિયાપ્રતિક્રિયા કરે છે, ત્યારે CO2 છોડવામાં આવ્યો હતો. આ વાયુના કયા દળની રચના થઈ હતી?
આપેલ: 1mol x
m (SiO2) = 120g Na2CO3 + SiO2 = Na2SiO3 + CO2
m (Na2CO3) = 106 ગ્રામ 1 મોલ 1 મોલ 1 મોલ
V (CO2) - ? M (Na2CO3) = 106g/mol
M (SiO2) = 60 ગ્રામ/મોલ
M (CO2) = 44 ગ્રામ/મોલ
υ (Na2CO3) = m /M = 106 / 106 = 1 mol (અપૂરતું)
υ (SiO2) = 120 / 60 = 2 mol (g)
V(CO2) = 1 મોલ
m (CO2) = M · υ = 44 · 1 = 44g.
D.I. મેન્ડેલીવના સામયિક કોષ્ટકના જૂથ IV (જૂથ IVA) ના મુખ્ય પેટાજૂથના તત્વોનો બીજો પ્રતિનિધિ સિલિકોન સી છે.
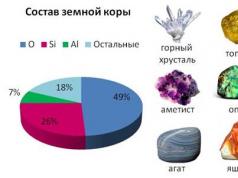
પ્રકૃતિમાં, ઓક્સિજન પછી સિલિકોન એ બીજું સૌથી વધુ વિપુલ પ્રમાણમાં રાસાયણિક તત્વ છે. પૃથ્વીના પોપડાના એક ક્વાર્ટર કરતાં વધુ તેના સંયોજનો ધરાવે છે. સૌથી સામાન્ય સિલિકોન સંયોજન સિલિકોન ઓક્સાઇડ (IV) SiO 2 છે, તેનું બીજું નામ સિલિકા છે.
પ્રકૃતિમાં, તે ખનિજ ક્વાર્ટઝ (ફિગ. 158) બનાવે છે, જેમાંથી ઘણી જાતો - રોક ક્રિસ્ટલ અને તેનું પ્રખ્યાત જાંબલી સ્વરૂપ - એમિથિસ્ટ, તેમજ એગેટ, ઓપલ, જાસ્પર, ચેલ્સડોની, કાર્નેલિયન, સુશોભન અને અર્ધ-કિંમતી તરીકે ઓળખાય છે. પત્થરો સામાન્ય અને ક્વાર્ટઝ રેતીમાં પણ સિલિકોન (IV) ઓક્સાઇડ હોય છે.

ચોખા. 158.
ડોલોમાઇટમાં જડિત ક્વાર્ટઝ સ્ફટિકો
આદિમ લોકો સિલિકોન (IV) ઓક્સાઇડ (ફ્લિન્ટ, ચેલ્સડોની, વગેરે) પર આધારિત વિવિધ પ્રકારના ખનિજોમાંથી સાધનો બનાવતા હતા. તે ચકમક હતી, આ અસ્પષ્ટ અને ખૂબ ટકાઉ પથ્થર નથી, જે પથ્થર યુગની શરૂઆતને ચિહ્નિત કરે છે - ચકમક સાધનોનો યુગ (ફિગ. 159). આના બે કારણો છે: ચકમકનો વ્યાપ અને પ્રાપ્યતા, તેમજ જ્યારે ચીપ કરવામાં આવે ત્યારે તીક્ષ્ણ કટીંગ ધાર બનાવવાની તેની ક્ષમતા.

ચોખા. 159.
પથ્થર યુગના સાધનો
કુદરતી સિલિકોન સંયોજનોનો બીજો પ્રકાર સિલિકેટ્સ છે. તેમાંથી, સૌથી સામાન્ય એલ્યુમિનોસિલિકેટ્સ છે (તે સ્પષ્ટ છે કે આ સિલિકેટ્સ રાસાયણિક તત્વ એલ્યુમિનિયમ ધરાવે છે). એલ્યુમિનોસિલિકેટ્સમાં ગ્રેનાઈટ, વિવિધ પ્રકારની માટી અને મીકાનો સમાવેશ થાય છે. એક સિલિકેટ જેમાં એલ્યુમિનિયમ નથી, ઉદાહરણ તરીકે, એસ્બેસ્ટોસ, જેમાંથી અગ્નિ-પ્રતિરોધક કાપડ બનાવવામાં આવે છે.
સિલિકોન (IV) ઓક્સાઇડ SiO 2 છોડ અને પ્રાણીઓના જીવન માટે જરૂરી છે. તે છોડની દાંડી અને પ્રાણીઓના રક્ષણાત્મક આવરણને શક્તિ આપે છે (ફિગ. 160). તેના માટે આભાર, રીડ્સ, રીડ્સ અને ઘોડાની પૂંછડીઓ બેયોનેટની જેમ મજબૂત છે, છરીની જેમ કાપેલા તીક્ષ્ણ પાંદડા, સોયની જેમ કાપેલા ખેતરમાં ખંજવાળ, અને અનાજની દાંડી એટલી મજબૂત છે કે તેઓ ખેતરોમાંના ખેતરોને મંજૂરી આપતા નથી. વરસાદ અને પવનથી નીચે સૂઈ જાઓ. માછલીના ભીંગડા, જંતુના છીપ, બટરફ્લાયની પાંખો, પક્ષીઓના પીછાઓ અને પ્રાણીઓની રૂંવાટી ટકાઉ હોય છે કારણ કે તેમાં સિલિકા હોય છે.

ચોખા. 160.
સિલિકોન (IV) ઓક્સાઇડ છોડના દાંડીને અને પ્રાણીઓના રક્ષણાત્મક આવરણને શક્તિ આપે છે
સિલિકોન સંયોજનો માનવ વાળ અને નખને સરળતા અને શક્તિ આપે છે.
સિલિકોન એ નીચલા સજીવોનો પણ એક ભાગ છે - ડાયટોમ્સ અને રેડિયોલેરિયન, જીવંત પદાર્થોના સૌથી નાજુક ગઠ્ઠો જે સિલિકા (ફિગ. 161)માંથી તેમના અજોડ સૌંદર્ય હાડપિંજર બનાવે છે.

ચોખા. 161.
ડાયટોમ્સ (a) અને રેડિયોલેરિયન્સ (b) ના હાડપિંજરમાં સિલિકા હોય છે
સિલિકોનના ગુણધર્મો. તમે સૌર બેટરી સાથે માઇક્રોકેલ્ક્યુલેટરનો ઉપયોગ કરી રહ્યાં છો અને તેથી તમને સ્ફટિકીય સિલિકોનની સમજ છે. આ સેમિકન્ડક્ટર છે. ધાતુઓથી વિપરીત, તેની વિદ્યુત વાહકતા વધતા તાપમાન સાથે વધે છે. ઉપગ્રહો, સ્પેસશીપ્સ, સ્ટેશનો અને ઘરોની છત (ફિગ. 162) પર સૌર પેનલ સ્થાપિત કરવામાં આવે છે, જે સૌર ઊર્જાને વિદ્યુત ઊર્જામાં રૂપાંતરિત કરે છે. તેઓ સેમિકન્ડક્ટર ક્રિસ્ટલ્સનો ઉપયોગ કરે છે, મુખ્યત્વે સિલિકોન. સિલિકોન સૌર કોષો 10% સુધી શોષિત સૌર ઊર્જાને વીજળીમાં રૂપાંતરિત કરી શકે છે.

ચોખા. 162.
ઘરની છત પર સોલાર બેટરી
સિલિકોન ઓક્સિજનમાં બળી જાય છે, જે પહેલાથી જાણીતા સિલિકોન ઓક્સાઇડ (IV) બનાવે છે:
![]()
બિન-ધાતુ હોવાને કારણે, જ્યારે ગરમ થાય છે, ત્યારે સિલિકોન ધાતુઓ સાથે મળીને સિલિસાઇડ્સ બનાવે છે, ઉદાહરણ તરીકે:
![]()
સિલિસાઇડ્સ પાણી અથવા એસિડ દ્વારા સરળતાથી વિઘટિત થાય છે, જે સિલિકોન - સિલેનનું વાયુયુક્ત હાઇડ્રોજન સંયોજન મુક્ત કરે છે:
હાઇડ્રોકાર્બનથી વિપરીત, સિલેન સ્વયંભૂ હવામાં સળગે છે અને બળીને સિલિકોન (IV) ઓક્સાઇડ અને પાણી બનાવે છે:
CH4 મિથેનની તુલનામાં સિલેનની વધેલી પ્રતિક્રિયા એ હકીકત દ્વારા સમજાવવામાં આવે છે કે સિલિકોનનું અણુ કદ કાર્બન કરતા મોટું છે, તેથી Si-H રાસાયણિક બોન્ડ C-H બોન્ડ કરતાં ઓછા મજબૂત છે.
સિલિકોન આલ્કલીના કેન્દ્રિત જલીય દ્રાવણ સાથે પ્રતિક્રિયા આપે છે, સિલિકેટ્સ અને હાઇડ્રોજન બનાવે છે:
સિલિકોન મેગ્નેશિયમ અથવા કાર્બન સાથે સિલિકોન (IV) ઓક્સાઇડમાંથી ઘટાડીને મેળવવામાં આવે છે:

સિલિકોન ઓક્સાઇડ (IV), અથવા સિલિકોન ડાયોક્સાઇડ, અથવા સિલિકા SiO 2, જેમ કે CO 2, એક એસિડિક ઓક્સાઇડ છે. જો કે, CO2 થી વિપરીત, તેમાં પરમાણુ નથી, પરંતુ અણુ સ્ફટિક જાળી છે. તેથી, SiO 2 એ નક્કર અને પ્રત્યાવર્તન પદાર્થ છે. તે પાણી અને એસિડમાં ઓગળતું નથી, સિવાય કે, જેમ તમે જાણો છો, હાઇડ્રોફ્લોરિક એસિડ, પરંતુ તે ઉચ્ચ તાપમાને આલ્કલીસ સાથે પ્રતિક્રિયા કરીને સિલિકિક એસિડ ક્ષાર - સિલિકેટ્સ બનાવે છે:
સિલિકેટ્સ સિલિકોન (IV) ઓક્સાઇડને મેટલ ઓક્સાઇડ અથવા કાર્બોનેટ સાથે ફ્યુઝ કરીને પણ મેળવી શકાય છે:

સોડિયમ અને પોટેશિયમ સિલિકેટને દ્રાવ્ય કાચ કહેવામાં આવે છે. તેમના જલીય દ્રાવણો જાણીતા સિલિકેટ ગુંદર છે.
સિલિકેટ્સનાં દ્રાવણમાંથી, તેમના પર મજબૂત એસિડની ક્રિયા દ્વારા - હાઇડ્રોક્લોરિક, સલ્ફ્યુરિક, એસિટિક અને કાર્બનિક, સિલિકિક એસિડ H 2 SiO 3 મેળવવામાં આવે છે (ફિગ. 163):

ચોખા. 163. સિલિકેટ આયનની ગુણાત્મક પ્રતિક્રિયા
તેથી, H 2 SiO 3 એ ખૂબ જ નબળું એસિડ છે. તે પાણીમાં અદ્રાવ્ય છે અને જિલેટીનસ અવક્ષેપના રૂપમાં પ્રતિક્રિયા મિશ્રણમાંથી બહાર પડે છે, કેટલીકવાર તે દ્રાવણના સમગ્ર જથ્થાને સઘન રીતે ભરે છે, તેને જેલી અથવા જેલી જેવા અર્ધ-ઘન સમૂહમાં ફેરવે છે. જ્યારે આ સમૂહ સુકાઈ જાય છે, ત્યારે એક અત્યંત છિદ્રાળુ પદાર્થ બને છે - સિલિકા જેલ, જેનો વ્યાપકપણે શોષક તરીકે ઉપયોગ થાય છે - અન્ય પદાર્થોનું શોષક.
પ્રયોગશાળા પ્રયોગ નંબર 40
સિલિકિક એસિડની તૈયારી અને તેના ગુણધર્મોનો અભ્યાસ
સિલિકોન એપ્લિકેશન્સ. તમે પહેલેથી જ જાણો છો કે સિલિકોનનો ઉપયોગ સેમિકન્ડક્ટર સામગ્રી તેમજ એસિડ-પ્રતિરોધક એલોય બનાવવા માટે થાય છે. જ્યારે ઉચ્ચ તાપમાને ક્વાર્ટઝ રેતી કોલસા સાથે ભળી જાય છે, ત્યારે સિલિકોન કાર્બાઇડ SiC બને છે, જે કઠિનતામાં હીરા પછી બીજા ક્રમે છે. તેથી, તેનો ઉપયોગ મેટલ-કટીંગ મશીનોના કટરને શાર્પ કરવા અને કિંમતી પથ્થરોને પોલિશ કરવા માટે થાય છે.
વિવિધ ક્વાર્ટઝ રાસાયણિક કાચના વાસણો પીગળેલા ક્વાર્ટઝમાંથી બનાવવામાં આવે છે, જે ઊંચા તાપમાનનો સામનો કરી શકે છે અને જ્યારે અચાનક ઠંડક આવે ત્યારે ક્રેક થતા નથી.
સિલિકોન સંયોજનો કાચ અને સિમેન્ટના ઉત્પાદન માટે આધાર તરીકે સેવા આપે છે.
સામાન્ય વિન્ડો ગ્લાસમાં એક રચના હોય છે જે સૂત્ર Na 2 O CaO 6 SiO 2 દ્વારા વ્યક્ત કરી શકાય છે. તે ખાસ કાચની ભઠ્ઠીઓમાં સોડા, ચૂનાના પત્થર અને રેતીના મિશ્રણને મિશ્રિત કરીને બનાવવામાં આવે છે.
કાચની એક વિશિષ્ટ વિશેષતા એ નરમ કરવાની ક્ષમતા છે અને, પીગળેલી સ્થિતિમાં, જ્યારે કાચ સખત થાય ત્યારે સાચવેલ કોઈપણ આકાર લે છે. ટેબલવેર અને અન્ય ગ્લાસ ઉત્પાદનોનું ઉત્પાદન આના પર આધારિત છે.
વિવિધ ઉમેરણો કાચને વધારાના ગુણો આપે છે. આમ, લીડ ઓક્સાઇડ દાખલ કરીને, ક્રિસ્ટલ કાચ મેળવવામાં આવે છે, ક્રોમિયમ ઓક્સાઇડ કાચને લીલો, કોબાલ્ટ ઓક્સાઇડ વાદળી વગેરે રંગ આપે છે (ફિગ. 164).

ચોખા. 164.
રંગીન કાચ ઉત્પાદનો
કાચ એ માનવજાતની સૌથી જૂની શોધોમાંની એક છે. પહેલેથી જ 3-4 હજાર વર્ષ પહેલાં, ઇજિપ્ત, સીરિયા, ફેનિસિયા અને કાળો સમુદ્ર પ્રદેશમાં કાચનું ઉત્પાદન વિકસાવવામાં આવ્યું હતું.
ગ્લાસ એ માત્ર કારીગરો માટે જ નહીં, પણ કલાકારો માટે પણ સામગ્રી છે. પ્રાચીન રોમના માસ્ટરોએ ઉચ્ચ પૂર્ણતા પ્રાપ્ત કરી, જેઓ રંગીન કાચ કેવી રીતે મેળવવો અને તેમના ટુકડામાંથી મોઝેઇક કેવી રીતે બનાવવું તે જાણતા હતા.

ચોખા. 165.
નોટ્રે ડેમ કેથેડ્રલ, ચાર્ટ્રેસમાં રંગીન કાચ
કાચની બનેલી કલાના કાર્યો એ કોઈપણ મોટા મ્યુઝિયમની ફરજિયાત વિશેષતાઓ છે, અને ચર્ચની રંગીન રંગીન કાચની બારીઓ અને મોઝેક પેનલ આના આબેહૂબ ઉદાહરણો છે (ફિગ. 165). રશિયન એકેડેમી ઓફ સાયન્સની સેન્ટ પીટર્સબર્ગ શાખાના એક પરિસરમાં પીટર Iનું મોઝેક પોટ્રેટ છે, જે એમ.વી. લોમોનોસોવ (ફિગ. 166) દ્વારા બનાવવામાં આવ્યું છે.

ચોખા. 166.
પીટર I નું મોઝેક પોટ્રેટ
કાચની અરજીના ક્ષેત્રો ખૂબ વ્યાપક છે. આ બારી, બોટલ, દીવો, અરીસો કાચ છે; ઓપ્ટિકલ ગ્લાસ - ચશ્માથી કેમેરા ચશ્મા સુધી; અસંખ્ય ઓપ્ટિકલ સાધનોના લેન્સ - માઇક્રોસ્કોપથી દૂરબીન સુધી.
સિલિકોન સંયોજનોમાંથી મેળવવામાં આવતી અન્ય મહત્વપૂર્ણ સામગ્રી સિમેન્ટ છે. તે ખાસ રોટરી ભઠ્ઠામાં સિન્ટરિંગ માટી અને ચૂનાના પત્થર દ્વારા મેળવવામાં આવે છે.
જો સિમેન્ટ પાવડરને પાણીમાં ભેળવવામાં આવે છે, તો સિમેન્ટની પેસ્ટ બને છે, અથવા, બિલ્ડરો તેને "સિમેન્ટ મોર્ટાર" કહે છે, જે ધીમે ધીમે સખત બને છે. જ્યારે રેતી અથવા કચડી પથ્થરને ફિલર તરીકે સિમેન્ટમાં ઉમેરવામાં આવે છે, ત્યારે કોંક્રિટ મેળવવામાં આવે છે. જો તેમાં લોખંડની ફ્રેમ દાખલ કરવામાં આવે તો કોંક્રિટની મજબૂતાઈ વધે છે - પ્રબલિત કોંક્રિટ મેળવવામાં આવે છે, જેમાંથી દિવાલ પેનલ્સ, ફ્લોર બ્લોક્સ, બ્રિજ ટ્રસ વગેરે બનાવવામાં આવે છે.
સિલિકેટ ઉદ્યોગ કાચ અને સિમેન્ટનું ઉત્પાદન કરે છે. તે સિલિકેટ સિરામિક્સ પણ બનાવે છે - ઈંટ, પોર્સેલેઈન (ફિગ. 167), માટીના વાસણો અને તેમાંથી બનાવેલા ઉત્પાદનો.

ચોખા. 167.
પોર્સેલિન
સિલિકોનની શોધ. જો કે પહેલાથી જ પ્રાચીન સમયમાં લોકો રોજિંદા જીવનમાં સિલિકોન સંયોજનોનો વ્યાપકપણે ઉપયોગ કરતા હતા, સિલિકોન પોતે 1824 માં સ્વીડિશ રસાયણશાસ્ત્રી જે. યા. બર્ઝેલિયસ દ્વારા પ્રાપ્ત થયું હતું. જો કે, તેમના 12 વર્ષ પહેલા, જે. ગે-લુસાક અને એલ. થનાર્ડ દ્વારા સિલિકોન મેળવવામાં આવ્યું હતું, પરંતુ તે અશુદ્ધિઓથી ખૂબ જ દૂષિત હતું.
લેટિન નામ સિલિકિયમ લેટિન શબ્દ સિલેક્સ - "ફ્લિન્ટ" પરથી ઉદ્દભવ્યું છે. રશિયન નામ "સિલિકોન" ગ્રીક ક્રિમનોસ - "ખડક, ખડક" પરથી આવે છે.
નવા શબ્દો અને વિભાવનાઓ
- કુદરતી સિલિકોન સંયોજનો: સિલિકા, ક્વાર્ટઝ અને તેની જાતો, સિલિકેટ્સ, એલ્યુમિનોસિલિકેટ્સ, એસ્બેસ્ટોસ.
- સિલિકોનનું જૈવિક મહત્વ.
- સિલિકોનના ગુણધર્મો: સેમિકન્ડક્ટર, ઓક્સિજન, ધાતુઓ, આલ્કલીસ સાથે ક્રિયાપ્રતિક્રિયા.
- સિલાન.
- સિલિકોન(IV) ઓક્સાઇડ. તેની રચના અને ગુણધર્મો: આલ્કલીસ, મૂળભૂત ઓક્સાઇડ, કાર્બોનેટ અને મેગ્નેશિયમ સાથે ક્રિયાપ્રતિક્રિયા.
- સિલિકિક એસિડ અને તેના ક્ષાર. દ્રાવ્ય કાચ.
- સિલિકોન અને તેના સંયોજનોનો ઉપયોગ.
- કાચ.
- સિમેન્ટ.
સ્વતંત્ર કાર્ય માટે કાર્યો
સિલિકોન IV ઓક્સાઇડ TU 6-09-3379-79
SiO2
સિલિકા (સિલિકા, SiO2; lat સિલિકા) - સિલિકોન (IV) ઓક્સાઇડ. +1713…+1728 °C ના ગલનબિંદુ સાથે રંગહીન સ્ફટિકો, ઉચ્ચ કઠિનતા અને શક્તિ ધરાવે છે.
સિલિકોન ડાયોક્સાઇડ એ લગભગ તમામ પાર્થિવ ખડકોનો મુખ્ય ઘટક છે, ખાસ કરીને ડાયટોમેસિયસ પૃથ્વી. લિથોસ્ફિયરના 87% સમૂહમાં સિલિકા અને સિલિકેટ્સ હોય છે. માનવ રક્ત અને પ્લાઝ્મામાં, સિલિકાની સાંદ્રતા વજન દ્વારા 0.001% છે.
ગુણધર્મો
- એસિડ ઓક્સાઇડના જૂથ સાથે સંબંધિત છે.
- જ્યારે ગરમ થાય છે, ત્યારે તે મૂળભૂત ઓક્સાઇડ અને આલ્કલી સાથે પ્રતિક્રિયા આપે છે.
- હાઇડ્રોફ્લોરિક એસિડ સાથે પ્રતિક્રિયા આપે છે.
- SiO 2 કાચ બનાવતા ઓક્સાઇડના જૂથ સાથે સંબંધિત છે, એટલે કે, તે સુપરકૂલ્ડ મેલ્ટ - ગ્લાસની રચના માટે સંવેદનશીલ છે.
- શ્રેષ્ઠ ડાઇલેક્ટ્રિક્સમાંથી એક (જો તેમાં અશુદ્ધિઓ ન હોય અને તે ગરમ ન થાય તો તે ઇલેક્ટ્રિક પ્રવાહનું સંચાલન કરતું નથી).
પોલીમોર્ફિઝમ
સિલિકોન ડાયોક્સાઇડમાં અનેક પોલીમોર્ફિક ફેરફારો છે.
પૃથ્વીની સપાટી પર તેમાંથી સૌથી સામાન્ય - α-ક્વાર્ટઝ - ત્રિકોણ પ્રણાલીમાં સ્ફટિકીકરણ કરે છે. સામાન્ય સ્થિતિમાં, સિલિકોન ડાયોક્સાઇડ મોટેભાગે α-ક્વાર્ટઝ પોલીમોર્ફમાં જોવા મળે છે, જે +573 °C થી ઉપરના તાપમાને β-ક્વાર્ટઝમાં ઉલટાવી શકાય છે. તાપમાનમાં વધુ વધારા સાથે, ક્વાર્ટઝ ટ્રાઇડાઇમાઇટ અને ક્રિસ્ટોબાલાઇટમાં પરિવર્તિત થાય છે. આ પોલીમોર્ફ્સ ઊંચા તાપમાન અને નીચા દબાણમાં સ્થિર છે.
પ્રકૃતિમાં પણ સ્વરૂપો છે - ઓપલ, ચેલ્સેડની, ક્વાર્ટઝિન, લ્યુટેસાઇટ, ઓથિજેનિક ક્વાર્ટઝ, જે સિલિકા જૂથ સાથે સંબંધિત છે. ઓપલ (SiO 2 *nH 2 O) પાતળા વિભાગમાં રંગહીન, સમસ્થાનિક છે, નકારાત્મક રાહત ધરાવે છે, દરિયાઈ જળાશયોમાં જમા થાય છે અને ઘણા સિલિસીસ ખડકોનો ભાગ છે. ચેલ્સડોની, ક્વાર્ટઝ, લ્યુટેસાઇટ - SiO 2 - ક્વાર્ટઝની ક્રિપ્ટોક્રિસ્ટલાઇન જાતો છે. તેઓ તંતુમય સમૂહ, રોઝેટ્સ, ગોળાકાર, રંગહીન, વાદળી, પીળાશ બનાવે છે. તેઓ કેટલાક ગુણધર્મોમાં એકબીજાથી અલગ પડે છે - ચેલ્સેડની અને ક્વાર્ટઝિન સીધી લુપ્તતા ધરાવે છે, લ્યુટેસાઇટમાં ત્રાંસી લુપ્તતા હોય છે, અને ચેલ્સેડનીમાં નકારાત્મક વિસ્તરણ હોય છે.
ઊંચા તાપમાન અને દબાણમાં, સિલિકોન ડાયોક્સાઇડ સૌપ્રથમ કોએસાઇટમાં પરિવર્તિત થાય છે (જેનું સંશ્લેષણ અમેરિકન રસાયણશાસ્ત્રી લોરીંગ કોએસ દ્વારા 1953માં કરવામાં આવ્યું હતું), અને પછી સ્ટીશોવાઇટમાં (જેનું સંશ્લેષણ 1961માં એસ.એમ. સ્ટીશોવ દ્વારા કરવામાં આવ્યું હતું, અને 1962માં ઉલ્કામાં શોધાયું હતું) [ સ્ત્રોત 2294 દિવસ ઉલ્લેખિત નથી ] કેટલાક અભ્યાસો અનુસાર, સ્ટિશોવાઇટ આવરણનો નોંધપાત્ર ભાગ બનાવે છે, તેથી પૃથ્વી પર કયા પ્રકારનો SiO 2 સૌથી સામાન્ય છે તે પ્રશ્નનો હજુ સુધી સ્પષ્ટ જવાબ નથી.
તેમાં આકારહીન ફેરફાર પણ છે - ક્વાર્ટઝ ગ્લાસ.
રાસાયણિક ગુણધર્મો
સિલિકોન ડાયોક્સાઇડ SiO 2 એ એસિડિક ઓક્સાઇડ છે જે પાણી સાથે પ્રતિક્રિયા આપતું નથી.
રાસાયણિક રીતે એસિડ સામે પ્રતિરોધક, પરંતુ હાઇડ્રોજન ફ્લોરાઇડ ગેસ સાથે પ્રતિક્રિયા આપે છે:
અને હાઇડ્રોફ્લોરિક એસિડ:
આ બે પ્રતિક્રિયાઓનો વ્યાપકપણે ગ્લાસ એચિંગ માટે ઉપયોગ થાય છે.
જ્યારે SiO 2 ને આલ્કલીસ અને મૂળભૂત ઓક્સાઇડ્સ તેમજ સક્રિય ધાતુઓના કાર્બોનેટ સાથે મિશ્રિત કરવામાં આવે છે, ત્યારે સિલિકેટ્સ રચાય છે - સામાન્ય સૂત્ર xH 2 O ySiO 2 (ઘણી વાર સાહિત્યમાં બિન-સિલિકિક એસિડનો ઉલ્લેખ કરવામાં આવ્યો છે, અને સિલિકિક એસિડ, જો કે હકીકતમાં આપણે સમાન પદાર્થ વિશે વાત કરી રહ્યા છીએ).
ઉદાહરણ તરીકે, સોડિયમ ઓર્થોસિલિકેટ મેળવી શકાય છે:
કેલ્શિયમ મેટાસિલિકેટ:
અથવા મિશ્રિત કેલ્શિયમ અને સોડિયમ સિલિકેટ:
વિન્ડો ગ્લાસ સિલિકેટ Na 2 CaSi 6 O 14 (Na 2 O·CaO·6SiO2)માંથી બનાવવામાં આવે છે.
મોટા ભાગના સિલિકેટમાં સતત રચના હોતી નથી. તમામ સિલિકેટ્સમાંથી માત્ર સોડિયમ અને પોટેશિયમ સિલિકેટ જ પાણીમાં દ્રાવ્ય હોય છે. પાણીમાં આ સિલિકેટ્સનું સોલ્યુશન લિક્વિડ ગ્લાસ કહેવાય છે. હાઇડ્રોલિસિસને લીધે, આ ઉકેલો અત્યંત આલ્કલાઇન વાતાવરણ દ્વારા વર્ગીકૃત થયેલ છે. હાઇડ્રોલાઇઝ્ડ સિલિકેટ્સ સાચા નહીં, પરંતુ કોલોઇડલ સોલ્યુશન્સની રચના દ્વારા વર્ગીકૃત થયેલ છે. જ્યારે સોડિયમ અથવા પોટેશિયમ સિલિકેટ્સનું દ્રાવણ એસિડિફાઇડ થાય છે, ત્યારે હાઇડ્રેટેડ સિલિકિક એસિડનો જિલેટીનસ સફેદ અવક્ષેપ થાય છે.
ઘન સિલિકોન ડાયોક્સાઇડ અને તમામ સિલિકેટ્સ બંનેનું મુખ્ય માળખાકીય તત્વ જૂથ છે, જેમાં સિલિકોન અણુ Si એ ચાર ઓક્સિજન અણુઓ O ના ટેટ્રાહેડ્રોનથી ઘેરાયેલું છે. આ કિસ્સામાં, દરેક ઓક્સિજન અણુ બે સિલિકોન અણુઓ સાથે જોડાયેલ છે. ટુકડાઓ એકબીજા સાથે અલગ અલગ રીતે જોડી શકાય છે. સિલિકેટ્સ વચ્ચે, તેમના ટુકડાઓમાં જોડાણોની પ્રકૃતિ અનુસાર, તેઓ ટાપુ, સાંકળ, રિબન, સ્તરવાળી, ફ્રેમ અને અન્યમાં વહેંચાયેલા છે.
રસીદ
કૃત્રિમ સિલિકોન ડાયોક્સાઇડ ઓક્સિજન વાતાવરણમાં +400...500 °C તાપમાને સિલિકોનને ગરમ કરીને ઉત્પન્ન થાય છે, જ્યારે સિલિકોનને SiO 2 ડાયોક્સાઇડમાં ઓક્સિડાઇઝ કરવામાં આવે છે. તેમજ ઊંચા તાપમાને થર્મલ ઓક્સિડેશન.
પ્રયોગશાળાની પરિસ્થિતિઓમાં, દ્રાવ્ય સિલિકેટ્સ પર એસિડ, નબળા એસિટિક એસિડની ક્રિયા દ્વારા કૃત્રિમ સિલિકોન ડાયોક્સાઇડ મેળવી શકાય છે. દાખ્લા તરીકે:
સિલિકિક એસિડ તરત જ પાણીમાં તૂટી જાય છે અને SiO 2, જે અવક્ષેપ કરે છે.
રેતીના સ્વરૂપમાં કુદરતી સિલિકાનો ઉપયોગ થાય છે જ્યાં સામગ્રીની ઉચ્ચ શુદ્ધતાની જરૂર નથી.
અરજી
સિલિકોન ડાયોક્સાઇડનો ઉપયોગ કાચ, સિરામિક્સ, ઘર્ષણ, કોંક્રિટ ઉત્પાદનોના ઉત્પાદનમાં, સિલિકોનના ઉત્પાદન માટે, રબરના ઉત્પાદનમાં ફિલર તરીકે, સિલિકા રિફ્રેક્ટરીના ઉત્પાદનમાં, ક્રોમેટોગ્રાફી વગેરેમાં થાય છે. ક્વાર્ટઝ સ્ફટિકો પીઝોઇલેક્ટ્રિક ગુણધર્મો ધરાવે છે અને તેથી તેનો ઉપયોગ રેડિયો એન્જિનિયરિંગ, અલ્ટ્રાસોનિક ઇન્સ્ટોલેશન અને લાઇટરમાં થાય છે .અમોર્ફસ બિન-છિદ્રાળુ સિલિકોન ડાયોક્સાઇડનો ઉપયોગ ખાદ્ય ઉદ્યોગમાં એક્સિપિયન્ટ E551 તરીકે થાય છે, જે કેકિંગ અને કેકિંગને અટકાવે છે, પેરાફાર્માસ્યુટિકલ્સ (ટૂથપેસ્ટ), ફાર્માસ્યુટિકલ ઉદ્યોગમાં એક્સિપિયન્ટ તરીકે (સૂચિબદ્ધ) મોટાભાગના ફાર્માકોપીઆસમાં), તેમજ ફૂડ એડિટિવ અથવા એન્ટરસોર્બન્ટ તરીકે દવા.
સિલિકોન ડાયોક્સાઇડની કૃત્રિમ રીતે ઉત્પાદિત ફિલ્મોનો ઉપયોગ માઇક્રોસિર્કિટ અને અન્ય ઇલેક્ટ્રોનિક ઘટકોના ઉત્પાદનમાં ઇન્સ્યુલેટર તરીકે થાય છે.
ફાઈબર ઓપ્ટિક કેબલના ઉત્પાદન માટે પણ વપરાય છે. પ્યોર ફ્યુઝ્ડ સિલિકાનો ઉપયોગ તેમાં કેટલાક ખાસ ઘટકો ઉમેરવામાં આવે છે.
સિલિકા ફિલામેન્ટનો ઉપયોગ ઈલેક્ટ્રોનિક સિગારેટના તત્વોને ગરમ કરવા માટે પણ થાય છે, કારણ કે તે પ્રવાહીને સારી રીતે શોષી લે છે અને કોઈલની ગરમી હેઠળ તૂટી પડતું નથી.
મોટા સ્પષ્ટ ક્વાર્ટઝ સ્ફટિકોનો ઉપયોગ અર્ધ કિંમતી પથ્થરો તરીકે થાય છે; રંગહીન સ્ફટિકોને રોક ક્રિસ્ટલ, વાયોલેટ સ્ફટિકોને એમિથિસ્ટ્સ અને પીળા સ્ફટિકોને સિટ્રીન કહેવામાં આવે છે.
માઈક્રોઈલેક્ટ્રોનિક્સમાં, સિલિકોન ડાયોક્સાઇડ મુખ્ય સામગ્રીઓમાંની એક છે. તેનો ઉપયોગ ઇન્સ્યુલેટીંગ લેયર તરીકે અને રક્ષણાત્મક કોટિંગ તરીકે પણ થાય છે. તે સિલિકોનના થર્મલ ઓક્સિડેશન, રાસાયણિક વરાળના નિકાલ અને મેગ્નેટ્રોન સ્પુટરિંગ દ્વારા પાતળા ફિલ્મોના સ્વરૂપમાં મેળવવામાં આવે છે.
છિદ્રાળુ સિલિકા
છિદ્રાળુ સિલિકા વિવિધ પદ્ધતિઓ દ્વારા મેળવવામાં આવે છે.
સિલોક્રોમ એકંદર એરોસિલ દ્વારા મેળવવામાં આવે છે, જે બદલામાં, સિલેન (SiH 4) ને બાળીને મેળવવામાં આવે છે. સિલોક્રોમ ઉચ્ચ શુદ્ધતા અને ઓછી યાંત્રિક શક્તિ દ્વારા વર્ગીકૃત થયેલ છે. ચોક્કસ સપાટીનું લાક્ષણિક કદ 60-120 m²/g છે. તેનો ઉપયોગ ક્રોમેટોગ્રાફી, રબર ફિલર અને કેટાલિસિસમાં સોર્બન્ટ તરીકે થાય છે.
સિલિકા જેલ સિલિકિક એસિડ જેલને સૂકવીને મેળવવામાં આવે છે. સિલોક્રોમની તુલનામાં, તેની શુદ્ધતા ઓછી છે, પરંતુ તેની સપાટી અત્યંત વિકસિત હોઈ શકે છે: સામાન્ય રીતે 300 m²/g થી 700 m²/g.
સિલિકોન એરજેલ આશરે 99.8% હવા છે અને તેની ઘનતા 1.9 kg/m³ (હવાની ઘનતાના માત્ર 1.5 ગણી) સુધી હોઈ શકે છે.