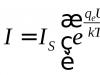1. lapa
3. Uzrakstiet elektronisku formulu Jona tallijs Tl 3+. Valences elektroniem atoms Tl norāda visu četru kvantu skaitļu kopu.
Risinājums:
Saskaņā ar Klečkovska likumu, pildījums enerģijas līmeņi un apakšlīmeņi notiek šādā secībā:
1s2s2p3s3p4s3d4p5s4d5p6s(5d 1)4f
5d6p7s (6d 3-2)5f6d7p.
Elementa tallija Tl kodollādiņš ir +81 (atomskaitlis 81), attiecīgi 81 elektrons. Saskaņā ar Klečkovska likumu mēs sadalām elektronus pa enerģijas apakšlīmeņiem un iegūstam elementa Tl elektronisko formulu:
81 Tl tallijs 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 1
Tallija jona Tl 3+ lādiņš ir +3, kas nozīmē, ka atoms atteicās no 3 elektroniem, un tā kā atoms var atdot tikai ārējā līmeņa valences elektronus (tallijam tie ir divi 6s un viens 6p elektroni), tā elektroniskā formula izskatīsies šādi:
81 Tl 3+ tallijs 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 0 4f 14 5d 10 6p 0
Galvenais kvantu skaitlis n nosaka elektrona kopējo enerģiju un tā izņemšanas no kodola pakāpi (enerģijas līmeņa skaitli); tas pieņem jebkuras veselas vērtības, sākot no 1 (n = 1, 2, 3, ...), t.i. atbilst perioda numuram.
Orbitālais (sānu vai azimutālais) kvantu skaitlis l nosaka atomu orbitāles formu. Tas var ņemt veselu skaitļu vērtības no 0 līdz n-1 (l = 0, 1, 2, 3,..., n-1). Neatkarīgi no enerģijas līmeņa numura, katras vērtības l Orbitālais kvantu skaitlis atbilst īpašas formas orbitālei.
Orbitāles ar l= 0 sauc par s-orbitālēm,
l= 1 – p-orbitāles (3 veidi, atšķiras ar magnētisko kvantu skaitu m),
l= 2 – d-orbitāles (5 veidi),
l= 3 – f-orbitāles (7 veidi).
Magnētiskais kvantu skaitlis m l raksturo elektronu orbitāles stāvokli telpā un ņem veselus skaitļus no - l uz + l, ieskaitot 0. Tas nozīmē, ka katrai orbītas formai ir (2 l+ 1) enerģētiski līdzvērtīga orientācija telpā.
Spin kvantu skaitlis m S raksturo magnētisko momentu, kas rodas, elektronam griežoties ap savu asi. Pieņem tikai divas vērtības +1/2 un –1/2, kas atbilst pretējiem griešanās virzieniem.
Valences elektroni ir elektroni ārējā enerģijas līmenī. Tallijam ir 3 valences elektroni: 2 s elektroni un 1 p elektrons.
Kvantu skaitļi s – elektroni:
Orbitālais kvantu skaitlis l= 0 (s — orbitāle)
Magnētiskais kvantu skaitlis m l = (2 l+ 1 = 1): m l = 0.
Griezuma kvantu skaitlis m S = ±1/2
Kvantu skaitļi p – elektrons:
Galvenais kvantu skaitlis n = 6 (sestais periods)
Orbitālais kvantu skaitlis l= 1 (p — orbitāle)
Magnētiskais kvantu skaitlis (2 l+ 1 = 3): m = -1, 0, +1
Griezuma kvantu skaitlis m S = ±1/2
23. Norādiet šos rekvizītus ķīmiskie elementi, kas periodiski mainās. Kāds ir iemesls šo īpašību periodiskai atkārtošanai? Izmantojot piemērus, izskaidro ķīmisko savienojumu īpašību izmaiņu periodiskuma būtību.
Risinājums:
Elementu īpašības, ko nosaka atomu ārējo elektronisko slāņu struktūra, dabiski mainās atkarībā no periodiem un grupām periodiskā tabula. Šajā gadījumā elektronisko struktūru līdzība rada analogo elementu īpašību līdzību, bet ne šo īpašību identitāti. Tāpēc, pārejot no viena elementa uz otru grupās un apakšgrupās, tiek novērots nevis vienkāršs īpašību atkārtojums, bet gan to vairāk vai mazāk izteikta dabiskā maiņa. Jo īpaši elementu atomu ķīmiskā uzvedība izpaužas to spējā zaudēt un iegūt elektronus, t.i. to spēja oksidēties un reducēt. Kvantitatīvs atoma spēju mērs zaudēt elektroni ir jonizācijas potenciāls (E Un ) un viņu spēju mēraukla atgūt– elektronu afinitāte (E Ar ). Šo lielumu izmaiņu raksturs pārejā no viena perioda uz otru atkārtojas, un šo izmaiņu pamatā ir atoma elektroniskās konfigurācijas izmaiņas. Tādējādi pabeigtiem elektroniskajiem slāņiem, kas atbilst inerto gāzu atomiem, ir paaugstināta stabilitāte un palielināta vērtība jonizācijas potenciāls noteiktā laika posmā. Tajā pašā laikā pirmās grupas s-elementiem (Li, Na, K, Rb, Cs) ir viszemākās jonizācijas potenciāla vērtības.
Elektronegativitāte ir noteikta elementa atoma spējas piesaistīt elektronus, salīdzinot ar citu savienojuma elementu atomiem. Saskaņā ar vienu no definīcijām (Mulliken) atoma elektronegativitāti var izteikt kā pusi no tā jonizācijas enerģijas un elektronu afinitātes summas: = (E un + E c).
Periodos ir vispārējā tendence elementa elektronegativitātes pieaugums, bet apakšgrupās – tā samazināšanās. Zemākās vērtības I grupas s-elementiem ir elektronegativitāte, un VII grupas p-elementiem ir vislielākā elektronegativitāte.
Viena un tā paša elementa elektronegativitāte var mainīties atkarībā no valences stāvokļa, hibridizācijas, oksidācijas stāvokļa utt. Elektronegativitāte būtiski ietekmē elementu savienojumu īpašību izmaiņu raksturu. Piemēram, sērskābe uzrāda spēcīgākas skābes īpašības nekā tās ķīmiskais analogs - selēnskābe, jo pēdējā centrālais selēna atoms, pateicoties tā zemākai elektronegativitātei, salīdzinot ar sēra atomu, tik spēcīgi nepolarizē skābē esošās H–O saites. , kas nozīmē skābuma pavājināšanos.
H-O O
Vēl viens piemērs: hroma (II) hidroksīds un hroma (VI) hidroksīds. Hroma (II) hidroksīdam Cr(OH) 2 ir pamata īpašības atšķirībā no hroma (VI) hidroksīda H 2 CrO 4, jo hroma +2 oksidācijas pakāpe nosaka Cr 2+ Kulona mijiedarbības vājumu ar hidroksīda jonu un šī jona izvadīšanas vieglumu, t.i. pamatīpašību izpausme. Tajā pašā laikā augstais hroma +6 oksidācijas stāvoklis hroma (VI) hidroksīdā nosaka spēcīgo Kulona pievilcību starp hidroksīda jonu un centrālo hroma atomu un disociācijas neiespējamību gar saiti.  – Ak. No otras puses, augstais hroma oksidācijas stāvoklis hroma(VI) hidroksīdā uzlabo tā spēju piesaistīt elektronus, t.i. elektronegativitāte, kas izraisa augstu H-O saišu polarizācijas pakāpi šajā savienojumā, kas ir priekšnoteikums skābuma palielināšanai.
– Ak. No otras puses, augstais hroma oksidācijas stāvoklis hroma(VI) hidroksīdā uzlabo tā spēju piesaistīt elektronus, t.i. elektronegativitāte, kas izraisa augstu H-O saišu polarizācijas pakāpi šajā savienojumā, kas ir priekšnoteikums skābuma palielināšanai.
Tālāk svarīga īpašība atomi ir to rādiuss. Periodos metāla atomu rādiusi samazinās, palielinoties elementa atomu skaitam, jo palielinoties elementa atomu skaitam periodā, palielinās kodola lādiņš un līdz ar to arī kopējais elektronu lādiņš, kas to līdzsvaro; kā rezultātā palielinās arī elektronu Kulona pievilcība, kas galu galā samazina attālumu starp tiem un kodolu. Visizteiktākā rādiusa samazināšanās vērojama īsu periodu elementos, kuros ārējais enerģijas līmenis ir piepildīts ar elektroniem.
Lielos periodos d- un f-elementi uzrāda vienmērīgāku rādiusu samazināšanos, palielinoties atoma kodola lādiņam. Katrā elementu apakšgrupā atomu rādiusiem ir tendence palielināties no augšas uz leju, jo šāda nobīde nozīmē pāreju uz augstāku enerģijas līmeni.
Elementu jonu rādiusu ietekmi uz to veidoto savienojumu īpašībām var ilustrēt ar piemēru par halogenūdeņražskābju skābuma palielināšanos gāzes fāzē: HI > HBr > HCl > HF.
43. Nosauciet elementus, kuru atomiem ir iespējams tikai viens valences stāvoklis, un norādiet, vai tas būs slīpēts vai ierosināts.
Risinājums:
To elementu atomiem, kuriem ārējā valences enerģijas līmenī ir viens nepāra elektrons, var būt viens valences stāvoklis - tie ir periodiskās sistēmas I grupas elementi (H - ūdeņradis, Li - litijs, Na - nātrijs, K - kālijs, Rb - rubīdijs , Ag – sudrabs, Cs – cēzijs, Au – zelts, Fr – francijs), izņemot varu, jo ķīmisko saišu veidošanā, kuru skaitu nosaka valence, pirms ārējā līmeņa d-elektroni. arī piedalīties (vara atoma 3d 10 4s 1 pamatstāvoklis ir saistīts ar piepildītā d-čaulas stabilitāti, tomēr pirmais ierosinātais stāvoklis 3d 9 4s 2 enerģētikā pārsniedz pamatstāvokli tikai par 1,4 eV (apmēram 125). kJ/mol Tāpēc, in). ķīmiskie savienojumi Abi stāvokļi izpaužas vienādā mērā, radot divas vara savienojumu sērijas (I) un (II)).
Arī elementu atomiem, kuros ārējais enerģijas līmenis ir pilnībā piepildīts un elektroniem nav iespējas nonākt ierosinātā stāvoklī, var būt viens valences stāvoklis. Tie ir VIII grupas galvenās apakšgrupas elementi – inertās gāzes (He – hēlijs, Ne – neons, Ar – argons, Kr – kriptons, Xe – ksenons, Rn – radons).
Visiem uzskaitītajiem elementiem vienīgais valences stāvoklis ir pamatstāvoklis, jo nav iespējas pāriet uz satrauktu stāvokli. Turklāt pāreja uz ierosināto stāvokli attiecīgi nosaka atoma jauno valences stāvokli, ja šāda pāreja ir iespējama, dotā atoma valences stāvoklis nav vienīgais.
63. Valences atgrūšanas modeļa izmantošana elektronu pāri un valences saites metodi, ņemiet vērā piedāvāto molekulu un jonu telpisko struktūru. Norāda: a) centrālā atoma savienojošo un vientuļo elektronu pāru skaitu; b) hibridizācijā iesaistīto orbitāļu skaits; c) hibridizācijas veids; d) molekulas vai jona veids (AB m E n); e) elektronu pāru telpiskais izvietojums; f) molekulas vai jona telpiskā struktūra.
SO 3; 
Risinājums:
Saskaņā ar valences saišu metodi (izmantojot šo metodi tiek iegūts tāds pats rezultāts kā izmantojot OEPVO modeli) molekulas telpisko konfigurāciju nosaka centrālā atoma hibrīda orbitāļu telpiskais izvietojums, kas veidojas kā rezultātā. mijiedarbība starp orbitālēm.
Lai noteiktu centrālā atoma hibridizācijas veidu, ir jāzina hibridizējošo orbitāļu skaits. To var atrast, saskaitot centrālā atoma saišu un vientuļo elektronu pāru skaitu un atņemot π saišu skaitu.
SO 3 molekulā

kopējais saišu pāru skaits ir 6. Atņemot π-saišu skaitu, iegūstam hibridizējošo orbitāļu skaitu: 6 – 3 = 3. Tādējādi hibridizācijas veids ir sp 2, jona tips ir AB 3, elektronu pāru telpiskajam izvietojumam ir trīsstūra forma, un pati molekula ir trīsstūris:

Jonā 

kopējais saišu pāru skaits ir 4. Nav π saišu. Hibridizējošo orbitāļu skaits: 4. Tātad hibridizācijas veids ir sp 3, AB 4 jona tips, elektronu pāru telpiskajam izvietojumam ir tetraedra forma, bet pats jons ir tetraedrs:

83. Uzrakstiet vienādojumus iespējamās reakcijas KOH, H 2 SO 4, H 2 O, Be(OH) 2 mijiedarbība ar tālāk norādītajiem savienojumiem:
H 2 SO 3, BaO, CO 2, HNO 3, Ni(OH) 2, Ca(OH) 2;
Risinājums:
a) KOH reakcijas
2KOH + H 2 SO 3 K 2 SO 3 + 2H 2 O
2K + + 2 Ak! - + 2H+ + SO 3 2- 2K + + SO 3 2- + H 2 O
Ak! - + H + H 2 O
KOH + BaO nav reakcijas
2KOH + CO 2 K 2 CO 3 + H 2 O
2K + + 2 Ak! - + CO 2 2K + + CO 3 2- + H 2 O
2Ak! - + H 2 CO 3 CO 3 2- + H 2 O
KOH + HNO 3 nav reakcijas, šķīdums vienlaikus satur jonus:
K + + OH - + H + + NO 3 -
2KOH + Ni(OH) 2 K
2K + + 2 Ak!- + Ni(OH) 2 K + + -
KOH + Ca(OH) 2 nav reakcijas
b) reakcijas reakcijas H 2 SO 4
H 2 SO 4 + H 2 SO 3 reakcijas nav
H 2 SO 4 + BaO BaSO 4 + H 2 O
2H + + SO 4 2- + BaO BaSO 4 + H 2 O
H 2 SO 4 + CO 2 nekādas reakcijas
H 2 SO 4 + HNO 3 nav reakcijas
H 2 SO 4 + Ni(OH) 2 NiSO 4 + 2H 2 O
2H+ + SO 4 2- + Ni(OH) 2 Ni 2+ + SO 4 2- + 2 H 2 O
2H + + Ni(OH) 2 Ni 2+ + 2H 2 O
H 2 SO 4 + Ca(OH) 2 CaSO 4 + 2H 2 O
2H + + SO 4 2- + Ca(OH) 2 CaSO 4 + 2H 2 O
c) H 2 O reakcijas
H 2 O + H 2 SO 3 reakcijas nav
H 2 O + BaO Ba(OH) 2
H 2 O + BaO Ba 2+ + 2OH -
H 2 O + CO 2 nekādas reakcijas
H 2 O + HNO 3 nav reakcijas
H 2 O + NO 2 nekādas reakcijas
H 2 O + Ni(OH) 2 nekādas reakcijas
H 2 O + Ca(OH) 2 nenotiek reakcijas
a) reakcijas reakcijas Be(OH) 2
Be(OH) 2 + H 2 SO 3 BeSO 3 + 2H 2 O
Esi (OH) 2 + 2H+ + SO 3 2- Be 2+ + SO 3 2- + 2 H 2 O
Esi (OH) 2 + 2H+ Esi 2+ + 2 H 2 O
Be(OH) 2 + BaO nav reakcijas
2Be (OH) 2 + CO 2 Be 2 CO 3 (OH) 2 ↓ + 2H 2 O
Be(OH)2 + 2HNO3 Be(NO3)2 + 2H 2O
Esi (OH) 2 + 2H+ + NO 3 - Esi 2+ + 2NO 3 - + 2 H 2 O
Esi (OH) 2 + 2H + Esi 2+ + 2H 2 O
Be(OH) 2 + Ni(OH) 2 nav reakcijas
Be(OH) 2 + Ca(OH) 2 nav reakcijas
103. Par norādīto reakciju
b) paskaidro, kurš no faktoriem: entropija vai entalpija veicina spontānu reakcijas rašanos virzienā uz priekšu;
c) kurā virzienā (tiešā vai pretējā virzienā) reakcija noritēs pie 298K un 1000K;
e) nosauc visus veidus, kā palielināt līdzsvara maisījuma produktu koncentrāciju.
f) attēlo ΔG p (kJ) atkarību no T (K)
Risinājums:
CO (g) + H2 (g) = C (k) + H2O (g)
Vielu veidošanās standarta entalpija, entropija un Gibsa enerģija
1. (ΔH 0 298) h.r. =
 –
–  = -241,84 + 110,5 = -131,34 kJ 2. (ΔS 0 298) c.r. =
= -241,84 + 110,5 = -131,34 kJ 2. (ΔS 0 298) c.r. =  +
+  –
–  –
–  = 188,74+5,7-197,5-130,6 = -133,66 J/K = -133,66 10 -3 kJ/mol > 0.
= 188,74+5,7-197,5-130,6 = -133,66 J/K = -133,66 10 -3 kJ/mol > 0. Tiešo reakciju pavada entropijas samazināšanās, traucējumi sistēmā samazinās - nelabvēlīgs faktors ķīmiskā reakcija virzienā uz priekšu.
3. Aprēķiniet reakcijas standarta Gibsa enerģiju.
saskaņā ar Hesa likumu:
(ΔG 0 298) h.r. =  –
–  = -228,8 +137,1 = -91,7 kJ
= -228,8 +137,1 = -91,7 kJ
Izrādījās, ka (ΔН 0 298) ch.r. > (ΔS 0 298) c.r. ·T un pēc tam (ΔG 0 298) h.r.
4.  ≈
≈  ≈ 982,6 K.
≈ 982,6 K.
 ≈ 982,6 K ir aptuvenā temperatūra, pie kuras tiek izveidots patiesais ķīmiskais līdzsvars virs šīs temperatūras, notiks apgrieztā reakcija. Pie noteiktas temperatūras abi procesi ir vienlīdz iespējami.
≈ 982,6 K ir aptuvenā temperatūra, pie kuras tiek izveidots patiesais ķīmiskais līdzsvars virs šīs temperatūras, notiks apgrieztā reakcija. Pie noteiktas temperatūras abi procesi ir vienlīdz iespējami.
5. Aprēķiniet Gibsa enerģiju pie 1000 K:
(ΔG 0 1000) h.r. ≈ ΔН 0 298 – 1000·ΔS 0 298 ≈ -131,4 – 1000·(-133,66)·10 -3 ≈ 2,32 kJ > 0.
Tie. pie 1000 K: ΔS 0 h.r. ·Т > ΔН 0 h.r.
Entalpijas faktors kļuva par izšķirošu, spontāna tiešās reakcijas rašanās kļuva neiespējama. Notiek apgrieztā reakcija: no viena mola gāzes un 1 mola cietas vielas veidojas 2 moli gāzes.
log K 298 = 16,1; K 298 ≈ 10 16 >> 1.
Sistēma ir tālu no patiesa ķīmiskā līdzsvara stāvokļa, tajā dominē reakcijas produkti.

ΔG 0 atkarība no reakcijas temperatūras
CO (g) + H2 (g) = C (k) + H2O (g)
K 1000 = 0,86 > 1 – sistēma ir tuvu līdzsvaram, bet šajā temperatūrā tajā dominē izejvielas.
8. Saskaņā ar Le Šateljē principu, paaugstinoties temperatūrai, līdzsvaram ir jānovirzās uz pretējo reakciju, un līdzsvara konstantei jāsamazinās.
9. Apskatīsim, kā mūsu aprēķinātie dati saskan ar Le Šateljē principu. Piedāvāsim dažus datus, kas parāda Gibsa enerģijas un šīs reakcijas līdzsvara konstantes atkarību no temperatūras:
|
T, K |
ΔG 0 t, kJ |
K t |
|
298 |
-131,34 |
10 16 |
|
982,6 |
0 |
1 |
|
1000 |
2,32 |
0,86 |
Tādējādi iegūtie aprēķinātie dati atbilst mūsu secinājumiem, kas izdarīti, pamatojoties uz Le Šateljē principu.
123. Līdzsvars sistēmā:
![]() )
)
izveidota plkst sekojošām koncentrācijām: [B] un [C], mol/l.
Noteikt vielas sākotnējo koncentrāciju [B] 0 un līdzsvara konstanti, ja vielas A sākotnējā koncentrācija ir [A] 0 mol/l
No vienādojuma var redzēt, ka, lai izveidotu 0,26 molus vielas C, nepieciešami 0,13 moli vielas A un tikpat daudz vielas B.
Tad vielas A līdzsvara koncentrācija ir [A] = 0,4-0,13 = 0,27 mol/l.
Vielas B sākotnējā koncentrācija [B] 0 = [B] + 0,13 = 0,13+0,13 = 0,26 mol/l.

Atbilde: [B] 0 = 0,26 mol/l, Kp = 1,93.
143. a) 300 g šķīduma satur 36 g KOH (šķīduma blīvums 1,1 g/ml). Aprēķiniet šī šķīduma procentuālo un molāro koncentrāciju.
b) Cik gramu kristāliskās sodas Na 2 CO 3 ·10H 2 O jāņem, lai pagatavotu 2 litrus 0,2 M Na 2 CO 3 šķīduma?
Risinājums:
Mēs atrodam procentuālo koncentrāciju, izmantojot vienādojumu:

KOH molārā masa ir 56,1 g/mol;
Lai aprēķinātu šķīduma molaritāti, mēs atrodam KOH masu, kas atrodas 1000 ml (t.i., 1000 · 1,100 = 1100 g) šķīduma:
1100: 100 = plkst: 12; plkst= 12 1100 / 100 = 132 g
C m = 56,1 / 132 = 0,425 mol/l.
Atbilde: C = 12%, Cm = 0,425 mol/l
Risinājums:
1. Atrodiet bezūdens sāls masu
m = cm·M·V, kur M – molārā masa, V – apjoms.
m = 0,2 106 2 = 42,4 g.
2. No proporcijas atrodiet kristāliskā hidrāta masu
kristāliskā hidrāta molārā masa 286 g/mol - masa X
bezūdens sāls molārā masa 106g/mol - masa 42,4g
tātad X = m Na 2 CO 3 10H 2 O = 42,4 286/106 = 114,4 g.
Atbilde: m Na 2 CO 3 10H 2 O = 114,4 g.
163. Aprēķina viršanas temperatūru 5% naftalīna C 10 H 8 šķīdumam benzolā. Benzola viršanas temperatūra ir 80,2 0 C.
|
Ņemot vērā: Vidējais (C 10 H 8) = 5% vāra (C 6 H 6) = 80,2 0 C |
|
Atrast: vāra (šķīdums) -? |
Risinājums:
No Raula otrā likuma
ΔT = E m = (E m B 1000) / (m A μ B)
Šeit E ir šķīdinātāja ebulioskopiskā konstante
E(C6H6) = 2,57
m A ir šķīdinātāja svars, m B ir izšķīdušās vielas svars, M B ir tā molekulmasa.
Pieņemsim, ka šķīduma masa ir 100 grami, tāpēc izšķīdušās vielas masa ir 5 grami, bet šķīdinātāja masa ir 100 – 5 = 95 grami.
M (naftalīns C 10 H 8) = 12 10 + 1 8 = 128 g/mol.
Mēs aizstājam visus datus formulā un atrodam šķīduma viršanas temperatūras pieaugumu salīdzinājumā ar tīru šķīdinātāju:
ΔT = (2,57 5 1000)/(128 95) = 1,056
Naftalīna šķīduma viršanas temperatūru var atrast, izmantojot formulu:
T k.r-ra = T k.r-la + ΔT = 80,2 + 1,056 = 81,256
Atbilde: 81,256 o C
183. Uzdevums 1. Uzraksti disociācijas vienādojumus un disociācijas konstantes vājiem elektrolītiem.
2. uzdevums. Doti jonu vienādojumi, uzrakstiet atbilstošos molekulāros vienādojumus.
3. uzdevums. Uzrakstiet reakcijas vienādojumus sekojošām transformācijām molekulārās un jonu formās.
|
Nē. |
1. uzdevums |
2. uzdevums |
3. uzdevums |
|
183 |
Zn(OH)2, H3AsO4 |
Ni 2+ + OH – + Cl – = NiOHCl |
NaHSO 3 → Na 2 SO 3 → H 2 SO 3 → NaHSO 3 |
Risinājums:
Uzrakstiet disociācijas vienādojumus un disociācijas konstantes vājiem elektrolītiem.
Ist.: Zn(OH) 2 ↔ ZnOH + + OH -
Kd 1 =  = 1,5·10 -5
= 1,5·10 -5
IIst.: ZnOH + ↔ Zn 2+ + OH -
Kd 2 =  = 4,9·10 -7
= 4,9·10 -7
Zn(OH) 2 – amfoteriskais hidroksīds, iespējama skābes tipa disociācija
Ist.: H 2 ZnO 2 ↔ H + + HZnO 2 -
Kd 1 = 
IIst.: HZnO 2 - ↔ H + + ZnO 2 2-
Kd 2 = 
H 3 AsO 4 – ortoarsēnskābe – spēcīgs elektrolīts, šķīdumā pilnībā disocē:
H 3 AsO 4 ↔ 3Н + + AsO 4 3-
Ņemot vērā jonu vienādojumus, uzrakstiet atbilstošos molekulāros vienādojumus.
Ni 2+ + OH – + Cl – = NiOHCl
NiCl2 + NaOH(nepietiekami) = NiOHCl + NaCl
Ni 2+ + 2Cl - + Na + + OH - = NiOHCl + Na + + Cl -
Ni 2+ + Cl - + OH - = NiOHCl
Uzrakstiet reakcijas vienādojumus sekojošām transformācijām molekulārās un jonu formās.
NaHSO 3 → Na 2 SO 3 → H 2 SO 3 → NaHSO 3
1) NaHSO 3 + NaOH → Na 2 SO 3 + H 2 O
Na++ HSO 3 - +Na++ Ak!- → 2Na ++ SO 3 2- + H 2 O
HSO 3 - + Ak! - → + SO 3 2- + H 2 O
2) Na 2 SO 3 + H 2 SO 4 → H 2 SO 3 + Na 2 SO 3
2Na ++ SO 3 2- + 2N+ + SO 4 2- → H 2 SO 3 + 2Na + + SO 3 2-
SO 3 2- + 2N + → H 2 SO 3 + SO 3 2-
3) H 2 SO 3 (pārmērīgs) + NaOH → NaHSO 3 + H 2 O
2 N + + SO 3 2- + Na + + Ak!- → Na + + HSO 3 - + H 2 O
2
N + + SO 3 2 + Ak!- → Na + + H 2 O
203. 1. uzdevums. Uzrakstiet vienādojumus sāļu hidrolīzei molekulārā un jonu formā, norādiet šķīdumu pH (pH > 7, pH 2. uzdevums. Uzrakstiet vienādojumus reakcijām, kas notiek starp vielām ūdens šķīdumi
|
Nē. |
1. uzdevums |
2. uzdevums |
|
203 |
Na2S; CrBr 3 |
FeCl 3 + Na 2 CO 3; Na 2 CO 3 + Al 2 (SO 4) 3 |
1. uzdevums. Uzrakstiet vienādojumus sāļu hidrolīzei molekulārā un jonu formā, norādiet šķīdumu pH (pH > 7, pH
Na2S - sāls, ko veido spēcīga bāze un vāja skābe, pie anjona hidrolizē. Vides reakcija ir sārmaina (pH > 7).
Ist. Na 2 S + HON ↔ NaHS + NaOH
2Na + + S 2- + HON ↔ Na + + HS - + Na + + OH -
IIst. NaHS + HOH ↔ H 2 S + NaOH
Na + + HS - + HOH ↔ Na + + H 2 S + OH -
CrBr 3 -
sāls, ko veido vāja bāze un spēcīga skābe, hidrolizējas par katjonu. Vides reakcija ir skāba (pH
Ist. CrBr 3 + HOH ↔ CrOHBr 2 + HBr
Cr 3+ + 3Br - + HOH ↔ CrOH 2+ + 2Br - + H + + Br -
IIst. CrOHBr 2 + HON ↔ Cr(OH) 2 Br + HBr
CrOH 2+ + 2Br - + HOH ↔ Cr(OH) 2 + + Br - + H + + Br -
III Art. Cr(OH) 2 Br + HON↔ Cr(OH) 3 + HBr
Cr(OH) 2 + + Br - + HOH↔ Cr(OH) 3 + H + + Br -
Hidrolīze galvenokārt notiek pirmajā posmā.
2. uzdevums. Uzrakstiet vienādojumus reakcijām, kas notiek starp vielām ūdens šķīdumos
FeCl 3 + Na 2 CO 3
FeCl3 – sāls, ko veido spēcīga skābe un vāja bāze
Na 2 CO 3 – sāls, ko veido vāja skābe un spēcīga bāze
2FeCl3 + 3Na 2CO 3 + 6H(OH) = 2Fe(OH)3 + 3H 2CO 3 + 6NaCl
2Fe 3+ + 6Cl - + 6Na + + 3 CO 3 2- + 6N(VIŅŠ) = 2Fe( Ak!) 3 + 3H 2 CO 3 + 6Na + + 6Cl -
2Fe 3+ + 3CO 3 2- + 6N(VIŅŠ) = 2Fe( Ak!) 3 + 3H 2 O + 3CO 2
Na 2 CO 3 + Al 2 (SO 4) 3
Notiek savstarpēja hidrolīzes palielināšanās
Al 2 (SO 4) 3 – sāls, ko veido spēcīga skābe un vāja bāze
Na2CO3 – sāls, ko veido vāja skābe un spēcīga bāze
Kad divi sāļi tiek hidrolizēti kopā, veidojas vāja bāze un vāja skābe:
Ist: 2Na 2CO 3 + Al 2 (SO 4) 3 + 2HOH => 4Na + + 2HCO 3 - + 2AlOH 2+ + 3 SO 4 2 -
IIst: 2HCO 3 - + 2AlOH 2+ + 2HOH => 2H 2 CO 3 + 2Al(OH) 2 +
IIIst: 2Al(OH)2++2HOH => 2Al(OH)3+2H+
Kopsavilkuma hidrolīzes vienādojums
Al 2 (SO 4) 3 + 2 Na 2 CO 3 + 6H 2 O = 2Al(OH) 3 ↓ + 2H 2 CO 3 + 2 Na 2 SO 4 + H 2 SO 4
2Al 3+ + 3 SO 4 2 - + 2 Na + + 2 CPAR 3 2- + 6H 2 O = 2Al(OH) 3 ↓ + 2H 2 C O 3 + 2 Na + + 2SO 4 2 - + 2H + + SO 4 2 -
2Al 3+ + 2CPAR 3
2- + 6H 2 O = 2Al(OH) 3 ↓ + 2H 2 C O 3
1. lpp
Rakstot elementu atomu elektroniskās formulas, norādiet enerģijas līmeņus (galvenā kvantu skaitļa vērtības n skaitļu veidā - 1, 2, 3 utt.), enerģijas apakšlīmeņi (orbitālās kvantu skaitļu vērtības l burtu veidā - s, lpp, d, f) un skaitlis augšpusē norāda elektronu skaitu noteiktā apakšlīmenī.
Pirmais elements tabulā ir D.I. Mendeļejevs ir ūdeņradis, tātad atoma kodola lādiņš N vienāds ar 1, atomam ir tikai viens elektrons s-pirmā līmeņa apakšlīmenis. Tāpēc ūdeņraža atoma elektroniskajai formulai ir šāda forma:
Otrais elements ir hēlijs, tā atomam ir divi elektroni, tāpēc hēlija atoma elektroniskā formula ir 2 Nav 1s 2. Pirmais periods ietver tikai divus elementus, jo pirmais enerģijas līmenis ir piepildīts ar elektroniem, kurus var aizņemt tikai 2 elektroni.
Trešais elements kārtībā - litijs - jau atrodas otrajā periodā, tāpēc tā otrais enerģijas līmenis sāk piepildīties ar elektroniem (par to mēs runājām iepriekš). Otrā līmeņa piepildīšana ar elektroniem sākas ar s-apakšlīmenis, tāpēc litija atoma elektroniskā formula ir 3 Li 1s 2 2s 1. Berilija atoms ir pabeigts, piepildoties ar elektroniem s- apakšlīmenis: 4 Ve 1s 2 2s 2 .
Nākamajos 2. perioda elementos otrais enerģijas līmenis turpina būt piepildīts ar elektroniem, tikai tagad tas ir piepildīts ar elektroniem r- apakšlīmenis: 5 IN 1s 2 2s 2 2r 1 ; 6 AR 1s 2 2s 2 2r 2 … 10 Ne 1s 2 2s 2 2r 6 .
Neona atoms pabeidz piepildīšanos ar elektroniem r-apakšlīmenis, šis elements beidz otro periodu, tam ir astoņi elektroni, kopš s- Un r-apakšlīmeņi var saturēt tikai astoņus elektronus.
3. perioda elementiem ir līdzīga trešā līmeņa enerģijas apakšlīmeņu aizpildīšanas secība ar elektroniem. Dažu šī perioda elementu atomu elektroniskās formulas ir šādas:
11 Na 1s 2 2s 2 2r 6 3s 1 ; 12 Mg 1s 2 2s 2 2r 6 3s 2 ; 13 Al 1s 2 2s 2 2r 6 3s 2 3lpp 1 ;
14 Si 1s 2 2s 2 2r 6 3s 2 3lpp 2 ;…; 18 Ar 1s 2 2s 2 2r 6 3s 2 3lpp 6 .
Trešais periods, tāpat kā otrais, beidzas ar elementu (argonu), kas ir pilnībā piepildīts ar elektroniem r-apakšlīmenis, lai gan trešais līmenis ietver trīs apakšlīmeņus ( s, r, d). Saskaņā ar iepriekš minēto enerģijas apakšlīmeņu piepildīšanas secību saskaņā ar Klečkovska noteikumiem, 3. apakšlīmeņa enerģija d vairāk 4. apakšlīmeņa enerģijas s tāpēc kālija atoms blakus argonam un kalcija atoms aiz tā ir piepildīti ar elektroniem 3 s– ceturtā līmeņa apakšlīmenis:
19 UZ 1s 2 2s 2 2r 6 3s 2 3lpp 6 4s 1 ; 20 Ca 1s 2 2s 2 2r 6 3s 2 3lpp 6 4s 2 .
Sākot no 21. elementa - skandija, 3. apakšlīmenis elementu atomos sāk piepildīties ar elektroniem d. Šo elementu atomu elektroniskās formulas ir:
21 Sc 1s 2 2s 2 2r 6 3s 2 3lpp 6 4s 2 3d 1 ; 22 Ti 1s 2 2s 2 2r 6 3s 2 3lpp 6 4s 2 3d 2 .
24. elementa (hroma) un 29. elementa (vara) atomos tiek novērota parādība, ko sauc par elektrona “noplūdi” vai “atteici”: elektrons no ārējā 4. s– apakšlīmenis “krīt” par 3 d– apakšlīmenis, aizpildot to līdz pusei (hromam) vai pilnībā (varam), kas veicina lielāku atoma stabilitāti:
24 Kr 1s 2 2s 2 2r 6 3s 2 3lpp 6 4s 1 3d 5 (nevis...4 s 2 3d 4) un
29 Cu 1s 2 2s 2 2r 6 3s 2 3lpp 6 4s 1 3d 10 (nevis...4 s 2 3d 9).
Sākot no 31. elementa - gallija, turpinās 4. līmeņa piepildīšanās ar elektroniem, tagad - r- apakšlīmenis:
31 Ga 1s 2 2s 2 2r 6 3s 2 3lpp 6 4s 2 3d 10 4lpp 1 …; 36 Kr 1s 2 2s 2 2r 6 3s 2 3lpp 6 4s 2 3d 10 4lpp 6 .
Šis elements noslēdz ceturto periodu, kas jau ietver 18 elementus.
Līdzīga enerģijas apakšlīmeņu piepildīšanas kārtība ar elektroniem notiek 5. perioda elementu atomos. Pirmajiem diviem (rubidijs un stroncijs) tas ir piepildīts s– 5. līmeņa apakšlīmenis, nākamajiem desmit elementiem (no itrija līdz kadmijam) tiek aizpildīts d– 4.līmeņa apakšlīmenis; Periodu pabeidz seši elementi (no indija līdz ksenonam), kuru atomi ir piepildīti ar elektroniem r– ārējā, piektā līmeņa apakšlīmenis. Periodā ir arī 18 elementi.
Sestā perioda elementiem šī aizpildīšanas kārtība tiek pārkāpta. Perioda sākumā, kā parasti, ir divi elementi, kuru atomi ir piepildīti ar elektroniem s– ārējā, sestā, līmeņa apakšlīmenis. Nākamais elements aiz tiem, lantāns, sāk piepildīties ar elektroniem d– iepriekšējā līmeņa apakšlīmenis, t.i. 5 d. Tas pabeidz pildījumu ar elektroniem 5 d-apakšlīmenis apstājas un nākamie 14 elementi – no cērija līdz lutecijam – sāk pildīties f-4.līmeņa apakšlīmenis. Visi šie elementi ir iekļauti vienā tabulas šūnā, un tālāk ir izvērsta šo elementu rinda, ko sauc par lantanīdiem.
Sākot no 72. elementa - hafnija - līdz 80. elementam - dzīvsudrabam, piepildīšanās ar elektroniem turpinās 5 d-apakšlīmenis, un periods, kā parasti, beidzas ar sešiem elementiem (no tallija līdz radonam), kuru atomi ir piepildīti ar elektroniem r– ārējā, sestā, līmeņa apakšlīmenis. Šis ir lielākais periods, ieskaitot 32 elementus.
Septītā, nepilnīgā, perioda elementu atomos ir redzama tāda pati apakšlīmeņu aizpildīšanas secība, kā aprakstīts iepriekš. Mēs ļaujam studentiem to rakstīt pašiem. elektroniskās formulas 5. – 7. perioda elementu atomi, ņemot vērā visu iepriekš minēto.
Piezīme:dažos mācību grāmatas pieļaujama cita elementu atomu elektronisko formulu rakstīšanas secība: nevis to aizpildīšanas secībā, bet gan atbilstoši tabulā norādītajam elektronu skaitam katrā enerģijas līmenī. Piemēram, arsēna atoma elektroniskā formula var izskatīties šādi: Kā 1s 2 2s 2 2r 6 3s 2 3lpp 6 3d 10 4s 2 4lpp 3 .
Elektroniskā konfigurācija atoms ir formula, kas parāda elektronu izvietojumu atomā pa līmeņiem un apakšlīmeņiem. Izpētot rakstu, uzzināsiet, kur un kā atrodas elektroni, iepazīsieties ar kvantu skaitļiem un varēsiet konstruēt atoma elektronisko konfigurāciju pēc tā skaita raksta beigās ir elementu tabula.
Kāpēc pētīt elementu elektronisko konfigurāciju?
Atomi ir kā konstrukcijas komplekts: ir noteikts skaits detaļu, tās atšķiras viena no otras, bet divas viena veida daļas ir absolūti vienādas. Bet šis konstrukcijas komplekts ir daudz interesantāks par plastmasas, un lūk, kāpēc. Konfigurācija mainās atkarībā no tā, kurš atrodas tuvumā. Piemēram, skābeklis blakus ūdeņradim pārvēršas ūdenī, nātrija tuvumā pārvēršas gāzē, un dzelzs tuvumā pilnībā pārvērš rūsā.
Lai atbildētu uz jautājumu, kāpēc tas notiek, un prognozētu atoma uzvedību blakus citam, ir jāizpēta elektroniskā konfigurācija, kas tiks apspriesta tālāk.
Cik elektronu ir atomā? Atoms sastāv no kodola un elektroniem, kas rotē ap to, kodols sastāv no protoniem un neitroniem. Neitrālā stāvoklī katram atomam ir elektronu skaits, kas vienāds ar protonu skaitu tā kodolā. Tiek norādīts protonu skaits sērijas numurs
elementam, piemēram, sēram, ir 16 protoni - periodiskās tabulas 16. elements. Zeltā ir 79 protoni - 79. periodiskās tabulas elements. Attiecīgi sēram neitrālā stāvoklī ir 16 elektroni, bet zeltā ir 79 elektroni.
Kur meklēt elektronu?
- Novērojot elektronu uzvedību, tika iegūti noteikti modeļi, tie ir aprakstīti ar kvantu skaitļiem, kopā ir četri:
- Galvenais kvantu skaitlis
- Orbitālais kvantu skaitlis
- Magnētiskais kvantu skaitlis
Griezuma kvantu skaitlis
Orbitāls
Tālāk vārda orbīta vietā izmantosim terminu “orbitāle” ir aptuveni elektrona viļņu funkcija, tā ir apgabals, kurā elektrons pavada 90% sava laika.
N - līmenis
L - apvalks
M l - orbitālais skaitlis
M s - pirmais vai otrais elektrons orbitālē
Orbitālais kvantu skaitlis l Elektronu mākoņa izpētes rezultātā tika konstatēts, ka atkarībā no enerģijas līmenis
, mākonim ir četras pamatformas: bumba, hantele un divas citas sarežģītākas formas.
Enerģijas palielināšanas secībā šīs formas sauc par s-, p-, d- un f-apvalku.
Katram no šiem apvalkiem var būt 1 (uz s), 3 (uz p), 5 (uz d) un 7 (uz f) orbitāles. Orbitālais kvantu skaitlis ir apvalks, kurā atrodas orbitāles. Orbitālajam kvantu skaitlim s, p, d un f orbitālēm ir attiecīgi vērtības 0, 1, 2 vai 3.
Uz s-čaulas ir viena orbitāle (L=0) - divi elektroni
Uz p-čaulas (L=1) atrodas trīs orbitāles – seši elektroni
Uz d-čaulas (L=2) ir piecas orbitāles – desmit elektroni
Uz f-čaulas (L=3) atrodas septiņas orbitāles – četrpadsmit elektroni
Apsveriet d-shell:
D-apvalks atbilst vērtībai L=2, tas ir, piecas orbitāles (-2,-1,0,1 un 2), pirmie pieci elektroni aizpilda apvalku, ņemot vērtības M l =-2, M l = -1, M l = 0, M l = 1, M l = 2.
Griezuma kvantu skaitlis m s
Spins ir elektrona griešanās virziens ap savu asi, ir divi virzieni, tāpēc spina kvantu skaitlim ir divas vērtības: +1/2 un -1/2. Vienā enerģijas apakšlīmenī var būt tikai divi elektroni ar pretējiem spiniem. Griezuma kvantu skaitlis ir apzīmēts ar m s
Galvenais kvantu skaitlis n
Galvenais kvantu skaitlis ir enerģijas līmenis pie šobrīd ir zināmi septiņi enerģijas līmeņi, katrs apzīmēts ar arābu cipariem: 1,2,3,...7. Apvalku skaits katrā līmenī ir vienāds ar līmeņa numuru: pirmajā līmenī ir viens apvalks, otrajā ir divi utt.
Elektronu numurs

Tātad jebkuru elektronu var aprakstīt ar četriem kvantu skaitļiem, šo skaitļu kombinācija ir unikāla katrai elektrona pozīcijai, ņemam pirmo elektronu, zemākais enerģijas līmenis ir N = 1, pirmajā līmenī ir viens apvalks, pirmajam apvalkam jebkurā līmenī ir bumbiņas forma (s -shell), t.i. L=0, magnētiskajam kvantu skaitlim var būt tikai viena vērtība, M l =0 un spins būs vienāds ar +1/2.
Ja ņemam piekto elektronu (lai kurā atomā tas būtu), tad galvenie kvantu skaitļi tam būs: N=2, L=1, M=-1, spin 1/2.
Algoritms elementa elektroniskās formulas sastādīšanai:
1. Nosakiet elektronu skaitu atomā, izmantojot ķīmisko elementu periodisko tabulu D.I. Mendeļejevs.
2. Izmantojot perioda numuru, kurā atrodas elements, nosaka enerģijas līmeņu skaitu; elektronu skaits pēdējā elektroniskajā līmenī atbilst grupas numuram.
3. Sadaliet līmeņus apakšlīmeņos un orbitālēs un piepildiet tos ar elektroniem saskaņā ar orbitāļu aizpildīšanas noteikumiem: Jāatceras, ka pirmajā līmenī ir ne vairāk kā 2 elektroni 1s 2 s, otrajā - ne vairāk kā 8 (divi un seši r: 2s 2 2p 6 s), trešajā - ne vairāk kā 18 (divi lpp, seši , un desmit).
- d: 3s 2 3p 6 3d 10 n Galvenais kvantu skaitlis
- jābūt minimālam. Vispirms jāaizpilda s- apakšlīmenis, tadр-, d- b f-
- apakšlīmeņi.
- Elektroni aizpilda orbitāles orbitāļu enerģijas pieauguma secībā (Kļečkovska likums).
- Apakšlīmenī elektroni vispirms pa vienam ieņem brīvās orbitāles un tikai pēc tam veido pārus (Hunda likums).
Vienā orbitālē nevar būt vairāk par diviem elektroniem (Pauli princips).
1. Izveidosim slāpekļa elektronisko formulu. Slāpeklis ir 7. numurs periodiskajā tabulā.

2. Izveidosim argona elektronisko formulu. Argons ir 18. numurs periodiskajā tabulā.
1s 2 2s 2 2p 6 3s 2 3p 6.

3. Izveidosim hroma elektronisko formulu. Hroms ir 24. numurs periodiskajā tabulā.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5

Cinka enerģijas diagramma.
4. Izveidosim elektronisku formulu cinkam. Cinks ir 30. numurs periodiskajā tabulā.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10
Lūdzu, ņemiet vērā, ka daļa no elektroniskās formulas, proti, 1s 2 2s 2 2p 6 3s 2 3p 6, ir argona elektroniskā formula.
Cinka elektronisko formulu var attēlot šādi: