12884 0
در طی هیستروسکوپی در نیمه اول مرحله تکثیر (تا روز هفتم سیکل)، آندومتر رنگ پریده، نازک، با خونریزی های کوچک و نواحی صورتی کم رنگ منفرد از آندومتر رد نشده است. دهان ها لوله های فالوپبه خوبی قابل تشخیص
در نیمه دوم مرحله تکثیر (از روز نهم سیکل)، اندومتر رنگ پریده است. رنگ صورتیضخیم، عروق تلفظ نمی شود. بعداً چین های طولی یا عرضی ضخیم شده در نواحی خاصی مشخص می شوند.
در مرحله ترشح، آندومتر رنگ مایل به زرد، غلیظ شده است. چینهایی که بهویژه در یک سوم بالایی بدنه رحم به خوبی بیان میشوند، شناسایی میشوند. 2-3 روز قبل از قاعدگی، آندومتر قرمز با نواحی رد بنفش تیره است. منافذ لوله های فالوپ ممکن است توسط چین های آندومتر پنهان شوند.
2-3 روز اول در طول قاعدگی، حفره رحم با لایه های رد شده آندومتر پر می شود: در یک سوم بالایی به رنگ بنفش تیره، در یک سوم پایین و میانی صورتی کم رنگ است.
در طی دوره پس از یائسگی، هیستروسکوپی تصویری از آتروفی آندومتر را نشان می دهد. در این حالت آندومتر نازک شده و رنگ پریده ای دارد.
در طی کولپوسکوپی، غشای مخاطی دهانه رحم صاف، براق و صورتی است.
در زنان یائسه، نازک شدن اپیتلیوم به طور معمول تشخیص داده می شود که از طریق آن عروق قابل مشاهده هستند.
در طول لاپاراسکوپی، رحم بدون تغییر با صفاق براق پوشیده شده است، دارای سطح صاف و شکل مشخص با تقارن نسبت به صفحه طولی است.
با هیستروسالپنگوگرافی، سایه حفره رحم به شکل مثلث با اضلاع کمی مقعر و خطوط صاف و یکنواخت است. قاعده مثلث رو به بالا و راس رو به پایین است.
گوشه های فوقانی مربوط به دهانه لوله های فالوپ است، گوشه پایین مربوط به دهانه داخلی کانال دهانه رحم است. حفره رحم 4 تا 6 میلی لیتر مایع کنتراست را در خود جای می دهد.
با سونوگرافی، خطوط یک رحم طبیعی شفاف و صاف، بیضی یا گلابی شکل است. تراکم اکو آندومتر بیشتر از تراکم اکو میومتر است که بسته به فاز تغییر نمی کند. چرخه قاعدگی. ساختار پژواک میومتر بدون تغییر به دلیل بسیاری از سیگنال های اکو نقطه ای و خطی به خوبی پراکنده شده است.
آندومتر به عنوان یک تشکیل اکو مثبت که خطی (پس از پایان خونریزی قاعدگی)، بیضی یا قطره ای شکل است، تعریف می شود. بلافاصله پس از پایان سیکل قاعدگی، آندومتر را می توان به شکل نوار اکو مثبت به ضخامت 1-2 میلی متر ردیابی کرد.

در روزهای 8-10 چرخه (وسط مرحله تکثیر)، اندومتر تا حدودی ضخیم می شود، به طور متوسط تا 8 میلی متر (از 5 تا 10 میلی متر). ساختار اکو در مقایسه با دوره قبل تقریباً بدون تغییر باقی مانده است.

در مرحله تکثیر اواخر (11-14 روز)، علاوه بر ضخیم شدن بیشتر، به طور متوسط تا 11 میلی متر (از 7 تا 14 میلی متر)، اکوژنیسیته اندومتر شروع به افزایش اندکی می کند و نزدیک به میانگین می شود.

در مرحله ترشح اولیه (روزهای 15-18)، سرعت رشد آندومتر کاهش می یابد، ضخامت آن به 12 میلی متر می رسد. اکوژنیسیته آندومتر همچنان از محیط به مرکز افزایش مییابد، در نتیجه قطعه مرکزی هیپواکوی شکل قطرهای به خود میگیرد. بخش گستردهدر ناحیه فوندوس رحم به سمت دهانه رحم باریک می شود). در طول این مرحله، خط هایپراکوی در مرکز دیگر به وضوح قابل مشاهده نیست.

در مرحله اواسط ترشح (روزهای 19-23)، آندومتر به حداکثر ضخامت خود می رسد - به طور متوسط 14 میلی متر (از 12 تا 18 میلی متر). اکوژنیسیته آندومتر حتی بیشتر می شود.

در روزهای 24-27 چرخه (دیر ترشح)، ضخامت اندومتر اندکی کاهش می یابد - به طور متوسط به 12 میلی متر (از 10 تا 17 میلی متر). یکی از ویژگی های این دوره اکوژنیسیته بالای آندومتر در ترکیب با ساختار داخلی ناهمگن آن است که به همین دلیل خط بسته شدن متوقف می شود.

در طول قاعدگی، یک نوار نازک هایپراکوی یا اکوساختارهای هیپراکوی (لخته خون) در حفره رحم تشخیص داده می شود. گاهی اوقات به دلیل محتوای اکو منفی، حفره کمی گشاد شده به نظر می رسد.

حفره رحم در پس از یائسگی یک M-echo به شکل یک خط هایپراکوی نازک است که معمولاً 1-2 میلی متر (نه بیشتر از 4-5 میلی متر) ضخامت دارد.

هنگامی که توموگرافی مغناطیسی هسته ای (NMT) در نیمه اول چرخه، آندومتر در بخش ساژیتال میانی به عنوان یک خط نازک (تا 3 میلی متر) تعیین می شود، میومتر مانند یک ساختار همگن با خطوط صاف به نظر می رسد.

در نیمه دوم چرخه، آندومتر به عنوان یک ساختار نسبتاً همگن با ضخامت متوسط 7 میلی متر، شدیدتر از میومتر دیده می شود.

در دوره پس از یائسگی، توموگرام کاهش حجم رحم را با کاهش شدت تصویر میومتر نشان می دهد، در حالی که آندومتر، به طور معمول، تجسم نمی شود.

دهانه رحم در توموگرام به عنوان یک ناحیه استوانه ای غیر شدید با یک ناحیه شفاف تعریف می شود. طرح کلی صافکه ساختار و حفره آن با بدنه رحم مطابقت دارد. سونوگرافی معمولا کانال دهانه رحم را تجسم نمی کند.
V.N. سروف، I.N. زونیگورودسکی
Dueholm، C. Møller، S. Rydbjerg، E. S. Hansen، G. Ørtoft
P.G.Leone، D.Timmerman، T.Bourne، L.Valentin، E.Epstein، S.R.Goldstein، H.Marret، A.K.Parsons، B.Gull، O.Istre، W.Sepulveda، E.Ferrazzi، T.Van den Bosch
ترانس واژینال معاینه سونوگرافیاین دارد پراهمیتدر تشخیص سرطان آندومتر در زنان مبتلا به خونریزی پس از یائسگی. زنان با ضخامت آندومتر ≤ 4 میلیمتر که با اسکن ترانس واژینال اندازهگیری میشود، در صورت عدم استفاده از درمان جایگزینی هورمونی، در معرض خطر کم ابتلا به سرطان آندومتر (1 در 100 مورد) هستند. هورمون درمانی، 1 در 1000 اگر در حال درمان هستند). زنان با خونریزی پس از یائسگی و ضخامت آندومتر ≥ 5 میلی متر دارند ریسک بالاسرطان آندومتر (1 مورد از 4 مورد)، بنابراین لازم است یک خراش داخل رحمی با کیفیت بالا برای تجزیه و تحلیل بافت شناسی. سونوگرافی می تواند اطلاعاتی در مورد خطرات فردی ارائه دهد نئوپلاسم های بدخیمدر زنان یائسه با خونریزی و ضخامت آندومتر ≥ 5 میلی متر.
مطالعه ما شامل زنانی با خونریزی پس از یائسگی و ضخامت آندومتر ≥ 5 میلیمتر بود که توسط پروب ترانس واژینال اندازهگیری شد. این مطالعه در بیمارستان دانشگاه آرهوس، دانمارک، بین نوامبر 2010 و فوریه 2012 انجام شد. همه زنان تحت اسکن ترانس واژینال (TVS) و سونوگرافی انفوزیون ژل (GIS) قرار گرفتند، همه آنها برای هیستروسکوپی با بیوپسی رزکتوسکوپی و کورتاژ اضافی برنامه ریزی شدند. آسیب شناسی داخل رحمی (جدول 1).
میز 1. طرح انتخاب بیمار برای مطالعه
اسکن ترانس واژینال (TVS)
TVS بر اساس پروتکل اسکن بر روی یک Voluson E8 Expert مجهز به سنسور اندواژینال (6-12 مگاهرتز) انجام شد. پارامترهای داپلر از قبل تنظیم و استاندارد شده بودند (فرکانس 6 مگاهرتز، افزایش توان داپلر 50، محدوده دینامیکی 10 دسی بل، پایداری 2، رنگ نقشه 1، فیلتر 3).
اسکن TVS شامل ارزیابی بصری پارامترهای زیر بود که مشخص شد گروه بین المللیآنالیز تومور آندومتر (IETA): ضخامت آندومتر، اکوژنیسیته آن (هیپر، هیپو، و ایزواکویک، همنو/هتروژن)، جزء کیستیک (بله/خیر)، در صورت وجود، سپس محدودیتهای صاف یا ناهموار، مرزهای آندومتر (صاف یا ناهموار) ، همگون-/ناهمگن)، خط بسته (بله/خیر)، قطع شده (بله/خیر)).
تجزیه و تحلیل پاور داپلر شامل ارزیابی بصری پارامترهای زیر بود: عروق (حال (بله / خیر)، وجود یک رگ غالب (بله / خیر)، اگر یک رگ غالب وجود دارد، سپس یک (بله / نه) یا دو (بله) / نه)، منشاء (کانونی / چند کانونی) عروق چندگانه (بله / خیر)، در صورت وجود شاخه ها، سپس دستور داده شده / نامنظم، جهت دایره ای عروق (بله / خیر) ما به صورت ذهنی ارزیابی کردیم: بزرگ؛ عروق (بله/خیر)، داپلر رنگی (بله/خیر)، تراکم عروقی (بله/خیر).
سونوگرافی انفوزیون ژل (GIS)
GIS پس از TVS انجام شد. ما از یک کاتتر استریل انعطاف پذیر کوچک مجهز به یک سرنگ 10 میلی لیتری حاوی Instillagel® (E.Tjellesen A/S, Lynge, Denmark) استفاده کردیم که در حفره رحم قرار داده شد. در بیماران مبتلا به انسداد دهانه رحم از دیلاتور کوچک هگار استفاده کردیم. ژل تحت کنترل اولتراسوند به داخل حفره رحم وارد شد.
سپس حفره رحم در صفحات ساژیتال و عرضی اسکن شد و پارامترهای مشابه برای TVS های معمولی ارزیابی شد. موارد زیر نیز ارزیابی شدند: وجود تشکیل، محل آن و درصد آسیب آندومتر (یعنی ≤ 25٪ از سطح آسیب دیده است) (بله/خیر). ساختار سطحی آسیب محلی (یکنواخت / ناهموار)؛ ساختار سطح کلی آندومتر (صاف، پولیپوید، ناهموار).
هیستروسکوپی
هیستروسکوپی سرپایی در تمام بیماران با استفاده از موضعی یا انجام شد بیهوشی عمومی. در 112 بیمار، هیستروسکوپی بلافاصله پس از سونوگرافی و در سایر بیماران در ویزیت بعدی در عرض 3 هفته پس از معاینه سونوگرافی انجام شد. در طول هیستروسکوپی، تلاش برای برداشتن تمام بافت از حفره رحم انجام شد. سه تا پنج نمونه آندومتر از یک بیمار جمع آوری شد.
محاسبه خطر ابتلا به سرطان آندومتر با استفاده از سیستم امتیازدهی
(امتیاز خطر ابتلا به سرطان آندومتر (امتیاز REC))
بر اساس تجزیه و تحلیل ما، ما یک سیستم امتیازدهی خطر برای سرطان آندومتر ایجاد کردیم (شکل 1). سیستم امتیازدهی شامل شاخص توده بدن (≥30 = 1 امتیاز)، ضخامت آندومتر (≥10mm = 1 امتیاز)، (≥15mm = 1 امتیاز)، وجود عروقی، عروق غالب (حال حاضر = 1 امتیاز)، عروق متعدد (حال حاضر). = 1 امتیاز)، عروق بزرگ (حال حاضر = 1 نقطه) و عروق متراکم (حالا = 1 نقطه)، ناحیه اندومیوتریال ناپیوسته (حالا = 1 نقطه) و سطح ناهموار آندومتر در GIS (حالا = 1 نقطه). افزودن این مقادیر امتیاز خطر سرطان آندومتر را ایجاد می کند. امتیاز 3 برای TVS یا 4 برای GIS نتایج اسکن خوبی را نشان داد و به درستی تشخیص داده شد سطح بالاتوسعه سرطان آندومتر در حدود 90٪ از همه بیماران.

عکس. 1. نمایش شماتیک تعیین خطر ابتلا به سرطان آندومتر با استفاده از یک سیستم امتیازدهی.
پارامترهای معاینه سونوگرافی اندومتر توسط گروه بین المللی آنالیز تومور اندومتر (IETA) تعیین شد.
ضخامت اندومتر در صفحه ساژیتال اندازه گیری می شود. کولیس ها باید در سطح مشترک آندومتر-میومتر، عمود بر خط وسط آندومتر قرار گیرند (شکل 2). هنگامی که مایع وجود دارد، سپس ضخامت بخش های جداگانه آندومتر اندازه گیری می شود و مجموع آنها ثبت می شود (شکل 2b).

شکل 2. تصویر شماتیک و سونوگرافی اندازه گیری اندومتر به طور معمول (الف) و در حضور مایع داخل رحمی (ب).
اکوژنیسیته آندومتر در مقایسه با اکوژنیسیته میومتر به صورت هایپراکوئیک، ایزواکوئیک یا هیپواکوئیک ارزیابی می شود.
همگنی آندومتر با ساختار آن ارزیابی می شود. آندومتر "همگن" همگن است و ساختاری سه لایه دارد (شکل 3). آندومتر "ناهمگن" زمانی توصیف می شود که ناهمگنی در ساختار، عدم تقارن یا وجود داشته باشد. تشکیلات کیستیک(شکل 4).

شکل 3. آندومتر "همگن": (الف) نمایش شماتیک یک آندومتر سه لایه، (ب) هیپواکویک، (ج) هایپراکویک، (د) ایزواکویک.
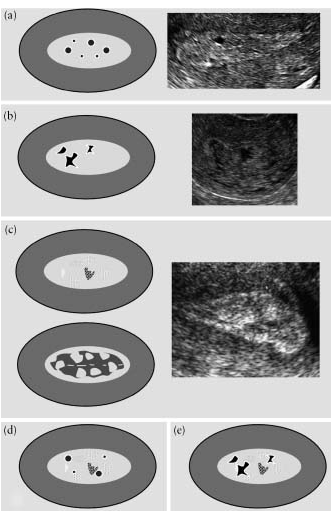
شکل 4. آندومتر "ناهمگن": تشکیلات کیستیک با لبه های صاف در برابر یک پس زمینه همگن (a)، تشکیلات کیستیک با لبه های ناهموار در یک زمینه همگن (ب)، یک زمینه ناهمگن بدون مناطق کیستیک (c)، تشکیلات کیستیک با لبه های صاف مشاهده می شود. در یک پس زمینه ناهمگن (d) و در یک زمینه ناهمگن، تشکیلات کیستیک با لبه های ناهموار (e) وجود دارند.
اگر خط بسته شدن لایه های آندومتر مستقیم باشد، آندومتر «خطی» در نظر گرفته می شود و اگر خط بسته به صورت «متصل» یا «قطع» یا کاملاً وجود نداشته باشد، «غیرخطی» در نظر گرفته می شود (شکل 5).
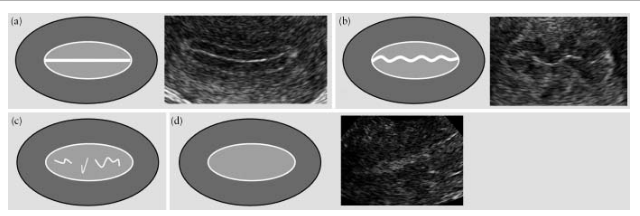
شکل 5. خط بسته شدن لایه های آندومتر: "خطی" (الف)، "متصل" (ب)، "مقطع" (ج) و یکی که قابل مشاهده نیست (د).
ناحیه آندومتر-میومتر بهعنوان «صاف»، «پارهدار»، «منقطع» یا «نامشخص» توصیف میشود (شکل 6).

شکل 6. ناحیه آندومتر-میومتر: «صاف» (الف)، «ناهموار» (ب)، «منقطع» (ج) و «نامشخص» (د).
مایع داخل رحمی به عنوان اکوژنیسیته آنکوئیک، ایزواکوئیک یا مختلط توصیف می شود (شکل 7).

شکل 7. مایع داخل رحمی: (الف) هیپواکویک، (ب) ایزواکوئیک، (ج) اکوژنیک مختلط.
ارزیابی داپلر
تنظیمات داپلر باید برای اطمینان از حداکثر حساسیت تنظیم شود (فرکانس اولتراسوند حداقل 5.0 مگاهرتز، فرکانس تکرار پالس (PRF) 0.3-0.9 کیلوهرتز، فیلتر دیواره رگ 30-50 هرتز، افزایش رنگ داپلر باید تا زمانی که تمام آثار رنگی ناپدید شوند کاهش یابد).
داپلر با وجود جریان خون نمرهگذاری میشود: زمانی که سیگنالهای رنگی به داخل آندومتر جریان نداشته باشد، نمره ۱ داده میشود، اگر فقط جریان حداقل قابل تشخیص باشد، نمره ۲، در صورت وجود جریان متوسط نمره ۳، و امتیاز 4 زمانی که جریان خون قابل توجهی مشهود است (شکل 8).
بحث
ما یک سیستم امتیازدهی (REC) ساختیم که می تواند به طور موثری خوش خیم و تشکیلات بدخیمآندومتر سیستم امتیاز دهی REC ضایعات را در 9 زن از 10 زن یائسه با ضخامت آندومتر ≥ 5 میلی متر به درستی شناسایی کرد. روش نمره دهی می تواند برای کاهش تعداد روش های تهاجمی انجام شده استفاده شود.
ما از اصطلاحات و طبقه بندی های تعریف شده توسط گروه بین المللی آنالیز تومور اندومتر (IETA) استفاده کردیم که می تواند برای اندازه گیری و توصیف آسیب شناسی واقع در حفره رحم استفاده شود. هدف اصلی این کار ایجاد فهرستی از اصطلاحات و تعاریف است که هم در فعالیت روزانه پزشکان و هم در تحقیقات علمی قابل استفاده باشد.
به گفته V.N. دمیدوف و A.I. گوسا، سونوگرافیآزمایش آندومتر باید در سه روز اول پس از پایان قاعدگی انجام شود، در این زمان آندومتر باید کاملاً همگن و هیپواکو باشد.
در هیپرپلازی غددضخامت آندومتر (GE) 1-1.5 سانتی متر است که به ندرت به 2.0 سانتی متر می رسد. گاهی اوقات یک اثر تقویت صوتی در دیستال GE مشاهده می شود (شکل 1-4). هنگام تجسم مناطق افزایش اکوژنیک در پس زمینه یک آندومتر عملاً بدون تغییر، می توان نتیجه گرفت که هیپرپلازی کانونیآندومتر (شکل).
وضعیت با تشخیص سونوگرافیهیپرپلازی آتیپیک آندومتر (AHE). تعدادی از نویسندگان نشان می دهند که هیچ معیار اکوگرافی خاصی برای تشخیص AGE وجود ندارد. ضخامت آندومتر در این حالت بین 1.5-2.0 سانتی متر است که در برخی موارد به 3.0 سانتی متر می رسد.
همانطور که به درستی توسط V.N. دمیدوف و A.I. گاس، علیرغم تفاوتهای مورفولوژیکی قابلتوجه در پولیپهای آندومتر (غدهای، غدهای-فیبری، فیبری، آدنوماتوز)، تصویر اکوگرافیک آنها اشتراکات زیادی دارد. یک تصویر معمولی اکو از یک پولیپ آندومتر (PE) یک شکل بیضی یا گرد با اکوژنیسیته متوسط یا افزایش یافته با مرز واضح بین پولیپ و بافتهای اطراف است که معمولاً به شکل لبه آنکوئیک است (شکل 7-15).
اندازه پولیپ ها می تواند بسیار متفاوت باشد، از 0.5 سانتی متر تا 4-6 سانتی متر (در مورد PE فیبری غده ای و آدنوماتوز). در حضور PE کوچک (<0.5 см) диагностика затруднена, и, как замечают В.Н. Демидов и А.И. Гус, единственным эхопризнаком может явиться деформация срединной линейной гиперэхогенной структуры М-эхо.
داپلروگرافیبا فرآیندهای هیپرپلاستیک آندومتر. به گفته B.I. Zykin، با GE، جریان خون در داخل غشای مخاطی یا ثبت نشد (در 75-80٪ بیماران)، یا چند مکان رنگی مشاهده شد (شکل 16).
داپلروگرافی رنگی پولیپ های آندومتر یک رگ تغذیه کننده را به شکل "پل رنگی" بین ناحیه زیر و آندومتر نشان داد (شکل 17-18).
شاخص های جریان خون در فرآیندهای هیپرپلاستیک خوش خیم آندومتر با سرعت کم و مقاومت نسبتاً بالا مشخص شدند (شکل 19-21، جدول 1). داده های مشابهی توسط سایر نویسندگان به دست آمد.
جدول شماره 1.شاخص های جریان خون داخل آندومتر در طی فرآیندهای هیپرپلاستیک (B.I. Zykin، 2001).
سرطان آندومتری
تعداد بسیار زیادی از مطالعات به تلاش برای ارتباط بین خطر سرطان آندومتر (EC) با ضخامت M-echo، به ویژه در پس از یائسگی اختصاص داده شده است. بنابراین، A. Kurjak و همکاران ضخامت آندومتر > 8 میلی متر در دوران پیش از یائسگی و > 5 میلی متر در پس از یائسگی را پاتوژنومیک برای EC می دانند. S. S. Suchocki و همکاران. تعدادی از نویسندگان اشاره می کنند که یک مورد سرطان یا هیپرپلازی با ضخامت آندومتر پیدا نکرد توجه ویژهبه ویژگی بسیار کم ضخیم شدن آندومتر به عنوان معیاری برای آندومتریوز آندومتر. بنابراین، با توجه به I. Fistonic و همکاران. در بیماران با خونریزی پس از یائسگی، ضخامت آندومتر: 6.2 میلی متر با آتروفی آندومتر، 12.4 میلی متر با هیپرپلازی ساده، 13.4 میلی متر با هیپرپلازی پیچیده، 14.1 میلی متر با کارسینوما بود. نویسندگان تفاوت معنی داری در ضخامت آندومتر بین گروه های هیپرپلازی و کارسینوم پیدا نکردند. که در آن میانگین سنبیماران مبتلا به کارسینوم به طور معنی داری بالاتر بود (62 سال). باکور و همکاران با استفاده از ضخامت آندومتر 4 میلی متر به عنوان معیار بدخیمی، قادر به تشخیص کارسینوم آندومتر با حساسیت، ویژگی، PCR، PCR 92.9٪، 50.0٪، 24.1٪، 97.6٪ بودند. نویسندگان به این نتیجه رسیدند که در زنان مبتلا به خونریزی پس از یائسگی، ضخامت آندومتر<4 мм позволяет с высокой вероятностью исключить вероятность карциномы, однако толщина 4 мм не добавляет значимой информации о наличии или отсутствии малигнизации.
هنگام تشخیص EC، ارزیابی ساختار اکو داخلی M-echo می تواند نقش مهمی ایفا کند. با توجه به T. Dubinsky و همکاران. آندومتر همگن نازک یک نشانه پیش آگهی یک یافته خوش خیم است، در حالی که تجسم یک اکوساختار ناهمگن همیشه نیاز به بررسی بافت شناسی برای روشن شدن تشخیص دارد. استفاده ترکیبی از سه معیار اکوگرافی (ضخامت 5 میلی متر، کانتور ناهموار، ساختار پژواک ناهمگن) به G. Weber و همکاران اجازه داد. تشخیص کارسینوم آندومتر با حساسیت، ویژگی، PCR، PCR 97٪، 65٪، 80٪، 94٪.
امکان ارزیابی اکوگرافیک تهاجم بدخیم به میومتر مهم است. بنابراین با توجه به F. Olaya و همکاران. هنگام تشخیص تهاجم عمیق کارسینوم آندومتر به میومتر (بیش از 50٪)، حساسیت، ویژگی و دقت اکووگرافی ترانس واژینال 94.1٪، 84.8٪، 88٪ بود. هنگام افتراق درجه تهاجم کارسینوم آندومتر به میومتر (بدون تهاجم، تهاجم به لایه های مجاور آندومتر، تهاجم عمیق)، حساسیت، ویژگی و دقت اکووگرافی ترانس واژینال 66.2٪، 83.1٪، 77.2٪ بود. نتایج به دست آمده با اثربخشی MRI بدون حاجب قابل مقایسه است و کمی کمتر از اثربخشی MRI با کنتراست است.
به ویژه آثاری که نویسندگان آنها مواردی از کارسینوم آندومتر را در زنان یائسه با اندومتر نازک یا حتی غیرمجسم یا با ترکیبی از تصویر اکو آتروفی آندومتر و سرومتر توصیف میکنند (اعتقاد بر این است که تصویر اکو مایع در حفره رحم با 50 درصد موارد سرطان آندومتر همراه است). بنابراین S. Li et al. سرطان آندومتر در 3.9 درصد از بیماران با ضخامت آندومتر مشاهده شد<5мм. По данным М. Briley и соавт. , при постменопаузальном кровотечении у 20% пациенток с невизуализируемым эндометрием имела место карцинома. Авторы считают, что у пациенток с постменопаузальным кровотечением при визуализации тонкого эндометрия (<6мм) биопсии можно избежать, однако утолщенный, и что важно - невизуализируемый эндометрий являются показанием для биопсии. H. Krissi и соавт. описали рак эндометрия при эхокартине атрофии в сочетании с серометрой, считая, что последняя может служить показанием для биопсии, поскольку компрессия стенок матки при серометре может скрывать патологические изменения эндометрия. В то же время R. Bedner и соавт. полагают, что небольшая серометра в постменопаузе (до 5 см3) вряд ли может ассоциироваться с карциномой эндометрия, описывая случай последней с объемом внутриматочной жидкости 12см3.
با حرکت به جزئیات علائم اکو EC، لازم به یادآوری است که دومی به نوع پاتوژنتیک I (PE-I) که در پس زمینه هیپرپلازی آندومتر رخ می دهد و نوع پاتوژنتیک II که در پس زمینه رخ می دهد تقسیم می شود. آتروفی آندومتر (PE-II).
- ضخامت M-echo بزرگ، بیش از نیمی از ضخامت رحم
- ناهمواری و تاری خطوط
- افزایش اکوژنیسیته
- افزایش رسانایی صدا
- ساختار پژواک داخلی ناهمگون
- اجزاء مایع داخلی
- نازک شدن ناهموار میومتر که نشان دهنده تهاجم است
- مایع در حفره رحم. تصویر اکو RE-II کاملاً غیراختصاصی است، اما اگر علائم اکو زیر در خانمی با خونریزی پس از یائسگی یافت شود باید به این نوع شک کرد (شکل 28).
- آندومتر غیر قابل مشاهده
- مایع در حفره رحم.
|
بنابراین، با جمع بندی بخش اختصاص یافته به تشخیص اکوگرافیک EC، نمی توان با B.I موافق نبود. زایکین که معتقد است برای تشخیص سرطان آندومتر شاخص ضخامت تعیین کننده نیست و نتیجه می گیرد که در مرحله حاضر اکووگرافی ترانس واژینال (B-mode) خود را به عنوان روشی برای تشخیص سرطان آندومتر خسته کرده و به سقف دقت رسیده است. 75-85٪.
داپلروگرافی برای RE. همانطور که توسط B.I. Zykin، با RE-I، جریان خون داخل آندومتر در 100٪ بیماران به شکل مکان های رنگی متعدد، اغلب به طور آشفته ای شناسایی شد (شکل 24). شاخص های داپلر با سرعت بالا و مقاومت کم جریان خون مشخص شدند (شکل 25-27، جدول 2). داده های مشابهی توسط اکثر نویسندگانی که با این مشکل سروکار دارند به دست آمده است.
| شکل 26 |
| سرطان آندومتری (I نوع بیماری زا) مقاومت کم جریان خون |
| شکل 27 |
| سرطان آندومتری (I نوع بیماری زا) سرعت جریان خون بالا |
در EC-II، مکان های رنگی در برجستگی مخاط آتروفی شده مشاهده نشد و سرطان تنها با افزایش قابل توجه جریان خون در نواحی زیر آندومتر میومتر خود را نشان داد (شکل 28). بنابراین، تنها معیار اولتراسوند برای مشکوک شدن به بدخیمی آندومتر، ضخامت آندومتر نبود، بلکه جایگاه رنگی غیرطبیعی بود.
جدول 2.شاخصهای جریان خون داخل آندومتر در کارسینوم آندومتر (B.I. Zykin، 2001).
شکی نیست که استفاده گسترده از اکووگرافی ترانس واژینال با وضوح بالا و داپلروگرافی سطح تشخیص زودهنگام EC را به میزان قابل توجهی افزایش می دهد و احتمالاً دفعات کورتاژهای غیر ضروری را در زنان مبتلا به خونریزی پس از یائسگی کاهش می دهد.
- Demidov V.N., Gus A.I. تشخیص سونوگرافی فرآیندهای هیپرپلاستیک و تومور آندومتر در کتاب: راهنمای بالینی برای تشخیص اولتراسوند / ویرایش. Mitkova V.V.، Medvedeva M.V. ت. 3. م.: ویدار، 1997. ص 175-201.
- دمیدوف V.N.، Zykin B.I. تشخیص اولتراسوند در زنان // M. Medicine. 1990.
- مدودف M.V.، Zykin B.I.، Khokholin V.L.، Struchkova N.Yu. تشخیص افتراقی سونوگرافی در زنان // M. Vidar. 1997
- زیکین بی.آی. استانداردسازی مطالعات داپلر در انکولوژی زنان // پایان نامه برای درجه دکتری علوم پزشکی. مسکو. 2001. 275.ص.
- Kurjak A., Kupesic S., (Ed.) اطلس داپلر رنگی ترانس واژینال. چاپ دوم. // گروه انتشارات پارتنون. نیویورک. لندن. 2000. ص161-178.
- Suchocki S., Luczynski K., Szymczyk A., Jastrzebski A., Mowlik R. ارزیابی ضخامت آندومتر با سونوگرافی ترانس واژینال به عنوان یک روش غربالگری در تشخیص زودهنگام سرطان آندومتر // Ginekol-Pol. مه 1998، 69 (5): 279-82.
- Bakour SH.، Dwarakanath LS.، Khan KS.، Newton JR.، Gupta JK. دقت تشخیصی اسکن اولتراسوند در پیش بینی هیپرپلازی آندومتر و سرطان در خونریزی پس از یائسگی // Obstet Gynecol Scand. مه 1999، 78 (5): 447-51.
- Fistonic I.، Hodek B.، Klaric P.، Jokanovic L.، Grubisic G.، Ivicevic Bakulic T. ارزیابی سونوگرافی ترانس واژینال تغییرات پیش بدخیم و بدخیم در آندومتر در خونریزی پس از یائسگی // سونوگرافی J Clin. اکتبر 1997، 25(8): 431-5.
- Dubinsky TJ.، Stroehlein K.، Abu Gazzeh Y.، Parvey HR.، Maklad N پیش بینی بیماری خوش خیم و بدخیم آندومتر: همبستگی هیستروسونوگرافی-پاتولوژیک // رادیولوژی. فوریه 1999، 210 (2): 393-7.
- Weber G., Merz E., Bahlmann F., Rosch B. ارزیابی پارامترهای مختلف تشخیصی سونوگرافی ترانس واژینال در زنان مبتلا به خونریزی پس از یائسگی // Ultrasound Obstet Gynecol. اکتبر 1998، 12 (4): 265-70.
- Olaya F.J.، Dualde D.، Garcia E.، Vidal P.، Labrador T.، Martinez F.، Gordo G. سونوگرافی ترانس واژینال در کارسینوم آندومتر: ارزیابی قبل از عمل از عمق تهاجم میومتر در 50 مورد // Eur J Radiol. فوریه 1998، 26 (3): 274-9.
- مدودف V.M.، Chekalova M.A.، Teregulova L.E. سرطان آندومتر // در کتاب: داپلروگرافی در زنان. ویرایش شده توسط Zykin B.I., Medvedev M.V. چاپ 1. M. RAVUZDPG، زمان واقعی. 2000. صص 145-149.
- Li S., Gao S. ارزش تشخیصی ارزیابی آندومتر با سونوگرافی ترانس واژینال در بیماران مبتلا به خونریزی پس از یائسگی // Chung Hua Fu Chan Ko Tsa Chih. ژانویه 1997، 32 (1): 31-3.
- بریلی ام.، لیندسل DR. نقش سونوگرافی ترانس واژینال در بررسی زنان مبتلا به خونریزی پس از یائسگی // Clin Radiol. ژوئیه 1998، 53 (7): 502-5.
- Krissi H.، Bar Hava I.، Orvieto R.، Levy T.، Ben Rafael Z. کارسینوم آندومتر در یک زن یائسه با آندومتر آتروفیک و مایع داخل حفره ای: گزارش موردی // Eur J Obstet Gynecol Reprod Biol. آوریل 1998، 77 (2): 245-7.
- Bedner R., Rzepka Gorska I. ارزش تشخیصی جمع آوری مایع حفره رحم در تشخیص ضایعات پیش نئوپلاستیک و کارسینوم آندومتر در زنان بدون علامت یائسه // Ginekol Pol. مه 1998، 69 (5): 237-40.
حق چاپ © 2000-2006 "شرکت پزشکی ایسکرا"، Bulanov M.N.
تمامی حقوق محفوظ است. هیچ بخشی از این صفحه (از جمله متن، تصاویر و فایلها) به هیچ وجه بدون اجازه کتبی صاحبان حق چاپ قابل تکثیر نیست.بر اساس آمارهای جهانی، سرطان رحم در بین بیماری های بدخیم رتبه هفتم را دارد. تجزیه و تحلیل وضعیت انکولوژیک در دهه گذشته در روسیه نشان دهنده افزایش مداوم در بروز سرطان آندومتر است که تا سال 2007 جایگاه دوم را در بین تمام تومورهای بدخیم در زنان به خود اختصاص داد. سهم سرطان رحم در ساختار بروز نئوپلاسم های بدخیم در هر 100000 جمعیت زن روسیه در مناطق مختلف از 4.5 تا 22.5 متغیر است. افزایش ثابتی در میزان بروز از 9.8 در سال 1990 به 13.9 در سال 2005 وجود دارد که با رتبه سوم از نظر افزایش بروز نئوپلاسم های بدخیم مطابقت دارد. در حال حاضر، افزایش تعداد موارد تازه تشخیص داده شده سرطان رحم کمتر از تومورهای سینه نیست. در کشورهای جهان سوم، خطر ابتلا به سرطان آندومتر به طور کلی کمتر است، اما میزان مرگ و میر همچنان بالاست. در آمریکای شمالی و اروپا، این بیماری بسیار شایعتر است و شایعترین تومور بدخیم دستگاه تناسلی زنان است و پس از سرطان سینه، ریه و کولون رتبه چهارم را در بین تمام نئوپلاسمهای بدخیم دارد. بروز سرطان آندومتر در سنین 40 تا 54 سالگی به شدت افزایش می یابد و بیشترین میزان بروز آن در سنین 60 تا 64 سالگی است. بروز سرطان آندومتر و پویایی آن در کشورهای مختلف، با در نظر گرفتن تأثیر فرآیندهای مهاجرت و سن، نشان دهنده ویژگی های خاص بیماری و وابستگی وقوع آن به مجموعه ای از علل ماهیت درونی و برون زا است.
در میان عوامل خطر برای ایجاد سرطان رحم، توجه به تعداد کم تولدها یا ناباروری، چاقی، یائسگی دیررس و دیابت شیرین، عمدتاً نوع 2، جلب شده است. در بیشتر موارد، خطر ابتلا به سرطان آندومتر با اشکال مختلف هیپرپلازی آندومتر - 81.3٪، اختلال عملکرد ناشی از سندرم تخمدان پلی کیستیک - 25٪، پولیپوز آندومتر - 5.3-25٪، فیبروم رحم - 1.6-8٪ همراه است. اخیراً، افزایش قابل توجهی در اشکال پیشرفته محلی سرطان آندومتر وجود داشته است که با اقدامات تشخیصی اولیه ناکارآمد همراه است. مسائل روشن کننده تشخیص سرطان آندومتر موضوع مطالعه دقیق است.
در پاتوژنز این بیماری، نظریه تحریک بیش از حد استروژن آندومتر، همراه با کمبود پروژسترون، از اهمیت بالایی برخوردار است. اعتقاد بر این است که قرار گرفتن بیش از حد استروژن می تواند منجر به هیپرپلازی آندومتر شود که می تواند به یک نوع آتیپیک و در 20-25٪ موارد به انتقال به آدنوکارسینوم منجر شود. در عین حال، رابطه موجود بین میزان تکثیر آندومتر و غلظت استروژن در خون تا یک مقدار آستانه مشخص مشاهده می شود و حتی تکثیر شدید در همه موارد با تبدیل بدخیم آندومتر همراه نیست. ارتباط کشف شده بین محتوای استروژن و آسیب DNA در آندومتر طبیعی و بدخیم ما را وادار می کند تا به نقش عوامل ژنتیکی و مورفولوژیکی مولکولی در شکل گیری انواع مختلف سرطان رحم توجه بیشتری داشته باشیم. سرطان آندومتر با ماهیت ناهمگن مشخص می شود، که خود را در سطح عوامل خطر و پاتوژنز آن نشان می دهد، که ویژگی های تشکیل گروه های خطر را برای این بیماری تعیین می کند.
در حال حاضر، برای شناسایی آسیب شناسی آندومتر، کورتاژ تشخیصی حفره رحم، هیستروسکوپی و معاینه سیتولوژی آسپیراسیون و همچنین روش های تشخیصی پرتویی که در این میان سونوگرافی (سونوگرافی) از اهمیت بالایی برخوردار است، استفاده می شود. با این حال، هیچ معیار اکوگرافیک مبتنی بر روششناسی یکسانی برای رشد تومور مهاجم وجود ندارد. معرفی فناوریهای جدید اولتراسوند به برنامههای معاینه یکپارچه بیماران، مانند داپلر پالس، آنژیوگرافی اولتراسوند و بازسازی تصویر سه بعدی، کارایی تشخیص اولیه و نظارت بر بیماران مبتلا به سرطان آندومتر را در فرآیند درمان اختصاصی بهطور چشمگیری افزایش داده است.
هدف از این کار بررسی قابلیتهای سونوگرافی پیچیده با استفاده از داپلر رنگی و (و EC) و بازسازی تصویر سهبعدی در تشخیص اولیه و روشنکننده سرطان آندومتر بود.
مواد و روش ها
ما 139 بیمار 21 تا 87 ساله مشکوک به سرطان آندومتر را در دوره حوالی و پس از یائسگی بررسی کردیم. در 34 بیمار، فرآیندهای هیپرپلاستیک آندومتر، در 105 - فرآیندهای بدخیم آندومتر شناسایی شد. میانگین سنی بیماران مبتلا به پاتولوژی خوش خیم 2/7±6/42 سال و بیماران مبتلا به سرطان آندومتر 7±4/65 سال بود. در تمام موارد، تأیید بافت شناسی تشخیص به دست آمد.
همه بیماران به طور جامع توسط سونوگرافی با استفاده از رویکردهای ترانس شکمی (سنسور محدب 3.5 مگاهرتز) و ترانس واژینال (سنسور 6.5-7 مگاهرتز) بر روی دستگاههای سونوگرافی مدرن Logiq S6 (GE, Healthcare) و Accuvix-XQ (Medison) طبق یک برنامه خاص با استفاده از آخرین تکنیک های اولتراسوند، از جمله سونوگرافی داپلر عروق رحم، گردش رنگ و EC با بازسازی تصویر سه بعدی. در معاینه ترانس شکمی در بیماران با مثانه پر، وضعیت رحم و تخمدان ها بررسی شد، حجم بدن و دهانه رحم و عرض M-echo تعیین شد. در طول سونوگرافی ترانس واژینال (TVUS)، از اندازه گیری داپلر برای اندازه گیری جریان خون و شاخص مقاومت در شریان های رحمی و برای ارزیابی شدت جریان خون داخل تومور استفاده شد. در تمام مراحل مطالعه، وضعیت ساختار اندود و میومتر، ارتباط و همگنی آنها تعیین شد. هنگامی که تغییرات کانونی تشخیص داده شد، اندازه، میزان شیوع و ارتباط آنها با اندامها و ساختارهای اطراف تعیین شد و ارزیابی مقایسهای از ضخامت دیواره رحم در ناحیه تومور و خارج از ناحیه تمرکز تومور انجام شد. در صورت امکان، پارامترهای خطی و حجمی تومور، وضوح خطوط آن به طور دقیق تعیین شد و وضعیت غشای مخاطی مجاور بررسی شد. پارامتر اصلی برای ارزیابی آندومتر، تغییر ضخامت آن است. حجم آندومتر نیز برای تشخیص زودهنگام بیماری استفاده می شود. مقادیر آن در تشخیص افتراقی سرطان و فرآیندهای هیپرپلاستیک خوش خیم از اندازه گیری عرض آندومتر قابل اعتمادتر است. معیار ضایعات بدخیم آندومتر مقادیر حجم آندومتر بیش از 13 سانتی متر مکعب است. این امر 100% حساسیت و 92% قابل پیش بینی بودن تست مثبت را در تشخیص سرطان آندومتر تضمین می کند.
مهمترین خصوصیات یک نئوپلاسم آندومتر درجه و ماهیت عروقی شدن آن بود که در حالت سینه لوپ برای به دست آوردن کاملترین و بصری ترین نمایش ارزیابی شد. یک ارزیابی کیفی از عرضه خون با توجه به تعداد سیگنال های رنگی از عروق نئوپلاسم انجام شد: هیپوواسکولار، عروقی متوسط، هیپرواسکولار. ما از فناوری استفاده کردیم که داده های حجمی را به مجموعه ای از بخش های متوالی تا ضخامت 0.5 میلی متر تبدیل می کرد. انتخاب هدفمند بخشهای خاص از دادههای حجمی سهبعدی، انتخاب بخشهای بهینه بدن و حفره رحم و تخمین اندازههای آنها تا حد امکان دقیق و تعیین ارتباط تغییرات شناساییشده با وضعیت اندامها و بافتهای اطراف امکانپذیر شد. فناوری Volume CT View بر اساس اسکن سه بعدی، امکان ارزیابی خطوط و ساختار آندومتر، ماهیت خون رسانی آن و استفاده از گزینه هیستوگرام، تعیین دقیق شاخص عروقی را ممکن کرد.
توجه ویژهای به ارزیابی عمق تهاجم میومتر، انتقال احتمالی فرآیند بدخیم به کانال گردن رحم و وضعیت غدد لنفاوی منطقهای شد که در تعیین مرحله بیماری و انتخاب تاکتیکهای درمانی بسیار مهم بود.
نتایج و بحث
در نتیجه این مطالعه، فرآیندهای هیپرپلاستیک آندومتر در 34 بیمار شناسایی شد که ما آنها را به شکلهای nosological جداگانه که با توصیههای WHO مطابقت دارند شناسایی کردیم. روی میز شکل 1 توزیع بیماران را بسته به مورفوژنز فرآیندهای هیپرپلاستیک اندومتر شناسایی شده نشان می دهد.
میز 1. توزیع بیماران بر اساس نوع فرآیندهای هیپرپلاستیک آندومتر.
فرآیندهای هیپرپلاستیک آندومتر با اختلالات چرخه قاعدگی مانند منومتروراژی، کم خونی درجه I-II آشکار شد. در مورد پاتولوژی خوش خیم آندومتر، در 24 بیمار (71.4%)، افزایش ضخامت M-echo به طور متوسط با سونوگرافی مقیاس خاکستری 3.2 ± 14.6 میلی متر تعیین شد. با اکووگرافی ترانس واژینال، هیپرپلازی کیستیک غدد به عنوان تشکیل افزایش اکوژنیسیته، یک ساختار همگن، با انکلوزیونهای چند نقطهای هیپو- یا آنکوئیک تا 1.5 میلیمتر، گاهی اوقات با اثر تقویت آکوستیک تعریف شد. با هیپرپلازی غیر معمول، یک ساختار جامد هیپراکوییک ناهمگن در حفره رحم تشخیص داده شد. پولیپ ها به صورت گرد، بیضی یا مستطیلی، در برخی موارد روی یک ساقه بلند، تشکیلات هیپراکویک با اندازه های مختلف، تغییر شکل حفره رحم و به وضوح در برابر پس زمینه محتویات مایع حفره رحم، تعریف می شوند. با استفاده از حالت داپلر پالس، پارامترهای همودینامیک در شریان های رحمی مورد ارزیابی کمی قرار گرفت که عبارت بودند از: MSS - 2.1±9.3 سانتی متر بر ثانیه، شاخص مقاومت - 0.05±0.56.
با استفاده از این تکنیک، جریان خون داخل توموری رنگی در هیپرپلازی کیستیک غده به شکل سیگنال های منفرد از عروق واقع در امتداد محیط ثبت شد. در پولیپ های فیبروگلندولار، جریان خون محیطی وریدی و شریانی نسبتاً مشخص با مقادیر متوسط مقاومت عروق محیطی مشاهده شد. در 2 بیمار مبتلا به هیپرپلازی غدد، هیپرواسکولاریزاسیون شدید آندومتر مشخص شد. در هیپرپلازی آتیپیک، جریان خون داخل توموری مرکزی و محیطی با شدت متوسط ثبت شد. در 5 بیمار مبتلا به هیپرپلازی کیستیک غده و آندومتر آتروفیک، جریان خون ثبت نشد. علائم مشخصه یک نئوپلاسم خوش خیم، حتی در حضور رشدهای چندگانه پولیپوید، حفظ شکل حفره رحم، تعریف واضح کانتور خارجی آندومتر و توزیع یکنواخت عروق میومتر بود (شکل 1 و 2). ).
برنج. 1. TVUS، حالت نقشه برداری انرژی. هیپرپلازی اندومتر کیستیک غددی.

برنج. 2. TVUS، حالت نقشه برداری انرژی. پولیپ آندومتر
پاتولوژی بدخیم آندومتر در 105 بیمار تشخیص داده شد. 80 درصد از افراد مورد بررسی با این آسیب شناسی 50 تا 69 سال سن داشتند که 82 نفر (78 درصد) دارای دگرگونی بدخیم اندومتر همراه با خونریزی پس از یائسگی بودند. معاینه بیماران مشکوک به سرطان آندومتر افزایش ضخامت M-echo را به 18.1±6.7 میلی متر نشان داد. در مرحله Ia، ضخامت M-echo 3.7±11.5 میلیمتر، در مرحله Ib - 8.4±15.8 میلیمتر، در مرحله Ic - 3.4±17 میلیمتر، در مرحله II - 4.1±21 میلیمتر، در مرحله III - 27 ± 27 میلیمتر بود. 2.0 میلی متر، در مرحله IV - بیش از 30 میلی متر. مرحله سرطان رحم بر اساس طبقه بندی بین المللی سرطان (FIGO، 1988) تعیین شد. روی میز 2، مقایسه ای از هیستوتایپ خاص سرطان آندومتر با مرحله بیماری انجام شد.
جدول 2. مقایسه هیستوتیپ و مرحله سرطان آندومتر.
| هیستوتایپ تومور | صحنه | جمع | |||||
|---|---|---|---|---|---|---|---|
| یاا | Ib | مدار مجتمع | II | III | IV | ||
| آدنوکارسینوم: | |||||||
| بسیار متمایز | 12 | 3 | 3 | 4 | 2 | 1 | 25 |
| نسبتاً متمایز شده است | 22 | 6 | 2 | 6 | 6 | 2 | 44 |
| درجه کم | 5 | - | - | 1 | 3 | 1 | 10 |
| سروزی-پاپیلاری | 3 | - | - | 1 | 3 | 1 | 8 |
| سلول شفاف | - | 1 | - | - | - | 1 | 2 |
| کارسینوم سلول سنگفرشی غده ای | 1 | 1 | - | 2 | 1 | - | 5 |
| سارکوم | 2 | - | 1 | 1 | 3 | 2 | 9 |
| آکانتوما | 1 | 1 | - | - | - | - | 2 |
| جمع | 46 | 12 | 6 | 15 | 18 | 8 | 105 |
همانطور که از جدول مشخص است. 2، بیش از 60 درصد از بیماران مبتلا به سرطان رحم مرحله I تشخیص داده شدند که 46 بیمار دارای مرحله Ia بودند. بیماران مبتلا به اشکال شایع بیماری های بدخیم بدن رحم 23٪ را تشکیل می دهند. در اکثر موارد (89 بیمار، 85٪)، آدنوکارسینوم با درجات مختلف تمایز تشخیص داده شد.
در مطالعه ما، درجه تمایز تومور با مرحله بیماری مرتبط است: در آدنوکارسینوم بسیار متمایز، این فرآیند عمدتاً به بدن رحم محدود میشود. آدنوکارسینومهای پاپیلاری و سلولی شفاف با تمایز ضعیف در مراحل II، III و IV با گسترش تومور به خارج از اندام مشاهده شد. مرحله 1 کارسینوم سلول سنگفرشی در 2 بیمار، مراحل II و III - در 3 تشخیص داده شد. ترکیبی از آدنوکارسینوم و سارکوم استرومایی آندومتر در 9 بیمار تشخیص داده شد، که 5 مورد با مراحل III و IV بیماری تشخیص داده شدند. علائم اصلی اولتراسوند سرطان آندومتر در مطالعات ترانس شکمی و ترانس واژینال در حالت B-scan را می توان افزایش M-echo در نظر گرفت که برای این بیمار معمولی نیست، ناهمواری و ناهمگنی آندومتر و همچنین اکوژنیسیته بالاتر آن. ساختار به عنوان یک کل یا تشکیل کانونی شناسایی شده در مقایسه با میومتر بدون تغییر، وجود یک کانتور خارجی ناهموار که به اعماق مختلف نفوذ می کند. در موارد گسترش موضعی قابل توجه تومور، تجسم لبه هیپواکویک در اطراف تومور یا عدم وجود مرز بین کانون تومور و میومتر ممکن است. در مطالعه ما، شاخص رشد تهاجمی (IGI) - تعیین نسبت حجم آندومتر تغییر یافته (AVI) به حجم بدن رحم را ارزیابی کردیم. داده های به دست آمده در جدول ارائه شده است. 3. محاسبه این شاخص ها فقط برای مرحله 1 سرطان آندومتر امکان پذیر بود، زمانی که مرز آندومتر تغییر یافته کاملاً واضح تعریف شده بود (شکل 3).
جدول 3. پارامترهای سونوگرافی رحم و M-echo در سرطان آندومتر در مراحل مختلف.
در مرحله Ia، حجم آندومتر 2.2±4.2 سانتیمتر مکعب، IIR - 4.2±11.9، در مرحله Ib AIE - 4.6±8.3 سانتیمتر مکعب، IIR - 5.4±7.5 سانتیمتر مکعب، در مرحله Ic AIE - 5.3±15.4 سانتیمتر مکعب، IIR - بود. 4.3±2.9. همانطور که در جدول نشان داده شده است. 3 داده ها، با افزایش درجه تهاجم تومور در میومتر، افزایش واضحی در حجم آندومتر و کاهش مقادیر IRI وجود دارد. برای اکثر بیماران مبتلا به سرطان آندومتر، محلی سازی آن مشخصه فوندوس رحم یا یکی از زوایای لوله بود. نکروز تومور با تغییر شکل حفره رحم و وجود مایع در آن در مراحل III و IV فرآیند تعیین شد.
بر اساس داده های ادبیات، ما سه نوع اصلی رشد سرطان مهاجم آندومتر را شناسایی کرده ایم.
- ایجاد چندین کانون تومور بسیار متمایز در پس زمینه فرآیندهای هیپرپلاستیک کل آندومتر.
- ایجاد یک کانون تومور بسیار متمایز، که توسط یک غشای مخاطی هیپرپلاستیک در یک ناحیه کوتاه احاطه شده است.
- ایجاد یک کانون تومور با تمایز متوسط یا ضعیف در پس زمینه یک غشای مخاطی آتروفیک.
شکل اگزوفیتیک رشد تومور در 15 درصد موارد تشخیص داده شد. رشد تومور اگزوفیتیک با عدم تغییر شکل حفره رحم، مرزهای واضح اندو و میومتر یا تشخیص تشکیل در لومن حفره رحم مشخص می شود. در 85 درصد موارد، شکل رشد اندوفیت با تهاجم به میومتر مشاهده شد. نقض یکپارچگی لبه هیپواکوی در سرطان آندومتر نشانه خاصی از تهاجم به میومتر است. رشد تومور اندوفیت منجر به عدم تقارن و تغییر شکل حفره رحم می شود. با یک فرآیند نفوذ عمیق، گزینه دوم در 30٪، گزینه 3 - در 70٪ موارد ذکر شد. سونوگرافی فقط در مراحل اولیه بیماری به وضوح شکل رشد تومور را تعیین کرد. در مرحله Ia سرطان آندومتر، در مورد اولتراسوند در حالت B، یک ساختار هیپراکوییک همگن از M-echo متوسط تعیین شد و در 69.5٪، ناهمگونی ساختار آندومتر به دلیل گنجاندن یک شکل گرد، با خطوط صاف و در برخی موارد نامشخص، اکوژنیسیته را افزایش داد که اندازه متوسط آن 8/3±3/6 میلیمتر بود. مرزهای آندومتر در تمام مشاهدات در مرحله اول بیماری مشخص و یکنواخت تعیین شد.
جدول 4. پارامترهای همودینامیک در آسیب شناسی خوش خیم و بدخیم اندومتر
توجه داشته باشید. * - ر<0,05
در مشاهدات ما، تمایز نوع 1 و 2 توسعه تومور در حالت B معمول فقط در 10 بیمار امکان پذیر بود. در موارد دیگر، به دلیل گسترش موضعی قابل توجه تومور، این تفاوت ها مشخص نشد. با یک فرآیند نفوذ عمیق در مراحل III و IV بیماری، ضخامت M-echo از 27.0 میلی متر فراتر رفت. مرزهای بین تومور و میومتر در همه موارد نامشخص، خطوط ناهموار بود و در 61 بیمار (58.0%) مرزهای تومور تا کانتور بیرونی رحم مشخص نبود. ساختار M-echo در 30.3 درصد موارد هیپراکوییک همگن، در 20.1 درصد - هیپواکوی همگن و در 50 درصد - ناهمگن، عمدتا هایپراکویک بود. اکوساختار تومور نیز میتواند دارای اکوژنیسیته متفاوتی باشد: در 44.6% موارد هیپراکوییک همگن، در 10.4% - هیپواکوییک همگن، در 45.0% - مخلوط بود.
ما شاخصهای کمی همودینامیک را با استفاده از شریانهای رحمی و عروق تومور ارزیابی کردیم. روی میز جدول 4 توصیف مقایسه ای پارامترهای همودینامیک در پاتولوژی های خوش خیم و بدخیم آندومتر را نشان می دهد.
همانطور که از داده های ارائه شده مشاهده می شود، همودینامیک جریان خون منطقه ای در سرطان آندومتر با تمایل به افزایش سرعت جریان خون در عروق رحم و کاهش معنی دار آماری در شاخص مقاومت محیطی در عروق تومور همراه است. ، که می تواند فعالیت جریان خون داخل تومور را مشخص کند. MSS در شریان های رحمی به حجم بدن رحم بستگی دارد که می تواند با وجود فیبروم ها و ماهیت عروقی شدن تومور مرتبط باشد. شاخصهای جریان خون داخل توموری و IR از نظر آماری به هیستوتیپ سرطان آندومتر وابسته نبودند.

برنج. 4. TVUS، حالت نقشه برداری انرژی. سرطان آندومتر مرحله Ia. کانونی از هیپرواسکولاریزاسیون در امتداد دیواره قدامی رحم مشخص می شود.

برنج. 5.

برنج. 6. TVUS، داپلر رنگی، اسکن طولی. مرحله Ia سرطان آندومتر. تشکیل ارتشاحی ساختار هیپراکوئیک در ناحیه فوندوس بدن رحم با کاهش عروق.
هنگام تجزیه و تحلیل ماهیت و درجه عروقی شدن سرطان آندومتر، که با استفاده از حالتهای CDC و EC ارزیابی شد، گزینههای مختلف برای جریان خون داخل آندومتر تعیین شد. عروق پاتولوژیک آندومتر در 92 بیمار (87.6%) مبتلا به سرطان آندومتر رخ داد. در موارد دیگر، حتی در صورت وجود علائم مشخصه اولتراسوند ضایعات بدخیم، جریان خون داخل توموری با استفاده از تکنیکهای مورد استفاده مشاهده نشد. در مورد تومور بدن رحم، سه نوع اصلی خون رسانی (A، B، C) شناسایی شد و وابستگی خاصی از الگوی گردش رنگ و EC با مراحل و اشکال شناسایی شده رشد تومور مشاهده شد. شدت جریان خون در آندومتر و گره تومور، که در حالتهای CDC و EC تعیین میشود، به نوع رشد تومور بستگی دارد و میتواند به وضوح در حالت حلقه سینما ارائه شود. مناطق جریان خون تومور در سرطان آندومتر در بیش از 90 درصد موارد تشخیص داده می شود (شکل 4-8).
مشخص شد که گزینه A مشخصه مرحله Ia است: با انفیلتراسیون میومتر تا عمق 5 میلی متر، که در 33.8٪ موارد مشخص شد و با افزایش ناهموار جریان خون داخل آندومتر به دلیل افزایش موضعی در آن مشخص شد. تعداد لکه های رنگی با شدت رنگ های مختلف، در غیاب جایگاه های رنگی در ناحیه ساب اندومتر. همین نوع مشخصه شکل اگزوفیتیک رشد با نوع داخل توموری نئوواسکولاریزاسیون بود.

برنج. 7. TVUSI، CDC. مرحله چهارم سرطان آندومتر هیپرواسکولاریزاسیون تشکیل یک ساختار ناهمگن در ناحیه زاویه سمت چپ رحم. جریان خون آندومتر و داخل تومور تعیین می شود.

برنج. 8. TVUS، ترکیبی از حالت B و حالت نقشه برداری انرژی. مرحله چهارم سرطان آندومتر تمرکز هیپرواسکولاریزاسیون در امتداد دیواره خلفی رحم با جریان خون آندومتر هیپرواسکولار.
گزینه B (47.6٪) با افزایش کلی در جریان خون داخل آندومتر به دلیل تعداد زیادی از مکان های رنگی به طور آشفته، با افزایش محلی همزمان در تعداد سیگنال های رنگی در ناحیه ساب اندومتر مشخص شد. در 27.5 درصد موارد، عروقی متوسط تومور، همراه با عروق غنی میومتر مشخص شد. این نوع در 78.3 درصد از بیماران مبتلا به سرطان آندومتر به شکل مختلط شناسایی شد.
گزینه C (19.6٪) با افزایش جزئی در جریان خون داخل آندومتر همراه با افزایش کل قابل توجهی در تعداد سیگنال های رنگی در ناحیه ساب اندومتر مشخص شد. این واریانت مشخصه فرم رشد اندوفیت (92.5%) بود و با جریان خون شدید داخل و اطراف تومور همراه بود.
اگرچه هیچ ارتباط مستقیمی بین شدت جریان خون تومور و مرحله بیماری و همچنین درجه تمایز ایجاد نشد، وجود یک منطقه قابل تشخیص از نئوواسکولاریزاسیون با مرحله بالاتری از فرآیند مطابقت دارد. جریان خون هیپوواسکولار و متوسط در آندومتر در بیماران مبتلا به آدنوکارسینوم خوب تمایز یافته مشاهده شد.
در 12.4 درصد موارد، نوواسکولاریزاسیون فرآیند پاتولوژیک ثبت نشد. دلیل این امر می تواند حذف یک تومور کوچک در نتیجه کورتاژ تشخیصی اولیه حفره رحم و در آدنوکارسینوم بسیار متمایز باشد که در پس زمینه آتروفی آندومتر ایجاد شده است.
با ساخت صفحات فرونتال، تعیین دقیق تر وضعیت آندومتر و ایجاد عدم تقارن آن امکان پذیر شد. یک الگوی عروقی نامرتب، که توسط آنژیوگرافی سه بعدی در یک بلوک حجمی، هنگام ترکیب حالتهای اسکن، آشکار شد، یک علامت اضافی مهم از ضایعات بدخیم آندومتر بود. دقیق ترین نتایج در ارزیابی میزان تهاجم کارسینوم آندومتر با استفاده از بازسازی سه بعدی در حالت آنژیوگرافی اولتراسوند به دست می آید (شکل 9-11 یک نشانه مهم از فرآیندهای تهاجمی رایج، وجود مناطق افزایش عروق خونی در ناحیه است). میومتر در مجاورت نواحی تومور.

برنج. 9.سونوگرافی با استفاده از فناوری نمایش چند تکه انجام می شود. با استفاده از مقاطع لایه به لایه، تعیین دقیق ساختار اندومتر و عروق آن ممکن می شود.
قابلیتهای روش اولتراسوند در تشخیص سرطان آندومتر محدودیتهای خود را دارد، زیرا فرآیندهای هیپرپلاستیک و مراحل اولیه بیماری ویژگیهای تشخیصی افتراقی خاصی ندارند. خونریزی رحمی همزمان با تشکیل فیبرین، شناسایی مناطق ضخیم شدن آندومتر را پیچیده می کند. مشکلات خاصی در تعیین عمق تهاجم میومتر در مراحل اولیه سرطان آندومتر در محدوده حداکثر تا 5 میلی متر و همچنین در موارد آدنومیوز همزمان ایجاد می شود. سونوگرافی حجم ضایعات سرطانی را در زنان با گره های میوماتوز زیر مخاطی بزرگ و متعدد که حفره رحم را تغییر شکل می دهند، به درستی تعیین نمی کند.

برنج. 10. TVUS، حالت نقشه برداری انرژی. سونوگرافی با استفاده از فناوری Oblique view انجام می شود. داده های حجمی سه بعدی به ما امکان می دهد وضعیت اندومتر و ماهیت عروق آندومتر و زیر آندومتر را روشن کنیم.

برنج. یازدهحالت بازسازی چند هواپیما. نمای سی تی حجمی. داده های سه بعدی به شما امکان می دهد حجم ها را تا حد امکان دقیق تعیین کنید.
نتیجه گیری
معاینه اولتراسوند با استفاده از داپلر پالس، داپلر رنگی، نقشه انرژی و بازسازی تصویر سه بعدی یک روش بسیار آموزنده برای شفاف سازی غیرتهاجمی تشخیص آسیب شناسی آندومتر است. نتایج بهدستآمده نشاندهنده کارایی بالای روشهای مورد استفاده در تشخیص افتراقی فرآیندهای خوشخیم و بدخیم است. آنژیوگرافی اولتراسوند و بازسازی تصویر سه بعدی برای سرطان آندومتر به دستیابی به اطلاعات اضافی و بسیار مهم در مورد ویژگی های فرآیند تومور، عمق تهاجم تومور به میومتر و ماهیت نئوواسکولاریزاسیون شناسایی شده کمک می کند تا میزان سرطان را پیش بینی کنیم. رشد تومور
استفاده از فن آوری های مدرن اولتراسوند این امکان را فراهم می کند تا مشکلات تشخیص درونی سرطان آندومتر را در یک سطح کیفی و کمی کاملاً جدید حل کند و همچنین بیماران را در روند درمان خاص تحت نظر داشته باشد.
ادبیات
- داویدوف M.I.، Aksel E.M. آمار نئوپلاسم های بدخیم در روسیه و کشورهای CIS در سال 2005 // بولتن مرکز تحقیقات انکولوژی روسیه به نام. N.N. بلوخین RAMS. 2007. T. 18.
- Urmancheeva A.S.، Tyulyandin S.A.، Moiseenko V.M. انکوژنیکولوژی عملی (سخنرانی های منتخب) // M.: انتشارات. "تام سنتر" 2008. 400 ص.
- اشرفیان L.A.، Kharchenko N.V.، Ogryzkova V.L. و سایر اصول مدرن تشخیص اولیه و روشن کننده سرطان آندومتر // انکولوژی عملی. 2004. T. 5. شماره 1.
- دمیدوف V.N.، سه A.I. تشخیص اولتراسوند فرآیندهای هیپرپلاستیک و تومور آندومتر // Ed. Mitkova V.V.، Medvedeva M.V. راهنمای بالینی تشخیص اولتراسوند، 3 جلد M.: Vidar. 1376. صص 120-131.
- کاپوستینا I.N.، Sidorova A.N.، Sarantsev A.N. نقشه برداری رنگی داپلر در تشخیص سرطان آندومتر // Sonoace International. نسخه روسی. جلد 9، 2001. صص 34-39.
- ماکسیموا N.A. برخی از جنبه های تشخیص اولتراسوند سرطان آندومتر // تشخیص اولتراسوند در زنان، زایمان و اطفال. 1999. شماره 3. ص 196-201.
- Stolyarova I.V.، Minko B.A.، Sirazitdinov B.R. قابلیت های آنژیوگرافی اولتراسونیک سه بعدی در تشخیص سرطان آندومتر // 19 کنگره بین المللی درمان ضد سرطان پاریس، 5-8 فوریه؛ 2008. ص 255-256.
- گاژنوا V.E. تشخیص سونوگرافی در زنان // M.: "MEDpress-inform". 2005. 264 ص.
- تیتووا V.A.، Kharchenko N.V.، Stolyarova I.V. پرتودرمانی خودکار سیستم تولید مثل زنان // M.: پزشکی. 2006. 160 ص.
- Gruboeck K.، Jurkovic D.، Lawton F. و همکاران. ارزش تشخیصی اندازه گیری ضخامت و حجم آندومتر با سونوگرافی سه بعدی در بیماران مبتلا به خونریزی پس از یائسگی // Ultrasound Obstet. ژنیکول. 1375. شماره 8. ص 272-276.
- Stolyarova I.V.، Minko B.A.، Lisyanskaya A.S. و سایر امکانات تکنیک های سونوگرافی مدرن در تشخیص سرطان آندومتر // کنگره بین المللی نوسکی رادیولوژی انجمن "افق های جدید" 7-10 آوریل، 2007 سنت پترزبورگ، صفحات 364-365.
- چکالووا M.A., Zuev V.M. تشخیص اولتراسوند در انکولوژی زنان // M.: انتشارات. خانه "دکتر روسی". 2004. 92 ص.
- Teregulova A.E. اکوگرافی ترانس واژینال با استفاده از نقشه برداری داپلر رنگی در بیماران مبتلا به سرطان آندومتر // تشخیص اولتراسوند. 1375. شماره 4. صص 21-23.
- Kurjak A.، Shalan H.، Sosic A. و همکاران. کارسینوم آندومتر در زنان یائسه: ارزیابی با سونوگرافی رنگی داپلر ترانس واژینال // Am. J. Obstet. ژنیکول. 1993. V. 169. ص 1597-1603.








