7. Topienie i krystalizacja (§ 12-14)
1. Przestudiuj materiały edukacyjne
Zbiorcze stany skupienia
Topienie i krystalizacja
2. Sprawdź się. Testy „Agregacyjne stany skupienia”, „Topnienie i krzepnięcie”
3. Odpowiedz na pytania:
1. Jak zmieniają się prędkości cząsteczek i odstępy między nimi podczas procesu topienia i krzepnięcia? Któremu procesowi towarzyszy wzrost, a któremu spadek energii wewnętrznej ciała?
2. Co stanie się z lodem o temperaturze zerowej, jeśli zostanie umieszczony w wodzie o tej samej temperaturze?
3. Co bardziej obniży temperaturę ciepłej wody: kawałek lodu czy taka sama ilość wody o temperaturze zerowej?
4. Korzystając z tabeli „Temperatura topnienia” dowiedz się: w jakim stanie znajduje się cyna w temperaturze 230°C; stal w temperaturze 1503°C; azot w temperaturze -215°C?
5. Korzystając z wykresu, odpowiedz na pytania:
Jaka jest początkowa temperatura ciała?
- W którym momencie rozpoczęło się topienie ciała?
- Z jaką substancją zachodziły procesy termiczne?
- w jakim stanie było ciało po 3 minutach od rozpoczęcia ogrzewania?
- Ile czasu zajęło stopienie ciała?
- w jakim stanie było ciało po 8 minutach od rozpoczęcia ogrzewania?
6. Skonstruuj wykres procesów cieplnych zachodzących w organizmie:
woda: 80°С —› - 10°С
Jeśli lód zostanie umieszczony w pojemniku i umieszczony nad płonącym palnikiem, pojemnik nagrzeje się i lód zacznie się topić. Jednakże, dopóki cały lód nie ulegnie skropleniu, temperatura wody nie wzrośnie powyżej 0°C (32°F), niezależnie od tego, jak gorący jest piec. Dzieje się tak, ponieważ całe ciepło dostarczane do lodu jest wykorzystywane do pokonania sił fizycznych, które wiążą jego cząsteczki.
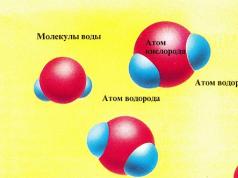
W lodzie cząsteczki wody są połączone wiązaniami międzycząsteczkowymi utworzonymi pomiędzy atomem wodoru (pokazanym na niebiesko) jednej cząsteczki i atomem tlenu (pokazanym na czerwono) drugiej. Powstała sześciokątna struktura krystaliczna ma dość wysoką wytrzymałość. W temperaturze 0°C cząsteczki poruszają się tak szybko, że wiązania słabną. Niektóre wiązania międzycząsteczkowe zostają zerwane, umożliwiając cząsteczkom wody opuszczenie lodu i utworzenie cieczy. Proces ten nazywa się przemianą fazową (przejście wody z fazy stałej w fazę ciekłą), a temperaturę, w której zachodzi, nazywa się temperaturą topnienia.
Aby rozerwać wiązania, które pozwalają wodzie pozostać w stanie stałym, potrzebna jest energia, i to w bardzo dużych ilościach, dlatego całe ciepło wytwarzane przez palnik idzie na rozerwanie tych wiązań, a nie na podniesienie temperatury lodu. Ciepło potrzebne do zakończenia opisanej powyżej przemiany fazowej nazywane jest utajonym ciepłem topnienia lub ciepłem przemiany fazowej, ponieważ ciepło to nie powoduje wzrostu temperatury. Dopiero po zerwaniu ostatnich wiązań i stopieniu całego lodu temperatura wody zacznie rosnąć i przekroczy 0°C.
Jak topi się lód?
- W lodzie cząsteczki wody poruszają się tak wolno, że zawsze pozostają ze sobą połączone, tworząc ciało stałe. Kiedy lód jest poddawany działaniu ciepła (pokazane jako żółte kulki na rysunku po prawej), cząsteczki wody zyskują dodatkową energię i poruszają się szybciej, ale nadal są ze sobą związane w postaci lodu.
- Jeśli dopływ ciepła będzie kontynuowany, cząsteczki wody na powierzchni lodu zwiększają prędkość swoich ruchów wibracyjnych, rozrywając wiązania międzycząsteczkowe, które wcześniej utrzymywały je na miejscu. Cząsteczki te opuszczają lód i tworzą ciekłą fazę wody. Dalszy dopływ ciepła prowadzi do zniszczenia pozostałych wiązań międzycząsteczkowych i stopniowego topnienia lodu.
- Ciągłe dodawanie ciepła ostatecznie daje ostatnim cząsteczkom zamrożonej wody wystarczającą ilość energii, aby pokonać wiązania międzycząsteczkowe, które spajały je w postaci lodu. Cała woda stała się teraz płynna.

Lód, woda i temperatura

Kiedy ciepło jest dostarczane do lodu (rysunek po lewej), jego temperatura najpierw wzrasta. Jednakże w temperaturze 0°C (32°F) wzrost temperatury zatrzymuje się i następuje przemiana fazowa: lód zaczyna się topić. Jak pokazuje niebieska krzywa na wykresie, dodatkowy dopływ ciepła prowadzi do dalszego topnienia lodu bez zwiększania temperatury wody. Dopiero gdy cały lód przejdzie w stan ciekły (rysunek nad tekstem), dodatkowe doprowadzenie ciepła prowadzi do wzrostu temperatury wody.
Nazywa się przejście substancji ze stanu stałego krystalicznego do ciekłego topienie. Aby stopić stałe ciało krystaliczne, należy je podgrzać do określonej temperatury, to znaczy należy dostarczyć ciepło.Nazywa się temperatura, w której topi się substancjatemperatura topnienia substancji.
Proces odwrotny – przejście ze stanu ciekłego do stanu stałego – zachodzi, gdy temperatura spada, tj. ciepło jest usuwane. Przejście substancji ze stanu ciekłego do stałego nazywa sięhartowanie , Lub kryształlizacja . Nazywa się temperaturą, w której substancja krystalizujetemperatura kryształucje .
Doświadczenie pokazuje, że każda substancja krystalizuje i topi się w tej samej temperaturze.
Rysunek przedstawia wykres temperatury ciała krystalicznego (lodu) w funkcji czasu ogrzewania (od punktu A do momentu D) i czas chłodzenia (od pkt D do momentu K). Pokazuje czas na osi poziomej i temperaturę na osi pionowej.
Z wykresu wynika, że obserwację procesu rozpoczęto od momentu, gdy temperatura lodu wynosiła -40°C, czyli, jak mówią, temperatura w początkowym momencie Tpoczątek= -40°C (pkt A na wykresie). Wraz z dalszym ogrzewaniem temperatura lodu wzrasta (na wykresie jest to przekrój AB). Temperatura wzrasta do 0°C – temperatury topnienia lodu. W temperaturze 0°C lód zaczyna się topić, a jego temperatura przestaje rosnąć. Przez cały czas topienia (tj. do momentu stopienia całego lodu) temperatura lodu nie zmienia się, chociaż palnik nadal się pali i w związku z tym dostarczane jest ciepło. Proces topienia odpowiada poziomej części wykresu Słońce . Dopiero gdy cały lód stopi się i zamieni w wodę, temperatura zaczyna ponownie rosnąć (rozdz płyta CD). Gdy temperatura wody osiągnie +40°C, palnik gaśnie i woda zaczyna się ochładzać, czyli usuwa się ciepło (w tym celu można umieścić naczynie z wodą w innym, większym naczyniu z lodem). Temperatura wody zaczyna spadać (rozdz DE). Gdy temperatura osiągnie 0°C, temperatura wody przestaje spadać, mimo że ciepło jest nadal usuwane. Jest to proces krystalizacji wody - tworzenia się lodu (przekrój poziomy E.F.). Dopóki cała woda nie zamieni się w lód, temperatura się nie zmieni. Dopiero potem temperatura lodu zaczyna spadać (rozdz FK).
Wygląd rozważanego wykresu wyjaśniono w następujący sposób. Lokalizacja na AB W wyniku dostarczonego ciepła wzrasta średnia energia kinetyczna cząsteczek lodu i wzrasta jego temperatura. Lokalizacja na Słońce cała energia otrzymana przez zawartość kolby jest zużywana na zniszczenie sieci kryształków lodu: uporządkowany układ przestrzenny jej cząsteczek zostaje zastąpiony nieuporządkowanym, zmienia się odległość między cząsteczkami, tj. Cząsteczki są ułożone w taki sposób, że substancja staje się płynna. Średnia energia kinetyczna cząsteczek nie zmienia się, więc temperatura pozostaje niezmieniona. Dalszy wzrost temperatury stopionej wody lodowej (w rejonie płyta CD) oznacza wzrost energii kinetycznej cząsteczek wody w wyniku ciepła dostarczonego przez palnik.
Podczas chłodzenia wody (rozdz DE) część energii jest mu odbierana, cząsteczki wody poruszają się z mniejszą prędkością, spada ich średnia energia kinetyczna – spada temperatura, woda się ochładza. W temperaturze 0°C (przekrój poziomy E.F.) cząsteczki zaczynają układać się w określonej kolejności, tworząc sieć krystaliczną. Do czasu zakończenia tego procesu temperatura substancji nie ulegnie zmianie pomimo odprowadzenia ciepła, co oznacza, że podczas krzepnięcia ciecz (woda) wydziela energię. Jest to dokładnie energia, którą pochłonął lód, zamieniając się w ciecz (sekcja Słońce). Energia wewnętrzna cieczy jest większa niż ciała stałego. Podczas topnienia (i krystalizacji) energia wewnętrzna ciała zmienia się gwałtownie.
Nazywa się metale topiące się w temperaturach powyżej 1650 ºС oporny(tytan, chrom, molibden itp.). Wolfram ma najwyższą wśród nich temperaturę topnienia - około 3400 ° C. Metale ogniotrwałe i ich związki stosowane są jako materiały żaroodporne w budowie samolotów, technologii rakietowej i kosmicznej oraz energetyce jądrowej.
Podkreślmy jeszcze raz, że substancja topiąc się, pochłania energię. Natomiast podczas krystalizacji uwalnia go do środowiska. Odbierając pewną ilość ciepła uwolnionego podczas krystalizacji, medium nagrzewa się. Jest to dobrze znane wielu ptakom. Nic dziwnego, że można je zobaczyć zimą przy mroźnej pogodzie, siedząc na lodzie pokrywającym rzeki i jeziora. Ze względu na uwalnianie energii podczas tworzenia się lodu, powietrze nad nim jest o kilka stopni cieplejsze niż nad drzewami w lesie, co wykorzystują ptaki.
Topienie substancji amorficznych.
Dostępność pewna temperatury topnienia- Jest to ważna cecha substancji krystalicznych. Dzięki tej cesze można je łatwo odróżnić od ciał amorficznych, które są również klasyfikowane jako ciała stałe. Należą do nich w szczególności szkło, bardzo lepkie żywice i tworzywa sztuczne.
Substancje amorficzne(w przeciwieństwie do krystalicznych) nie mają określonej temperatury topnienia - nie topią się, a miękną. Na przykład kawałek szkła po podgrzaniu najpierw staje się miękki, a twardy, można go łatwo zgiąć lub rozciągnąć; w wyższej temperaturze element zaczyna zmieniać swój kształt pod wpływem własnego ciężaru. W miarę nagrzewania gęsta, lepka masa przyjmuje kształt naczynia, w którym się znajduje. Ta masa jest najpierw gęsta jak miód, potem jak śmietana, a na koniec staje się prawie taką samą cieczą o niskiej lepkości jak woda. Nie da się tu jednak wskazać pewnej temperatury przejścia ciała stałego w ciecz, gdyż ona nie istnieje.
Przyczyną tego jest zasadnicza różnica w budowie ciał amorficznych od struktury ciał krystalicznych. Atomy w ciałach amorficznych są ułożone losowo. Ciała amorficzne swoją budową przypominają ciecze. Już w litym szkle atomy są ułożone losowo. Oznacza to, że podwyższenie temperatury szkła jedynie zwiększa zakres drgań jego cząsteczek, dając im stopniowo coraz większą swobodę ruchu. Dlatego szkło mięknie stopniowo i nie wykazuje ostrego przejścia „ciało stałe-ciecz”, charakterystycznego dla przejścia od ułożenia cząsteczek w ścisłym porządku do nieuporządkowanego.
Ciepło topnienia.
Ciepło topnienia- jest to ilość ciepła, jaką należy przekazać substancji pod stałym ciśnieniem i w stałej temperaturze równej temperaturze topnienia, aby całkowicie przekształciła się ona ze stanu stałego krystalicznego w ciecz. Ciepło topnienia jest równe ilości ciepła wydzielanego podczas krystalizacji substancji ze stanu ciekłego. Podczas topienia całe ciepło dostarczone do substancji zwiększa energię potencjalną jej cząsteczek. Energia kinetyczna nie zmienia się, ponieważ topnienie zachodzi w stałej temperaturze.
Badając eksperymentalnie topienie różnych substancji o tej samej masie, można zauważyć, że do przekształcenia ich w ciecz potrzeba różnej ilości ciepła. Przykładowo, aby stopić kilogram lodu, trzeba wydać 332 J energii, a aby stopić 1 kg ołowiu – 25 kJ.
Ilość ciepła wydzielanego przez ciało uważa się za ujemną. Dlatego przy obliczaniu ilości ciepła uwolnionego podczas krystalizacji substancji o masie M, powinieneś użyć tej samej formuły, ale ze znakiem minus:
Ciepło spalania.
Ciepło spalania(Lub Wartość opałowa, zawartość kalorii) to ilość ciepła wydzielana podczas całkowitego spalania paliwa.
Do ogrzewania ciał często wykorzystuje się energię uwalnianą podczas spalania paliwa. Paliwo konwencjonalne (węgiel, ropa naftowa, benzyna) zawiera węgiel. Podczas spalania atomy węgla łączą się z atomami tlenu w powietrzu, tworząc cząsteczki dwutlenku węgla. Energia kinetyczna tych cząsteczek okazuje się większa niż energii cząstek pierwotnych. Wzrost energii kinetycznej cząsteczek podczas spalania nazywa się uwalnianiem energii. Energia wydzielana podczas całkowitego spalania paliwa jest ciepłem spalania tego paliwa.
Ciepło spalania paliwa zależy od rodzaju paliwa i jego masy. Im większa masa paliwa, tym większa ilość ciepła wydzielonego podczas jego całkowitego spalania.
Nazywa się wielkość fizyczną pokazującą, ile ciepła wydziela się podczas całkowitego spalania paliwa o masie 1 kg ciepło właściwe spalania paliwa.Ciepło właściwe spalania jest oznaczone literąQi jest mierzony w dżulach na kilogram (J/kg).
Ilość ciepła Q uwalniany podczas spalania M kg paliwa określa się według wzoru:
Aby obliczyć ilość ciepła wydzieloną podczas całkowitego spalania paliwa o dowolnej masie, należy pomnożyć ciepło właściwe spalania tego paliwa przez jego masę.
Samodzielna praca z fizyki Skupione stany materii Topienie i krzepnięcie ciał krystalicznych dla uczniów klasy VIII. Samodzielna praca składa się z 2 opcji, każda z 5 zadaniami.
1 opcja
1. Jak zmieniają się prędkości cząsteczek i przestrzenie między nimi podczas procesu topienia i krzepnięcia? Któremu procesowi towarzyszy wzrost, a któremu spadek energii wewnętrznej?
2. Co stanie się z lodem o temperaturze zerowej, jeśli zostanie umieszczony w wodzie o tej samej temperaturze?
3. Co bardziej obniży temperaturę ciepłej wody: kawałek lodu czy taka sama ilość wody o temperaturze zerowej?
4. Jesienią w rurach pozostała woda, a wiosną okazało się, że rury pękły. Dlaczego?
5. Czasami na przedniej szybie samochodu pojawiają się chipy i gwiazdki. Powodem jest uderzenie kamieni od samochodów jadących z przodu. Dlaczego te wady szkła trzeba eliminować przed pierwszymi przymrozkami?
Opcja 2
1. Cyna jest przenoszona z jednego stanu skupienia do drugiego. Czy stał się stały lub stopiony, jeśli wiadomo, że zwiększył swoją energię wewnętrzną?
2. W jakim przypadku woda nagrzeje się do wyższej temperatury: jeśli wleje się do niej płynną cynę w temperaturze krzepnięcia lub wrzuci się do niej stałą cynę w temperaturze topnienia?
3. Dlaczego duże naczynie z wodą umieszczone w piwnicy ratuje warzywa przed pierwszymi przymrozkami?
4. Czasami butelki po wodzie pozostawione w zamrażarce pękają. Dlaczego?
5. Gdzie i kiedy tworzą się sople lodu?
Odpowiedzi na samodzielne prace z fizyki Skupione stany materii Topienie i krzepnięcie ciał krystalicznych
1 opcja
1. Podczas topienia prędkość cząsteczek wzrasta, podczas zestalania wręcz przeciwnie, maleje. Podczas topienia energia wewnętrzna wzrasta, podczas krzepnięcia maleje.
2. Lód na pewno będzie pływał w wodzie, ponieważ gęstość lodu jest mniejsza niż gęstość wody, ale lód na pewno się nie stopi, ponieważ nie otrzyma ciepła do topnienia od wody, ponieważ wymiana ciepła w tej samej temperaturze jest niemożliwa.
3. Kawałek lodu, ponieważ oprócz ogrzewania część ciepła zostanie wydana na stopienie lodu.
4. Kiedy woda zamarza, rozszerza się.
5. Ponieważ woda dostanie się do tych wiórów, a podczas zamarzania objętość lodu będzie większa niż objętość wody, a lód będzie w dalszym ciągu niszczył szkło, zwiększając rozmiar wiórów i pęknięć.
Opcja 2
1. Stopił się, ponieważ zwiększył energię wewnętrzną. A hartowanie charakteryzuje się tym, że uwalnia tę energię.
2. Jeśli wlejesz płynną puszkę w temperaturze krzepnięcia.
3. Jeśli nastąpi nagłe ochłodzenie, woda zamarznie. Kiedy woda zamarza, uwalniana jest część ciepła.
4. Podczas zamrażania zwiększa się objętość wody.
5. Sople powstają, gdy woda z miejsca, w którym temperatura jest wyższa od zera, powoli przepływa do miejsca, w którym temperatura jest poniżej zera. Na przykład: słońce ogrzewa dach, a śnieg się na nim topi.