7. Erish va kristallanish (§ 12-14)
1. O'quv materialini o'rganish
Moddaning agregat holatlari
Erish va kristallanish
2. O'zingizni sinab ko'ring. Sinovlar "Materaning agregativ holatlari", "Erish va qotib qolish"
3. Savollarga javob bering:
1. Erish va qotib qolish jarayonida molekulalarning tezligi va ular orasidagi bo'shliqlar qanday o'zgaradi? Qaysi jarayon tananing ichki energiyasining ko'payishi va qaysi biri kamayishi bilan birga keladi?
2. Nol haroratda muz bir xil haroratdagi suvga joylashtirilsa, u bilan nima sodir bo'ladi?
3. Iliq suvning harorati nima ko'proq pasaytiradi: muz bo'lagimi yoki nol haroratda bir xil miqdordagi suvmi?
4. “Erish nuqtasi” jadvalidan foydalanib, aniqlang: 230 ° S haroratda qalay qanday holatda; 1503 ° S haroratda po'lat; -215°S haroratda azot?
5. Grafikdan foydalanib, savollarga javob bering:
Dastlabki tana harorati qanday?
- Tananing erishi qaysi davrda boshlangan?
- Issiqlik jarayonlari qanday modda bilan sodir bo'lgan?
- isitish boshlanganidan keyin 3 minut ichida tana qanday holatda edi?
- Tananing erishi uchun qancha vaqt kerak bo'ldi?
- isitish boshlanganidan keyin 8 minut ichida tana qanday holatda edi?
6. Organizmda sodir bo'ladigan issiqlik jarayonlarining grafigini tuzing:
suv: 80°S —› - 10°S
Agar muz idishga solib, yonib turgan gorelka ustiga qo‘yilsa, idish qiziydi va muz eriy boshlaydi. Biroq, barcha muz suyultirilmaguncha, pechka qanchalik issiq bo'lishidan qat'i nazar, suv harorati 0 ° C (32 ° F) dan oshmaydi. Bu muzga berilgan barcha issiqlik uning molekulalarini bir-biriga bog'laydigan jismoniy kuchlarni engish uchun ishlatilishi tufayli yuzaga keladi.
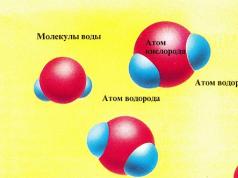
Muzda suv molekulalari bir molekulaning vodorod atomi (ko'k rangda ko'rsatilgan) va boshqa molekulaning kislorod atomi (qizil rangda ko'rsatilgan) o'rtasida hosil bo'lgan molekulalararo bog'lanishlar orqali tutiladi. Olingan olti burchakli kristall strukturasi ancha yuqori quvvatga ega. 0 ° C da molekulalar shunchalik tez harakat qiladiki, aloqalar zaiflashadi. Ba'zi molekulalararo bog'lanishlar buzilib, suv molekulalarining suyuqlik hosil qilish uchun muzni tark etishiga imkon beradi. Bu jarayon fazaviy o'tish (suvning qattiq fazadan suyuq fazaga o'tishi) deb ataladi va u sodir bo'lgan harorat erish nuqtasi deb ataladi.
Suvning qattiq holatda qolishiga imkon beruvchi aloqalarni uzish uchun energiya kerak va juda ko'p miqdorda, shuning uchun burner tomonidan ishlab chiqarilgan barcha issiqlik muzning haroratini oshirishga emas, balki bu aloqalarni buzishga ketadi. Yuqorida tavsiflangan fazaviy o'zgarishlarni bajarish uchun zarur bo'lgan issiqlik termoyadroviyning yashirin issiqligi yoki faza o'zgarishi issiqligi deb ataladi, chunki bu issiqlik haroratning oshishiga olib kelmaydi. Faqat oxirgi bog'lanishlar uzilib, barcha muzlar eriganidan keyin suv harorati ko'tarila boshlaydi va 0 ° C dan yuqori bo'ladi.
Muz qanday eriydi?
- Muzda suv molekulalari shunchalik sekin harakat qiladiki, ular doimo bir-biri bilan bog'lanib, qattiq moddani hosil qiladi. Muzga issiqlik qo'llanilganda (o'ngdagi rasmda sariq sharlar shaklida ko'rsatilgan), suv molekulalari qo'shimcha energiya oladi va tezroq harakat qiladi, lekin baribir muz kabi bir-biriga bog'langan.
- Agar issiqlik ta'minoti davom etsa, muz yuzasidagi suv molekulalari tebranish harakatlarining tezligini oshiradi, avval ularni ushlab turgan molekulalararo aloqalarni buzadi. Bu molekulalar muzni tark etib, suvning suyuq fazasini hosil qiladi. Keyinchalik issiqlik ta'minoti qolgan molekulalararo aloqalarning yo'q qilinishiga va muzning asta-sekin erishiga olib keladi.
- Issiqlikning davom etishi oxir-oqibat muzlatilgan suv molekulalarining oxirgi qismini muzdek ushlab turgan molekulalararo aloqalarni yengish uchun etarli energiya beradi. Endi barcha suv suyuqlikka aylandi.

Muz, suv va harorat

Muzga issiqlik berilganda (chapdagi rasm), avval uning harorati ortadi. Biroq, 0 ° C (32 ° F) da haroratning oshishi to'xtaydi va fazali o'tish sodir bo'ladi: muz eriy boshlaydi. Grafikdagi ko'k egri chiziqdan ko'rinib turibdiki, qo'shimcha issiqlik kiritish suv haroratini oshirmasdan muzning yanada erishiga olib keladi. Faqatgina barcha muzlar suyuq holatga aylangandan so'ng (matn ustidagi rasm) qo'shimcha issiqlik ta'minoti suv haroratining oshishiga olib keladi.
Moddaning qattiq kristall holatdan suyuqlikka o'tishi deyiladi erish. Qattiq kristall jismni eritish uchun uni ma'lum bir haroratgacha qizdirish kerak, ya'ni issiqlik bilan ta'minlash kerak.Moddaning erishi harorati deyiladimoddaning erish nuqtasi.
Teskari jarayon - suyuqlikdan qattiq holatga o'tish - harorat pasayganda sodir bo'ladi, ya'ni issiqlik chiqariladi. Moddaning suyuqlikdan qattiq holatga o'tishi deyiladiqattiqlashishi , yoki kristalllizing . Moddaning kristallanish harorati deyiladikristall haroratilar .
Tajriba shuni ko'rsatadiki, har qanday modda bir xil haroratda kristallanadi va eriydi.
Rasmda kristall jism (muz) haroratining isitish vaqtiga (nuqtadan boshlab) grafigi ko'rsatilgan. A nuqtaga D) va sovutish vaqti (nuqtadan D nuqtaga K). U gorizontal o'q bo'ylab vaqtni va vertikal o'q bo'ylab haroratni ko'rsatadi.
Grafik shuni ko'rsatadiki, jarayonni kuzatish muz harorati -40 ° C bo'lgan paytdan boshlangan yoki ular aytganidek, vaqtning dastlabki momentidagi harorat tboshlanishi= -40 °C (nuqta A grafikda). Keyinchalik isitish bilan muzning harorati ko'tariladi (grafikda bu qism AB). Harorat 0 °C ga ko'tariladi - muzning erishi harorati. 0 ° C da muz eriy boshlaydi va uning harorati ko'tarilishni to'xtatadi. Butun erish vaqtida (ya'ni, barcha muz eriguncha) muzning harorati o'zgarmaydi, garchi burner yonishda davom etsa va shuning uchun issiqlik ta'minlanadi. Erish jarayoni grafikning gorizontal qismiga mos keladi Quyosh . Barcha muzlar erishi va suvga aylanganidan keyingina harorat yana ko'tarila boshlaydi (bo'lim CD). Suv harorati +40 ° C ga yetgandan so'ng, burner o'chiriladi va suv sovib keta boshlaydi, ya'ni issiqlik chiqariladi (buning uchun siz suv bilan idishni boshqa, muzli kattaroq idishga joylashtirishingiz mumkin). Suv harorati pasayishni boshlaydi (bo'lim DE). Harorat 0 ° C ga yetganda, issiqlik hali ham olib tashlanishiga qaramay, suv harorati pasayishni to'xtatadi. Bu suvning kristallanish jarayoni - muz hosil bo'lishi (gorizontal qism E.F.). Barcha suv muzga aylanmaguncha, harorat o'zgarmaydi. Shundan keyingina muz harorati pasayishni boshlaydi (bo'lim FK).
Ko'rib chiqilayotgan grafikning ko'rinishi quyidagicha izohlanadi. Joylashuv yoqilgan AB Berilgan issiqlik tufayli muz molekulalarining o'rtacha kinetik energiyasi ortadi va uning harorati ko'tariladi. Joylashuv yoqilgan Quyosh kolba tarkibidagi barcha energiya muz kristall panjarasini yo'q qilishga sarflanadi: uning molekulalarining tartibli fazoviy joylashuvi tartibsiz bilan almashtiriladi, molekulalar orasidagi masofa o'zgaradi, ya'ni. Molekulalar modda suyuq bo'ladigan tarzda qayta joylashadi. Molekulalarning o'rtacha kinetik energiyasi o'zgarmaydi, shuning uchun harorat o'zgarishsiz qoladi. Erigan muzli suv haroratining yanada oshishi (hududda CD) yondirgich tomonidan beriladigan issiqlik hisobiga suv molekulalarining kinetik energiyasini oshirishni anglatadi.
Suvni sovutganda (bo'lim DE) energiyaning bir qismi undan olinadi, suv molekulalari past tezlikda harakatlanadi, ularning o'rtacha kinetik energiyasi tushadi - harorat pasayadi, suv soviydi. 0 ° C da (gorizontal qism E.F.) molekulalar kristall panjara hosil qilib, ma'lum bir tartibda qatorlana boshlaydi. Bu jarayon tugagunga qadar, issiqlik olib tashlanishiga qaramay, moddaning harorati o'zgarmaydi, ya'ni qattiqlashganda suyuqlik (suv) energiya chiqaradi. Aynan shu energiya muz so'rib, suyuqlikka aylanadi (bo'lim Quyosh). Suyuqlikning ichki energiyasi qattiq jismnikidan kattaroqdir. Erish (va kristallanish) vaqtida tananing ichki energiyasi keskin o'zgaradi.
1650ºS dan yuqori haroratlarda eriydigan metallar deyiladi o'tga chidamli(titan, xrom, molibden va boshqalar). Volfram ular orasida eng yuqori erish nuqtasiga ega - taxminan 3400 ° S. O‘tga chidamli metallar va ularning birikmalari issiqlikka chidamli material sifatida samolyotsozlikda, raketa va kosmik texnikada, atom energetikasida qo‘llaniladi.
Yana bir bor ta'kidlaymizki, erish paytida modda energiyani yutadi. Kristallanish jarayonida, aksincha, uni atrof-muhitga chiqaradi. Kristallanish jarayonida ajralib chiqadigan ma'lum miqdordagi issiqlikni qabul qilib, muhit qiziydi. Bu ko'plab qushlarga yaxshi ma'lum. Ularni qishda sovuq havoda daryo va ko'llarni qoplagan muz ustida o'tirgan holda ko'rish mumkinligi ajablanarli emas. Muz hosil bo'lganda energiya chiqishi tufayli uning ustidagi havo o'rmondagi daraxtlarga qaraganda bir necha daraja issiqroq bo'ladi va qushlar bundan foydalanadilar.
Amorf moddalarning erishi.
Muayyan mavjudligi erish nuqtalari- Bu kristall moddalarning muhim xususiyati. Aynan shu xususiyati bilan ularni amorf jismlardan osongina ajratish mumkin, ular ham qattiq jismlarga kiradi. Bularga, xususan, shisha, juda yopishqoq qatronlar va plastmassalar kiradi.
Amorf moddalar(kristaldan farqli o'laroq) o'ziga xos erish nuqtasiga ega emas - ular erimaydi, balki yumshaydi. Qizdirilganda, masalan, shisha bo'lagi birinchi navbatda qattiqdan yumshoq bo'ladi, u osongina egilishi yoki cho'zilishi mumkin; yuqori haroratda bo'lak o'z tortishish kuchi ta'sirida shaklini o'zgartira boshlaydi. U qizib ketganda, qalin yopishqoq massa u yotadigan idishning shaklini oladi. Bu massa birinchi navbatda asal kabi qalin, keyin smetana kabi va nihoyat suv kabi deyarli bir xil past viskoziteli suyuqlikka aylanadi. Biroq, bu erda qattiq jismning suyuqlikka o'tishning ma'lum bir haroratini ko'rsatish mumkin emas, chunki u mavjud emas.
Buning sabablari amorf jismlarning tuzilishidagi kristall jismlarning tuzilishidan tubdan farq qilishidadir. Amorf jismlardagi atomlar tasodifiy joylashtirilgan. Amorf jismlar tuzilishi jihatidan suyuqliklarga o'xshaydi. Qattiq shishada allaqachon atomlar tasodifiy joylashtirilgan. Bu shuni anglatadiki, shisha haroratining ko'tarilishi uning molekulalarining tebranish diapazonini oshiradi va ularga asta-sekin kattaroq va kattaroq harakat erkinligini beradi. Shu sababli, shisha asta-sekin yumshaydi va molekulalarning qat'iy tartibda joylashishidan tartibsiz holatga o'tishga xos bo'lgan keskin "qattiq-suyuqlik" o'tishini ko'rsatmaydi.
Eritish issiqligi.
Erish issiqligi- bu qattiq kristall holatdan suyuqlikka to'liq o'tishi uchun erish nuqtasiga teng doimiy bosim va doimiy haroratda moddaga berilishi kerak bo'lgan issiqlik miqdori. Erishish issiqligi moddaning suyuq holatdan kristallanishi paytida ajralib chiqadigan issiqlik miqdoriga teng. Erish jarayonida moddaga berilgan barcha issiqlik uning molekulalarining potentsial energiyasini oshirishga ketadi. Erish doimiy haroratda sodir bo'lganligi sababli kinetik energiya o'zgarmaydi.
Bir xil massadagi turli moddalarning erishini eksperimental ravishda o'rganib, ularni suyuqlikka aylantirish uchun har xil miqdorda issiqlik kerakligini ko'rish mumkin. Masalan, bir kilogramm muzni eritish uchun 332 J, 1 kg qo'rg'oshinni eritish uchun esa 25 kJ energiya sarflash kerak bo'ladi.
Tana tomonidan chiqarilgan issiqlik miqdori salbiy hisoblanadi. Shuning uchun, massaga ega bo'lgan moddaning kristallanishi paytida ajralib chiqadigan issiqlik miqdorini hisoblashda m, siz bir xil formuladan foydalanishingiz kerak, lekin minus belgisi bilan:
Yonish issiqligi.
Yonish issiqligi(yoki kaloriya qiymati, kaloriya tarkibi) - yoqilg'ining to'liq yonishi paytida ajralib chiqadigan issiqlik miqdori.
Jismlarni isitish uchun ko'pincha yoqilg'ining yonishi paytida chiqarilgan energiya ishlatiladi. An'anaviy yoqilg'ida (ko'mir, neft, benzin) uglerod mavjud. Yonish jarayonida uglerod atomlari havodagi kislorod atomlari bilan birlashib, karbonat angidrid molekulalarini hosil qiladi. Bu molekulalarning kinetik energiyasi dastlabki zarrachalarnikidan kattaroq bo'lib chiqadi. Yonish jarayonida molekulalarning kinetik energiyasining ortishi energiyaning chiqishi deyiladi. Yoqilg'ining to'liq yonishi paytida chiqarilgan energiya bu yoqilg'ining yonish issiqligidir.
Yoqilg'ining yonish issiqligi yoqilg'ining turiga va uning massasiga bog'liq. Yoqilg'i massasi qanchalik katta bo'lsa, uning to'liq yonishi paytida chiqadigan issiqlik miqdori shunchalik ko'p bo'ladi.
1 kg og'irlikdagi yoqilg'ining to'liq yonishi paytida qancha issiqlik ajralib chiqishini ko'rsatadigan fizik miqdor deyiladi. yoqilg'ining o'ziga xos yonish issiqligi.Yonishning o'ziga xos issiqligi harf bilan belgilanadiqva kilogramm boshiga joul bilan o'lchanadi (J/kg).
Issiqlik miqdori Q yonish paytida chiqariladi m kg yoqilg'i quyidagi formula bo'yicha aniqlanadi:
Ixtiyoriy massali yoqilg'ining to'liq yonishi paytida chiqarilgan issiqlik miqdorini topish uchun ushbu yoqilg'ining o'ziga xos yonish issiqligini uning massasiga ko'paytirish kerak.
Fizika fanidan mustaqil ish 8-sinf o`quvchilari uchun moddalarning agregat holatlari Kristal jismlarning erishi va qotib qolishi. Mustaqil ish har birida 5 ta vazifadan iborat 2 ta variantdan iborat.
1 variant
1. Erish va qotib qolish jarayonida molekulalarning tezligi va ular orasidagi bo'shliqlar qanday o'zgaradi? Qaysi jarayon ichki energiyaning ortishi va qaysi biri kamayishi bilan kechadi?
2. Agar muz bir xil haroratdagi suvga joylashtirilsa, uni nol haroratda nima qiladi?
3. Iliq suvning haroratini nima ko'proq pasaytiradi: muz bo'lagimi yoki nol haroratda bir xil miqdordagi suvmi?
4. Kuzda quvurlarda suv qolib ketgan, bahorda esa quvurlar yorilib ketgani ma'lum bo'ldi. Nega?
5. Ba'zan avtomobilning old oynasida chiplar va yulduzlar paydo bo'ladi. Buning sababi, oldidagi mashinalardan toshlarning zarbasi. Nima uchun bu shisha nuqsonlarni birinchi sovuqdan oldin yo'q qilish kerak?
Variant 2
1. Qalay bir agregat holatidan ikkinchisiga o'tadi. Agar u ichki energiyasini oshirganligi ma'lum bo'lsa, u qattiq yoki eriganmi?
2. Qaysi holatda suv yuqoriroq haroratgacha qiziydi: agar unga qotib qolgan haroratda suyuq qalay quyilsa yoki erish haroratida qattiq qalay tashlansa?
3. Nima uchun qabrlarga suv qo'yilgan katta idish sabzavotlarni birinchi sovuqdan qutqaradi?
4. Ba'zida muzlatgichda qolgan suv idishlari yorilib ketadi. Nega?
5. Muzlar qayerda va qachon hosil bo'ladi?
Fizikadan mustaqil ishlarga javoblar Moddaning agregat holatlari Kristal jismlarning erishi va qotib qolishi.
1 variant
1. Eriganda molekulalarning tezligi ortadi, qotib qolganda esa aksincha pasayadi. Erish paytida ichki energiya ortadi, qattiqlashganda esa kamayadi.
2. Muz albatta suvda suzadi, chunki muzning zichligi suv zichligidan kamroq, lekin muz albatta erimaydi, chunki u suvdan erishi uchun issiqlikni olmaydi, chunki bir xil haroratda issiqlik almashinuvi mumkin emas.
3. Muzning bir bo'lagi, chunki isitishdan tashqari, muzni eritishga bir oz issiqlik sarflanadi.
4. Suv muzlaganda u kengayadi.
5. Chunki suv bu chiplarga kiradi va muzlaganda muzning hajmi suv hajmidan kattaroq bo'ladi va muz shishani yo'q qilishda davom etadi, chip va yorilish hajmini oshiradi.
Variant 2
1. U ichki energiyani oshirganligi sababli erigan. Va qattiqlashuv bu energiyani chiqarishi bilan tavsiflanadi.
2. Qattiqlashuv haroratida suyuq qalay quysangiz.
3. To'satdan sovuq bo'lsa, suv muzlaydi. Suv muzlaganda, bir oz issiqlik chiqariladi.
4. Muzlaganda suv hajmi ortadi.
5. Harorati muzlashdan yuqori boʻlgan joydan suv harorati noldan past boʻlgan joyga sekin oqib oʻtganda muzliklar hosil boʻladi. Masalan: quyosh tomni isitadi, qor esa eriydi.