7. Topljenje i kristalizacija (§ 12-14)
1. Proučite obrazovni materijal
Agregatna stanja materije
Topljenje i kristalizacija
2. Testirajte se. Testovi "Agregatna stanja materije", "Otapanje i skrućivanje"
3. Odgovorite na pitanja:
1. Kako se mijenjaju brzine molekula i praznine između njih tokom procesa topljenja i očvršćavanja? Koji proces je praćen povećanjem, a kojim smanjenjem unutrašnje energije tijela?
2. Šta se dešava sa ledom na nultoj temperaturi ako se stavi u vodu iste temperature?
3. Šta će više sniziti temperaturu tople vode: komad leda ili ista količina vode na nultoj temperaturi?
4. Pomoću tabele „Tačka topljenja“ saznajte: u kakvom je stanju kalaj na temperaturi od 230°C; čelik na temperaturi od 1503°C; azota na temperaturi od -215°C?
5. Koristeći grafikon, odgovorite na pitanja:
Kolika je početna tjelesna temperatura?
- U kom trenutku je počelo topljenje tela?
- Sa kojom supstancom su se odvijali termički procesi?
- u kakvom je stanju telo bilo 3 minuta nakon početka zagrevanja?
- Koliko je vremena trebalo da se tijelo otopi?
- u kakvom je stanju tijelo bilo 8 minuta nakon početka zagrijavanja?
6. Napravi graf termičkih procesa koji se dešavaju u tijelu:
voda: 80°S —› - 10°S
Ako se led stavi u posudu i stavi na gorionik koji gori, posuda će se zagrijati i led će se početi topiti. Međutim, dok se sav led ne ukapi, temperatura vode neće porasti iznad 0°C (32°F), bez obzira na to koliko je peć vruća. To se događa zbog činjenice da se sva toplina dovedena u led koristi za savladavanje fizičkih sila koje povezuju njegove molekule.
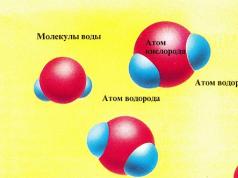
U ledu se molekule vode drže zajedno intermolekularnim vezama formiranim između atoma vodika (prikazano plavom bojom) jednog molekula i atoma kisika (prikazano crvenom) drugog. Dobivena heksagonalna kristalna struktura ima prilično visoku čvrstoću. Na 0°C, molekuli se kreću tako brzo da veze slabe. Neke od međumolekularnih veza su prekinute, dozvoljavajući molekulima vode da napuste led i formiraju tečnost. Ovaj proces se naziva fazni prijelaz (voda prelazi iz čvrste faze u tečnu fazu), a temperatura na kojoj se odvija naziva se tačka topljenja.
Za raskid veza koje omogućavaju da voda ostane u čvrstom stanju potrebna je energija, i to u veoma velikim količinama, tako da sva toplota koju stvara gorionik ide na razbijanje ovih veza, a ne na povećanje temperature leda. Toplina potrebna da se završi gore opisana fazna transformacija naziva se latentna toplina fuzije ili toplina promjene faze, budući da ta toplina ne uzrokuje povećanje temperature. Tek nakon što se posljednje veze pokidaju i sav led se otopi, temperatura vode će početi da raste i prelazi 0°C.
Kako se led topi?
- U ledu se molekuli vode kreću tako sporo da uvijek ostaju povezani jedni s drugima, formirajući čvrstu supstancu. Kada se toplota primeni na led (prikazano kao žute kuglice na slici desno), molekuli vode dobijaju dodatnu energiju i kreću se brže, ali su i dalje povezani kao led.
- Ako se dovod topline nastavi, molekule vode na površini leda povećavaju brzinu svojih vibracijskih kretanja, razbijajući međumolekularne veze koje su ih prethodno držale na mjestu. Ovi molekuli napuštaju led i formiraju tečnu fazu vode. Dalje dovod topline dovodi do razaranja preostalih međumolekularnih veza i postepenog topljenja leda.
- Kontinuirano dodavanje topline na kraju daje posljednjim od smrznutih molekula vode dovoljno energije da prevladaju međumolekularne veze koje su ih držale zajedno kao led. Sva voda je sada postala tečna.

Led, voda i temperatura

Kada se led dovede toplotom (slika lijevo), njegova temperatura se prvo povećava. Međutim, na 0°C (32°F), povećanje temperature prestaje i dolazi do faznog prijelaza: led počinje da se topi. Kao što pokazuje plava kriva na grafikonu, dodatni unos toplote dovodi do daljeg topljenja leda bez povećanja temperature vode. Tek nakon što je sav led prešao u tečno stanje (slika iznad teksta) dodatni dovod topline dovodi do povećanja temperature vode.
Prijelaz tvari iz čvrstog kristalnog stanja u tekućinu naziva se topljenje. Da bi se rastopilo čvrsto kristalno tijelo, ono se mora zagrijati na određenu temperaturu, odnosno donijeti toplinu.Temperatura na kojoj se supstanca topi naziva setačka topljenja supstance.
Obrnuti proces - prijelaz iz tekućeg u čvrsto stanje - događa se kada se temperatura smanji, tj. kada se toplina ukloni. Prijelaz tvari iz tekućeg u čvrsto stanje naziva seotvrdnjavanje , ili kristallizacija . Temperatura na kojoj se supstanca kristališe naziva setemperatura kristalacije .
Iskustvo pokazuje da svaka tvar kristalizira i topi se na istoj temperaturi.
Na slici je prikazan grafik temperature kristalnog tijela (leda) u odnosu na vrijeme zagrijavanja (od tačke A do tačke D) i vrijeme hlađenja (od tačke D do tačke K). Prikazuje vrijeme duž horizontalne ose, a temperaturu duž vertikalne ose.
Grafikon pokazuje da je posmatranje procesa počelo od trenutka kada je temperatura leda bila -40°C, ili, kako kažu, temperatura u početnom trenutku vremena tpočetak= -40 °C (tačka A na grafikonu). Daljnjim zagrijavanjem temperatura leda raste (na grafikonu je ovo dio AB). Temperatura se povećava na 0 °C - temperatura topljenja leda. Na 0°C led počinje da se topi i njegova temperatura prestaje da raste. Za cijelo vrijeme topljenja (tj. dok se sav led ne otopi) temperatura leda se ne mijenja, iako gorionik nastavlja da gori i toplota se, dakle, dovodi. Proces topljenja odgovara horizontalnom dijelu grafikona Ned . Tek nakon što se sav led otopi i pretvori u vodu, temperatura ponovo počinje rasti (odjeljak CD). Nakon što temperatura vode dostigne +40 °C, gorionik se gasi i voda počinje da se hladi, odnosno uklanja se toplota (da biste to učinili, posudu sa vodom možete staviti u drugu, veću posudu sa ledom). Temperatura vode počinje opadati (odjeljak DE). Kada temperatura dostigne 0 °C, temperatura vode prestaje da se smanjuje, uprkos činjenici da se toplota i dalje uklanja. To je proces kristalizacije vode - formiranje leda (horizontalni presjek E.F.). Sve dok se sva voda ne pretvori u led, temperatura se neće promijeniti. Tek nakon toga temperatura leda počinje opadati (odjeljak FK).
Izgled razmatranog grafa je objašnjen na sljedeći način. Lokacija uključena AB Zbog dovedene topline, prosječna kinetička energija molekula leda raste, a temperatura raste. Lokacija uključena Ned sva energija koju prima sadržaj tikvice troši se na uništavanje kristalne rešetke leda: uređeni prostorni raspored njegovih molekula zamjenjuje se nesređenim, mijenja se udaljenost između molekula, tj. Molekuli su preuređeni na takav način da supstanca postaje tečna. Prosječna kinetička energija molekula se ne mijenja, tako da temperatura ostaje nepromijenjena. Daljnji porast temperature rastopljene ledene vode (na području CD) znači povećanje kinetičke energije molekula vode zbog topline koju dovodi gorionik.
Prilikom hlađenja vode (odjeljak DE) dio energije mu se oduzima, molekuli vode se kreću manjim brzinama, njihova prosječna kinetička energija opada – temperatura se smanjuje, voda se hladi. Na 0°C (horizontalni presjek E.F.) molekuli se počinju nizati određenim redoslijedom, formirajući kristalnu rešetku. Dok se ovaj proces ne završi, temperatura tvari se neće mijenjati, unatoč toplini koja se uklanja, što znači da pri skrućivanju tekućina (voda) oslobađa energiju. To je upravo energija koju je led apsorbirao, pretvarajući se u tečnost (presjek Ned). Unutrašnja energija tečnosti je veća od energije čvrste materije. Tokom topljenja (i kristalizacije), unutrašnja energija tijela se naglo mijenja.
Zovu se metali koji se tope na temperaturama iznad 1650 ºS vatrostalna(titanijum, hrom, molibden, itd.). Volfram ima najvišu tačku topljenja među njima - oko 3400 ° C. Vatrostalni metali i njihovi spojevi koriste se kao materijali otporni na toplinu u konstrukciji aviona, raketnoj i svemirskoj tehnologiji, te nuklearnoj energiji.
Još jednom naglasimo da pri topljenju supstanca upija energiju. Prilikom kristalizacije, naprotiv, ispušta ga u okolinu. Primajući određenu količinu toplote koja se oslobađa tokom kristalizacije, medij se zagrijava. Ovo je dobro poznato mnogim pticama. Nije ni čudo što se mogu vidjeti zimi po mraznom vremenu kako sjede na ledu koji prekriva rijeke i jezera. Zbog oslobađanja energije prilikom stvaranja leda, zrak iznad njega je nekoliko stupnjeva topliji nego na drveću u šumi, a ptice to iskorištavaju.
Topljenje amorfnih materija.
Dostupnost određenog tačke topljenja- Ovo je važna karakteristika kristalnih supstanci. Po ovoj osobini se lako mogu razlikovati od amorfnih tijela, koja se također klasificiraju kao čvrsta tijela. To uključuje, posebno, staklo, vrlo viskozne smole i plastiku.
Amorfne supstance(za razliku od kristalnih) nemaju određenu tačku topljenja - ne tope se, već omekšaju. Kada se zagrije, komad stakla, na primjer, prvo postaje mekan od tvrdog, lako se može saviti ili rastegnuti; na višoj temperaturi, komad počinje mijenjati svoj oblik pod utjecajem vlastite gravitacije. Kako se zagrije, gusta viskozna masa poprima oblik posude u kojoj leži. Ova masa je prvo gusta, poput meda, zatim poput kisele pavlake, a na kraju postaje skoro ista tečnost niske viskoznosti kao voda. Međutim, ovdje je nemoguće naznačiti određenu temperaturu prijelaza čvrste tvari u tekućinu, jer ona ne postoji.
Razlozi za to leže u fundamentalnoj razlici u strukturi amorfnih tijela od strukture kristalnih. Atomi u amorfnim tijelima su raspoređeni nasumično. Amorfna tijela po svojoj strukturi podsjećaju na tekućine. Već u čvrstom staklu atomi su raspoređeni nasumično. To znači da povećanje temperature stakla samo povećava opseg vibracija njegovih molekula, dajući im postepeno sve veću slobodu kretanja. Stoga staklo omekšava postupno i ne pokazuje oštar prijelaz "čvrsto-tekuće", karakterističan za prijelaz sa rasporeda molekula po strogom redu u neuređeni.
Toplota fuzije.
Toplota topljenja- to je količina topline koja se mora prenijeti tvari pri konstantnom pritisku i konstantnoj temperaturi jednakoj tački topljenja da bi se ona potpuno prevela iz čvrstog kristalnog stanja u tekućinu. Toplota fuzije jednaka je količini toplote koja se oslobađa tokom kristalizacije supstance iz tekućeg stanja. Tokom topljenja, sva toplota dovedena u supstancu ide na povećanje potencijalne energije njenih molekula. Kinetička energija se ne mijenja jer se topljenje odvija na konstantnoj temperaturi.
Eksperimentalnim proučavanjem topljenja različitih supstanci iste mase može se uočiti da su potrebne različite količine toplote da bi se one pretvorile u tečnost. Na primjer, da biste otopili jedan kilogram leda, potrebno je potrošiti 332 J energije, a da biste otopili 1 kg olova - 25 kJ.
Količina topline koju tijelo oslobađa smatra se negativnom. Stoga, pri izračunavanju količine topline koja se oslobađa tijekom kristalizacije tvari s masom m, trebali biste koristiti istu formulu, ali sa predznakom minus:
Toplota sagorevanja.
Toplota sagorevanja(ili kalorijska vrijednost, sadržaj kalorija) je količina toplote koja se oslobađa tokom potpunog sagorevanja goriva.
Za zagrijavanje tijela često se koristi energija koja se oslobađa tokom sagorijevanja goriva. Konvencionalno gorivo (ugalj, nafta, benzin) sadrži ugljenik. Tokom sagorevanja, atomi ugljenika se kombinuju sa atomima kiseonika u vazduhu i formiraju molekule ugljen-dioksida. Ispostavilo se da je kinetička energija ovih molekula veća od one originalnih čestica. Povećanje kinetičke energije molekula tokom sagorevanja naziva se oslobađanjem energije. Energija koja se oslobađa tokom potpunog sagorevanja goriva je toplota sagorevanja ovog goriva.
Toplota sagorevanja goriva zavisi od vrste goriva i njegove mase. Što je veća masa goriva, to je veća količina toplote koja se oslobađa tokom njegovog potpunog sagorevanja.
Fizička veličina koja pokazuje koliko se toplote oslobađa pri potpunom sagorevanju goriva težine 1 kg naziva se specifična toplota sagorevanja goriva.Specifična toplota sagorevanja je označena slovomqi mjeri se u džulima po kilogramu (J/kg).
Količina toplote Q oslobađa se tokom sagorevanja m kg goriva određuje se po formuli:
Da bi se pronašla količina toplote koja se oslobađa tokom potpunog sagorevanja goriva proizvoljne mase, specifična toplota sagorevanja ovog goriva mora se pomnožiti sa njegovom masom.
Samostalni rad iz fizike Agregatna stanja materije Topljenje i očvršćavanje kristalnih tela za učenike 8. razreda. Samostalni rad se sastoji od 2 opcije, svaka sa 5 zadataka.
1 opcija
1. Kako se mijenjaju brzine molekula i razmaci između njih tokom procesa topljenja i očvršćavanja? Koji proces je praćen povećanjem, a kojim smanjenjem unutrašnje energije?
2. Šta se dešava sa ledom na nultoj temperaturi ako se stavi u vodu iste temperature?
3. Šta će više sniziti temperaturu tople vode: komad leda ili ista količina vode na nultoj temperaturi?
4. U jesen je ostala voda u cijevima, a u proljeće se ispostavilo da su cijevi pukle. Zašto?
5. Ponekad se na vjetrobranskom staklu automobila pojavljuju čipovi i zvijezde. Razlog tome je udar kamenja od automobila ispred. Zašto ove nedostatke stakla treba otkloniti prije prvog mraza?
Opcija 2
1. Kalaj se prenosi iz jednog agregatnog stanja u drugo. Da li je postao čvrst ili rastopljen ako se zna da je povećao svoju unutrašnju energiju?
2. U kom slučaju će se voda zagrijati na višu temperaturu: ako se u nju sipa tečni kalaj na temperaturi skrućivanja ili se u njega baci čvrsti kalaj na temperaturi topljenja?
3. Zašto velika posuda s vodom stavljena u podrum čuva povrće od prvog mraza?
4. Ponekad boce vode ostavljene u zamrzivaču puknu. Zašto?
5. Gdje i kada nastaju ledenice?
Odgovori na samostalan rad iz fizike Agregatna stanja materije Topljenje i očvršćavanje kristalnih tijela
1 opcija
1. Prilikom topljenja, brzina molekula se povećava, a pri očvršćavanju se, naprotiv, smanjuje. Prilikom topljenja, unutrašnja energija se povećava, a pri očvršćavanju se smanjuje.
2. Led će sigurno plutati u vodi, jer je gustina leda manja od gustine vode, ali led se definitivno neće otopiti, jer neće dobiti toplotu za topljenje iz vode, jer je izmjena toplote na istoj temperaturi nemoguća.
3. Komad leda, jer će se, osim na zagrijavanje, nešto topline potrošiti i na otapanje leda.
4. Kada se voda smrzne, ona se širi.
5. Budući da će voda ući u ove čipove i kada se smrzavaju, zapremina leda će biti veća od zapremine vode i led će nastaviti da uništava staklo, povećavajući veličinu iverja i pukotine.
Opcija 2
1. Rastopilo se jer je povećalo unutrašnju energiju. A otvrdnjavanje karakteriše činjenica da oslobađa ovu energiju.
2. Ako sipate tečni lim na temperaturi skrućivanja.
3. Ako dođe do iznenadnog zahlađenja, voda će se smrznuti. Kada se voda zamrzne, oslobađa se nešto toplote.
4. Prilikom smrzavanja, volumen vode se povećava.
5. Ledene nastaju kada voda sa mesta gde je temperatura iznad nule polako teče do mesta gde je temperatura ispod nule. Na primjer: sunce grije krov i snijeg se na njemu topi.