7. Tavení a krystalizace (§ 12-14)
1. Prostudujte si výukový materiál
Souhrnné stavy hmoty
Tání a krystalizace
2. Otestujte se. Testy "Skupenství hmoty", "Tání a tuhnutí"
3. Odpovězte na otázky:
1. Jak se mění rychlosti molekul a mezery mezi nimi během procesu tání a tuhnutí? Který proces je doprovázen nárůstem a který poklesem vnitřní energie těla?
2. Co se stane s ledem při nulové teplotě, pokud jej vložíme do vody o stejné teplotě?
3. Co sníží teplotu teplé vody více: kousek ledu nebo stejné množství vody při nulové teplotě?
4. Pomocí tabulky „Bod tání“ zjistěte: v jakém stavu je cín při teplotě 230°C; ocel při teplotě 1503°C; dusíku při teplotě - 215°C?
5. Pomocí grafu odpovězte na otázky:
Jaká je počáteční tělesná teplota?
- V jakém okamžiku začalo tání těla?
- S jakou látkou proběhly tepelné procesy?
- v jakém stavu bylo tělo za 3 minuty po začátku zahřívání?
- Jak dlouho trvalo, než se tělo roztavilo?
- v jakém stavu bylo tělo za 8 minut po začátku zahřívání?
6. Sestrojte graf tepelných procesů probíhajících v těle:
voda: 80°С —› - 10°С
Pokud je led umístěn do nádoby a umístěn nad hořící hořák, nádoba se zahřeje a led začne tát. Dokud však všechen led nezkapalní, teplota vody nestoupne nad 0°C (32°F), bez ohledu na to, jak jsou kamna horká. K tomu dochází díky tomu, že veškeré teplo dodané ledu je využito k překonání fyzikálních sil, které spojují jeho molekuly dohromady.
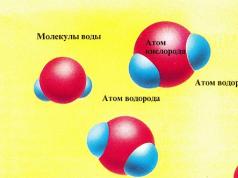
V ledu jsou molekuly vody drženy pohromadě mezimolekulárními vazbami vytvořenými mezi atomem vodíku (zobrazeno modře) jedné molekuly a atomem kyslíku (zobrazeno červeně) druhé. Výsledná hexagonální krystalová struktura má poměrně vysokou pevnost. Při 0 °C se molekuly pohybují tak rychle, že vazby slábnou. Některé z mezimolekulárních vazeb jsou přerušeny, což umožňuje molekulám vody opustit led a vytvořit kapalinu. Tento proces se nazývá fázový přechod (voda přechází z pevné fáze do kapalné fáze) a teplota, při které k němu dochází, se nazývá bod tání.
K přerušení vazeb, které umožňují vodě zůstat v pevném stavu, je zapotřebí energie, a to ve velmi velkém množství, takže veškeré teplo generované hořákem jde na rozbití těchto vazeb, a ne na zvýšení teploty ledu. Teplo potřebné k dokončení fázové transformace popsané výše se nazývá latentní teplo tání nebo teplo fázové změny, protože toto teplo nezpůsobuje zvýšení teploty. Teprve po rozbití posledních vazeb a rozpuštění veškerého ledu se teplota vody začne zvyšovat a překročí 0°C.
Jak taje led?
- V ledu se molekuly vody pohybují tak pomalu, že vždy zůstávají navzájem spojené a tvoří pevnou látku. Když je na led aplikováno teplo (zobrazeno jako žluté kuličky na obrázku vpravo), molekuly vody získávají další energii a pohybují se rychleji, ale stále jsou spolu vázány jako led.
- Pokud dodávka tepla pokračuje, molekuly vody na ledové ploše zvýší rychlost svých vibračních pohybů a naruší mezimolekulární vazby, které je předtím držely na místě. Tyto molekuly opouštějí led a tvoří kapalnou fázi vody. Další přívod tepla vede k destrukci zbývajících mezimolekulárních vazeb a postupnému tání ledu.
- Pokračující přidávání tepla nakonec dodá poslední ze zmrzlých molekul vody dostatek energie k překonání mezimolekulárních vazeb, které je držely pohromadě jako led. Všechna voda se nyní stala tekutou.

Led, voda a teplota

Když je ledu dodáváno teplo (obrázek vlevo), jeho teplota se nejprve zvýší. Při 0 °C (32 °F) se však nárůst teploty zastaví a dojde k fázovému přechodu: led začne tát. Jak ukazuje modrá křivka na grafu, dodatečný přívod tepla vede k dalšímu tání ledu, aniž by se zvýšila teplota vody. Teprve po přeměně veškerého ledu na kapalné skupenství (obrázek nad textem) vede dodatečný přívod tepla ke zvýšení teploty vody.
Přechod látky z pevného krystalického stavu do kapalného se nazývá tání. K roztavení pevného krystalického tělesa je třeba jej zahřát na určitou teplotu, to znamená dodat teplo.Teplota, při které látka taje, se nazývábod tání látky.
Opačný proces – přechod z kapalného do pevného skupenství – nastává, když teplota klesá, tj. odebírá se teplo. Přechod látky z kapalného do pevného skupenství se nazývákalení , nebo krystallizace . Teplota, při které látka krystalizuje, se nazýváteplota krystalůních .
Zkušenosti ukazují, že jakákoli látka krystalizuje a taje při stejné teplotě.
Obrázek ukazuje graf teploty krystalického tělesa (ledu) v závislosti na době ohřevu (od bodu A do té míry D) a doba chlazení (od bodu D do té míry K). Zobrazuje čas na vodorovné ose a teplotu na svislé ose.
Graf ukazuje, že pozorování procesu začalo od okamžiku, kdy teplota ledu byla -40 ° C, nebo, jak se říká, teplota v počátečním okamžiku tzačátek= -40 °C (bod A na grafu). S dalším ohřevem se teplota ledu zvyšuje (na grafu je to řez AB). Teplota se zvýší na 0 °C - teplota tání ledu. Při 0°C začne led tát a jeho teplota přestane stoupat. Po celou dobu tání (tj. dokud neroztaje všechen led) se teplota ledu nemění, ačkoli hořák dále hoří a teplo je tedy přiváděno. Proces tání odpovídá vodorovnému řezu grafu slunce . Teprve poté, co všechen led roztaje a promění se ve vodu, začne teplota opět stoupat (oddíl CD). Po dosažení teploty vody +40 °C hořák zhasne a voda se začne ochlazovat, tj. odebírá teplo (k tomu můžete umístit nádobu s vodou do jiné větší nádoby s ledem). Teplota vody začíná klesat (oddíl DE). Když teplota dosáhne 0 °C, teplota vody přestane klesat, přestože teplo je stále odebíráno. Jedná se o proces krystalizace vody - tvorba ledu (horizontální řez E.F.). Dokud se všechna voda nezmění v led, teplota se nezmění. Teprve poté začne teplota ledu klesat (oddíl FK).
Vzhled uvažovaného grafu je vysvětlen následovně. Umístění zapnuto AB Vlivem dodaného tepla se průměrná kinetická energie molekul ledu zvyšuje a jeho teplota stoupá. Umístění zapnuto slunce veškerá energie přijatá obsahem baňky je vynaložena na destrukci mřížky ledových krystalů: uspořádané prostorové uspořádání jejích molekul je nahrazeno neuspořádaným, mění se vzdálenost mezi molekulami, tzn. Molekuly jsou přeskupeny takovým způsobem, že se látka stává kapalnou. Průměrná kinetická energie molekul se nemění, takže teplota zůstává nezměněna. Další zvýšení teploty roztavené ledové vody (v oblasti CD) znamená zvýšení kinetické energie molekul vody vlivem tepla dodávaného hořákem.
Při chlazení vody (oddíl DE) část energie se jí odebere, molekuly vody se pohybují nižší rychlostí, jejich průměrná kinetická energie klesá - teplota klesá, voda se ochlazuje. Při 0°C (horizontální řez E.F.) molekuly se začnou seřazovat v určitém pořadí a vytvářejí krystalovou mřížku. Dokud není tento proces ukončen, teplota látky se i přes odebrané teplo nemění, což znamená, že při tuhnutí kapalina (voda) uvolňuje energii. To je přesně ta energie, kterou led absorboval a proměnil se v kapalinu (oddíl slunce). Vnitřní energie kapaliny je větší než energie pevné látky. Během tání (a krystalizace) se vnitřní energie tělesa prudce mění.
Nazývají se kovy, které tají při teplotách nad 1650 ºС žáruvzdorný(titan, chrom, molybden atd.). Wolfram má mezi nimi nejvyšší bod tání - asi 3400 ° C. Žáruvzdorné kovy a jejich sloučeniny se používají jako žáruvzdorné materiály v konstrukci letadel, raketové a kosmické technice a jaderné energetice.
Ještě jednou zdůrazněme, že při tání látka pohlcuje energii. Při krystalizaci jej naopak uvolňuje do okolí. Přijetím určitého množství tepla uvolněného během krystalizace se médium zahřeje. To je dobře známo mnoha ptákům. Není divu, že je lze vidět v zimě v mrazivém počasí, jak sedí na ledu, který pokrývá řeky a jezera. Díky uvolňování energie při tvorbě ledu je vzduch nad ním o několik stupňů teplejší než na stromech v lese a ptáci toho využívají.
Tavení amorfních látek.
Dostupnost určitého body tání- To je důležitá vlastnost krystalických látek. Právě podle tohoto znaku je lze snadno odlišit od amorfních těles, která se také řadí mezi pevné látky. Patří sem zejména sklo, velmi viskózní pryskyřice a plasty.
Amorfní látky(na rozdíl od krystalických) nemají konkrétní bod tání – netajou, ale měknou. Při zahřátí například kus skla nejprve změkne z tvrdého, lze jej snadno ohnout nebo natáhnout; při vyšší teplotě začne díl vlivem vlastní gravitace měnit svůj tvar. Jak se zahřívá, hustá viskózní hmota nabývá tvaru nádoby, ve které leží. Tato hmota je nejprve hustá jako med, pak jako zakysaná smetana a nakonec se stává téměř stejnou kapalinou s nízkou viskozitou jako voda. Nelze zde však uvést určitou teplotu přechodu pevné látky v kapalinu, protože ta neexistuje.
Důvody toho spočívají v zásadním rozdílu ve struktuře amorfních těles od struktury krystalických. Atomy v amorfních tělesech jsou uspořádány náhodně. Amorfní tělesa svou stavbou připomínají kapaliny. Již v pevném skle jsou atomy uspořádány náhodně. To znamená, že zvyšování teploty skla pouze zvyšuje rozsah vibrací jeho molekul, čímž jim dává postupně větší a větší volnost pohybu. Sklo proto postupně měkne a nevykazuje ostrý přechod „pevná látka-kapalina“, charakteristický pro přechod od uspořádání molekul v přísném pořadí k uspořádání neuspořádanému.
Teplo tání.
Teplo tání- to je množství tepla, které musí být odevzdáno látce při konstantním tlaku a konstantní teplotě rovné bodu tání, aby se zcela přeměnila z pevného krystalického stavu na kapalný. Skupenské teplo tání se rovná množství tepla, které se uvolní při krystalizaci látky z kapalného stavu. Během tání veškeré teplo dodávané látce zvyšuje potenciální energii jejích molekul. Kinetická energie se nemění, protože tání probíhá při konstantní teplotě.
Experimentálním studiem tání různých látek stejné hmotnosti si lze všimnout, že k jejich přeměně na kapalinu je zapotřebí různá množství tepla. Například, abyste roztavili jeden kilogram ledu, musíte vynaložit 332 J energie a pro roztavení 1 kg olova - 25 kJ.
Množství tepla uvolněného tělem je považováno za negativní. Proto při výpočtu množství tepla uvolněného při krystalizaci látky s hmotou m, měli byste použít stejný vzorec, ale se znaménkem mínus:
Spalné teplo.
Spalné teplo(nebo výhřevnost, obsah kalorií) je množství tepla uvolněného při úplném spálení paliva.
K ohřevu těles se často využívá energie uvolněná při spalování paliva. Konvenční palivo (uhlí, ropa, benzín) obsahuje uhlík. Během spalování se atomy uhlíku spojují s atomy kyslíku ve vzduchu a vytvářejí molekuly oxidu uhličitého. Kinetická energie těchto molekul se ukáže být větší než u původních částic. Nárůst kinetické energie molekul při spalování se nazývá uvolňování energie. Energie uvolněná při úplném spalování paliva je spalné teplo tohoto paliva.
Spalné teplo paliva závisí na druhu paliva a jeho hmotnosti. Čím větší je hmotnost paliva, tím větší je množství tepla uvolněného při jeho úplném spalování.
Fyzikální veličina udávající, kolik tepla se uvolní při úplném spálení paliva o hmotnosti 1 kg měrné spalné teplo paliva.Měrné spalné teplo je označeno písmenemqa měří se v joulech na kilogram (J/kg).
Množství tepla Q uvolňuje při spalování m kg paliva se určuje podle vzorce:
Pro zjištění množství tepla uvolněného při úplném spálení paliva libovolné hmotnosti je třeba měrné spalné teplo tohoto paliva vynásobit jeho hmotností.
Samostatná práce ve fyzice Souhrnné skupenství látek Tání a tuhnutí krystalických těles pro žáky 8. ročníku. Samostatná práce se skládá ze 2 možností, každá s 5 úkoly.
1 možnost
1. Jak se mění rychlosti molekul a prostory mezi nimi během procesu tání a tuhnutí? Který proces je doprovázen nárůstem a který poklesem vnitřní energie?
2. Co se stane s ledem při nulové teplotě, pokud se vloží do vody o stejné teplotě?
3. Co sníží teplotu teplé vody více: kousek ledu nebo stejné množství vody při nulové teplotě?
4. Na podzim zůstala v potrubí voda a na jaře se ukázalo, že potrubí prasklo. Proč?
5. Někdy se na čelním skle automobilu objevují čipy a hvězdy. Důvodem je náraz kamenů od aut vpředu. Proč je potřeba tyto vady skla odstranit před prvním mrazem?
Možnost 2
1. Cín se přenáší z jednoho stavu agregace do druhého. Stalo se pevným nebo roztaveným, pokud je známo, že zvýšil svou vnitřní energii?
2. V jakém případě se voda zahřeje na vyšší teplotu: když se do ní nalije tekutý cín při teplotě tuhnutí nebo se do ní vhodí pevný cín při teplotě tání?
3. Proč velká nádoba s vodou umístěná ve sklepě zachrání zeleninu před prvním mrazem?
4. Někdy prasknou lahve s vodou, které zůstaly v mrazáku. Proč?
5. Kde a kdy se tvoří rampouchy?
Odpovědi na samostatnou práci ve fyzice Souhrnné stavy látek Tání a tuhnutí krystalických těles
1 možnost
1. Při tání se rychlost molekul zvyšuje, při tuhnutí naopak klesá. Při tání se vnitřní energie zvyšuje, při tuhnutí se snižuje.
2. Led bude určitě plavat ve vodě, protože hustota ledu je menší než hustota vody, ale led rozhodně neroztaje, protože nebude přijímat teplo pro tání z vody, protože výměna tepla při stejné teplotě je nemožná.
3. Kus ledu, protože kromě zahřívání se nějaké teplo spotřebuje na tání ledu.
4. Když voda zamrzne, roztáhne se.
5. Protože se do těchto třísek dostane voda a při zmrazování bude objem ledu větší než objem vody a led bude dále ničit sklo, zvětšovat třísku a praskat.
Možnost 2
1. Roztavil se, protože zvýšil vnitřní energii. A otužování se vyznačuje tím, že tuto energii uvolňuje.
2. Pokud nalijete tekutý cín při teplotě tuhnutí.
3. Pokud dojde k náhlému ochlazení, voda zmrzne. Když voda zamrzne, uvolňuje se trochu tepla.
4. Při zmrazování se objem vody zvětšuje.
5. Rampouchy se tvoří, když voda z místa, kde je teplota nad bodem mrazu, pomalu teče tam, kde je teplota pod nulou. Například: slunce ohřívá střechu a sníh na ní taje.