12884 0
При гістероскопії у першій половині фази проліферації (до 7-го дня циклу) ендометрій блідий, тонкий, з дрібними крововиливами та одиничними блідо-рожевими ділянками не відкинутого ендометрію. Устя маткових трубдобре помітні.
У другій половині фази проліферації (з 9-го дня циклу) ендометрій блідо- рожевого кольору, потовщений, судини не виражені. Пізніше на окремих ділянках розрізняються потовщені поздовжні або поперечні складки.
У фазі секреції ендометрій жовтого кольору, потовщений. Визначаються особливо добре виражені у верхній третині тіла матки складки. За 2-3 дні до менструації ендометрій червоного кольору з ділянками відторгнення темно-червоного кольору. Гирла маткових труб можуть бути приховані складками ендометрію.
Перші 2-3 дні під час менструації порожнина матки заповнена пластами ендометрію, що відторглися: у верхній третині темно-багряного кольору, у нижній і середній - блідо-рожевого.
У період постменопаузи при гістероскопії виявляється картина атрофії ендометрію. При цьому ендометрій витончений, має бліде забарвлення.
При кол'поскопії слизова оболонка шийки матки гладка, блискуча, рожевого кольору.
У жінок у постменопаузальному періоді в нормі визначається стоншення епітелію, через який просвічують судини.
При лапароскопії незмінена матка покрита блискучою очеревиною, має рівну поверхню та характерну форму із симетрією щодо поздовжньої площини.
При гістеросальпінгографії тінь порожнини матки має вигляд трикутника зі злегка увігнутими сторонами та чіткими рівними контурами. Основа трикутника звернена вгору, а вершина – вниз.
Верхні кути відповідають отворам маткових труб, нижній кут – внутрішньому отвору каналу шийки матки. Порожнина матки містить від 4 до 6 мл контрастної рідини.
При ультрасонографії контури нормальної матки чіткі та рівні, форма овальна або грушоподібна. Ехоплотність ендометрію вище ехоплотності міометрію, яка не змінюється в залежності від фази менструального циклу. Ехоструктура незміненого міометрію є дрібнодисперсною за рахунок безлічі точкових та лінійних ехосигналів.
Ендометрій визначається як ехопозитивне утворення лінійної (після закінчення менструальної кровотечі), овальної або краплеподібної форми. Відразу після закінчення менструального циклу ендометрій простежується у вигляді ехопозитивної смужки завтовшки 1-2 мм.

На 8-10 дні циклу (середина фази проліферації) ендометрій дещо потовщується, середньому до 8 мм (від 5 до 10 мм). Ехоструктура, порівняно з попереднім періодом, практично не змінюється.

У фазу пізньої проліферації (11-14 дні) крім подальшого потовщення, в середньому до 11 мм (від 7 до 14 мм), ехогенність ендометрію починає дещо підвищуватися і наближається до середньої.

У фазу ранньої секреції (15-18 дні) темпи збільшення ендометрію знижуються, він сягає товщини 12 мм. Ехогенність ендометрію продовжує підвищуватися від периферії до центру, внаслідок чого гіпоехогенний центральний фрагмент набуває краплеподібної форми ( широка частинав ділянці дна матки звужується у напрямку до шийки). У цю фазу гіперехогенна лінія у центрі візуалізується вже нечітко.

У фазу середньої секреції (19-23 дні) ендометрій досягає максимальної товщини – у середньому 14 мм (від 12 до 18 мм). Ехогенність ендометрію підвищується ще більше, гіперехогенна лінія у центрі чітко не візуалізується.

На 24-27 дні циклу (пізня секреція) товщина ендометрію дещо зменшується – у середньому до 12 мм (від 10 до 17 мм). Особливістю цього періоду є висока ехогенність ендометрію у поєднанні з його неоднорідною внутрішньою ехоструктурою, за рахунок чого лінія змикання перестає візуалізуватися.

Під час менструації в порожнині матки визначається тонка гіперехогенна смужка або гіперехогенні ехоструктури (згустки крові). Іноді порожнина виглядає трохи розширеною за рахунок ехонегативного вмісту.

Порожнина матки в постменопаузі є М-ехо у вигляді тонкої гіперехогенної лінії зазвичай 1-2 мм (не більше 4-5 мм) товщиною.

При ядерно-магнітної томографії (ЯМТ) у першій половині циклу ендометрій на серединному сагіттальному зрізі визначається як тонка лінія (до 3 мм), міометрій виглядає як однорідна структура з рівними контурами.

У другій половині циклу ендометрій візуалізується як досить однорідна структура товщиною в середньому 7 мм, інтенсивніша ніж міометрій.

У періоді постменопаузи на томограмах визначається зменшення об'єму матки зі зниженням інтенсивності зображення міометрія, при цьому ендометрій, як правило, не візуалізується.

Шийка матки на томограмах визначається як неінтенсивна зона циліндричної форми з чітким рівним контуром, структура та порожнина якої відповідають тілу матки При ультрасонографії шийковий канал, як правило, не візуалізується.
В.М. Сєров, І.М. Звенигородський
Dueholm, C. Møller, S. Rydbjerg, E. S. Hansen, G. Ørtoft
P.G.Leone, D.Timmerman, T.Bourne, L.Valentin, E.Epstein, S.R.Goldstein, H.Marret, A.K.Parsons, B.Gull, O.Istre, W.Sepulveda, E.Ferrazzi, T.Van den Bosch
Трансвагінальне ультразвукове обстеженнямає велике значенняу діагностиці раку ендометрію у жінок із постменопаузальною кровотечею. Жінки з ендометрієм товщиною ≤ 4 мм, виміряним за допомогою трансвагінального сканування, мають низький ризик розвитку раку ендометрію (1 на 100 випадків, якщо вони не приймають замісну). гормональну терапію 1 на 1000, якщо вони приймають терапію). У жінок з постменопаузальною кровотечею та товщиною ендометрію ≥ 5 мм присутній високий ризикраку ендометрію (1 на 4 випадки), тому необхідно отримати якісний внутрішньоматковий зішкріб для гістологічного аналізу. Ультразвукове дослідження може надати інформацію про індивідуальний ризик злоякісних новоутвореньу жінок у постменопаузі з кровотечею та товщиною ендометрію ≥ 5 мм.
Наше дослідження включає жінок з постменопаузальною кровотечею та товщиною ендометрію ≥ 5 мм, який був виміряний трансвагінальним датчиком. Дослідження проводилося в Університетській клініці в Орхусі, Данія, у період з листопада 2010 по лютий 2012. Всім жінкам проводили трансвагінальне сканування (TVS) та гель-інфузійну сонографію (ГІС), всі були заплановані на гістероскопію з резектоскопом. патології (Таб.1).
Таблиця 1. Схема відбору пацієнтів на дослідження.
Трансвагінальне сканування (TVS)
TVS проводили на апараті Voluson E8 Expert, обладнаному ендовагінальним датчиком (6-12 МГц), згідно з протоколом сканування. Параметри доплерографії було налаштовано заздалегідь, стандартизовано (частота 6 МГц, коефіцієнт посилення потужності допплера 50, динамічний діапазон 10 дБ; персистентність 2, колір карти 1, фільтр 3).
TVS сканування включало візуальну оцінку наступних параметрів, визначених Міжнародною групоюПухлинного Аналізу Ендометрія (IETA): товщина ендометрію, його ехогенність (гіпер-, гіпо-, та ізоехогенний, гомо/гетерогенний), кістозний компонент (так/ні), якщо є, то рівні або нерівні межі, межі ендометрію (рівні або нерівні) , гомо-/гетерогенні), лінія змикання (так/ні), перервана (так/ні)).
Аналіз енергетичного допплера включав візуальну оцінку наступних параметрів: судини (існуючі (так/ні), наявність домінуючої судини (так/ні), якщо домінуючий посуд є, то одиничний (так/ні) або подвійний (так/ні), походження (фокусне) / мультифокусне) множинні судини (так / ні); (так/ні), щільність розташування судин (так/ні).
Гель-інфузійна сонографія (ГІС)
ГІС було проведено після TVS. Ми використовували невеликий гнучкий стерильний катетер, оснащений шприцом на 10 мл, що містить Instillagel® (E.Tjellesen A/S, Lynge, Данія), який вводився в порожнину матки. У пацієнтів із непрохідною шийкою матки ми використовували невеликий розширювач Гегара. Введення гелю в порожнину матки проводили під контролем УЗД.
Порожнину матки потім сканували в сагітальній та поперечній площинах, оцінюючи ті ж параметри, що і для звичайного TVS. Також було оцінено: наявність освіти, її локалізацію та відсоток ураження ендометрію (тобто пошкоджено ≤ 25% поверхні) (так/ні); Структура поверхні локального ушкодження (рівномірна/нерівномірна); Структура загальної поверхні ендометрію (гладка, поліпоподібна, нерівна).
Гістероскопія
Амбулаторна гістероскопія проведена всім пацієнтам з використанням місцевої або загальної анестезії. У 112 пацієнтів гістероскопія була виконана відразу після ультразвукового дослідження, в інших пацієнтів при наступному візиті протягом 3 тижнів після ультразвукового дослідження. Під час гістероскопії були спроби видалити всю тканину з порожнини матки. У одного пацієнта було відібрано від трьох до п'яти зразків ендометрію.
Розрахунок ризику розвитку раку ендометрію за бальною системою
(Risk of endometrial cancer score (REC score))
На основі наших аналізів ми розробили систему підрахунку балів ризику розвитку раку ендометрію (Рис.1). Система підрахунку балів включила індекс маси тіла (≥30 = 1 бал), товщину ендометрію (≥10мм = 1 бал), (≥15мм = 1 бал), наявність васкуляризації, домінантну судину (присутня = 1 бал), кілька судин (присутні = 1 бал), великі судини (присутні = 1 бал) та щільно розташовані судини (присутні = 1 бал), переривчаста ендоміометріальна зона (присутня = 1 бал) та нерівна поверхня ендометрію при ГІС (присутня = 1 бал). Додавання цих значень становить бал ризику розвитку раку ендометрію. Кількість балів 3 для TVS або 4 для ГІС показали хороші результати під час сканування та правильно діагностували високий рівеньрозвитку раку ендометрію близько 90% всіх пацієнтів.

Рис.1. Схематичне зображення визначення ризику розвитку раку ендометрію за бальною системою.
УЗД параметри дослідження ендометрію визначено Міжнародною Групою Пухлинного Аналізу Ендометрія (IETA)
Товщина ендометрію вимірюється в сагітальній площині. Каліпери повинні бути розміщені на межі ендометріально-міометріального шару, перпендикулярно до середньої лінії ендометрію (рис.2). Коли є рідина, тоді вимірюється товщина окремих частин ендометрію і сума їх записується (рис.2b).

Рис.2. Схематичне та УЗ-зображення вимірювання ендометрію в нормі (а), та за наявності внутрішньоматкової рідини (b).
Ехогенність ендометрію оцінюється в порівнянні з ехогенністю міометрія, як гіперехогенний, ізоехогенний або гіпоехогенний.
Гомогеність ендометрію оцінюється за його структурою. "Гомогенний" ендометрій є однорідним і має тришарову структуру (Рис.3). "Гетерогенний" ендометрій описується, якщо є неоднорідність структури, асиметрія або кістозні утворення(Мал.4).

Рис.3. "Гомогенний" ендометрій: (a) схематичне зображення тришарового ендометрію, (b) гіпоехогенний, (c) гіперехогенний, (d) ізоехогенний.
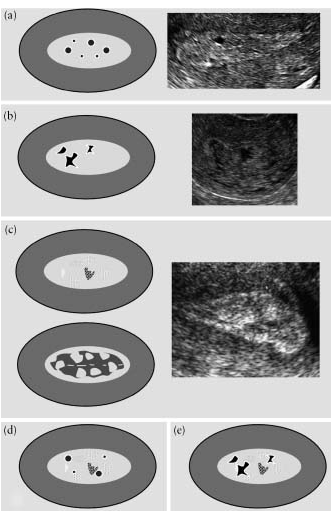
Рис.4. "Гетерогенний" ендометрій: на однорідному тлі візуалізуються кістозні утворення з рівними краями (а), на однорідному тлі спостерігаються кістозні утворення з нерівними краями (b), гетерогенний фон без кістозних ділянок (с), на гетерогенному тлі присутні кістозні утворення з рівними d) та на гетерогенному тлі кістозні утворення з нерівними краями (е).
Ендометрій вважається "лінійним", якщо лінія змикання листків ендометрію визначається як пряма, і "нелінійним", якщо лінія змикання візуалізується як "зазубрена" або "перервана" або взагалі відсутня (рис.5).
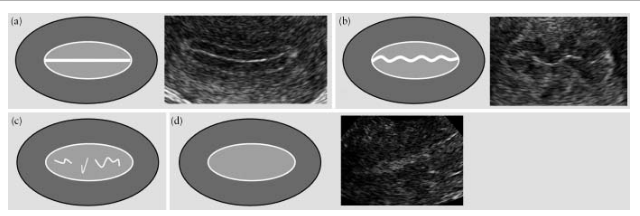
Рис.5. Лінія змикання листків ендометрію: "лінійна" (а), "зазубрена" (b), "перервана" (с) і така, яка не візуалізується (d).
Ендометріально-міометріальна ділянка описується як "рівна", "нерівна", "перервана" або "невизначена" (рис.6).

Рис.6. Ендометріально-міометріальна ділянка: “рівна” (a), “нерівна” (b), “перервана” (c) та “невизначена” (d).
Внутрішньоматочна рідина описується як анехогенна, ізоехогенна, змішаної ехогенності (Рис.7).

Рис.7. Внутрішньоматочна рідина: (a) гіпоехогенна, (b) ізоехогенна, (c) змішаної ехогенності.
Оцінка доплерометрії
Налаштування доплера повинні бути скориговані, щоб забезпечити максимальну чутливість (частота ультразвуку не менше 5,0 МГц, частота повторення імпульсів (PRF) 0,3-0,9 кГц, фільтр стінки судин 30-50 Гц, посилення кольору доплера має бути зменшено до тих пір, поки всі кольорові артефакти не зникнуть).
Допплер оцінюється за присутністю кровотоку: 1 бал дається, коли немає потоку кольорових сигналів в ендометрію, 2 бали, якщо тільки мінімальний кровотік може бути виявлений, 3 бали - коли помірний кровотік присутній, і оцінка 4, коли проявляється значний кровотік (Рис.8) .
ОБГОВОРЕННЯ
Ми побудували систему підрахунку балів (REC), що дозволяє ефективно відрізняти доброякісні та злоякісні утворенняендометрію. REC система підрахунку балів правильно визначила новоутворення у дев'яти із 10 жінок у постменопаузі з товщиною ендометрію ≥ 5 мм. Підхід розрахунку балів може бути використаний зниження кількості проведення інвазивних процедур.
Ми користувалися термінами та класифікацією, визначеними Міжнародною групою пухлинного аналізу ендометрію (IETA), які можна використовувати для вимірювання та опису патології з локалізацією в порожнині матки. Основна мета даної роботи полягає у створенні списку термінів та визначень, які можуть бути використані як у щоденній практиці лікарів, так і у наукових дослідженнях.
На думку В.М. Демидова та А.І. Гуса, ультразвукове дослідженняендометрію слід здійснювати у перші три дні після закінчення менструації, в нормі в цей час ендометрій має бути повністю однорідним та гіпоехогенним.
При залізистої гіперплазії(ГЕ) товщина ендометрію становить 1-1.5 см, рідко досягаючи 2.0 см. Ехогенність гіперплазії підвищена, ехоструктура однорідна, часто з множинними анехогенними включеннями. Іноді дистальніше ГЕ відзначається акустичний ефект посилення (рис. 1-4). При візуалізації ділянок підвищення ехогенності на тлі практично незміненого ендометрію можливий висновок про наявність осередкової гіперплазіїендометрію (рис.).
Абсолютно неоднозначна ситуація з ультразвуковою діагностикоюатипової гіперплазії ендометрію (АГЕ) Ряд авторів зазначають, що специфічних ехографічних критеріїв діагностики АГЕ немає. Товщина ендометрію при цьому стані коливається в межах 1.5-2.0 см, в окремих випадках досягаючи 3.0 см. Ехогенність АГЕ середня, ехоструктура однорідна (рис.5-6).
Як слушно зазначають В.М. Демидов та А.І. Гус, незважаючи на суттєві морфологічні відмінності поліпів ендометрію (залізисті, залізисто-фіброзні, фіброзні, аденоматозні), в їх ехографічному зображенні є багато спільного. Типова ехокартина поліпа ендометрію (ПЕ) - овальне або округле утворення середньої або підвищеної ехогенності з чіткою межею між поліпом та навколишніми тканинами, як правило, у вигляді анэхогенного обідка (рис. 7-15).
Розміри поліпів можуть дуже суттєво варіювати, від 0,5 см до 4-6 см (у разі залізисто-фіброзних та аденоматозних ПЕ). За наявності дрібних ПЕ (<0.5 см) диагностика затруднена, и, как замечают В.Н. Демидов и А.И. Гус, единственным эхопризнаком может явиться деформация срединной линейной гиперэхогенной структуры М-эхо.
Доплерографіяпри гіперпластичних процесах ендометрію. За даними Б.І. Зикіна, при ГЕ кровотік усередині слизової оболонки або не реєструвався (у 75-80% хворих), або візуалізувалися нечисленні колірні локуси (рис. 16).
Колірна доплерографія поліпів ендометрію виявляла живильну судину у вигляді "колірного містка" між суб-і ендометріальною зонами (рис. 17-18).
Показники кровотоку при доброякісних гіперпластичних процесах ендометрію характеризувалися низькою швидкістю та досить високою резистентністю (рис. 19-21, табл. 1). Подібні дані отримані іншими авторами.
Таблиця №1.Показники інтраендометріального кровотоку при гіперпластичних процесах (Б.І. Зыкін, 2001).
Рак ендометрію
Дуже велика кількість робіт присвячена спробі співвіднести ризик раку ендометрію (РЕ) з товщиною М-ехо, особливо в постменопаузі. Так A. Kurjak та співавт вважають патогномонічним для РЕ товщину ендометрію >8 мм у перименопаузі, та >5 мм у постменопаузі. S. S. Suchocki та співавт. не виявили жодного випадку раку або гіперплазії при товщині ендометрію Ряд авторів звертають особливу увагуна дуже низьку специфічність потовщення ендометрію як критерію РЕ. Так, за даними I. Fistonic і співавт. у пацієнток із постменопаузальними кровотечами товщина ендометрію становила: 6.2 мм при атрофії ендометрію, 12.4 мм при простій гіперплазії, 13.4 мм при комплексній гіперплазії, 14.1 мм при карциномі. Автори не виявили достовірних відмінностей у товщині ендометрію між групами з гіперплазією та карциномою. При цьому середній вікхворих з карциномою був достовірно вищим (62 роки). Bakour та співавт. , Використовуючи товщину ендометрію 4 мм, як критерій малігнізації, змогли діагностувати карциному ендометрію з чутливістю, специфічністю, ПЦПР, ПЦОР 92.9%, 50,0%, 24.1%, 97.6%. Автори приходять до висновку, що у жінок з постменопаузальною кровотечею товщина ендометрію.<4 мм позволяет с высокой вероятностью исключить вероятность карциномы, однако толщина 4 мм не добавляет значимой информации о наличии или отсутствии малигнизации.
При діагностиці РЕ суттєву роль може відіграти оцінка внутрішньої ехоструктури М-луна. На думку Т.Дубінскій і співавт. тонкий гомогенний ендометрій є прогностичною ознакою доброякісної знахідки, тоді як візуалізація неоднорідної ехоструктури завжди потребує гістологічного дослідження для уточнення діагнозу. Комбіноване використання трьох ехографічних критеріїв (товщина 5мм, нерівний контур, неоднорідна ехоструктура) дозволило G.Weber та співавт. діагностувати карциному ендометрію з чутливістю, специфічністю, ПЦПР, ПЦОР 97%, 65%, 80%, 94%.
Важливе значення має можливість ехографічної оцінки злоякісної інвазії у міометрії. Так, за даними F. Olaya і співавт. при діагностиці глибокої інвазії карциноми ендометрію в міометрій (>50%) чутливість, специфічність та точність трансвагінальної ехографії склали 94.1%, 84.8%, 88%. При диференціації ступеня інвазії карциноми ендометрію в міометрій (інвазії немає, інвазія прилеглих до ендометрію шарів, глибока інвазія) чутливість, специфічність та точність трансвагінальної ехографії склали 66.2%, 83.1%, 7. Отримані результати можна порівняти з ефективністю МРТ без контрастування, і трохи нижче ефективності МРТ з контрастуванням.
На особливу увагу заслуговують роботи, автори яких описують випадки карциноми ендометрію в постменопаузі з тонким або навіть невізуалізованим ендометрієм, або при поєднанні ехокартини атрофії ендометрію та серометри (вважається, що ехокартина рідини в порожнині матки супроводжує 50% випадків раку ендометрію). Так S. Li та співавт. виявили рак ендометрію у 3,9% пацієнток із товщиною ендометрію.<5мм. По данным М. Briley и соавт. , при постменопаузальном кровотечении у 20% пациенток с невизуализируемым эндометрием имела место карцинома. Авторы считают, что у пациенток с постменопаузальным кровотечением при визуализации тонкого эндометрия (<6мм) биопсии можно избежать, однако утолщенный, и что важно - невизуализируемый эндометрий являются показанием для биопсии. H. Krissi и соавт. описали рак эндометрия при эхокартине атрофии в сочетании с серометрой, считая, что последняя может служить показанием для биопсии, поскольку компрессия стенок матки при серометре может скрывать патологические изменения эндометрия. В то же время R. Bedner и соавт. полагают, что небольшая серометра в постменопаузе (до 5 см3) вряд ли может ассоциироваться с карциномой эндометрия, описывая случай последней с объемом внутриматочной жидкости 12см3.
Переходячи до деталізації ехо ознак РЕ, необхідно нагадати, що останній ділиться на I патогенетичний варіант (РЕ-I), що виникає на тлі гіперплазії ендометрію, і II патогенетичний варіант, що виникає на тлі атрофії ендометрію (РЕ-II).
- Велика товщина М-луна, що становить більше половини товщини матки
- Нерівність та нечіткість контурів
- Підвищена ехогенність
- Підвищена звукопровідність
- Неоднорідна внутрішня ехоструктура
- Внутрішні рідинні включення
- Нерівномірне витончення міометрія, що свідчить про інвазію
- Рідина у порожнині матки. Ехокартина РЕ-II абсолютно неспецифічна, але цей тип слід запідозрити, виявивши у жінки з постменопаузальною кровотечею наступні ехоознаки (рис. 28)
- Невізуалізований ендометрій
- Рідина у порожнині матки.
|
Таким чином, підсумовуючи розділ, присвячений ехографічній діагностиці РЕ, не можна не погодитись з Б.І. Зыкиным , вважає, що з діагностики раку ендометрію показник товщини перестав бути визначальним, і що робить висновок, що у сучасному етапі трансвагінальна ехографія (В-режим) вичерпала себе як метод діагностики РЕ, досягнувши стелі точності 75-85%.
Доплерографія при РЕ. Як зазначає Б.І. Зыкін, при РЕ-I у 100% хворих виявлявся інтраендометріальний кровотік у вигляді множинних, частіше за хаотично розташованих колірних локусів (рис. 24). Доплерометричні показники характеризувалися високою швидкістю та низькою резистентністю кровотоку (рис. 25-27, табл. 2). Подібні дані отримані більшістю авторів, які займаються цією проблемою.
| Малюнок 26 |
| Рак ендометрію (І-й патогенетичний варіант) Низька резистентність кровотоку |
| Малюнок 27 |
| Рак ендометрію (І-й патогенетичний варіант) Висока швидкість кровотоку |
При РЕ-II у проекції атрофованої слизової оболонки колірні локуси не візуалізувалися, а рак видавав себе лише помітним посиленням кровотоку в субендометріальних зонах міометрія (рис. 28). Таким чином, єдиним ультразвуковим критерієм, що дозволяє запідозрити малігнізацію ендометрію, стала не товщина ендометрію, а аномальні колірні локуси.
Таблиця 2.Показники інтраендометріального кровотоку при карциномі ендометрію (Б.І. Зыкін, 2001).
Безперечно, що широке поширення високодозволяючої трансвагінальної ехографії та доплерографії істотно підніме рівень ранньої виявленості РЕ, і, можливо, знизить частоту необґрунтованих кюретажів у жінок із постменопаузальними кровотечами.
- Демідов В.М., Гус А.І. Ультразвукова діагностика гіперпластичних та пухлинних процесів ендометрію У книзі: Клінічне посібник з ультразвукової діагностики / За ред. Мітькова В.В., Медведєва М.В. Т. 3. М.: Відар, 1997. С. 175-201.
- Демідов В.М., Зикін Б.І. Ультразвукова діагностика у гінекології // М. Медицина. 1990.
- Медведєв М.В., Зыкін Б.І., Хохолін В.Л., Стручкова Н.Ю. Диференціальна ультразвукова діагностика у гінекології // М. Відар. 1997
- Зикін Б.І. Стандартизація доплерографічних досліджень в онкогінекології // Дисертація на здобуття наукового ступеня доктора медичних наук. Москва. 2001. 275.С.
- Kurjak A., Kupesic S., (Ed.) Ан Atlas of transvaginal color Doppler. Second edition. // The Parthenon publishing group. Нью-Йорк. London. 2000. P.161-178.
- Suchocki S., Luczynski K., Szymczyk A., Jastrzebski A., Mowlik R. Evaluation of endometrial thickness transvaginal ultrasonography as screening method in early diagnosis of endometrial cancer // Ginekol-Pol. 1998 May., 69 (5): 279-82.
- Bakour SH., Dwarakanath LS., Khan KS., Newton JR., Gupta JK. Діагностична надмірність ультразвукового сканування в профілактиці endometrial hyperplasia and cancer in postmenopausal bleeding // Obstet Gynecol Scand. 1999 May., 78 (5): 447-51.
- Fistonic I., Hodek B., Klaric P., Jokanovic L., Grubisic G., Ivicevic Bakulic T. Transvaginal sonographic assessment premalignant і malignant зміни в endometrium в postmenopausal bleeding // J Clin Ultrasound. 1997 Oct., 25 (8): 431-5.
- Dubinsky TJ., Stroehlein K., Abu Ghazzeh Y., Parvey HR., Maklad N Prediction of benign and malignant endometrial disease: hysterosonographic-pathologic correlation // Radiology. 1999 Feb., 210 (2): 393-7.
- Weber G., Merz E., Bahlmann F., Rosch B. Evaluation of different transvaginal sonographic diagnostic parameters in women with postmenopausal bleeding // Ultrasound Obstet Gynecol. 1998 Oct., 12 (4): 265-70.
- Olaya FJ., Dualde D., Garcia E., Vidal P., Labrador T., Martinez F., Gordo G. Transvaginal sonography в endometrial carcinoma: preoperative assessment depth myometrial invasion in 50 cases // Eur J Radiol. 1998 Feb., 26 (3): 274-9.
- Медведєв В.М., Чекалова М.А., Терегулова Л.Є. Рак ендометрію // У книзі: Доплерографія в гінекології. За редакцією Зикина Б.І., Медведєва М.В. 1-е видання. М. РАВУЗДПГ, Реальний час. 2000. С. 145-149.
- Li S., Gao S. Diagnostic value endometrial assessment by transvaginal ultrasonography in patients with postmenopausal bleeding // Chung Hua Fu Chan Ko Tsa Chih. 1997 Jan., 32 (1): 31-3.
- Briley M., Lindsell DR. Участь transvaginal ultrasound in investigation of women with post-menopausal bleeding // Clin Radiol. 1998 Jul., 53 (7): 502-5.
- Krissi H., Bar Hava I., Orvieto R., Levy T., Ben Rafael Z. Ендометричні карциноми в post-menopausal woman with atrophic endometrium and intra-cavitary fluid: case report // Eur J Obstet Gynecol Reprod Biol. 1998 Apr., 77 (2): 245-7.
- Bedner R., Rzepka Gorska I. Diagnostic value uterine cavity fluid collection in detection of pre-neoplastic lesions and endometrial carcinoma in asymptomatic post-menopausal women // Ginekol Pol. 1998 May., 69 (5): 237-40.
Copyright © 2000-2006 "Іскра Медікал Корпорейшн", Буланов М.М.
Всі права захищені. Ніяка частина цієї сторінки (включаючи текст, ілюстрації та файли) не може бути відтворена в будь-якій формі та будь-якими засобами без письмового дозволу власників авторських прав.Згідно зі світовою статистикою, рак тіла матки посідає 7-е місце серед злоякісних захворювань. Аналіз онкологічної ситуації в останнє десятиліття в Росії свідчить про неухильне зростання захворюваності на рак ендометрію, який до 2007 р. посів 2-е місце серед усіх злоякісних пухлин у жінок. Частка раку тіла матки у структурі захворюваності на злоякісні новоутворення на 100 000 жіночого населення Росії у різних регіонах коливається від 4,5 до 22,5. Простежується неухильне зростання частоти захворюваності з 9,8 у 1990 р. до 13,9 у 2005 р., що відповідає 3-му місцю за величиною показників приросту захворюваності на злоякісні новоутворення. В даний час збільшення числа вперше виявлених випадків раку тіла матки не поступається такому при пухлинах молочної залози. У країнах третього світу ризик розвитку раку тіла матки загалом нижчий, при цьому рівень смертності залишається високим. У країнах Північної Америки та Європи дане захворювання зустрічається значно частіше, будучи найпоширенішою злоякісною пухлиною жіночої статевої системи, і займає 4-е місце серед усіх злоякісних новоутворень після раку молочної залози, легень та товстої кишки. Захворюваність на рак ендометрію у віці від 40 до 54 років різко підвищується, пік захворюваності припадає на вік 60-64 роки. Частота поширення раку ендометрію та її динаміка в різних країнах з урахуванням впливу міграційних процесів та віку вказують на специфічні особливості захворювання та залежність його виникнення від комплексу причин ендо- та екзогенної природи.
Серед факторів ризику розвитку раку тіла матки привертають увагу мала кількість пологів або безпліддя, ожиріння, пізня менопауза, цукровий діабет, переважно 2-го типу. У більшості випадків ризик розвитку раку ендометрію асоціюється з різними формами гіперплазій ендометрію – 81,3%, дисфункцією на тлі полікістозу яєчників – 25%, поліпозом ендометрію – 5,3-25%, міомою матки – 1,6-8%. Останнім часом наголошується на суттєвому збільшенні місцевопоширених форм раку ендометрію, що пов'язано з неефективними заходами первинної діагностики. Питання уточнюючої діагностики раку ендометрію є предметом пильного вивчення.
У патогенезі захворювання провідне значення має теорія надмірної естрогенної стимуляції ендометрію, що поєднується з недостатністю прогестерону. Як вважають, надлишковий вплив естрогенів може призводити до гіперплазії ендометрію, яка здатна прогресувати в атиповий варіант та у 20-25% випадків до переходу в аденокарциному. У той же час існуюча залежність між ступенем проліферації ендометрію та концентрацією естрогенів у крові відзначається до певного, порогового значення і навіть інтенсивна проліферація не завжди супроводжується злоякісною трансформацією ендометрію. Виявлена кореляція між вмістом естрогенів та пошкодженням ДНК у нормальному та малігнізованому ендометрії змушує звертати більше уваги на роль молекулярногенетичних та морфологічних факторів при формуванні різних типів раку тіла матки. Рак ендометрію характеризується гетерогенною природою, що проявляється на рівні як факторів ризику, так і його патогенезу, чим визначаються особливості формування груп ризику при цьому захворюванні.
В даний час для виявлення патології ендометрію в основному використовуються діагностичне вишкрібання порожнини матки, гістероскопія та аспіраційно-цитологічне дослідження, а також методи променевої діагностики, серед яких провідне значення має ультразвукове дослідження (УЗД). При цьому відсутні єдині методично обґрунтовані ехографічні критерії інвазивного росту пухлини. Впровадження у програми інтегрованого обстеження хворих на нові ультразвукові технології, такі як імпульсна доплерометрія, ультразвукова ангіографія та тривимірна реконструкція зображень, дозволило суттєво підвищити ефективність первинної діагностики та моніторингу хворих на рак ендометрію в процесі специфічної терапії.
Метою справжньої роботи було вивчення можливостей комплексного УЗД із застосуванням колірного доплерівського та (і ЕК), та тривимірної реконструкції зображень у первинній та уточнюючій діагностиці раку ендометрію.
Матеріал та методи
Обстежено 139 пацієнток віком від 21 року до 87 років з підозрою на рак ендометрію у пери- та постменопаузальному періоді. У 34 хворих було виявлено гіперпластичні процеси ендометрію, у 105 – злоякісні процеси ендометрію. Середній вік хворих з доброякісною патологією становив 42,6±7,2 роки, хворих на рак ендометрію – 65,4±7 років. В усіх випадках отримано гістологічну верифікацію діагнозу.
Всі хворі були комплексно обстежені ультразвуковим методом з використанням трансабдомінального (конвексним датчиком 3,5 МГц) та трансвагінального (датчиком 6,5-7 МГц) доступів на сучасних ультразвукових апаратах Logiq S6 (GE, Healthcare) та Accuvix-XQ (Medison) програмі із застосуванням новітніх ультразвукових методик, що включають доплерометрію маткових судин, ЦДК та ЕК із тривимірною реконструкцією зображень. При трансабдомінальному дослідженні у пацієнток із наповненим сечовим міхуром оцінювали стан матки та яєчників, визначали об'єми тіла та шийки матки, ширину М-луна. При трансвагінальному УЗД (ТВУЗД) методами доплерометрії проводили вимірювання кровотоку та індексу резистентності в маткових артеріях, оцінювали інтенсивність внутрішньопухлинного кровотоку. На всіх етапах дослідження визначали стан структури ендо- та міометрія, їх взаємини та однорідність. При виявленні осередкових змін визначали їх розміри, ступінь поширеності та взаємовідносини з оточуючими органами та структурами, проводили порівняльну оцінку товщини маткової стінки в зоні пухлини та поза зоною локалізації пухлинного вогнища. По можливості точно визначали лінійні та об'ємні параметри пухлини, чіткість контурів, оцінювали стан прилеглої до неї слизової оболонки. Основним параметром оцінки ендометрію залишається зміна його товщини. Обсяг ендометрію також використовується для ранньої діагностики захворювання. Його значення більш достовірні у диференціальній діагностиці раку та доброякісних гіперпластичних процесів, ніж вимірювання ширини ендометрію. Критеріями злоякісного ураження ендометрію є значення обсягу ендометрію, що перевищують 13 см 3 . При цьому забезпечуються 100% чутливість та 92% передбачуваність позитивного тесту в діагностиці раку ендометрію.
Найважливішими характеристиками новоутворення ендометрію були ступінь та характер його васкуляризації, яку з метою отримання найбільш повного та наочного уявлення оцінювали в режимі кінопетлі. Проводили якісну оцінку кровопостачання за кількістю колірних сигналів від судин новоутворення: гіповаскулярний, помірно-васкулярний, гіперваскулярний. Нами використовувалася технологія з перетворенням об'ємних даних серію послідовних зрізів товщиною до 0,5 мм. Цілеспрямований вибір певних перерізів з 3D об'ємних даних дозволяв виділити оптимальні зрізи тіла та порожнини матки та максимально точно оцінити їх розміри, визначити взаємозв'язок виявлених змін зі станом навколишніх органів та тканин. Технологія Volume CT View дозволяла на основі 3D сканування оцінити контури та структуру ендометрію, характер його кровопостачання, а застосування опції гістограми – точно визначити індекс васкуляризації.
Особливу увагу приділяли оцінці глибини міометральної інвазії, можливому переходу злоякісного процесу на цервікальний канал та стану регіонарних лімфатичних вузлів, що мало вирішальне значення щодо стадії захворювання та вибору тактики лікування.
Результати та обговорення
В результаті проведеного дослідження у 34 пацієнток виявлено гіперпластичні процеси ендометрію, які були виділені нами в окремі нозологічні форми, що відповідають рекомендаціям ВООЗ. У табл. 1 представлено розподіл хворих залежно від морфогенезу виявлених гіперпластичних процесів ендометрію.
Таблиця 1. Розподіл хворих на тип гіперпластичних процесів ендометрію.
Гіперпластичні процеси ендометрію виявлялися порушеннями менструального циклу на кшталт менометрорагії, анемією І-ІІ ступеня. При доброякісній патології ендометрію у 24 (71,4%) пацієнток методом УЗД у режимі сірої шкали визначалося збільшення товщини М-луна в середньому 14,6±3,2 мм. При трансвагінальній ехографії залізисто-кістозна гіперплазія визначалася як утворення підвищеної ехогенності, однорідної структури, з множинними точковими гіпо-або анехогенними включеннями до 1,5 мм, іноді з ефектом акустичного посилення. При атиповій гіперплазії у порожнині матки виявлялася неоднорідна гіперехогенна солідна структура. Поліпи визначалися як округлі, овальні або довгасті, часом на довгій ніжці, гіперехогенні утворення різних розмірів, що деформують порожнину матки і чітко диференціюються на тлі рідинного вмісту порожнини матки. За допомогою імпульсного доплерівського режиму були кількісно оцінені показники гемодинаміки в маткових артеріях, які склали: МСС – 9,3±2,1 см/с, індекс резистентності – 0,56±0,05.
Методикою внутрішньопухлинний колірний кровотік при залізисто-кістозній гіперплазії реєструвався у вигляді одиничних сигналів від судин, розташованих по периферії. При фіброзно-залізистих поліпах візуалізувався помірно виражений венозний та артеріальний периферичний кровотік із середніми показниками периферичного судинного опору. У 2 пацієнток із залізистою гіперплазією визначалася виражена гіперваскуляризація ендометрію. При атиповій гіперплазії реєструвався центральний та периферичний внутрішньопухлинний кровотік помірної інтенсивності. У 5 хворих із залізисто-кістозною гіперплазією при атрофічному ендометрії кровотік не реєструвався. Характерними ознаками доброякісності новоутворення навіть за наявності множинних поліповидних розростань були збереження форми порожнини матки, чітке визначення зовнішнього контуру ендометрію та рівномірний розподіл судин міометрію (рис. 1 і 2).
Мал. 1.ТВУЗІ, режим енергетичного картування. Залізисто-кістозна гіперплазія ендометрію.

Мал. 2.ТВУЗІ, режим енергетичного картування. Поліп ендометрію.
Злоякісна патологія ендометрію діагностована у 105 пацієнток. 80% обстежених із цією патологією були віком від 50 до 69 років, з них у 82 (78%) злоякісна трансформація ендометрію супроводжувалася кров'яними виділеннями в постменопаузі. Обстеження хворих з підозрою на рак ендометрію виявило збільшення товщини М-відлуння до 18,1±6,7 мм. При Iа стадії товщина М-луна склала 11,5±3,7 мм, при Ib стадії - 15,8±8,4 мм, при Ic стадії - 17±3,4 мм, при II стадії - 21±4,1 мм, за III стадії - 27±2,0 мм, при IV стадії - понад 30 мм. Визначення стадії раку тіла матки було здійснено згідно з Міжнародною класифікацією раку (FIGO, 1988). У табл. 2 проведено зіставлення певного гістотипу раку ендометрію із стадією захворювання.
Таблиця 2. Зіставлення гістотипу та стадії раку ендометрію.
| Гістотип пухлини | Стадія | Усього | |||||
|---|---|---|---|---|---|---|---|
| Іа | Ib | Ic | II | III | IV | ||
| Аденокарцинома: | |||||||
| високодиференційована | 12 | 3 | 3 | 4 | 2 | 1 | 25 |
| помірно диференційована | 22 | 6 | 2 | 6 | 6 | 2 | 44 |
| низькодиференційована | 5 | - | - | 1 | 3 | 1 | 10 |
| серозно-папілярна | 3 | - | - | 1 | 3 | 1 | 8 |
| світлоклітинна | - | 1 | - | - | - | 1 | 2 |
| Залізисто-плоскоклітинний рак | 1 | 1 | - | 2 | 1 | - | 5 |
| Саркома | 2 | - | 1 | 1 | 3 | 2 | 9 |
| Акантома | 1 | 1 | - | - | - | - | 2 |
| Разом | 46 | 12 | 6 | 15 | 18 | 8 | 105 |
Як очевидно з табл. 2 більш ніж у 60% хворих був діагностований рак тіла матки I стадії, причому у 46 пацієнток Ia стадії. Хворі на поширені форми злоякісних захворювань тіла матки склали 23%. У більшості випадків (89 пацієнток, 85%) діагностовано аденокарциному різного ступеня диференціювання.
У нашому дослідженні ступінь диференціювання пухлини корелювала зі стадією захворювання: при високій помірно диференційованій аденокарциномі процес в основному обмежувався тілом матки. Низькодиференційована, серозно-папілярна та світлоклітинна аденокарциноми були відзначені при II, III та IV стадіях з поширенням пухлини за межі органу. Плоскоклітинний рак I стадії діагностований у 2 пацієнток, II та III стадій – у 3. Поєднання аденокарциноми та ендометріальної стромальної саркоми було виявлено у 9 пацієнток, з них у 5 визначено III та IV стадії захворювання. Основними ультразвуковими ознаками раку ендометрію при трансабдомінальному та трансвагінальному дослідженнях в режимі В-сканування можна вважати збільшення М-відлуння, не характерне для даної пацієнтки, нерівномірність і неоднорідність ендометрію, крім того, більш висока ехогенність його структури в цілому або виявленої вогнищевої освіти порівняно з незміненим міометрієм, наявність нерівного, зовнішнього контуру, що проникає на різну глибину. У випадках значного місцевого поширення пухлини можлива візуалізація гіпоехогенного обідка навколо новоутворення або відсутність межі між пухлинним осередком та міометрієм. У нашому дослідженні було проведено оцінку індексу інвазивного зростання (ІІР) – визначення відношення об'єму зміненого ендометрію (ОІЕ) до об'єму тіла матки. Отримані дані представлені у табл. 3. Розрахунок цих показників був можливий лише при раку ендометрію І стадії, коли межа зміненого ендометрію визначалася досить чітко (рис. 3).
Таблиця 3. Ехографічні параметри матки та М-луна при раку ендометрію різних стадій.
При Ia стадії обсяг ендометрію склав 4,2±2,2 см 3 ІР - 11,9±4,2, при Ib стадії ОІЕ - 8,3±4,6 см 3 ІР - 7,5±5,4 см3, при Ic стадії ОІЕ - 15,4±5,3 см 3 ІР - 4,3±2,9. Як показують наведені у табл. 3 дані, відзначаються чітке збільшення обсягу ендометрію та зниження значень ІІР у міру наростання ступеня інвазії пухлини в міометрії. Для більшості хворих на рак ендометрію характерною була його локалізація в ділянці дна матки або одного з трубних кутів. Некроз пухлини з деформацією порожнини матки та наявність у ній рідини визначалися при ІІІ та ІV стадіях процесу.
На підставі даних літератури, нами виділено три основні типи зростання інвазивного раку ендометрію.
- Розвиток множинних високодиференційованих пухлинних осередків на тлі гіперпластичних процесів всього ендометрію.
- Розвиток одного високодиференційованого пухлинного вогнища, оточеного гіперплазованою слизовою оболонкою на невеликому протязі.
- Розвиток одного помірно або низькодиференційованого пухлинного вогнища на тлі атрофічної слизової оболонки.
Екзофітна форма зростання пухлини виявлена у 15% випадків. Для екзофітного росту пухлини характерні відсутність деформації порожнини матки, чіткі межі ендо- та міометрія або виявлення утворення у просвіті порожнини матки. У 85% спостережень відзначалася ендофітна форма зростання з інвазією у міометрій. Порушення цілості гіпоехогенного обідка при раку ендометрію є специфічною ознакою інвазії у міометрії. Ендофітне зростання пухлини призводить до асиметрії та деформації порожнини матки. При глибокому інфільтративному процесі 2-й варіант відзначений 30%, 3-й варіант - 70% спостережень. При УЗД можливість чіткого визначення форми зростання пухлини була лише на початкових стадіях захворювання. При Iа стадії раку ендометрію у разі проведення УЗД у В-режимі визначалася однорідна гіперехогенна структура серединного М-луна, а в 69,5% виявлялася неоднорідність структури ендометрію за рахунок включень округлої форми, з рівними, у ряді випадків нечіткими контурами, підвищеної ехогенності, середній розмір становив 6,3±3,8 мм. Межі ендометрію у всіх спостереженнях при I стадії захворювання визначалися як чіткі та рівні.
Таблиця 4. Гемодинамічні показники при доброякісній та злоякісній патології ендометрію.
Примітка. * - р<0,05
У наших спостереженнях диференціювати у звичайному В-режимі 1-й та 2-й типи розвитку пухлинного процесу було можливо лише у 10 пацієнток. В інших випадках через значне місцеве поширення пухлини зазначені відмінності не визначалися. При глибокому інфільтративному процесі III і IV стадіях захворювання товщина М-эхо перевищувала 27,0 мм. Межі між пухлиною та міометрієм у всіх випадках були нечіткими, контури нерівними, а у 61 (58,0%) пацієнтки межі пухлини не визначалися аж до зовнішнього контуру матки. Структура М-луна в 30,3% випадків була однорідною гіперехогенною, в 20,1% - однорідною гіпоехогенною, а в 50% - неоднорідною, переважно гіперехогенною. Ехоструктура пухлини могла мати також різну ехогенність: у 44,6% спостережень була однорідною гіперехогенною, у 10,4% - однорідною гіпоехогенною, у 45,0% - змішаною.
Нами проведено оцінку кількісних показників гемодинаміки, виконану за допомогою в маткових артеріях та судинах пухлини. У табл. 4 наведено порівняльну характеристику гемодинамічних показників при доброякісній та злоякісній патології ендометрію.
Як видно з наведених даних, гемодинаміка регіонарного кровотоку при раку ендометрію супроводжується тенденцією до підвищення швидкісних показників кровотоку в судинах матки та статистично достовірним зниженням індексу периферичного опору в пухлинних судинах, що може характеризувати активність внутрішньопухлинного кровотоку. МСС у маткових артеріях залежала від об'єму тіла матки, який міг бути пов'язаний з наявністю фіброміоми, та характеру васкуляризації пухлини. Показники внутрішньопухлинного кровотоку та ІР статистично не залежали від гістотипу раку ендометрію.

Мал. 4.ТВУЗІ, режим енергетичного картування. Рак ендометрію Ia стадії. Визначається осередок гіперваскуляризації по передній стінці матки.

Мал. 5.

Мал. 6.ТВУЗІ, ЦДК, поздовжнє сканування. Рак ендометрію Іа стадії. Інфільтративне утворення гіперехогенної структури в ділянці дна тіла матки зі зниженою васкуляризацією.
При аналізі характеру та ступеня васкуляризації раку ендометрію, оціненої за допомогою режимів ЦДК та ЕК, визначалися різні варіанти інтраендометріального кровотоку. Патологічна васкуляризація ендометрію мала місце у 92 (87,6%) хворих на рак ендометрію. В інших випадках, навіть за наявності характерних ультразвукових ознак злоякісного ураження, внутрішньопухлинний кровотік використовуваними методиками не візуалізувався. При пухлини тіла матки виділено три основні варіанти кровопостачання (А, В, С), при цьому спостерігалася певна залежність картини ЦДК та ЕК зі стадіями та виділеними формами пухлинного росту. Інтенсивність кровотоку в ендометрії та пухлинному вузлі, визначена в режимах ЦДК та ЕК, залежала від типу зростання пухлини і найбільш наочно могла бути представлена в режимі кінопетлі. Зони пухлинного кровотоку виявляються при раку ендометрію більш ніж у 90% випадків (рис. 4-8).
Встановлено, що варіант А був характерний для Iа стадії: при інфільтрації міометрію на глибину до 5 мм, який визначався у 33,8% спостережень і характеризувався нерівномірним посиленням інтраендометріального кровотоку за рахунок локального збільшення кількості колірних плям з різною інтенсивністю забарвлення, за відсутності колірних локусів у субендометріальній зоні. Цей варіант був характерний для екзофітної форми росту з інтрапухлинним типом неоваскуляризації.

Мал. 7.ТВУЗІ, ЦДК. Рак ендометрію IV стадії. Гіперваскуляризація утворення гетерогенної структури в ділянці лівого маткового кута. Визначається ендометріальний та внутрішньопухлинний кровотік.

Мал. 8.ТВУЗІ, суміщення В-режиму та режиму енергетичного картування. Рак ендометрію IV стадії. Осередок гіперваскуляризації по задній стінці матки з гіперваскулярним ендометріальним кровотоком.
Варіант (47,6%) характеризувався тотальним посиленням інтраендометріального кровотоку за рахунок великої кількості хаотично розташованих колірних локусів, з одночасним локальним збільшенням кількості колірних сигналів в субендометріальній зоні. У 27,5% випадків визначалася помірна васкуляризація пухлини, що поєднувалася з багатою васкуляризацією міометрію. Цей варіант було виявлено у 78,3% хворих при змішаній формі раку ендометрію.
Варіант С (19,6%) характеризувався незначним посиленням інтраендометріального кровотоку при значному тотальному збільшенні кількості сигналів кольорів у субендометріальній зоні. Цей варіант був характерний для ендофітної форми росту (92,5%) і супроводжувався інтенсивним інтра-і періопухолевим кровотоком.
Хоча між вираженістю пухлинного кровотоку та стадією захворювання, а також ступенем диференціювання прямої кореляції не було встановлено, наявність зони неоваскуляризації, що визначається, відповідало вищій стадії процесу. Гіповаскулярний та помірно виражений кровотік в ендометрії спостерігався у хворих з високодиференційованою аденокарциномою.
Не зареєструвала неоваскуляризацію патологічного процесу у 12,4% спостережень. Причиною цього могло бути видалення пухлини малих розмірів внаслідок попереднього діагностичного вишкрібання порожнини матки та при високодиференційованій аденокарциномі, що виникла на тлі атрофії ендометрію.
За рахунок побудови фронтальних площин дозволяла точніше визначити стан ендометрію, встановити його асиметрію. Дезорганізований судинний малюнок, що виявляється при тривимірній ангіографії в об'ємному блоці, при суміщенні режимів сканування був важливою додатковою ознакою злоякісного ураження ендометрію. Найбільш точні результати в оцінці ступеня інвазії карциноми ендометрію досягаються при використанні тривимірної реконструкції в режимі ультразвукової ангіографії (рис. 9-11).

Мал. 9.УЗД, виконане із застосуванням технології Multi-slice view. На пошарових зрізах з'являється можливість точно визначити структуру ендометрію та його васкуляризацію.
Можливості ультразвукового методу в діагностиці раку ендометрію мають свої обмеження у зв'язку з тим, що гіперпластичні процеси та початкові стадії захворювання не мають специфічних диференційно-діагностичних ознак. Супутні маткові кровотечі із заснуванням фібрину ускладнюють виявлення зон потовщення ендометрію. Певні труднощі виникають у визначенні глибини міометріальної інвазії при початкових стадіях раку ендометрію у межах до 5 мм, а також у випадках супутнього аденоміозу. УЗД не дозволяє точно визначити обсяг ракового ураження у жінок з великими та множинними субмукозними міоматозними вузлами, що деформують порожнину матки.

Мал. 10.ТВУЗІ, режим енергетичного картування. УЗД, виконане із застосуванням технології Oblique view. 3D об'ємні дані дозволяють уточнити стан ендометрію та характер ендометріальної та субендометріальної васкуляризації.

Мал. 11.Режим багатопланової реконструкції. Volume CT view. 3D-дані дозволяють максимально точно визначати обсяги.
Висновки
Ультразвукове дослідження з використанням імпульсної доплерометрії, колірної доплерографії, енергетичного картування та тривимірної реконструкції зображень є високоінформативним методом неінвазивної уточнюючої діагностики патології ендометрію. Отримані результати свідчать про високу ефективність використаних методик у диференціальній діагностиці доброякісних та злоякісних процесів. Ультразвукова ангіографія і тривимірна реконструкція зображення при раку ендометрію сприяють отриманню додаткової і дуже важливої інформації про особливості пухлинного процесу, глибину інвазії пухлини в міометрій, а характер неоваскуляризації, що виявляється, дозволяє прогнозувати швидкість зростання новоутворення.
Використання сучасних ультразвукових технологій дозволяє абсолютно на новому якісному та кількісному рівні вирішувати завдання внутрішньонозологічної діагностики раку ендометрію, а також здійснювати моніторинг хворих у процесі специфічного лікування.
Література
- Давидов М.І., Аксель Є.М. Статистика злоякісних новоутворень у Росії та країнах СНД у 2005 р. // Вісник Російського онкологічного наукового центру ім. Н.М. Блохіна РАМН. 2007. Т. 18.
- Урманчеєва А.С., Тюляндін С.А., Моісеєнко В.М. Практична онкогінекологія (Вибрані лекції) // М.: Изд. Центр Томм. 2008. 400 с.
- Ашрафян Л.А., Харченко Н.В., Огризкова В.Л. та ін. Сучасні принципи первинної та уточнюючої діагностики раку ендометрію // Практична онкологія. 2004. Т. 5. Nо 1.
- Демідов В.М., Тує А.І. Ультразвукова діагностика гіперпластичних та пухлинних процесів ендометрію // За ред. Мітькова В.В., Медведєва М.В. Клінічне посібник з ультразвукової діагностики, 3 т. м.: Видар. 1997. С. 120-131.
- Капустіна І.М., Сидорова А.М., Саранцев А.М. Колірне допплерівське картування у діагностиці раку ендометрію // Sonoace international. Російська версія. Вип. 9, 2001. С. 34-39.
- Максимова Н.А. Деякі аспекти ультразвукової діагностики раку ендометрію // Ультразвукова діагностика в акушерстві, гінекології та педіатрії. 1999. No 3. С. 196-201.
- Столярова I.V., Minko B.A., Sirazitdinov B.R. Capabilities of three-dimensional ultrasonic angiography in specify diagnostics of endometrial carcinoma // 19 International Congress on Anti Cancer Treatment Paris, February 5-8; 2008. P. 255-256.
- Гаженова В.Є. Ультразвукова діагностика в гінекології// М.: "МЕДпрес-інформ". 2005. 264 с.
- Тітова В.А., Харченко Н.В., Столярова І.В. Автоматизована променева терапія органів жіночої статевої системи// М.: Медицина. 2006. 160 с.
- Gruboeck K., Jurkovic D., Lawton F. та ін. Diagnostic value endometrial thickness and volume measurements by three-dimensional ultrasoundi in patients with postmenopausal bleeding // Ultrasound Obstet. Gynecol. 1996. No 8. P. 272-276.
- Столярова І.В., Мінько Б.А., Лисянська О.С. та ін. Можливості сучасних ультразвукових методик в уточнюючій діагностиці раку ендометрію // Міжнародний конгрес Невський радіологічний форум "Нові горизонти" 7-10 квітня 2007 р. СПб., C. 364-365.
- Чекалова М.А., Зуєв В.М. Ультразвукова діагностика в онкогінекології// М.: Изд. будинок "Російський лікар". 2004. 92 с.
- Терегулова А.Є. Трансвагінальна ехографія з використанням колірного доплерівського картування у хворих на рак ендометрію // Ультразвукова діагностика. 1996. No 4. С. 21-23.
- Kurjak A., Shalan H., Sosic A. та ін. Endometrial carcinoma in postmenopausal women: evaluation by transvaginal color Doppler ultrasonography // Am. J. Obstet. Gynecol. 1993. V. 169. P. 1597-1603.