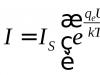Ardillas- polipéptidos naturales con un peso molecular enorme. Forman parte de todos los organismos vivos y realizan diversas funciones biológicas.
Estructura proteica.
Las proteínas tienen 4 niveles de estructura:
- estructura primaria de la proteína- secuencia lineal de aminoácidos en una cadena polipeptídica, plegada en el espacio:
- estructura secundaria de proteína- conformación de la cadena polipeptídica, porque girando en el espacio debido a los enlaces de hidrógeno entre Nueva Hampshire Y CO en grupos. Hay 2 métodos de instalación: α -espiral y β - estructura.
- estructura terciaria de la proteína es una representación tridimensional de un remolino α -espiral o β -estructuras en el espacio:

Esta estructura está formada por puentes disulfuro -S-S- entre residuos de cisteína. En la formación de dicha estructura participan iones con carga opuesta.
- estructura cuaternaria de la proteína Se forma debido a la interacción entre diferentes cadenas polipeptídicas:

Síntesis de proteínas.
La síntesis se basa en un método en fase sólida, en el que el primer aminoácido se fija en un soporte polimérico y se le añaden secuencialmente nuevos aminoácidos. Luego se separa el polímero de la cadena polipeptídica.
Propiedades físicas de las proteínas.
Las propiedades físicas de una proteína están determinadas por su estructura, por lo que las proteínas se dividen en globular(soluble en agua) y fibrilar(insoluble en agua).
Propiedades químicas de las proteínas.
1. Desnaturalización de proteínas(destrucción de la estructura secundaria y terciaria manteniendo la primaria). Un ejemplo de desnaturalización es la coagulación de las claras de huevo cuando se hierven los huevos.
2. Hidrólisis de proteínas- destrucción irreversible de la estructura primaria en una solución ácida o alcalina con formación de aminoácidos. De esta forma se puede establecer la composición cuantitativa de las proteínas.
3. Reacciones cualitativas:
reacción de biuret- interacción del enlace peptídico y las sales de cobre (II) en una solución alcalina. Al final de la reacción, la solución se vuelve violeta.
Reacción de xantoproteína- Al reaccionar con ácido nítrico se observa un color amarillo.
Importancia biológica de las proteínas.
1. Las proteínas son un material de construcción; a partir de ellas se forman músculos, huesos y tejidos.
2. Proteínas - receptores. Transmiten y perciben señales provenientes de células vecinas del entorno.
3. Las ardillas juegan papel importante V sistema inmunitario cuerpo.
4. Las proteínas realizan funciones de transporte y transportan moléculas o iones al sitio de síntesis o acumulación. (La hemoglobina transporta oxígeno a los tejidos).
5. Proteínas - catalizadores - enzimas. Se trata de catalizadores selectivos muy potentes que aceleran las reacciones millones de veces.
Hay una serie de aminoácidos que el cuerpo no puede sintetizar: insustituible, se obtienen únicamente de los alimentos: tisina, fenilalanina, metinina, valina, leucina, triptófano, isoleucina, treonina.
La hidrólisis enzimática de proteínas se produce bajo la acción de enzimas proteolíticas (proteasas). Se clasifican en endo y exopeptidasas. Las enzimas no tienen una especificidad de sustrato estricta y actúan sobre todas las proteínas desnaturalizadas y muchas nativas, escindiendo los enlaces peptídicos -CO-NH- en ellas.
Endopeptidasas (proteinasas): hidrolizan proteínas directamente a través de enlaces peptídicos internos. Como resultado, se forman una gran cantidad de polipéptidos y pocos aminoácidos libres.
Condiciones óptimas para la acción de las proteinasas ácidas: pH 4,5-5,0, temperatura 45-50 °C.
Las exopeptidasas (peptidasas) actúan principalmente sobre polipéptidos y péptidos rompiendo el enlace peptídico al final. Los principales productos de la hidrólisis son los aminoácidos. este grupo Las enzimas se dividen en amino, carboxi y dipeptidasas.
Las aminopeptidasas catalizan la hidrólisis del enlace peptídico adyacente al grupo amino libre.
H2N - CH - C - - NH - CH - C....
Las carboxipeptidasas hidrolizan el enlace peptídico adyacente al grupo carboxilo libre.
CO-NH-C-H
Las dipeptidades catalizan la escisión hidrolítica de dipéptidos en aminoácidos libres. Las dipeptidasas escinden sólo aquellos enlaces peptídicos adyacentes a los cuales hay simultáneamente grupos carboxilo y amina libres.
dipeptidasa
NH2CH2CONHCH2COOH + H2O 2CH2NH2COOH
Glicina-Glicina Glicocol
Condiciones óptimas de funcionamiento: pH 7-8, temperatura 40-50 oC. La excepción es la carboxipeptidasa, que muestra su máxima actividad a una temperatura de 50 °C y un pH de 5,2.
La hidrólisis de sustancias proteicas en la industria conservera es necesaria en la producción de jugos clarificados.
Ventajas del método enzimático para la producción de hidrolizados de proteínas.
Cuando se produce biológicamente sustancias activas De las materias primas que contienen proteínas, la más importante es su procesamiento profundo, que implica la descomposición de las moléculas de proteínas en los monómeros constituyentes. En este sentido, es prometedora la hidrólisis de materias primas proteicas con el fin de producir hidrolizados de proteínas, productos que contienen valiosos compuestos biológicamente activos: polipéptidos y aminoácidos libres. Cualquier proteína natural con una composición completa de aminoácidos, cuya fuente sea la sangre y sus componentes, puede utilizarse como materia prima para la producción de hidrolizados de proteínas; tejidos y órganos de animales y plantas; residuos de la industria láctea y alimentaria; confiscaciones veterinarias; Alimentos y productos alimenticios de bajo valor nutricional obtenidos mediante procesamiento. varios tipos animales, pájaros, peces; Residuos de producción de plantas procesadoras de carne y fábricas de colas, etc. En la obtención de hidrolizados de proteínas para uso médico y veterinario se utilizan principalmente proteínas de origen animal: sangre, tejido muscular Y órganos internos, cáscaras de proteínas, así como proteínas de suero.
El problema de la hidrólisis de proteínas y su implementación práctica ha atraído la atención de los investigadores durante mucho tiempo. A partir de la hidrólisis de proteínas se obtiene varias drogas, ampliamente utilizado en la práctica: como sustitutos de la sangre y para nutrición parenteral en medicina; compensar la deficiencia de proteínas, aumentar la resistencia y mejorar el desarrollo de los animales jóvenes en medicina veterinaria; como fuente de aminoácidos y péptidos para medios de cultivo y bacterias en biotecnología; en la industria alimentaria, perfumería. Calidad y propiedades de los hidrolizados de proteínas destinados a varias aplicaciones, están determinados por la materia prima, el método de hidrólisis y el procesamiento posterior del producto resultante.
Variar los métodos de obtención de hidrolizados de proteínas permite obtener productos con las propiedades deseadas. Dependiendo del contenido de aminoácidos y la presencia de polipéptidos en el rango del peso molecular correspondiente, la región de la mayoría uso efectivo hidrolizados. Los hidrolizados de proteínas obtenidos para diversos fines están sujetos a diferentes requisitos, dependiendo principalmente de la composición del hidrolizado. Así, en medicina es deseable utilizar hidrolizados que contengan entre un 15 y un 20% de aminoácidos libres; en la práctica veterinaria, para aumentar la resistencia natural de los animales jóvenes, predomina el contenido de péptidos en los hidrolizados (70...80%); Para fines alimentarios, las propiedades organolépticas de los productos resultantes son importantes. Pero el principal requisito a la hora de utilizar hidrolizados de proteínas en diversos campos es una composición equilibrada de aminoácidos.
La hidrólisis de proteínas se puede lograr de tres formas: mediante la acción de álcalis, ácidos y enzimas proteolíticas. La hidrólisis alcalina de proteínas produce residuos de lantionina y lisinoalanina, que son tóxicos para humanos y animales. Esta hidrólisis destruye la arginina, la lisina y la cistina, por lo que prácticamente no se utiliza para la obtención de hidrolizados. La hidrólisis ácida de proteínas es un método ampliamente utilizado. Muy a menudo, la proteína se hidroliza con azufre o ácido clorhídrico. Dependiendo de la concentración del ácido utilizado y de la temperatura de hidrólisis, el tiempo del proceso puede variar de 3 a 24 horas. La hidrólisis con ácido sulfúrico se realiza durante 3...5 horas con una temperatura de 100...130°C y una presión de 2...3 atmósferas; clorhídrico: durante 5...24 horas en el punto de ebullición de la solución a baja presión.
Con la hidrólisis ácida se consigue una mayor profundidad de descomposición de las proteínas y se elimina la posibilidad de contaminación bacteriana del hidrolizado. Esto es especialmente importante en medicina, donde los hidrolizados se utilizan principalmente por vía parenteral y es necesario excluir la anafilactogenicidad, la pirogenicidad y otras. consecuencias indeseables. EN practica medica Se utilizan ampliamente hidrolizados ácidos: aminokrovin, hidrolisina L-103, TsOLIPK, infusamina, gemmos y otros.
La desventaja de la hidrólisis ácida es la destrucción completa del triptófano, la destrucción parcial de los hidroxiaminoácidos (serina y treonina), la desaminación de los enlaces amida de la asparagina y la glutamina con la formación de nitrógeno amoniacal, la destrucción de las vitaminas y la formación de húmicos. sustancias cuya separación es difícil. Además, al neutralizar los hidrolizados ácidos se forma una gran cantidad de sales: cloruros o sulfatos. Estos últimos son especialmente tóxicos para el organismo. Por tanto, los hidrolizados ácidos requieren una purificación posterior, para lo cual en la producción se suele utilizar cromatografía de intercambio iónico.
Para evitar la destrucción de aminoácidos lábiles en el proceso de obtención de hidrolizados ácidos, algunos investigadores utilizaron regímenes de hidrólisis suaves en una atmósfera de gas inerte y también agregaron antioxidantes, tioalcoholes o derivados de indol a la mezcla de reacción. La hidrólisis ácida y alcalina, además de las indicadas, también tiene importantes limitaciones asociadas a la reactividad del medio ambiente, lo que conduce a una rápida corrosión de los equipos y requiere el cumplimiento de estrictos requisitos de seguridad para los operadores. Por tanto, la tecnología de hidrólisis ácida requiere bastante mano de obra y requiere el uso de equipos complejos (columnas de intercambio iónico, ultramembranas, etc.) y etapas adicionales de purificación de los fármacos resultantes.
Se han realizado investigaciones sobre el desarrollo de tecnología enzimática electroquímica para la producción de hidrolizados. El uso de esta tecnología permite excluir el uso de ácidos y álcalis del proceso, ya que el pH del medio se asegura como resultado de la electrólisis del medio procesado que contiene una pequeña cantidad de sal. Esto, a su vez, le permite automatizar el proceso y proporcionar un control operativo y más preciso de los parámetros del proceso.
Como se sabe, en el cuerpo la proteína está bajo la influencia de enzimas digestivas se descompone en péptidos y aminoácidos. Se puede realizar una división similar fuera del cuerpo. Para ello, se utilizan tejido pancreático, la mucosa del estómago o los intestinos, enzimas puras (pepsina, tripsina, quimotripsina) o preparaciones enzimáticas síntesis microbiana. Este método de descomposición de proteínas se llama enzimático y el hidrolizado resultante se llama hidrolizado enzimático. El método enzimático de hidrólisis es más preferible en comparación con metodos quimicos, ya que se realiza en condiciones “suaves” (a una temperatura de 35...50°C y presión atmosférica). La ventaja de la hidrólisis enzimática es el hecho de que durante su implementación los aminoácidos prácticamente no se destruyen y no entran en reacciones adicionales (racemización y otras). En este caso se forma una mezcla compleja de productos de degradación de proteínas con diferentes pesos moleculares, cuya proporción depende de las propiedades de la enzima utilizada, de las materias primas utilizadas y de las condiciones del proceso. Los hidrolizados resultantes contienen 10...15% de nitrógeno total y 3,0...6,0% de nitrógeno amínico. La tecnología para llevarlo a cabo es relativamente sencilla.
Así, en comparación con las tecnologías químicas, el método enzimático para la producción de hidrolizados tiene importantes ventajas, siendo las principales: accesibilidad y facilidad de implementación, bajo consumo energético y seguridad medioambiental.
Hidrólisis (hidrólisis) de proteínas.- Este es el proceso de romper cadenas de moléculas de proteínas en partes.
Los fragmentos resultantes se llaman y tienen un número de propiedades beneficiosas. El principal es una absorción mucho más rápida en comparación con la molécula original. La hidrólisis de proteínas ideal es la descomposición de la molécula de proteína en los aminoácidos que la componen. Forman la base de complejos de aminoácidos, los más drogas efectivas desde el punto de vista de la oferta células musculares material de construcción. Sin embargo, no siempre tiene sentido realizar un ciclo de hidrólisis completo. Para mejorar la tasa de absorción y aumentar las proteínas, basta con realizar una hidrólisis parcial de la proteína. Como resultado, la molécula original se descompone en cadenas de varios aminoácidos, que se denominan dipéptidos y tripéptidos.
Proceso de hidrólisis de proteínas.
A finales del siglo XIX, los científicos descubrieron que las proteínas están formadas por partículas más pequeñas llamadas aminoácidos. Y fue a partir de ese momento que se inició el estudio tanto de los aminoácidos como de los métodos para aislarlos de la estructura de las proteínas. En el que los aminoácidos no están unidos aleatoriamente, sino que se ubican en una secuencia de ADN específica. Para el cuerpo humano, esta secuencia no importa. El cuerpo sólo necesita aminoácidos, cuya tarea es “extraer” sistema digestivo. Durante el proceso de digestión, el cuerpo descompone las proteínas en aminoácidos individuales, que ingresan a la sangre. Sin embargo, dependiendo de cientos de factores, la eficiencia de la digestión está lejos del 100%. Según el porcentaje de sustancias absorbidas durante el proceso de digestión, se evalúa el valor nutricional de un producto en particular. La hidrólisis puede aumentar en gran medida el valor nutricional de las proteínas. No se opone a procesos de producción de proteínas como. La hidrólisis es el proceso de procesamiento secundario de una proteína que ya ha sido aislada de una forma u otra.
La materia prima para la hidrólisis ya es leche parcialmente procesada. Como regla general, se utiliza la proteína láctea más barata. Teniendo en cuenta el procesamiento posterior y el resultado final, no tiene sentido utilizar ingredientes más caros como la proteína de suero o el aislado. Con fines médicos, la sangre animal también se puede utilizar en hidrólisis, pero no es aplicable en la industria del deporte. Los principales métodos para hidrolizar las proteínas de la leche son hidrólisis ácida Y hidrólisis enzimática.
hidrólisis ácida
La esencia de este proceso es el procesamiento de materias primas con ciertos ácidos. La proteína se trata con ácido clorhídrico y se calienta a aproximadamente 105-110 °C. Se mantiene en este estado durante 24 horas. Como resultado, los enlaces moleculares se rompen y las proteínas se descomponen en aminoácidos individuales. La hidrólisis ácida es la más sencilla y económica de implementar. Sin embargo, presenta extremadamente altas exigencias al cumplimiento de la tecnología y, lo más importante, a la calidad y precisión de las dosis de reactivos. El uso de ácidos incorrectos o dosis incorrectas junto con enlaces moleculares puede destruir los propios aminoácidos. Como resultado, el producto final tendrá un espectro de aminoácidos incompleto. Y es poco probable que los restos de sales y ácidos tengan un efecto positivo en la digestión.
Hidrólisis enzimática (enzimática)
La hidrólisis enzimática de proteínas es algo similar. proceso natural digestión. El material de partida (generalmente -) se mezcla con enzimas que llevan a cabo la "digestión" de las proteínas y aseguran su descomposición en aminoácidos. Y es este método el que se utiliza con mayor frecuencia en la industria del deporte. La hidrólisis enzimática (enzimática) de proteínas es menos exigente en términos de tecnología. El exceso de enzimas es más fácil de eliminar y no causa tanto daño como los ácidos.
En la primera etapa de la hidrólisis enzimática, la materia prima se somete a un ligero tratamiento térmico. Como resultado, la proteína se desnaturaliza (destruye) parcialmente. Luego la fracción resultante se mezcla con enzimas que completan el proceso de hidrólisis.

El uso de la hidrólisis de proteínas en la nutrición deportiva.
La hidrólisis de proteínas es un verdadero hallazgo y una salvación para la industria. Gracias a él, no sólo es posible obtener complejos de aminoácidos puros, sino también aumentar significativamente la eficacia de las proteínas y ganadores convencionales. Muchos incluso tratan especialmente ciertos medicamentos con enzimas. Como resultado de esta hidrólisis parcial de la proteína, aumenta su tasa de absorción. También resuelve muchos problemas de intolerancia individual a los componentes de las proteínas de la leche. En algunos productos incluso se puede encontrar mención de la presencia de enzimas digestivas. En algunas proteínas, se trata de enzimas digestivas comunes que comienzan a funcionar sólo en el estómago. Y en algunos, estos son los restos del proceso de hidrólisis enzimática. En cualquier caso, estas proteínas se absorben mucho más rápido y mejor.
En teoría, la ingesta de proteínas hidrolizadas se puede sustituir tomando proteínas simples en combinación con enzimas digestivas (como festal, mezim forte, etc.). Será significativamente más barato. Sin embargo, tomar la proteína de la leche y las enzimas por separado no es tan eficaz. Nunca podrás identificar la dosis correcta enzimas. Es poco probable que su exceso sea beneficioso para el organismo. Desventaja: la hidrólisis de proteínas será solo parcial.
Los beneficios y daños de la hidrólisis de proteínas.
La hidrólisis de proteínas se utiliza en los siguientes casos:
- Para acelerar la absorción de proteínas.
- para reducir reacciones alérgicas
- Para obtener aminoácidos en su forma pura.
Particularmente dignos de mención son los problemas de reacciones alérgicas. Alergias alimentarias Hoy en día no es raro que la intolerancia a los alimentos o a sus componentes individuales se produzca con bastante regularidad. Un ejemplo es la intolerancia a la lactosa. Una alergia alimentaria es una reacción a proteínas específicas que se encuentran en los alimentos. Cuando se hidrolizan, estas proteínas se descomponen en péptidos. Que son sólo fragmentos de proteínas y ya no provocan reacciones alérgicas. Vale la pena señalar especialmente que valor nutricional Las mezclas resultantes no son en modo alguno inferiores en valor nutricional a las materias primas originales.
Entre las desventajas de la hidrólisis, cabe destacar la destrucción. bacterias beneficiosas. A pesar de que muchas empresas afirman la presencia de bifidobacterias, hay que ser objetivo: la hidrólisis las destruye. Y las bifidobacterias sólo pueden estar presentes cuando se introducen desde el exterior. Sin embargo, si hablamos de nutrición deportiva, entonces, en primer lugar, sigue siendo el valor nutricional de la mezcla resultante.
Ardillas- alto peso molecular compuestos orgánicos, que consta de residuos de aminoácidos conectados en una cadena larga mediante un enlace peptídico.
La composición de las proteínas en los organismos vivos incluye solo 20 tipos de aminoácidos, todos los cuales son alfa aminoácidos, y la composición de aminoácidos de las proteínas y su orden de conexión entre sí están determinadas por el código genético individual de un organismo vivo.
Una de las características de las proteínas es su capacidad para formar espontáneamente estructuras espaciales características únicamente de esta proteína en particular.
Debido a la especificidad de su estructura, las proteínas pueden tener diversas propiedades. Por ejemplo, proteínas que tienen una estructura cuaternaria globular, en particular proteínas huevo de gallina, disolver en agua para formar soluciones coloidales. Las proteínas con estructura cuaternaria fibrilar no se disuelven en agua. Las proteínas fibrilares, en particular, forman uñas, cabello y cartílago.
Propiedades químicas de las proteínas.
Hidrólisis
Todas las proteínas son capaces de sufrir reacciones de hidrólisis. En el caso de una hidrólisis completa de proteínas, se forma una mezcla de α-aminoácidos:
Proteína + nH 2 O => mezcla de α-aminoácidos
Desnaturalización
La destrucción de las estructuras secundaria, terciaria y cuaternaria de una proteína sin destruir su estructura primaria se llama desnaturalización. La desnaturalización de las proteínas puede ocurrir bajo la influencia de soluciones de sales de sodio, potasio o amonio; dicha desnaturalización es reversible:
La desnaturalización se produce bajo la influencia de la radiación (por ejemplo, calentamiento) o el tratamiento de la proteína con sales. metales pesados es irreversible:
Por ejemplo, se observa una desnaturalización irreversible de las proteínas durante el tratamiento térmico de los huevos durante su preparación. Como resultado de la desnaturalización de la clara de huevo, su capacidad para disolverse en agua para formar solución coloidal desaparece.
Reacciones cualitativas a las proteínas.
reacción de biuret
Si se agrega una solución de hidróxido de sodio al 10% a una solución que contiene proteínas y luego una pequeña cantidad de una solución de sulfato de cobre al 1%, aparecerá un color violeta.
solución de proteína + NaOH (solución al 10%) + CuSO 4 = color violeta
Reacción de xantoproteína
Las soluciones de proteínas se vuelven amarillas cuando se hierven con ácido nítrico concentrado:
solución proteica + HNO 3 (conc.) => color amarillo
Funciones biológicas de las proteínas.
| catalítico | acelerar diversas reacciones químicas en los organismos vivos | enzimas |
| estructural | material de construcción celular | colágeno, proteínas de la membrana celular |
| protector | proteger el cuerpo de infecciones | inmunoglobulinas, interferón |
| regulador | regular los procesos metabólicos | hormonas |
| transporte | transferencia de sustancias vitales de una parte del cuerpo a otra | la hemoglobina transporta oxígeno |
| energía | suministrar energía al cuerpo | 1 gramo de proteína puede aportar al organismo 17,6 J de energía |
| motor (motor) | cualquier función motora del cuerpo | miosina (proteína muscular) |
Como otras reacciones químicas, la hidrólisis de proteínas va acompañada del intercambio de electrones entre determinados átomos de las moléculas que reaccionan. Sin un catalizador, este intercambio se produce tan lentamente que no se puede medir. El proceso se puede acelerar añadiendo ácidos o bases; Los primeros dan iones H al disociarse, los segundos, iones OH. Los ácidos y las bases desempeñan el papel de verdaderos catalizadores: no se consumen durante la reacción.
Cuando la proteína se hierve con ácido concentrado, se descompone completamente en aminoácidos libres. Si tal descomposición ocurriera en una célula viva, naturalmente conduciría a su muerte. Bajo la influencia de las enzimas proterlíticas, las proteínas también se descomponen, e incluso más rápido, pero sin el más mínimo daño para el cuerpo. Y mientras que los iones H actúan indiscriminadamente sobre todas las proteínas y todos los enlaces peptídicos de cualquier proteína, las enzimas proteolíticas son específicas y solo rompen ciertos enlaces.
Las enzimas proteolíticas son en sí mismas proteínas. ¿En qué se diferencia una enzima proteolítica de una proteína sustrato (un sustrato es un compuesto que es el objetivo de la enzima)? ¿Cómo exhibe una enzima proteolítica su actividad catalítica sin destruirse a sí misma ni a la célula? Responder a estas preguntas básicas ayudaría a comprender el mecanismo de acción de todas las enzimas. Desde que M. Kunitz aisló por primera vez la tripsina en forma cristalina hace 30 años, las enzimas proteolíticas han servido como modelo para estudiar la relación entre la estructura de las proteínas y la función enzimática.
Las enzimas proteolíticas del tracto digestivo están asociadas con uno de funciones esenciales cuerpo humano- asimilación nutrientes. Es por eso que estas enzimas han sido objeto de investigación durante mucho tiempo; En este sentido, quizá sólo les aventajen las enzimas de levadura implicadas en la fermentación alcohólica. Las enzimas digestivas mejor estudiadas son la tripsina, la quimotripsina y las carboxipeptidasas (estas enzimas son secretadas por el páncreas). Es con su ejemplo que consideraremos todo lo que ahora se sabe sobre la especificidad, estructura y naturaleza de acción de las enzimas proteolíticas.
Las enzimas proteolíticas del páncreas se sintetizan en forma de precursores (zimógenos) y se almacenan en cuerpos intracelulares, los llamados gránulos de zimógeno. Los zimógenos carecen de actividad enzimática y, por tanto, no pueden actuar de forma destructiva sobre los componentes proteicos del tejido en el que se forman. Entrando intestino delgado, los zimógenos son activados por otra enzima; al mismo tiempo, en la estructura de sus moléculas hay pequeñas, pero muy cambios importantes. Entraremos en más detalles sobre estos cambios más adelante.
"Moléculas y Células", ed. franco