12884 0
Durante la histeroscopia en la primera mitad de la fase de proliferación (hasta el séptimo día del ciclo), el endometrio está pálido, delgado, con pequeñas hemorragias y áreas únicas de color rosa pálido de endometrio no rechazado. Bocas trompas de Falopio bien distinguible.
En la segunda mitad de la fase de proliferación (a partir del noveno día del ciclo), el endometrio está pálido. Color rosa, engrosados, los vasos no son pronunciados. Posteriormente, en determinadas zonas se distinguen pliegues longitudinales o transversales engrosados.
En la fase de secreción, el endometrio color amarillento, engrosado. Se identifican pliegues que se expresan especialmente bien en el tercio superior del cuerpo del útero. 2-3 días antes de la menstruación, el endometrio se enrojece con áreas de rechazo de color púrpura oscuro. Las aberturas de las trompas de Falopio pueden quedar ocultas por los pliegues del endometrio.
Los primeros 2-3 días durante la menstruación, la cavidad uterina se llena con capas rechazadas del endometrio: en el tercio superior es de color púrpura oscuro, en el tercio inferior y medio es de color rosa pálido.
Durante el período posmenopáusico, la histeroscopia revela un cuadro de atrofia endometrial. En este caso, el endometrio se adelgaza y tiene un color pálido.
Durante la colposcopia, la membrana mucosa del cuello uterino es lisa, brillante y rosada.
En las mujeres posmenopáusicas normalmente se detecta un adelgazamiento del epitelio, a través del cual se ven los vasos.
Durante la laparoscopia, el útero sin cambios está cubierto de peritoneo brillante, tiene una superficie lisa y una forma característica con simetría con respecto al plano longitudinal.
Con la histerosalpingografía, la sombra de la cavidad uterina tiene la forma de un triángulo con lados ligeramente cóncavos y contornos claros y uniformes. La base del triángulo mira hacia arriba y el vértice hacia abajo.
Las esquinas superiores corresponden a las aberturas de las trompas de Falopio, la esquina inferior corresponde a la abertura interna del canal cervical. La cavidad uterina contiene de 4 a 6 ml de líquido de contraste.
Con la ecografía, los contornos de un útero normal son claros y uniformes, ovalados o en forma de pera. La densidad de eco del endometrio es mayor que la densidad de eco del miometrio, que no cambia según la fase. ciclo menstrual. La ecoestructura del miometrio inalterado está finamente dispersada debido a muchas señales de eco puntuales y lineales.
El endometrio se define como una formación ecopositiva que es lineal (después del final del sangrado menstrual), ovalada o en forma de gota. Inmediatamente después del final del ciclo menstrual, se puede rastrear el endometrio en forma de una tira ecopositiva de 1 a 2 mm de espesor.

En los días 8-10 del ciclo (la mitad de la fase de proliferación), el endometrio se engrosa ligeramente, en promedio hasta 8 mm (de 5 a 10 mm). La estructura del eco permanece prácticamente sin cambios en comparación con el período anterior.

En la fase de proliferación tardía (11-14 días), además de un mayor engrosamiento, en promedio hasta 11 mm (de 7 a 14 mm), la ecogenicidad del endometrio comienza a aumentar ligeramente y se acerca al promedio.

En la fase de secreción temprana (días 15-18), la tasa de crecimiento endometrial disminuye y alcanza un espesor de 12 mm. La ecogenicidad del endometrio continúa aumentando desde la periferia hacia el centro, como resultado de lo cual el fragmento central hipoecoico adquiere forma de lágrima ( parte ancha en la zona del fondo del útero se estrecha hacia el cuello uterino). Durante esta fase, la línea hiperecoica en el centro ya no es claramente visible.

En la fase de secreción media (días 19 a 23), el endometrio alcanza su espesor máximo: un promedio de 14 mm (de 12 a 18 mm). La ecogenicidad del endometrio aumenta aún más; la línea hiperecoica en el centro no se visualiza claramente.

En los días 24 a 27 del ciclo (secreción tardía), el grosor del endometrio disminuye ligeramente, a un promedio de 12 mm (de 10 a 17 mm). Una característica de este período es la alta ecogenicidad del endometrio en combinación con su ecoestructura interna heterogénea, por lo que la línea de cierre deja de visualizarse.

Durante la menstruación, se detecta una fina franja hiperecoica o ecoestructuras hiperecoicas (coágulos de sangre) en la cavidad uterina. A veces, la cavidad parece ligeramente dilatada debido al contenido econegativo.

La cavidad uterina en la posmenopausia es un eco M en forma de una delgada línea hiperecoica, generalmente de 1 a 2 mm (no más de 4 a 5 mm) de espesor.

En la tomografía magnética nuclear (NMT) en la primera mitad del ciclo, el endometrio en la sección sagital media se determina como una línea delgada (hasta 3 mm), el miometrio parece una estructura homogénea con contornos suaves.

En la segunda mitad del ciclo, el endometrio se visualiza como una estructura bastante homogénea con un espesor promedio de 7 mm, más intensa que el miometrio.

En el período posmenopáusico, las tomografías revelan una disminución en el volumen del útero con una disminución en la intensidad de la imagen del miometrio, mientras que el endometrio, por regla general, no se visualiza.

El cuello uterino se define en las tomografías como una zona cilíndrica no intensa con una clara contorno suave, cuya estructura y cavidad corresponden al cuerpo del útero. La ecografía generalmente no visualiza el canal cervical.
V.N. Serov, I.N. Zvenígorodski
Dueholm, C. Møller, S. Rydbjerg, ES Hansen, G. Ørtoft
P.G.Leone, D.Timmerman, T.Bourne, L.Valentin, E.Epstein, S.R.Goldstein, H.Marret, AKParsons, B.Gull, O.Istre, W.Sepulveda, E.Ferrazzi, T.Van den Bosch
transvaginal examen de ultrasonido Tiene gran importancia en el diagnóstico de cáncer de endometrio en mujeres con sangrado posmenopáusico. Las mujeres con un espesor endometrial ≤ 4 mm medido mediante exploración transvaginal tienen un riesgo bajo de desarrollar cáncer de endometrio (1 en 100 casos) si no toman terapia de reemplazo hormonal. terapia hormonal, 1 en 1000 si están tomando terapia). Las mujeres con sangrado posmenopáusico y espesor endometrial ≥ 5 mm tienen alto riesgo cáncer de endometrio (1 de cada 4 casos), por lo que es necesario obtener un raspado intrauterino de alta calidad para análisis histológico. La ecografía puede proporcionar información sobre el riesgo individual neoplasmas malignos en mujeres posmenopáusicas con sangrado y espesor endometrial ≥ 5 mm.
Nuestro estudio incluyó mujeres con sangrado posmenopáusico y espesor endometrial ≥ 5 mm, medido con una sonda transvaginal. El estudio se llevó a cabo en el Hospital Universitario de Aarhus, Dinamarca, entre noviembre de 2010 y febrero de 2012. Todas las mujeres se sometieron a una exploración transvaginal (TVS) y una ecografía con infusión de gel (GIS), y a todas se les programó una histeroscopia con biopsia resectoscópica y legrado adicional para evaluar las patologías intrauterinas (Tabla 1).
Tabla 1. Esquema de selección de pacientes para el estudio.
Exploración transvaginal (TVS)
La TVS se realizó en un Voluson E8 Expert equipado con un sensor endovaginal (6-12 MHz), según el protocolo de exploración. Los parámetros Doppler se establecieron de antemano, estandarizados (frecuencia 6 MHz, ganancia de potencia Doppler 50, rango dinámico 10 dB; persistencia 2, color del mapa 1, filtro 3).
La exploración TVS incluyó una evaluación visual de los siguientes parámetros, determinados Grupo Internacional Análisis de tumores endometriales (IETA): espesor endometrial, su ecogenicidad (hiper, hipo e isoecoico, homo/heterogéneo), componente quístico (sí/no), si está presente, límites lisos o desiguales, límites endometriales (lisos o desiguales). , homo-/heterogéneo), línea de cierre (sí/no), interrumpida (sí/no)).
El análisis Power Doppler incluyó una evaluación visual de los siguientes parámetros: vasos (presentes (sí/no), presencia de un vaso dominante (sí/no), si hay un vaso dominante, entonces simple (sí/no) o doble (sí / no), origen (focal/multifocal) vasos múltiples (sí/no); ramificación (sí/no), si hay ramas, entonces ordenadas/desordenadas, dirección circular de los vasos (sí/no) Valoramos subjetivamente: grandes vasos (sí/no), Doppler color (sí/no), densidad vascular (sí/no).
Ecografía de infusión de gel (GIS)
El SIG se realizó después del TVS. Utilizamos un pequeño catéter estéril flexible equipado con una jeringa de 10 ml que contenía Instillagel® (E.Tjellesen A/S, Lynge, Dinamarca) que se insertó en la cavidad uterina. En pacientes con cuello uterino obstruido, utilizamos un pequeño dilatador de Hegar. El gel se introdujo en la cavidad uterina bajo control ecográfico.
Luego se escaneó la cavidad uterina en los planos sagital y transversal, evaluando los mismos parámetros que para la TVS convencional. También se evaluaron: la presencia de formación, su ubicación y el porcentaje de daño endometrial (es decir, ≤ 25% de la superficie está dañada) (sí/no); Estructura superficial del daño local (uniforme / desigual); La estructura de la superficie general del endometrio (lisa, polipoide, desigual).
histeroscopia
La histeroscopia ambulatoria se realizó en todos los pacientes utilizando métodos locales o anestesia general. En 112 pacientes, la histeroscopia se realizó inmediatamente después de la ecografía, en otros pacientes en la siguiente visita dentro de las 3 semanas posteriores a la ecografía. Durante la histeroscopia, se intentó eliminar todo el tejido de la cavidad uterina. Se recogieron de tres a cinco muestras de endometrio de un paciente.
Cálculo del riesgo de desarrollar cáncer de endometrio mediante un sistema de puntuación.
(Puntuación de riesgo de cáncer de endometrio (puntuación REC))
Basándonos en nuestros análisis, desarrollamos un sistema de puntuación de riesgo para el cáncer de endometrio (Fig. 1). El sistema de puntuación incluyó índice de masa corporal (≥30 = 1 punto), espesor endometrial (≥10 mm = 1 punto), (≥15 mm = 1 punto), presencia de vascularización, vaso dominante (presente = 1 punto), vasos múltiples (presente = 1 punto), vasos grandes (presente = 1 punto) y vasos densos (presente = 1 punto), zona endomiotrial discontinua (presente = 1 punto) y superficie endometrial desigual en el SIG (presente = 1 punto). Agregar estos valores crea una puntuación de riesgo de cáncer de endometrio. La puntuación de 3 para TVS o 4 para GIS mostró buenos resultados de escaneo y un diagnóstico correcto nivel alto desarrollo de cáncer de endometrio en aproximadamente el 90% de todos los pacientes.

Figura 1. Representación esquemática de la determinación del riesgo de desarrollar cáncer de endometrio mediante un sistema de puntuación.
Los parámetros del examen ecográfico del endometrio fueron determinados por el Grupo Internacional de Análisis de Tumores Endometriales (IETA)
El espesor endometrial se mide en el plano sagital. Los calibradores deben colocarse en la interfaz endometrio-miometrial, perpendiculares a la línea media del endometrio (Fig. 2). Cuando hay líquido, se mide el grosor de las partes individuales del endometrio y se registra su suma (Fig. 2b).

Figura 2. Imagen esquemática y ecográfica de la medición del endometrio en condiciones normales (a), y en presencia de líquido intrauterino (b).
La ecogenicidad del endometrio se evalúa en comparación con la ecogenicidad del miometrio como hiperecoica, isoecoica o hipoecoica.
La homogeneidad del endometrio se evalúa por su estructura. El endometrio "homogéneo" es homogéneo y tiene una estructura de tres capas (Fig. 3). El endometrio “heterogéneo” se describe cuando hay heterogeneidad en la estructura, asimetría o formaciones quísticas(Figura 4).

Fig. 3. Endometrio “homogéneo”: (a) representación esquemática de un endometrio de tres capas, (b) hipoecoico, (c) hiperecoico, (d) isoecoico.
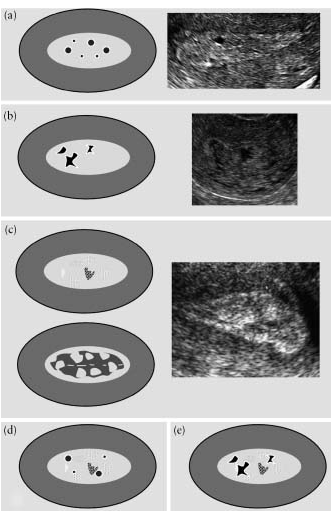
Fig.4. Endometrio “heterogéneo”: se visualizan formaciones quísticas con bordes lisos sobre un fondo homogéneo (a), se observan formaciones quísticas con bordes irregulares sobre un fondo homogéneo (b), un fondo heterogéneo sin áreas quísticas (c), formaciones quísticas con bordes lisos están presentes sobre un fondo heterogéneo ( d) y sobre un fondo heterogéneo, formaciones quísticas con bordes irregulares (e).
El endometrio se considera "lineal" si se determina que la línea de cierre de las capas endometriales es recta, y "no lineal" si la línea de cierre se visualiza como "irregular" o "interrumpida" o completamente ausente (Fig. 5).
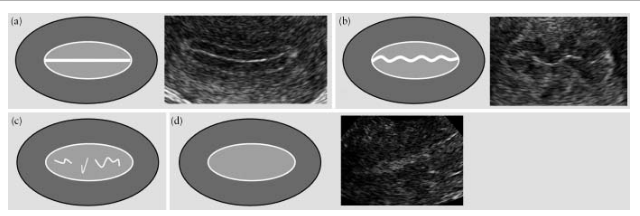
Fig.5. La línea de cierre de las capas endometriales: “lineal” (a), “irregular” (b), “interrumpida” (c) y no visualizada (d).
La región endometrio-miometrial se describe como “lisa”, “irregular”, “interrumpida” o “indeterminada” (Fig. 6).

Fig.6. Área endometrio-miometrial: “lisa” (a), “desigual” (b), “interrumpida” (c) e “indeterminada” (d).
El líquido intrauterino se describe como ecogenicidad anecoica, isoecoica o mixta (Fig. 7).

Fig.7. Líquido intrauterino: (a) hipoecoico, (b) isoecoico, (c) ecogenicidad mixta.
Evaluación Doppler
La configuración de Doppler debe ajustarse para garantizar la máxima sensibilidad (frecuencia de ultrasonido de al menos 5,0 MHz, frecuencia de repetición de pulso (PRF) de 0,3 a 0,9 kHz, filtro de pared vascular de 30 a 50 Hz, la ganancia de color Doppler debe reducirse hasta que desaparezcan todos los artefactos de color).
El Doppler se califica según la presencia de flujo sanguíneo: se otorga una puntuación de 1 cuando no hay flujo de señales de color hacia el endometrio, una puntuación de 2 si solo se puede detectar un flujo mínimo, una puntuación de 3 cuando hay un flujo moderado, y una puntuación de 4 cuando es evidente un flujo sanguíneo significativo (Figura 8).
DISCUSIÓN
Construimos un sistema de puntuación (REC) que puede distinguir eficazmente enfermedades benignas y formaciones malignas endometrio. El sistema de puntuación REC identificó correctamente lesiones en nueve de cada 10 mujeres posmenopáusicas con un espesor endometrial ≥ 5 mm. El enfoque de puntuación se puede utilizar para reducir la cantidad de procedimientos invasivos realizados.
Utilizamos términos y clasificaciones definidos por el Grupo Internacional de Análisis de Tumores Endometriales (IETA) que pueden usarse para medir y describir patología ubicada en la cavidad uterina. El objetivo principal de este trabajo es crear una lista de términos y definiciones que puedan utilizarse tanto en la práctica diaria de los médicos como en la investigación científica.
Según V.N. Demidov y A.I. Gusa, ultrasonografía las pruebas endometriales deben realizarse en los primeros tres días después del final de la menstruación normalmente, en este momento el endometrio debe ser completamente homogéneo e hipoecoico.
En hiperplasia glandular(GE) el espesor del endometrio es de 1 a 1,5 cm, rara vez alcanza los 2,0 cm. La ecogenicidad de la hiperplasia aumenta, la ecoestructura es homogénea, a menudo con múltiples pequeñas inclusiones anecoicas. A veces se observa un efecto de amplificación acústica distal al GE (fig. 1-4). Al visualizar áreas de mayor ecogenicidad en el contexto de un endometrio prácticamente sin cambios, se puede concluir que hiperplasia focal endometrio (Fig.).
La situación con diagnóstico por ultrasonido Hiperplasia endometrial atípica (AHE). Varios autores indican que no existen criterios ecográficos específicos para el diagnóstico de AGE. El espesor del endometrio en esta condición varía de 1,5 a 2,0 cm, en algunos casos alcanza los 3,0 cm. La ecogenicidad de la AGE es media y la ecoestructura es homogénea (fig. 5-6).
Como señaló acertadamente V.N. Demidov y A.I. Gus, a pesar de las importantes diferencias morfológicas entre los pólipos endometriales (glandulares, glandulares-fibrosos, fibrosos, adenomatosos), su imagen ecográfica tiene mucho en común. Una imagen ecográfica típica de un pólipo endometrial (EP) es una formación ovalada o redonda de ecogenicidad media o aumentada con un límite claro entre el pólipo y los tejidos circundantes, generalmente en forma de un borde anecoico (fig. 7-15).
El tamaño de los pólipos puede variar de forma muy significativa, desde 0,5 cm hasta 4-6 cm (en el caso de PE glandular fibrosa y adenomatosa). En presencia de PE pequeño (<0.5 см) диагностика затруднена, и, как замечают В.Н. Демидов и А.И. Гус, единственным эхопризнаком может явиться деформация срединной линейной гиперэхогенной структуры М-эхо.
Dopplerografía con procesos hiperplásicos del endometrio. Según B.I. Zykin, con GE, no se registró el flujo sanguíneo dentro de la membrana mucosa (en el 75-80% de los pacientes) o se visualizaron algunos loci de color (Fig. 16).
La Dopplerografía color de los pólipos endometriales reveló un vaso de alimentación en forma de "puente de color" entre las zonas sub y endometrial (fig. 17-18).
Los indicadores de flujo sanguíneo en los procesos hiperplásicos endometriales benignos se caracterizaron por una velocidad baja y una resistencia bastante alta (fig. 19-21, tabla 1). Otros autores obtuvieron datos similares.
Cuadro No. 1. Indicadores del flujo sanguíneo intraendometrial durante procesos hiperplásicos (B.I. Zykin, 2001).
Cáncer endometrial
Se dedica una gran cantidad de estudios a intentar correlacionar el riesgo de cáncer de endometrio (CE) con el grosor del eco M, especialmente en la posmenopausia. Por lo tanto, A. Kurjak et al consideran que el espesor endometrial >8 mm en la perimenopausia y >5 mm en la posmenopausia es patognomónico de CE. SS Suchocki et al. no se encontró ni un solo caso de cáncer o hiperplasia con espesor endometrial, señalan varios autores. Atención especial a la muy baja especificidad del engrosamiento endometrial como criterio para la endometriosis endometrial. Entonces, según I. Fistonic et al. en pacientes con sangrado posmenopáusico, el espesor del endometrio fue: 6,2 mm con atrofia endometrial, 12,4 mm con hiperplasia simple, 13,4 mm con hiperplasia compleja, 14,1 mm con carcinoma. Los autores no encontraron diferencias significativas en el grosor del endometrio entre los grupos de hiperplasia y carcinoma. Donde edad promedio de pacientes con carcinoma fue significativamente mayor (62 años). Bakour et al. , utilizando un espesor endometrial de 4 mm como criterio de malignidad, pudieron diagnosticar carcinoma de endometrio con sensibilidad, especificidad, PCR, PCR del 92,9%, 50,0%, 24,1%, 97,6%. Los autores concluyen que en mujeres con sangrado posmenopáusico, el grosor del endometrio<4 мм позволяет с высокой вероятностью исключить вероятность карциномы, однако толщина 4 мм не добавляет значимой информации о наличии или отсутствии малигнизации.
En el diagnóstico de EC, la evaluación de la estructura del eco interno del eco M puede desempeñar un papel importante. Según T. Dubinsky et al. el endometrio delgado y homogéneo es un signo pronóstico de un hallazgo benigno, mientras que la visualización de una ecoestructura heterogénea siempre requiere un examen histológico para aclarar el diagnóstico. El uso combinado de tres criterios ecográficos (espesor 5 mm, contorno desigual, estructura ecográfica heterogénea) permitió a G. Weber et al. diagnosticar carcinoma de endometrio con sensibilidad, especificidad, PCR, PCR 97%, 65%, 80%, 94%.
Es importante la posibilidad de una evaluación ecográfica de la invasión maligna del miometrio. Así según F. Olaya et al. al diagnosticar una invasión profunda del carcinoma de endometrio al miometrio (>50%), la sensibilidad, especificidad y precisión de la ecografía transvaginal fueron del 94,1%, 84,8%, 88%. Al diferenciar el grado de invasión del carcinoma de endometrio al miometrio (sin invasión, invasión de capas adyacentes al endometrio, invasión profunda), la sensibilidad, especificidad y precisión de la ecografía transvaginal fueron 66,2%, 83,1%, 77,2%. Los resultados obtenidos son comparables a la efectividad de la resonancia magnética sin contraste y ligeramente inferiores a la efectividad de la resonancia magnética con contraste.
Particularmente dignos de mención son los trabajos cuyos autores describen casos de carcinoma de endometrio en mujeres posmenopáusicas con un endometrio delgado o incluso no visualizado, o con una combinación de imagen ecográfica de atrofia endometrial y serometra (se cree que la imagen ecográfica del líquido en el la cavidad uterina acompaña al 50% de los casos de cáncer de endometrio). Entonces S. Li et al. encontró cáncer de endometrio en el 3,9% de las pacientes con espesor endometrial<5мм. По данным М. Briley и соавт. , при постменопаузальном кровотечении у 20% пациенток с невизуализируемым эндометрием имела место карцинома. Авторы считают, что у пациенток с постменопаузальным кровотечением при визуализации тонкого эндометрия (<6мм) биопсии можно избежать, однако утолщенный, и что важно - невизуализируемый эндометрий являются показанием для биопсии. H. Krissi и соавт. описали рак эндометрия при эхокартине атрофии в сочетании с серометрой, считая, что последняя может служить показанием для биопсии, поскольку компрессия стенок матки при серометре может скрывать патологические изменения эндометрия. В то же время R. Bedner и соавт. полагают, что небольшая серометра в постменопаузе (до 5 см3) вряд ли может ассоциироваться с карциномой эндометрия, описывая случай последней с объемом внутриматочной жидкости 12см3.
Pasando a detallar los signos ecográficos de la CE, es necesario recordar que esta última se divide en la variante patogénica I (PE-I), que ocurre en el contexto de la hiperplasia endometrial, y la variante patogénica II, que ocurre en el contexto de la atrofia endometrial (PE-II).
- Gran espesor del eco M, más de la mitad del espesor del útero
- Desigualdades y contornos borrosos.
- Mayor ecogenicidad
- Mayor conductividad del sonido.
- Estructura de eco interno heterogénea.
- Inclusiones líquidas internas
- Adelgazamiento desigual del miometrio, que indica invasión.
- Líquido en la cavidad uterina. La imagen ecográfica de RE-II es completamente inespecífica, pero se debe sospechar de este tipo si se encuentran los siguientes signos ecográficos en una mujer con sangrado posmenopáusico (Fig.28):
- Endometrio no visualizado
- Líquido en la cavidad uterina.
|
Así, resumiendo el apartado dedicado al diagnóstico ecográfico de la CE, no se puede dejar de estar de acuerdo con B.I. Zykin, quien cree que para el diagnóstico del cáncer de endometrio el indicador de espesor no es decisivo, y concluye que en la etapa actual la ecografía transvaginal (modo B) se ha agotado como método para diagnosticar el cáncer de endometrio, alcanzando un techo de precisión de 75-85%.
Dopplerografía para RE. Como señaló B.I. Zykin, con RE-I, el flujo sanguíneo intraendometrial se detectó en el 100% de los pacientes en forma de múltiples loci de color, a menudo ubicados de manera caótica (Fig. 24). Los indicadores Doppler se caracterizaron por una alta velocidad y una baja resistencia del flujo sanguíneo (fig. 25-27, tabla 2). La mayoría de los autores que se ocupan de este problema han obtenido datos similares.
| Figura 26 |
| Cáncer endometrial (I variante patogénica) Baja resistencia al flujo sanguíneo |
| Figura 27 |
| Cáncer endometrial (I variante patogénica) Alta velocidad del flujo sanguíneo |
En EC-II, los loci de color no se visualizaron en la proyección de la mucosa atrofiada y el cáncer se reveló solo por un aumento notable en el flujo sanguíneo en las zonas subendometriales del miometrio (Fig. 28). Por lo tanto, el único criterio ecográfico para sospechar malignidad endometrial no fue el grosor del endometrio, sino los lugares de color anormales.
Tabla 2. Indicadores de flujo sanguíneo intraendometrial en el carcinoma de endometrio (B.I. Zykin, 2001).
No hay duda de que el uso generalizado de la ecografía transvaginal de alta resolución y la Dopplerografía aumentará significativamente el nivel de detección temprana de la CE y, posiblemente, reducirá la frecuencia de legrados innecesarios en mujeres con sangrado posmenopáusico.
- Demidov V.N., Gus A.I. Diagnóstico ultrasónico de procesos hiperplásicos y tumorales del endometrio. En el libro: Guía clínica de diagnóstico por ultrasonido / Ed. Mitkova V.V., Medvedeva M.V. T. 3. M.: Vidar, 1997. P. 175-201.
- Demidov V.N., Zykin B.I. Diagnóstico por ultrasonido en ginecología // M. Medicina. 1990.
- Medvedev M.V., Zykin B.I., Khokholin V.L., Struchkova N.Yu. Diagnóstico diferencial por ecografía en ginecología // M. Vidar. 1997
- Zykin B.I. Estandarización de estudios Doppler en oncología ginecológica // Tesis para el grado de Doctor en Ciencias Médicas. Moscú. 2001. 275.P.
- Kurjak A., Kupesic S., (Ed.) Un atlas de Doppler color transvaginal. Segunda edicion. // El grupo editorial Partenón. Nueva York. Londres. 2000. P.161-178.
- Suchocki S., Luczynski K., Szymczyk A., Jastrzebski A., Mowlik R. Evaluación del espesor del endometrio mediante ecografía transvaginal como método de detección en el diagnóstico precoz del cáncer de endometrio // Ginekol-Pol. Mayo de 1998, 69(5): 279-82.
- Bakour SH., Dwarakanath LS., Khan KS., Newton JR., Gupta JK. La precisión diagnóstica de la ecografía para predecir la hiperplasia y el cáncer de endometrio en el sangrado posmenopáusico // Obstet Gynecol Scand. Mayo de 1999, 78(5): 447-51.
- Fistonic I., Hodek B., Klaric P., Jokanovic L., Grubisic G., Ivicevic Bakulic T. Evaluación ecográfica transvaginal de cambios premalignos y malignos en el endometrio en el sangrado posmenopáusico // J Clin Ultrasound. Octubre de 1997, 25(8): 431-5.
- Dubinsky TJ., Stroehlein K., Abu Ghazzeh Y., Parvey HR., Maklad N Predicción de enfermedad endometrial benigna y maligna: correlación histerosonográfica-patológica // Radiología. Febrero de 1999, 210(2): 393-7.
- Weber G., Merz E., Bahlmann F., Rosch B. Evaluación de diferentes parámetros de diagnóstico ecográfico transvaginal en mujeres con sangrado posmenopáusico // Ultrasound Obstet Gynecol. Octubre de 1998, 12(4): 265-70.
- Olaya F.J., Dualde D., García E., Vidal P., Labrador T., Martinez F., Gordo G. Ecografía transvaginal en carcinoma de endometrio: evaluación preoperatoria de la profundidad de la invasión miometrial en 50 casos // Eur J Radiol. 1998 febrero, 26(3): 274-9.
- Medvedev V.M., Chekalova M.A., Teregulova L.E. Cáncer de endometrio // En el libro: Dopplerografía en ginecología. Editado por Zykin B.I., Medvedev M.V. 1ª edición. M. RAVUZDPG, Tiempo real. 2000. págs. 145-149.
- Li S., Gao S. Valor diagnóstico de la evaluación endometrial mediante ecografía transvaginal en pacientes con hemorragia posmenopáusica // Chung Hua Fu Chan Ko Tsa Chih. Enero de 1997, 32(1): 31-3.
- Briley M., Lindsell DR. El papel de la ecografía transvaginal en la investigación de mujeres con sangrado posmenopáusico // Clin Radiol. Julio de 1998, 53(7): 502-5.
- Krissi H., Bar Hava I., Orvieto R., Levy T., Ben Rafael Z. Carcinoma de endometrio en una mujer posmenopáusica con endometrio atrófico y líquido intracavitario: reporte de un caso // Eur J Obstet Gynecol Reprod Biol. Abril de 1998, 77(2): 245-7.
- Bedner R., Rzepka Gorska I. Valor diagnóstico de la acumulación de líquido de la cavidad uterina en la detección de lesiones preneoplásicas y carcinoma de endometrio en mujeres posmenopáusicas asintomáticas // Ginekol Pol. Mayo de 1998, 69(5): 237-40.
Copyright © 2000-2006 "Iskra Medical Corporation", Bulanov M.N.
Reservados todos los derechos. Ninguna parte de esta página (incluidos textos, ilustraciones y archivos) puede reproducirse de ninguna forma ni por ningún medio sin el permiso por escrito de los propietarios de los derechos de autor.Según las estadísticas mundiales, el cáncer de útero ocupa el séptimo lugar entre las enfermedades malignas. Un análisis de la situación oncológica en la última década en Rusia indica un aumento constante de la incidencia del cáncer de endometrio, que en 2007 ocupó el segundo lugar entre todos los tumores malignos en las mujeres. La proporción del cáncer de útero en la estructura de la incidencia de neoplasias malignas por cada 100.000 habitantes de Rusia en diferentes regiones oscila entre 4,5 y 22,5. Hay un aumento constante en la tasa de incidencia de 9,8 en 1990 a 13,9 en 2005, lo que corresponde al tercer lugar en términos de aumento de la incidencia de neoplasias malignas. Actualmente, el aumento del número de casos recién diagnosticados de cáncer de útero no es inferior al de los tumores de mama. En los países del tercer mundo, el riesgo de desarrollar cáncer de endometrio es generalmente menor, pero la tasa de mortalidad sigue siendo alta. En América del Norte y Europa, esta enfermedad es mucho más común, siendo el tumor maligno más común del sistema reproductor femenino, y ocupa el cuarto lugar entre todas las neoplasias malignas después del cáncer de mama, pulmón y colon. La incidencia del cáncer de endometrio aumenta drásticamente entre las edades de 40 y 54 años, y la incidencia máxima se produce entre las edades de 60 y 64 años. La incidencia del cáncer de endometrio y su dinámica en diferentes países, teniendo en cuenta la influencia de los procesos migratorios y la edad, indican las características específicas de la enfermedad y la dependencia de su aparición de un complejo de causas de naturaleza endógena y exógena.
Entre los factores de riesgo para el desarrollo de cáncer de útero destacan el bajo número de nacimientos o la infertilidad, la obesidad, la menopausia tardía y la diabetes mellitus, principalmente tipo 2. En la mayoría de los casos, el riesgo de desarrollar cáncer de endometrio se asocia con diversas formas de hiperplasia endometrial (81,3%), disfunción debida al síndrome de ovario poliquístico (25%), poliposis endometrial (5,3-25%), fibromas uterinos (1,6-8%). Recientemente, ha habido un aumento significativo de formas localmente avanzadas de cáncer de endometrio, lo que se asocia con medidas de diagnóstico primario ineficaces. Las cuestiones relativas al diagnóstico claro del cáncer de endometrio son objeto de un estudio detenido.
En la patogénesis de la enfermedad, la teoría de la estimulación excesiva del endometrio por estrógenos, combinada con la deficiencia de progesterona, es de gran importancia. Se cree que la exposición excesiva a los estrógenos puede provocar hiperplasia endometrial, que puede progresar a una variante atípica y en el 20-25% de los casos pasar a un adenocarcinoma. Al mismo tiempo, la relación existente entre el grado de proliferación endometrial y la concentración de estrógenos en la sangre se observa hasta un cierto valor umbral, e incluso una proliferación intensa no siempre va acompañada de una transformación maligna del endometrio. La correlación descubierta entre el contenido de estrógenos y el daño del ADN en el endometrio normal y maligno nos obliga a prestar más atención al papel de los factores genéticos y morfológicos moleculares en la formación de diferentes tipos de cáncer de útero. El cáncer de endometrio se caracteriza por una naturaleza heterogénea, que se manifiesta tanto a nivel de factores de riesgo como de su patogénesis, lo que determina las características de la formación de grupos de riesgo de esta enfermedad.
Actualmente, para identificar la patología endometrial se utilizan principalmente el legrado diagnóstico de la cavidad uterina, la histeroscopia y el examen citológico por aspiración, así como los métodos de diagnóstico por radiación, entre los cuales la ecografía (ultrasonido) es de gran importancia. Sin embargo, no existen criterios ecográficos uniformes con base metodológica para el crecimiento de tumores invasivos. La introducción de nuevas tecnologías de ultrasonido en los programas de examen integrado de pacientes, como el Doppler pulsado, la angiografía por ultrasonido y la reconstrucción de imágenes tridimensionales, ha aumentado significativamente la eficiencia del diagnóstico primario y el seguimiento de los pacientes con cáncer de endometrio en el proceso de terapia específica.
El objetivo de este trabajo fue estudiar las capacidades de la ecografía compleja utilizando Doppler color y (y EC) y la reconstrucción de imágenes tridimensionales en el diagnóstico primario y esclarecedor del cáncer de endometrio.
material y métodos
Examinamos a 139 pacientes de entre 21 y 87 años con sospecha de cáncer de endometrio en el período peri y posmenopáusico. En 34 pacientes se detectaron procesos hiperplásicos del endometrio, en 105, procesos malignos del endometrio. La edad media de las pacientes con patología benigna fue de 42,6±7,2 años, la de las pacientes con cáncer de endometrio, de 65,4±7 años. En todos los casos se obtuvo la verificación histológica del diagnóstico.
Todos los pacientes fueron examinados exhaustivamente mediante ultrasonido utilizando abordajes transabdominal (sensor convexo de 3,5 MHz) y transvaginal (sensor de 6,5-7 MHz) en los modernos ecógrafos Logiq S6 (GE, Healthcare) y Accuvix-XQ (Medison) de acuerdo con un programa específico que utiliza el Las últimas técnicas de ultrasonido, incluida la ecografía Doppler de los vasos uterinos, la circulación cromática y la AE con reconstrucción de imágenes tridimensionales. Durante el examen transabdominal en pacientes con vejiga llena, se evaluó el estado del útero y los ovarios, se determinaron los volúmenes del cuerpo y el cuello uterino y el ancho del eco M. Durante la ecografía transvaginal (TVUS), se utilizaron mediciones Doppler para medir el flujo sanguíneo y el índice de resistencia en las arterias uterinas, y para evaluar la intensidad del flujo sanguíneo intratumoral. En todas las etapas del estudio se determinó el estado de la estructura endo y miometrial, su relación y homogeneidad. Cuando se detectaron cambios focales, se determinó su tamaño, grado de prevalencia y relación con los órganos y estructuras circundantes, y se realizó una evaluación comparativa del grosor de la pared uterina en el área del tumor y fuera del área del foco del tumor. . Si es posible, se determinaron con precisión los parámetros lineales y volumétricos del tumor, la claridad de sus contornos y se evaluó el estado de la membrana mucosa adyacente. El principal parámetro para evaluar el endometrio sigue siendo el cambio en su grosor. El volumen endometrial también se utiliza para el diagnóstico más temprano de la enfermedad. Sus valores son más fiables en el diagnóstico diferencial del cáncer y procesos hiperplásicos benignos que las mediciones del ancho endometrial. Los criterios para lesiones endometriales malignas son valores de volumen endometrial superiores a 13 cm 3 . Esto garantiza una sensibilidad del 100 % y una previsibilidad del 92 % de una prueba positiva en el diagnóstico del cáncer de endometrio.
Las características más importantes de una neoplasia endometrial fueron el grado y la naturaleza de su vascularización, que se evaluó en el modo cine-loop para obtener la representación visual más completa. Se realizó una evaluación cualitativa del suministro de sangre según la cantidad de señales de color de los vasos de la neoplasia: hipovascular, moderadamente vascular, hipervascular. Utilizamos una tecnología que convertía datos volumétricos en una serie de secciones sucesivas de hasta 0,5 mm de espesor. La selección intencionada de determinadas secciones a partir de datos volumétricos 3D permitió seleccionar las secciones óptimas del cuerpo y la cavidad uterina y estimar sus tamaños con la mayor precisión posible, así como determinar la relación de los cambios identificados con el estado de los órganos y tejidos circundantes. La tecnología Volume CT View permitió, basándose en el escaneo 3D, evaluar los contornos y la estructura del endometrio, la naturaleza de su suministro de sangre y el uso de la opción de histograma permitió determinar con precisión el índice de vascularización.
Se prestó especial atención a la evaluación de la profundidad de la invasión del miometrio, la posible transición del proceso maligno al canal cervical y el estado de los ganglios linfáticos regionales, lo que fue decisivo para determinar el estadio de la enfermedad y elegir las tácticas de tratamiento.
Resultados y discusión
Como resultado del estudio, se identificaron procesos hiperplásicos endometriales en 34 pacientes, que identificamos en formas nosológicas separadas que cumplen con las recomendaciones de la OMS. En mesa La Figura 1 muestra la distribución de pacientes dependiendo de la morfogénesis de los procesos hiperplásicos endometriales identificados.
tabla 1. Distribución de pacientes según el tipo de procesos hiperplásicos endometriales.
Los procesos hiperplásicos del endometrio se manifestaron por trastornos del ciclo menstrual como menometrorragia y anemia de grados I-II. En caso de patología endometrial benigna, en 24 (71,4%) pacientes, se determinó un aumento en el espesor del eco M en promedio mediante ecografía en escala de grises de 14,6 ± 3,2 mm. Con la ecografía transvaginal, la hiperplasia quística glandular se definió como la formación de una ecogenicidad aumentada, una estructura homogénea, con múltiples inclusiones hipo o anecoicas puntuales de hasta 1,5 mm, a veces con un efecto de amplificación acústica. Con hiperplasia atípica, se detectó una estructura sólida hiperecoica heterogénea en la cavidad uterina. Los pólipos se definieron como formaciones hiperecoicas redondas, ovaladas u oblongas, en algunos casos con un tallo largo, de varios tamaños, que deforman la cavidad uterina y se diferencian claramente en el contexto del contenido líquido de la cavidad uterina. Utilizando el modo Doppler pulsado se evaluaron cuantitativamente los parámetros hemodinámicos en las arterias uterinas, que fueron: MSS - 9,3±2,1 cm/s, índice de resistencia - 0,56±0,05.
Con esta técnica se registró el color del flujo sanguíneo intratumoral en la hiperplasia quística glandular en forma de señales únicas procedentes de los vasos situados a lo largo de la periferia. En los pólipos fibroglandulares se visualizó un flujo sanguíneo periférico arterial y venoso moderadamente pronunciado con valores medios de resistencia vascular periférica. En 2 pacientes con hiperplasia glandular se determinó una hipervascularización pronunciada del endometrio. En la hiperplasia atípica se registró un flujo sanguíneo intratumoral central y periférico de intensidad moderada. En 5 pacientes con hiperplasia quística glandular y endometrio atrófico, no se registró el flujo sanguíneo. Los signos característicos de una neoplasia benigna, incluso en presencia de múltiples crecimientos polipoides, fueron la preservación de la forma de la cavidad uterina, una definición clara del contorno externo del endometrio y una distribución uniforme de los vasos miometriales (Fig. 1 y 2). ).
Arroz. 1. TVUS, modo de mapeo energético. Hiperplasia endometrial quística glandular.

Arroz. 2. TVUS, modo de mapeo energético. Pólipo endometrial.
Se diagnosticó patología endometrial maligna en 105 pacientes. El 80% de las examinadas con esta patología tenían entre 50 y 69 años, de las cuales 82 (78%) presentaron transformación maligna del endometrio acompañada de sangrado posmenopáusico. Un examen de pacientes con sospecha de cáncer de endometrio reveló un aumento en el grosor del eco M a 18,1 ± 6,7 mm. En la etapa Ia, el espesor del eco M fue de 11,5±3,7 mm, en la etapa Ib - 15,8±8,4 mm, en la etapa Ic - 17±3,4 mm, en la etapa II - 21±4,1 mm, en la etapa III - 27± 2,0 mm, en la etapa IV - más de 30 mm. El estadio del cáncer de útero se determinó según la Clasificación Internacional del Cáncer (FIGO, 1988). En mesa 2, se hizo una comparación de un histotipo específico de cáncer de endometrio con el estadio de la enfermedad.
Tabla 2. Comparación de histotipo y estadio del cáncer de endometrio.
| histotipo tumoral | Escenario | Total | |||||
|---|---|---|---|---|---|---|---|
| I a | Ib | ic | II | III | IV | ||
| Adenocarcinoma: | |||||||
| altamente diferenciado | 12 | 3 | 3 | 4 | 2 | 1 | 25 |
| moderadamente diferenciado | 22 | 6 | 2 | 6 | 6 | 2 | 44 |
| grado bajo | 5 | - | - | 1 | 3 | 1 | 10 |
| seroso-papilar | 3 | - | - | 1 | 3 | 1 | 8 |
| celda clara | - | 1 | - | - | - | 1 | 2 |
| Carcinoma glandular de células escamosas | 1 | 1 | - | 2 | 1 | - | 5 |
| Sarcoma | 2 | - | 1 | 1 | 3 | 2 | 9 |
| acantoma | 1 | 1 | - | - | - | - | 2 |
| Total | 46 | 12 | 6 | 15 | 18 | 8 | 105 |
Como se puede ver en la tabla. 2, más del 60% de las pacientes fueron diagnosticadas con cáncer de útero en etapa I, y 46 pacientes tenían etapa Ia. Los pacientes con formas comunes de enfermedades malignas del cuerpo uterino representaron el 23%. En la mayoría de los casos (89 pacientes, 85%), se diagnosticó adenocarcinoma de diversos grados de diferenciación.
En nuestro estudio, el grado de diferenciación tumoral se correlacionó con el estadio de la enfermedad: en el adenocarcinoma altamente diferenciado, el proceso se limitó principalmente al cuerpo uterino. Se observaron adenocarcinomas serosos papilares y de células claras pobremente diferenciados en los estadios II, III y IV con diseminación del tumor más allá del órgano. El carcinoma de células escamosas en estadio I se diagnosticó en 2 pacientes, los estadios II y III, en 3. Se detectó una combinación de adenocarcinoma y sarcoma del estroma endometrial en 9 pacientes, de los cuales 5 fueron diagnosticados con los estadios III y IV de la enfermedad. Los principales signos ecográficos del cáncer de endometrio durante los estudios transabdominales y transvaginales en el modo B-scan pueden considerarse un aumento del eco M, que no es típico de esta paciente, la irregularidad y heterogeneidad del endometrio, además, una mayor ecogenicidad de su estructura en su conjunto o la formación focal identificada en comparación con el miometrio sin cambios, la presencia de un contorno externo desigual que penetra en diferentes profundidades. En casos de diseminación local significativa del tumor, es posible visualizar un borde hipoecoico alrededor del tumor o la ausencia de un borde entre el foco del tumor y el miometrio. En nuestro estudio, evaluamos el índice de crecimiento invasivo (IGI), que determina la relación entre el volumen del endometrio alterado (AVI) y el volumen del cuerpo uterino. Los datos obtenidos se presentan en la tabla. 3. El cálculo de estos indicadores fue posible sólo para el cáncer de endometrio en etapa I, cuando el borde del endometrio alterado estaba claramente definido (Fig. 3).
Tabla 3. Parámetros ecográficos del útero y M-eco en cáncer de endometrio en diferentes estadios.
En el estadio Ia, el volumen del endometrio fue de 4,2 ± 2,2 cm3, IIR - 11,9 ± 4,2, en el estadio Ib AIE - 8,3 ± 4,6 cm3, IIR - 7,5 ± 5,4 cm3, en el estadio Ic AIE - 15,4 ± 5,3 cm3, IIR - 4,3±2,9. Como se muestra en la tabla. 3, se observa un claro aumento del volumen endometrial y una disminución de los valores del IRI a medida que aumenta el grado de invasión tumoral en el miometrio. Para la mayoría de los pacientes con cáncer de endometrio, su localización era característica del fondo del útero o de uno de los ángulos tubáricos. La necrosis tumoral con deformación de la cavidad uterina y la presencia de líquido en ella se determinaron en las etapas III y IV del proceso.
Según los datos de la literatura, hemos identificado tres tipos principales de crecimiento del cáncer de endometrio invasivo.
- Desarrollo de múltiples focos tumorales altamente diferenciados en el contexto de procesos hiperplásicos de todo el endometrio.
- Desarrollo de un foco tumoral altamente diferenciado, rodeado por una membrana mucosa hiperplásica en un área corta.
- Desarrollo de un foco tumoral moderada o poco diferenciado en el contexto de una membrana mucosa atrófica.
La forma exofítica de crecimiento tumoral se detectó en el 15% de los casos. El crecimiento del tumor exofítico se caracteriza por la ausencia de deformación de la cavidad uterina, límites claros del endo y miometrio o la detección de una formación en la luz de la cavidad uterina. En el 85% de los casos se observó una forma de crecimiento endofítico con invasión del miometrio. La violación de la integridad del borde hipoecoico en el cáncer de endometrio es un signo específico de invasión del miometrio. El crecimiento de tumores endofíticos provoca asimetría y deformación de la cavidad uterina. Con un proceso infiltrativo profundo, la segunda opción se observó en el 30%, la tercera opción, en el 70% de los casos. La ecografía permitió determinar claramente la forma del crecimiento del tumor solo en las etapas iniciales de la enfermedad. En el cáncer de endometrio en estadio Ia, en el caso de la ecografía en modo B, se determinó una estructura hiperecoica homogénea del eco M mediano, y en el 69,5% se reveló heterogeneidad de la estructura endometrial debido a inclusiones de forma redonda, con contornos suaves, en algunos casos poco claros, mayor ecogenicidad, cuyo tamaño promedio fue de 6,3 ± 3,8 mm. En todas las observaciones en la etapa I de la enfermedad se determinó que los límites del endometrio eran claros y uniformes.
Tabla 4. Parámetros hemodinámicos en patología benigna y maligna del endometrio.
Nota. *-R<0,05
En nuestras observaciones, fue posible diferenciar el primer y segundo tipo de desarrollo tumoral en el modo B habitual solo en 10 pacientes. En otros casos, debido a la importante diseminación local del tumor, estas diferencias no se determinaron. Con un proceso infiltrativo profundo en las etapas III y IV de la enfermedad, el espesor del eco M superó los 27,0 mm. Los límites entre el tumor y el miometrio en todos los casos no estaban claros, los contornos eran desiguales y en 61 (58,0%) pacientes los límites del tumor no estaban definidos hasta el contorno externo del útero. La estructura del eco M en el 30,3% de los casos era hiperecoica homogénea, en el 20,1% hipoecoica homogénea y en el 50% heterogénea, predominantemente hiperecoica. La ecoestructura del tumor también podría tener una ecogenicidad diferente: en el 44,6% de los casos era hiperecoica homogénea, en el 10,4% hipoecoica homogénea, en el 45,0% mixta.
Se evaluaron los indicadores cuantitativos de la hemodinámica, realizados utilizando las arterias uterinas y los vasos tumorales. En mesa En la tabla 4 se muestra una descripción comparativa de los parámetros hemodinámicos en patologías endometriales benignas y malignas.
Como puede verse en los datos presentados, la hemodinámica del flujo sanguíneo regional en el cáncer de endometrio se acompaña de una tendencia a aumentar la velocidad del flujo sanguíneo en los vasos del útero y una disminución estadísticamente significativa en el índice de resistencia periférica en los vasos tumorales. , que puede caracterizar la actividad del flujo sanguíneo intratumoral. El MSS en las arterias uterinas dependía del volumen del cuerpo uterino, lo que podría estar asociado con la presencia de fibromas y la naturaleza de la vascularización del tumor. Los indicadores de flujo sanguíneo intratumoral e IR no dependieron estadísticamente del histotipo de cáncer de endometrio.

Arroz. 4. TVUS, modo de mapeo energético. Cáncer de endometrio en estadio Ia. Se identifica un foco de hipervascularización a lo largo de la pared anterior del útero.

Arroz. 5.

Arroz. 6. TVUS, Doppler color, escaneo longitudinal. Cáncer de endometrio en estadio Ia. Formación infiltrativa de una estructura hiperecoica en la zona del fondo del cuerpo uterino con vascularización reducida.
Al analizar la naturaleza y el grado de vascularización del cáncer de endometrio, evaluados mediante los modos CDC y EC, se determinaron diferentes opciones para el flujo sanguíneo intraendometrial. La vascularización patológica del endometrio se produjo en 92 (87,6%) pacientes con cáncer de endometrio. En otros casos, incluso en presencia de signos ecográficos característicos de lesiones malignas, no se visualizó el flujo sanguíneo intratumoral mediante las técnicas utilizadas. En el caso de un tumor del cuerpo uterino, se identificaron tres variantes principales del suministro de sangre (A, B, C), y se observó una cierta dependencia del patrón de circulación cromática y CE con las etapas y formas identificadas de crecimiento del tumor. La intensidad del flujo sanguíneo en el endometrio y el nódulo tumoral, determinada en los modos CDC y EC, dependía del tipo de crecimiento del tumor y podía presentarse más claramente en el modo cine-loop. En el cáncer de endometrio se detectan zonas de flujo sanguíneo tumoral en más del 90% de los casos (fig. 4-8).
Se encontró que la opción A era característica del estadio Ia: con infiltración del miometrio a una profundidad de 5 mm, que se determinó en el 33,8% de los casos y se caracterizó por un aumento desigual del flujo sanguíneo intraendometrial debido a un aumento local de la número de manchas de color con diferentes intensidades de color, en ausencia de loci de color en la zona subendometrial. La misma variante era característica de la forma de crecimiento exofítica con un tipo de neovascularización intratumoral.

Arroz. 7. TVUSI, CDC. Cáncer de endometrio en estadio IV. Hipervascularización de la formación de una estructura heterogénea en la zona del ángulo uterino izquierdo. Se determina el flujo sanguíneo endometrial e intratumoral.

Arroz. 8. TVUS, combinación de modo B y modo de mapeo de energía. Cáncer de endometrio en estadio IV. Un foco de hipervascularización a lo largo de la pared posterior del útero con flujo sanguíneo endometrial hipervascular.
La opción B (47,6%) se caracterizó por un aumento total del flujo sanguíneo intraendometrial debido a una gran cantidad de loci de color ubicados caóticamente, con un aumento local simultáneo en la cantidad de señales de color en la zona subendometrial. En el 27,5% de los casos se determinó una vascularización moderada del tumor, combinada con una rica vascularización del miometrio. Esta variante se identificó en el 78,3% de las pacientes con una forma mixta de cáncer de endometrio.
La opción C (19,6%) se caracterizó por un ligero aumento en el flujo sanguíneo intraendometrial con un aumento total significativo en el número de señales de color en la zona subendometrial. Esta variante fue característica de la forma de crecimiento endofítica (92,5%) y estuvo acompañada de un intenso flujo sanguíneo intra y peritumoral.
Aunque no se estableció una correlación directa entre la gravedad del flujo sanguíneo del tumor y el estadio de la enfermedad, así como el grado de diferenciación, la presencia de una zona detectable de neovascularización correspondía a un estadio superior del proceso. Se observó flujo sanguíneo hipovascular y moderado en el endometrio en pacientes con adenocarcinoma bien diferenciado.
En el 12,4% de los casos no se registró neovascularización del proceso patológico. La razón de esto podría ser la extirpación de un pequeño tumor como resultado de un legrado diagnóstico preliminar de la cavidad uterina y en el adenocarcinoma altamente diferenciado que surgió en el contexto de una atrofia endometrial.
La construcción de planos frontales permitió determinar con mayor precisión el estado del endometrio y establecer su asimetría. Un patrón vascular desorganizado, revelado por angiografía tridimensional en un bloque volumétrico, cuando se combinan modos de exploración, fue un signo adicional importante de lesiones endometriales malignas. Los resultados más precisos para evaluar el grado de invasión del carcinoma de endometrio se logran mediante reconstrucción tridimensional en modo de angiografía por ultrasonido (fig. 9-11). miometrio adyacente a las áreas tumorales.

Arroz. 9. Ultrasonido realizado con tecnología de visualización multicorte. Usando cortes capa por capa, es posible determinar con precisión la estructura del endometrio y su vascularización.
Las capacidades del método de ultrasonido para diagnosticar el cáncer de endometrio tienen sus limitaciones debido al hecho de que los procesos hiperplásicos y las etapas iniciales de la enfermedad no tienen características de diagnóstico diferencial específicas. El sangrado uterino concomitante con formación de fibrina complica la identificación de áreas de engrosamiento endometrial. Surgen ciertas dificultades para determinar la profundidad de la invasión del miometrio en las etapas iniciales del cáncer de endometrio dentro de límites de hasta 5 mm, así como en casos de adenomiosis concomitante. La ecografía no determina con precisión el volumen de lesiones cancerosas en mujeres con ganglios miomatosos submucosos grandes y múltiples que deforman la cavidad uterina.

Arroz. 10. TVUS, modo de mapeo energético. Ultrasonido realizado mediante tecnología de visión oblicua. Los datos volumétricos 3D nos permiten aclarar el estado del endometrio y la naturaleza de la vascularización endometrial y subendometrial.

Arroz. once. Modo de reconstrucción multiplano. Vista de TC de volumen. Los datos 3D le permiten determinar volúmenes con la mayor precisión posible.
conclusiones
El examen de ultrasonido mediante Doppler pulsado, Doppler color, mapeo de energía y reconstrucción de imágenes tridimensionales es un método altamente informativo para el diagnóstico clarificador no invasivo de la patología endometrial. Los resultados obtenidos indican la alta eficacia de los métodos utilizados en el diagnóstico diferencial de procesos benignos y malignos. La angiografía por ultrasonido y la reconstrucción de imágenes tridimensionales para el cáncer de endometrio ayudan a obtener información adicional y muy importante sobre las características del proceso tumoral, la profundidad de la invasión del tumor en el miometrio y la naturaleza de la neovascularización detectada, permite predecir la tasa de crecimiento tumoral.
El uso de tecnologías ultrasónicas modernas permite resolver los problemas del diagnóstico intranosológico del cáncer de endometrio a un nivel cualitativo y cuantitativo completamente nuevo, así como monitorear a los pacientes en el proceso de tratamiento específico.
Literatura
- Davydov M.I., Aksel E.M. Estadísticas de neoplasias malignas en Rusia y los países de la CEI en 2005 // Boletín del Centro Ruso de Investigaciones Oncológicas que lleva su nombre. N.N. RAMS Blokhin. 2007. T. 18.
- Urmancheeva A.S., Tyulyandin S.A., Moiseenko V.M. Oncoginecología práctica (Conferencias seleccionadas) // M.: Editorial. "Centro Tom" 2008. 400 págs.
- Ashrafyan L.A., Kharchenko N.V., Ogryzkova V.L. y otros Principios modernos del diagnóstico primario y esclarecedor del cáncer de endometrio // Oncología práctica. 2004. T. 5. No. 1.
- Demidov V.N., martes A.I. Diagnóstico ecográfico de procesos hiperplásicos y tumorales del endometrio // Ed. Mitkova V.V., Medvedeva M.V. Guía clínica de diagnóstico por ultrasonido, 3 vols.: Vidar. 1997. págs. 120-131.
- Kapustina I.N., Sidorova A.N., Sarantsev A.N. Mapeo Doppler color en el diagnóstico del cáncer de endometrio // Sonoace internacional. Versión rusa. vol. 9, 2001. págs. 34-39.
- Maksimova N.A. Algunos aspectos del diagnóstico ecográfico del cáncer de endometrio // Diagnóstico ecográfico en obstetricia, ginecología y pediatría. 1999. No. 3. P. 196-201.
- Stolyarova I.V., Minko B.A., Sirazitdinov B.R. Capacidades de la angiografía ultrasónica tridimensional en el diagnóstico específico del carcinoma de endometrio // 19 Congreso Internacional sobre Tratamiento Anticáncer París, 5-8 de febrero; 2008. págs. 255-256.
- Gazhenova V.E. Diagnóstico por ultrasonido en ginecología // M.: "MEDpress-inform". 2005. 264 pág.
- Titova V.A., Kharchenko N.V., Stolyarova I.V. Radioterapia automatizada del sistema reproductor femenino // M.: Medicina. 2006. 160 págs.
- Gruboeck K., Jurkovic D., Lawton F. et al. El valor diagnóstico de las mediciones de espesor y volumen endometrial mediante ecografía tridimensional en pacientes con sangrado posmenopáusico // Ultrasound Obstet. Ginecol. 1996. No. 8. P. 272-276.
- Stolyarova I.V., Minko B.A., Lisyanskaya A.S. y otros. Posibilidades de las técnicas modernas de ultrasonido para aclarar el diagnóstico del cáncer de endometrio // Congreso Internacional Foro Radiológico Nevsky "Nuevos Horizontes" 7 al 10 de abril de 2007 San Petersburgo, págs.
- Chekalova M.A., Zuev V.M. Diagnóstico por ultrasonido en oncología ginecológica // M.: Editorial. casa "médico ruso". 2004. 92 pág.
- Teregulova A.E. Ecografía transvaginal mediante mapeo Doppler color en pacientes con cáncer de endometrio // Diagnóstico por ultrasonido. 1996. N° 4. págs. 21-23.
- Kurjak A., Shalan H., Sosic A. et al. Carcinoma de endometrio en mujeres posmenopáusicas: evaluación mediante ecografía Doppler color transvaginal // Am. J. Obstet. Ginecol. 1993. V. 169. P. 1597-1603.








