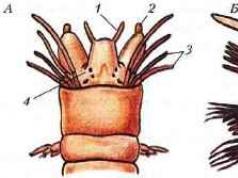
Діагностичні можливості бронхоальвеолярного лаважу
М.В. Самсонова
Впровадження в клінічну практикуфібробронхоскопії та методики бронхоальвеолярного лаважу (БАЛ), що дозволяє отримати бронхіальні змиви (БС) та бронхоальвеолярні змиви (БАС), значно розширило діагностичні можливості у пульмонології. Завдяки методиці БАЛ стало можливим застосуванняцілого спектра цитологічних, бактеріологічних, імунологічних, біохімічних та біофізичних методів. Ці дослідження сприяють правильній діагностиці онкологічних захворюваньта дисемінованих процесів у легенях, а також дозволяють оцінити активність запального процесуу бронхоальвеолярному просторі.
Методика БАЛ
БАЛ проводять при фібробронхо-скопії під місцевою або загальною анестезією. Бронхоскоп вводиться в пайовий бронх (зазвичай середньої частки правої легені), бронхіальне деревопромивається великою кількістю підігрітого до 37°З фізіологічного розчину. Після промивання розчин повністю аспірують із бронхіального дерева.
Бронхоскоп вводять у гирло сегментарного бронха, оклюзуючи його. Через біопсійний канал бронхоскопа проводять поліетиленовий катетер і через нього просвіт сегментарного бронха вводять 50 мл фізіологічного розчину, який потім повністю аспірують. Отримана порція рідини є бронхіальним змивом. Потім катетер просувають на 6-7 см вглиб сегментар-
Марія Вікторівна Самсонова -
докт. мед. наук, зав. лаб. патологічної анатоміїНДІ пульмонології Росздраву.
ного бронха і дробово вводять 4 порції по 50 мл фізіологічного розчину, які щоразу повністю аспірують. Ці змішані між собою порції складають бронхоальвеолярний змив.
Методи дослідження БС та БАС
Основні методи дослідження БС та БАС включають біохімічне та імунологічне дослідження супернатанту, а також вивчення клітинного осаду. При цьому підраховують життєздатність клітин БС та БАС, цитограму, проводять цитохімічні дослідження клітин, а також цитобактеріоскопічну оцінку. У Останнім часомрозроблено методику підрахунку макрофагальної формули БАС при різних захворюванняхбронхолегеневої системи. Дослідження БАЛ також дозволяє оцінити стан сурфактантної системи легень за допомогою вимірювання поверхневого натягу та вивчення фосфоліпідного складу сурфактанту.
Бронхіальну порцію БАЛ використовують для проведення якісних та кількісних мікробіологічних досліджень. Крім цього щодо змін клітинного складу БС можна визначити вираженість запальної реакціїу бронхіальному дереві.
бронхіальний епітелій 5-20%
в тому числі
циліндричний епітелій 4-15% плоский епітелій 1-5%
альвеолярні макрофаги 64-88% нейтрофіли 5-11%
лімфоцити 2-4%
огрядні клітини 0-0,5%
еозинофіли 0-0,5%
Нормальна цитограма альвеолярної порції БАЛ (рис. 1) наведено у табл. 1.
Діагностичне значення дослідження БС та БАС
Найбільше діагностичне значеннядослідження БС та БАС має для оцінки ступеня запалення в трахеобронхіальному дереві, при пухлинах легеніта альвеолярному протеїнозі.
Цитологічне дослідженняБАС має високу діагностичну цінність лише при деяких захворюваннях легень. До таких нозологій відноситься гістіоцитоз Х, при якому з'являються клітини Лангер-Ганс (у їх цитоплазмі при електронної мікроскопіївизначаються характерні Х-тельця, імунофенотипу - це СЕ1+-клітини). За допомогою БАС можна підтвердити наявність легеневої кровотечі. Дослідження БАС показано також при верифікації альвеолярного протеїнозу, для якого характерна наявність позаклітинної речовини (рис. 2), що добре визначається за допомогою світлової (ШІК-реакція) та електронної мікроскопії. У цьому захворюванні БАЛ служить як діагностичною, а й терапевтичною процедурою.
Мал. 1. Нормальний клітинний склад БАС. Забарвлення по Романівському. х400.
При пневмоконіозах за допомогою дослідження БАС можна лише підтвердити експозицію до пилового агента. Специфічна діагностикаберилліоз може бути проведена при дослідженні функціональної проліферативної активності клітин БАС у відповідь на дію солей берилію. При азбестозі в БАС можна виявити азбестові тільця (рис. 3) у вигляді характерних волокон - як позаклітинно, так і внутрішньоклітинно. Ці тільця є волокна азбесту з агрегованими на них ге-мосидерином, феритином, глікопротеїном, тому вони добре забарвлюються при проведенні ШІК-реакції та забарвлення по Перлсу. Вкрай рідко азбестові тільця виявляються в осіб, які мали непрофесійний контакт з азбестом, при цьому концентрація таких частинок БАС не перевищує 0,5 в 1 мл. У БАС також можуть бути виявлені псевдоазбестові тільця - при пневмоконіозах, пов'язаних із впливом пилу вугілля, алюмінію, скловолокон та ін.
У хворих з імунодефіцитними станами (зокрема, ВІЛ-інфекцією) БАЛ є методом вибору для виявлення збудників інфекційних уражень легень. Чутливість БА при діагностиці пневмоцистної інфекції (рис. 4), за деякими даними, перевищує 95%.
За інших захворювань дослідження БАС не є високоспецифічним, але може дати додаткову інформацію, яку оцінюють у комплексі з клінічними, рентгенологічними, функціональними та лабораторними даними.
При дифузній альвеолярній кровотечі (ДАК), що зустрічається при різних захворюваннях, у БАС можуть бути виявлені вільні та фагоцитовані еритроцити та сі-дерофаги (рис. 5). БАС служить ефективним методомвиявлення ДАК навіть за відсутності кровохаркання, коли діагностика цього стану вкрай складна. ДАК слід диференціювати з гострим респіраторним дистрес-синдромом (ОРДС),
при якому в БАС також з'являються сидерофаги.
У рамках диференціальної діагностикиідіопатичного фіб-розуючого альвеоліту (ІФА) цитологічне дослідження БАС дозволяє виключити інші інтерстиціальні захворювання легень. Так, помірне підвищення частки нейтрофілів та еозино-філів у БАС не суперечить діагнозу ІФА. Значне збільшення відсотка лімфоцитів та еозинофілів нехарактерне для ІФА, і в цих випадках слід задуматися про інші альвео-літи (екзогенні алергічні, лікарські або професійні).
Цитологічне дослідження БАС є чутливим методом у діагностиці екзогенного алергічного альвеоліту (ЕАА). Високий відсоток лімфоцитів, наявність плазматичних та опасистих клітин, а також “пилових” макрофагів у поєднанні з анамнестичними та лабораторними даними дозволяє діагностувати ЕАА. Можлива поява в БАС еозі-
Таблиця 1. Нормальна цитограма БАС
Клітковий склад БАС Курці, що не палять
Цитоз, кількість клітин х106/мл 0,1-0,3 >0,3
Альвеолярні макрофаги, % 82-98 94
Лімфоцити, % 7-12 5
Нейтрофіли, % 1-2 0,8
Еозінофіли, %<1 0,6
Гладкі клітини, %<1 <1
Мал. 2. Позаклітинна речовина у БАС при альвеолярному протеїнозі. Забарвлення по Романівському. х400.
нофілів чи гігантських багатоядерних клітин (рис. 6). Серед лімфоцитів переважають клітини з імунофенотипом С03+/С08+/С057+/С016-. Слід пам'ятати, що за кілька місяців від початку захворювання поряд з Т-супресорами починає збільшуватися кількість Т-хелперів. Додаткові методи дослідження дозволяють виключити інші захворювання, при яких має місце підвищення частки лімфоцитів в БАС, - дифузні хвороби сполучної тканини, лікарські альвеоліти (ЛА), облітеруючий бронхіоліт з пневмонією (ОБОП), що організується, силікоз.
При саркоїдозі також відзначається підвищення частки лімфоцитів у БАС, причому для саркоїдозу характерно со-
Мал. 4. Pneumocystis jiroveci в БАС. Забарвлення по Романівському. x400.
Мал. 5. Сидерофаги у БАС. Забарвлення за Перлсом. x100.
www.atmosphere-ph.ru
Мал. 6. ЕАА: підвищення частки еозинофілів, нейтрофілів, лімфоцитів у БАС, гігантська багатоядерна клітина. Забарвлення по Романівському. х200.
Мал. 7. “Аміодаронова легеня” (ЛА): макрофаги з пінистою цитоплазмою в БАС. Забарвлення по Романівському. х1000, масляна іммерсія.
Мал. 8. Лімфоцитарний тип цитограми БАС. Забарвлення по Романівському. х1000, масляна іммерсія.
відношення Т-хелперів і Т-супресорів (С04+/СЕ8+) вище 3,5 (чутливість цієї ознаки становить 55-95%, специфічність - до 88%). У БАС у хворих на саркоїдоз можуть бути також виявлені гігантські багатоядерні клітини (типу клітин стороннього тіла).
Мал. 9. Нейтрофільний тип цитограми БАС. Забарвлення по Романівському. х1000, масляна іммерсія.
При лікарських альвеолі-
морфологічні зміни в легенях можуть бути різноманітними, часто спостерігають альвеолярний геморагічний синдром або ОБОП. У цитограмі БАС може відзначатися збільшення частки еозинофілів, нейтрофілів, але найчастіше при ЛА опі-
Таблиця 2. Приклади застосування цитологічного аналізу БАС для диференціальної діагностики (за даними ОгеП М. е1 а1., 2000)
Показники цитограми
БАС та їх оцінка
Клінічні приклади цитограми БАС
Цитоз, х104/мл 29 110 100 20 64
Макрофаги, % 65,8 18,2 19,6 65,7 41,0
Лімфоцити, % 33,2 61,6 51,0 14,8 12,2
Нейтрофіли, % 0,6 12,8 22,2 12,4 4,2
Еозинофіли, % 0,2 6,2 7,0 6,8 42,2
Гладкі клітини, % 0,2 1,0 0,2 0,3 0,4
Плазмоцити, % 0 0,2 0 0 0
Відношення СО4+/СО8+ 3,6 1,8 1,9 2,8 0,8
Бактеріальний посів - - - - -
Найбільш вірогідний діагноз Саркоїдоз ЕАА ЛА ІФА ОЕП
Імовірність правильності діагнозу*, % 99,9 99,6 98,1 94,3 Не обчислювалася
* Обчислювалася за допомогою математичної моделі. Позначення: ОЕП – гостра еозинофільна пневмонія.
ють підвищення відсотка лімфоцитів, серед яких, як правило, переважають СЕ8+-клітини. Дуже високий вміст нейтрофілів в БАС зустрічається при прийомі антидепресанту номіфензину (частка нейтрофілів може досягати 80% з подальшим її зниженням і одночасним наростанням числа лімфоцитів). При аміодароновому ЛА (“аміодаронове легке”) відбуваються специфічні зміни БАС у вигляді появи великої кількості “піністих” макрофагів (рис. 7). Це дуже чутлива, але малоспецифічна ознака: такі ж макрофаги можуть бути виявлені і при інших захворюваннях (ЕАА, ОБОП), а також у пацієнтів, що приймають аміодарон, без альвеоліту (аміодарон підвищує вміст фосфоліпідів, особливо у фагоцитах).
В інших випадках, коли БАЛ не виявляє високоспецифічних ознак будь-якого захворювання, цей метод дозволяє обмежити диференціально-діагностичний пошук (табл. 2 та 3) рамками певної групи нозологічних одиниць з тим чи іншим типом аль-веоліту:
Лімфоцитарним (збільшення частки лімфоцитів, рис. 8): саркоїдоз, гіперчутливий пневмоніт, пострадіаційна пневмонія, ІФА, хронічний інфекційний процес у легенях, СНІД, силікоз, синдром Шегрена, хвороба Крона, канцероматпатії, лікарські;
Нейтрофільний (збільшення частки нейтрофілів, рис. 9): склеродермія, дерматоміозит, гострий інфекційний процес у легенях, саркоїдоз при злоякісному перебігу, азбестоз, лікарський аль-веоліт;
Еозинофільний (збільшення частки еозинофілів, рис. 10): ангіїт Чер-джа-Строс, еозинофільна пневмонія, лікарський альвеоліт;
Змішаним (рис. 11): туберкульоз. гістіоцитоз.
При діагностиці раку легені метод БАЛ має перевагу
Таблиця 3. Цитологічні показники БАС у нормі та їх зміни при різних патологіях (за даними ОгеП М. е1 а!., 2000)
Альвеолярні макрофаги Лімфоцити Нейтрофіли Еозинофіли Плазмоцити Гладкі клітини Відношення CD4+/CD8+
Нормальні значення
Некурці 9,5-10,5* 0,7-1,5* 0,05-0,25* 0,02-0,08* 0* 0,01-0,02* 2,2-2,8
85-95% 7,5-12,5% 1,0-2,0% 0,2-0,5% 0% 0,02-0,09%
Курці 25-42* 0,8-1,8* 0,25-0,95* 0,10-0,35* 0* 0,10-0,35* 0,7-1,8
90-95% 3,5-7,5% 1,0-2,5% 0,3-0,8% 0% 0,02-1,0%
Неінфекційні хвороби
Саркоїдоз Т = =/Т - =/Т Т/=/4
ЕАА “Пінисті” МФ ТТ Т =/Т +/- ТТ 4/=
Лікарський “Пінисті” МФ ТТ Т Т +/- ТТ 4/=
альвеоліт
ІФА Т Т/ТТ Т - Т =
ОБОП “Пінисті” МФ Т Т Т -/+ =/Т 4
Еозінофільна Т = ТТ +/- =/Т 4
пневмонія
Альвеолярний "Пінисті" МФ Т = = - Н.д. Т/=
протеїноз
Хвороби з'єдна- Т =/Т =/Т - =/Т Т/=/4
тельної тканини
Пневмоконіози ВКВ (частки) Т Т =/Т - =/Т Т/=/4
Дифузне альвео- Забарвлення = / Т Т = / Т - Н.д. =
лярна кровотеча на Fe: +++
ОРДС Забарвлення на Fe: + Т ТТ Т - =/Т 4/=
Злоякісні пухлини
Аденокарцинома = = = - = =
Раковий лімфангіїт Т Т/= Т/= -/+ Т/= 4/=
Гемобластози Т Т Т -/+ Т 4/=
Інфекції
Бактеріальні ВКВ (бактерії) = ТТ Т – Н.д. =
Вірусні ВКВ Т Т Т - Н.д. Т/=
Туберкульоз ВКВ (мікобактерії) Т = Т - Т =
ВІЛ ВКВ Т Т Т/= - Н.д. 4
Позначення: МФ – макрофаги, ВКВ – внутрішньоклітинні включення; показник: Т – підвищений; ТТ – значно підвищений; 4-знижений; =/Т – не змінений, рідше підвищений; Т/=/4 - може бути підвищений, знижений або змінений; Т/ТТ – підвищений, рідше значно підвищений; Т/= - підвищено, рідше не змінено; 4/= - знижений, рідше не змінений; = - не змінено; - Ні; -/+ - зустрічаються рідко; +/- зустрічаються; Н.Д. - немає даних.
* Дані представлені в абсолютних числах х104мл-1.
перед дослідженням мокротиння щодо виявлення пухлинних клітин, так як матеріал може бути по-
лучен з тієї частки або сегмента, де локалізується пухлина. БАЛ дає можливість з більшою ймовірністю
діагностувати периферичні пухлини, включаючи бронхіолоальвеолярний рак (рис. 12).
Мал. 10. Еозінофільний тип цитограми БАС, кристали Шар-ко-Лейдена. Забарвлення по Романівському. х200.
Мал. 11. Змішаний тип цитограми БАС: підвищення частки лімфоцитів, нейтрофілів, еозинофілів. Забарвлення по Романівському. х1000, масляна іммерсія.
Мал. 13. БАС при хронічному бронхіті: наявність циліндричних війчастих клітин, нейтрофілів, скупчення кокової флори. Забарвлення по Романівському. х1000, масляна іммерсія.
Мал. 14. Мікобактерії туберкульозу у БАС. Забарвлення по Цілю-Ніль-Сіну. х1000, масляна іммерсія.
Мал. 15. Псевдоміцелій гриба Candida albicans у БАС. Забарвлення по Романівському. х200.
Цитобактеріоскопічний метод дозволяє виявити і напівкількісно оцінити вміст у БАС бактерій (рис. 13), мікобактерій (рис. 14) і грибів (рис. 15). Ці результати (бактерії можуть бути диференційовані за Грамом) є основою для призначення відповідної антибактеріальної терапії до отримання результатів бактеріологічного дослідження. У казуїстич-
Мал. 16. Значне підвищення числа нейтрофілів у БАС, численні найпростіші типи амеб. Забарвлення по Романівському. х200.
Дослідження БАС дозволяє оцінити ступінь активності запального процесу при інфекційних захворюваннях та ефективність терапії, що проводиться. Низький рівень активності запалення характеризується збільшенням у БАС частки нейтрофілів у межах 10%,
середня – до 11-30%, висока – понад 30%.
Використання гістохімічних методів вивчення клітин БАЛ можливе за їх високої життєздатності (понад 80%).
Висновок
При оцінці виявлених у БС та БАС змін слід дотримуватись певних правил та пам'ятати про наступне:
Виявлені зміни характерні лише для досліджуваного сегмента, тому до них треба ставитись обережно, якщо процес не має дифузного характеру;
Виявлені зміни притаманні даного моменту часу;
Оскільки легені відчувають у собі вплив одночасно багатьох чинників (куріння, полютанти та інших.), необхідно завжди виключати можливість впливу цих чинників в розвитку легеневої патології.
Черняєв А.Л., Самсонова М.В. Патологічна анатомія легень: Атлас/За ред. Чучаліна А.Г. М., 2004.
Шапіро Н.А. Цитологічна діагностика захворювань легень: Кольоровий атлас. Т. 2. М., 2005.
Baughman R.P Bronchoalveolar Lavage. St. Louis, 1992.
Costabel U. Atlas of Bronchoalveolar Lavage. L., 1998.
Drent M. та ін. // Eur. Resp. Monograph. V 5. Mon. 14. Huddersfield, 2000. P. 63.
Книги Видавничого дому “АТМОСФЕ
Амеліна Є.Л. та ін. Мукоактивна терапія /
За ред. А.Г. Чучаліна, А.С. Бєлевського
У монографії підсумововані сучасні уявлення про будову та функціонування мукоциліарного кліренсу, його порушення при різних захворюваннях органів дихання, методах дослідження; розглядаються основні лікарські та нелікарські способи корекції мукоциліарного кліренсу при бронхолегеневій патології. 128 с., іл.
Для лікарів широкого профілю, терапевтів, пульмонологів, студентів медичних вишів.
На сьогоднішній день волоконно-оптична бронхоскопія є звичайною стандартною діагностичною процедурою, яка дозволяє безпосередньо оглянути верхні та нижні дихальні шляхи. У процесі просування ендоскопа через носоглотку, трахею великі бронхи легко можна визначити кількість слизу, як і ступінь набряку слизової оболонки і бронхоспазм. Крім дослідження просвіту дихальних шляхів, однією з великих переваг бронхоскопії є можливість взяття проб з великих і дрібних повітроносних шляхів і альвеол. Отримані зразки потім аналізуються щодо їх клітинних і неклітинних складових.
В останні роки у випадках підозри на дифузне запальне захворювання бронхоальвеолярний лаваж (БАЛ) з використанням ендоскопа або спеціальної трубки набув дещо більшої популярності, ніж традиційніші методи отримання зразків, такі як аспірація трахеї. Протягом багатьох років вважалося, що отримання проб з нижніх відділів трахеї надає репрезентативну інформацію про стан альвеол і малих повітроносних шляхів, так як вільні клітини дихальних шляхів з периферичної легені в кінцевому підсумку вимиваються до трахеї для видалення.
Однак велике дослідження клінічних випадків серед молодих спортивних коней з низькою працездатністю, пов'язаної з патологією нижніх дихальних шляхів, показало, що цитологічні та бактеріологічні результати мають погану кореляцію між зразками, отриманими шляхом трахеальної аспірації та такими, отриманими методом БАЛ. Дослідження показали, що чисельність різних клітин у цитологічних препаратах з трахеальних аспіратів та БАЛ від одного і того ж коня значно відрізнялася. Це свідчить, що зразки з трахеального скупчення рідини можуть неточно відбивати популяцію клітин та виділення, присутні усередині малих дихальних шляхів і альвеол. Це важливо, оскільки непереносимість фізичного навантаження, пошкодження дихальних шляхів при запаленні та гіперреактивність пов'язані із захворюванням дрібних дихальних шляхів, і найкращим методом діагностики є цитологія з БАЛ. Крім того, при бактеріальному культивуванні трахеальних аспіратів було отримано більше позитивних результатів, ніж при культивуванні БАЛ, виконаних в тому самому випадку. Таким чином, нижня частина трахеї, очевидно, містить нормальну бактеріальну флору, яка може бути відсутнім у малих повітроносних шляхах та альвеолах. З цих причин БАЛ стає дедалі популярнішим інструментом з метою оцінки запалення дистальних (малих) дихальних шляхів проти отриманням зразків методом трахеальної аспірації.
Щоб обґрунтувати значущість диференціальної чисельності клітин у БАЛ як додаткового діагностичного інструменту для оцінки дихальної системи, потрібні інші кількісні вимірювання на додаток до звичайного клінічного обстеження. Протягом останніх двох десятиліть був докладно вивчений синдром емфіземи, і кілька дослідницьких лабораторій по всьому світу виразно продемонстрували високу кореляцію між диференціацією клітин БАЛ та результатами дослідження функції легень та гістамінової бронхопровокації у хворих на емфізему коней. В останні роки аналогічно охарактеризована функція легень у молодих спортивних коней з неінфекційним запальним захворюванням дихальних шляхів (IAD) відповідала цим даними щодо діагностичної користі бронхоальвеолярного лаважу.
Метою цього розділу є обговорення застосування техніки бронхоальвеолярного лаважу як інструменту для ідентифікації та характеристики запалення у легенях у коней, які страждають на дифузну патологію легень, такий як IAD молодих спортивних коней та синдром емфіземи у дорослих тварин. Крім того, коротко розглянуті вірусні та бактеріальні хвороби легень в аспекті їхньої діагностики методом бронхоальвеолярного лаважу.
ПОКАЗАННЯ ДЛЯ БРОНХОАЛЬВЕОЛЯРНОГО ЛАВАЖУ
Запалення нижніх дихальних шляхів у коней може розвинутися з різних причин. Коні будь-якого віку можуть страждати на інфекційні (бактеріальні/вірусні) та неінфекційні IAD і можуть демонструвати різні клінічні, фізіологічні та патологічні ознаки. У великому перспективному дослідженні 2-3-річних Чистокровних коней у тренінгу кашель та закінчення з носа були на другому місці після кульгавості як найчастіша причина пропуску тренувальних днів. Неінфекційний IAD є найпоширенішою респіраторною патологією, яка зустрічається як у молодих, так і у дорослих спортивних коней.
Домінуючий ознака IAD - обструкція дихальних шляхів в результаті накопичення виділень, потовщення стінок дихальних шляхів, трансформації дихальних шляхів і, зрештою, у запущених випадках, втрата здатності підтримувати діаметр просвіту дрібних дихальних шляхів. Гіперреактивність дихальних шляхів є наслідком запального процесу і призводить до подальшої їх обструкції через бронхоспазму та інші функціональні відхилення. У здорових коней бронхоспазм виникає у відповідь інгаляцію аерозолі гістаміну в концентрації 16 мг/мл. Навпаки, у більш старих коней з емфіземою бронхоконстрикція настає від інгаляції гістаміну в концентрації менш ніж 8 мг/мл. У спортивних коней віком від 2 до 5 років з IAD бронхоконстрикція виникає у відповідь на інгаляцію гістаміну в концентрації всього 2-3 мг/мл, що вказує на ще більшу гіперреактивність дихальних шляхів. Така сильна гіперреактивність дихальних шляхів корелює із підвищеним вмістом запальних клітин у зразках, отриманих при БАЛ, і тому БАЛ є надзвичайно корисним інструментом для дослідження природи, основи запальних захворювань дихальних шляхів.
Поширеність низької працездатності внаслідок проблем з дихальною системою істотна, особливо у скакових коней. Часті респіраторні відхилення серед цієї популяції тварин включають IAD, індуковане навантаженням легеневу кровотечу та дисфункцію верхніх дихальних шляхів. У цьому контексті IAD робить суттєвий внесок у незадовільну стандартам спортивну форму, переривання стрибків або тренінгу і, зрештою, передчасне завершення спортивної кар'єри. Гістологічне дослідження препаратів шматочків легень від коней старшого віку (>10 років) виявило значне поширення неінфекційного IAD серед цієї вікової групи. Тому IAD відіграє суттєву роль у стані здоров'я та спортивній формі коней усіх вікових груп та спортивних дисциплін. Бронхоскопія та бронхоальвеолярний лаваж з метою визначення природи та ступеня такого запалення надзвичайно важливі, щоб визначитися з відповідним лікуванням та прогнозом у кожному випадку.
Більш рідкісні патології, але також значущі для спортивних коней різного віку - це септичні хвороби легень, такі як абсцеси легені та парапневмонічний випіт. Абсцеси зазвичай локалізуються в краніальній частині правої або лівої каудальної частки легені." Ці хвороби можуть бути легко розпізнані клінічно, завдяки наявності підвищеної температури тіла, анорексії та хворобливості при пальпації грудної клітки. Підозра на бронхопневмонію або абсцес легені підтверджується таким. - як і раніше має цінність бронхоскопія як з діагностичною, так і з терапевтичною метою.Під час бронхоскопії легко виявляється червонувато-коричневий слизовий секрет в нижньому відділі трахеї. слідувати за смужкою знебарвленого слизово-гнійного секрету і ідентифікувати конкретний сегментарний бронх-джерело.Затем, використовуючи біопсійний канал бронхоскопа, можна ввести поліетиленовий катетер всередину конкретного бронха з метою отримати стерильну пробу виділень для бактеріального посіву та цит. Як тільки ця процедура виконана, можна здійснити вливання в уражений бронх і негайне відсмоктування невеликого об'єму рідини (приблизно 200-250 мл за 2 або 3 впорскування), щоб видалити надлишок ексудату. Цей процес називається «туалетом» дихальних шляхів, а не бронхоальвеолярним лаважем. Ця процедура приносить терапевтичну користь завдяки ослабленню бактеріальної атаки та зменшенню ексудативного навантаження в ураженому регіоні легені. Після завершального відсмоктування рідини та перед виведенням ендоскопа можна локально ввести в уражену ділянку дозу розчиненого антибіотика. Цю процедуру можна повторювати щодня або через день як компонент лікування бактеріальної бронхопневмонії у поєднанні із системною терапією.
ПРОЦЕДУРА БРОНХОАЛЬВЕОЛЯРНОГО ЛАВАЖУ
БАЛ можна виконувати у більшості коней у соковитій киї зі слабкою седацією (ксилазин 0.3 0.5 мг/кг внутрішньовенно або роміфідин 0,03-0.05 мг/кг внутрішньовенно) та анестезією дихальних шляхів за допомогою місцевого анестетика (0.4% розчин). Цю процедуру можна проводити, використовуючи бронхоскоп довжиною 1,8-2 м або спеціальну трубку для БАЛ (Bivona Medical Technologies, Gary, Ind.). Коли бронхоскоп або бал-трубка і трахеї, досягнення біфуркації трахеї зазвичай провокує кашель. Тому на цьому етапі корисно влити 60 100 мл попередньо розігрітого розчину лідокаїну (0,4% без епінефрину) для десенсибілізації кашлевих рецепторів, розташованих у біфуркації. Після цієї інфузії ендоскоп або БАЛ-трубка обережно, без надмірного зусилля ) вводиться глибше. Попередньо розігрітий фізіологічний розчин (200-300 мл) швидко вливається в легеню і потім аспірується.
Загальний обсяг фізіологічного розчину для інфузії слід розділити на два окремих болюси, при цьому намагаючись між кожним болюсом отримати настільки багато рідини, наскільки це можливо. Загалом повернення 40-60% від загального обсягу інфузату вказує на задовільний БАЛ. У коней із занедбаним захворюванням відбираються невеликі обсяги, і існує менша тенденція до присутності меншої кількості піни (сурфактанту). Зразки рідини БАЛ потім об'єднують і хропуть на льоду, якщо їхня обробка неможлива протягом 1 години після отримання. Слід оцінити рідину макроскопічно, щоб виявити будь-який пластівцевий дебрис або зміна кольору. Одну або дві пробірки для сироватки або з етилендіамінтетрауксусією кислотою (EDTA) заповнюють рідиною ВАЛ і центрифугують (1500 оборотів/хв протягом 10 хвилин); після видалення супернатанту виготовляють мазки з краплі осаду, які потім висушують на повітрі. При приготуванні мазків скла необхідно швидко висушити на повітрі, використовуючи маленький настільний вентилятор, щоб добре зберегти клітинну морфологію. Виготовлені таким чином мазки можуть зберігатися при кімнатній температурі до 8-10 місяців з невеликими клітинними змінами. Висушені на повітрі мазки для інтерпретації клітинних і неклітинних складових можна пофарбувати барвниками Diff-Qnik, Payta-Gimse, May Грмнвальда, Лейшмана або Грама. Клітинний профіль та морфологія можуть бути ключем до природи ушкодження дихальних шляхів, запалення та імунологічної реакції легень на інфекції або чужорідні антигени.
ДИФЕРЕНЦІЙНИЙ ПІДРАХУНОК КЛІТИН У БАЛ ТА ЇХ ІНТЕРПРЕТАЦІЯ
У польових умовах обсяг введеної рідини часто різниться, варіюючи від 60 до 300 мл стерильного фізіологічного розчину на один ВАЛ. Крім того, у коней із сильним бронхосназмом обсяг вилученої рідини може бути значно зменшений. Внаслідок цих обставин ефект розведення заважає точно підрахувати загальну чисельність ядерних клітин, і з урахуванням великого діапазону значень TaKoii підрахунок представляє малу клінічну цінність в інтерпретації запальних станів легень і вважається таким, що не має діагностичного значення.

З іншого боку, диференціальна чисельність типів клітин майже схильна до впливу при розведенні і має цінність для характеристики патологічного підвищення чисельності конкретних клітинних популяції. Таким чином, за допомогою диференціального підрахунку клітин можливо ідентифікувати характерні риси септичних, несентичних та вірусних запальних захворювань дихальних шляхів, що допомагає при прийнятті рішення щодо лікувального підходу в кожному конкретному випадку. Були встановлені діапазони значень для диференціальної чисельності клітин БАЛ у здорових коней, коней з емфіземою та спортивних коней з поганою працездатністю. У кожній із відповідних груп є характерні цитологічні ознаки.
Диференціальний підрахунок клітин у здорових коней
Діапазони значень диференціальних чисельностей клітин БАЛ були встановлені при отриманні зразків методом БАЛ у коней, які не страждають на респіраторне захворювання, що було підтверджено різними методами. включаючи клінічне обстеження, перевірку функції легень та у деяких випадках відсутністю гіперреактивності дихальних шляхів у відповідь на бронхопровокацію аерозолем гістаміну (рис. 8.2-1). У молодих коней (вік 6 років) популяція нейтрофілів може становити в середньому до 15% у здорових тварин (на підставі вищеописаних методів діагностики) з відповідним зниженням відсоткового вмісту популяції макрофагів та лімфоцитів.
Відхилення у диференціальній чисельності клітин

Синдром емфіземи є часто діаностованим респіраторним захворюванням у дорослих коней з характерним анамнезом, клінічними ознаками, відхиленнями при перевірці функції легень та гіперреактивністю дихальних шляхів Коні з загостренням емфіземи мають щонайменше 23% нейтрофілів у БА2. Однак у таких випадках нейтрофіли часто становлять понад третину диференціальної чисельності всіх запальних клітин і відіграють основну роль у клінічному синдромі та згаданій гіперреактивності дихальних шляхів. Цитологічні препарати БАЛ у коней, що страждають на емфізему, часто мають рясний слизовий фон з безліччю нетоксичних і апоптуючих (старіючих) нейтрофілів. за ключених усередині цього слизу. У БАЛ у хворих на емфізему коней, крім підвищеної кількості нейтрофілів, також має місце значне збільшення загальної чисельності опасистих клітин, еозинофілів, лімфоцитів, макрофагів та епітеліальних клітин. Ці клітини необхідно розпізнати та оцінити окремо від нейтрофілів. Чисельність злущених епітеліальних клітин зазвичай збільшена в результаті ураження слизової ободочки через тяжкий запальний процес. хронічне несептичне запальне захворювання дихальних шляхів
ВИСНОВОК
БАЛ, безперечно, стає потужним допоміжним діагностичним інструментом, що допомагає в діагностиці клінічних і субклінічних захворювань нижніх дихальних шляхів, таких як неінфекційне запальне захворювання дихальних шляхів у молодих спортивних коней і рецидивна обструкція дихальних шляхів, або у дихальних шляхів, або у дихальних шляхів, або у дихальних шляхів, або у дихальних шляхів, або у дихальних шляхів, або у дихальних шляхів, або у дихальних шляхів, або у дихальних шляхів, або у дихальних шляхів, або у дихальних шляхів, або у дихальних шляхів, або у дихальних шляхів, або у дихальних шляхів, або у дихальних шляхів. Диференціальна чисельність клітин БАЛ для здорових коней чітко встановлена із застосуванням загальноприйнятих стандартизованих процедур, і будь-яке відхилення цитологічних профілів від нормальних значень помотає розпізнати широкий діапазон несептичних запальних процесів Хоча в даний час клініцисти призначають певне лікування на підставі цитологічних даних. щодо різних порушень у майбутньому зможуть дозволити лікарям, які працюють з кіньми, надавати більш точну прогностичну інформацію щодо респіраторних більших тренерів, спортсменів і власників. До того ж у більшості молодих та дорослих спортивних коней з великою кількістю білого слизово-гнійного секрету в дихальних шляхах та помітно підвищеним відсотковим вмістом нейтрофілів у клітинному диференціалі не вдається виявити септичного процесу. Скоріше такі випадки демонструють несептичне запальне захворювання дихальних шляхів.
Лаваж бронхоальвеолярний діагностичний - метод дослідження, що забезпечує отримання клітинних елементів, білкових та інших речовин з поверхні найдрібніших бронхів та альвеол шляхом заповнення субсегменту легені ізотоничним розчином з подальшою його аспірацією. Діагностичний субсегментарний бронхоальвеолярний лаваж зазвичай проводиться під час бронхофіброскопії під місцевою анестезією після підведення бронхофіброскопа до гирла субсегментарного бронха. Через канал бронхофіброскопа субсегментарний бронх інстилюється 50-60 мл ізотонічного розчину. Рідина, що надходить з просвіту бронха, що є бронхо-альвеолярним змивом, аспірують через канал бронхофіброскопа в поліетиленовий стаканчик. Інстиляцію та аспірацію повторюють 2-3 рази. В аспірованій рідині, очищеної від слизу шляхом фільтрування через марлю, досліджуються клітинний та білковий склад, функціональна активність альвеолярних макрофагів. Для вивчення клітинного складу бронхоальвеолярний змив центрифугується. З осаду виготовляються мазки, які забарвлюються гематоксилін-еозином або за Романовським. Діагностичний бронхоальвеолярний лаваж найчастіше застосовується для визначення активності дисемінованих процесів у легкому. Ознакою високої активності ідіопатичного фіброзуючого альвеоліту є значне збільшення у бронхоальвеолярному змиві числа нейтрофілів, а при саркоїдозі та екзогенному алергічному альвеоліті – зростання числа лімфоцитів.
ЛАВАЖ БРОНХОАЛЬВЕОЛЯРНИЙ ЛІКУВАЛЬНИЙ
Спосіб лікування захворювань легень, заснований на ендобронхіальному введенні великої кількості ізотонічного розчину та вимиванні згустків слизу, білкового та іншого вмісту дрібних бронхів та альвеол. Лікувальний бронхоальвеолярний лаваж може бути виконаний через бронхоскоп або двопросвітну трубку інтубації. Процедура зазвичай провадиться під наркозом. Штучна вентиляція легень у своїй здійснюється інжекційним способом. Ізотонічний розчин послідовно інстилюється в кожен пайовий або сегментарний бронх через керований катетер і відразу ж аспірується разом з в'язким секретом, що вимивається, і згустками слизу. Бронхоскопічна методика частіше застосовується у хворих на бронхіальну астму в астматичному статусі. Для промивання бронхів використовують 500-1500 мл ізотонічного розчину. Аспірувати зазвичай вдається близько 1/3 – 1/2 введеного об'єму рідини. Показання до лікувального бронхоальвеолярного лаважу у хворих на бронхіальну астму виникають рідко, оскільки комплекс інших лікувальних заходів зазвичай дозволяє купірувати астматичний статус.
Лікувальний бронхоальвеолярний лаваж через двопросвітну трубку інтубації проводиться при однолегеневій штучній вентиляції. У просвіт інтубаційної трубки в головний бронх проводиться катетер, через який здійснюються інстиляція та аспірація ізотонічного розчину. Одномоментно в легеню вводиться 1000-1500 мл розчину, назад аспірується 90-95% об'єму рідини, що вводиться. Процедура повторюється кілька разів. Загальний обсяг рідини, що вводиться, варіює від 3-5 до 40 л. Тотальний бронхоальвеолярний лаваж через двопросвітну трубку інтубації є найбільш ефективним способом лікування ідіопатичного альвеолярного протеїнозу.
Довідникз пульмонології / За ред. Н. В. Путова, Г. Б. Федосєєва, А. Г. Хоменка. - Л.: Медицина
Lynelle R. Johnson DVM, PhD, Dip ACVIM (Internal Medicine)
University of California, USA
Основні положення
Найчастіше колапс трахеї спостерігається у собак дрібних порід середнього віку з надмірною вагою тіла. Іноді ця патологія зустрічається і у молодих собак.
Колапс трахеї найчастіше відбувається у дорзо-вентральному напрямку. Йому передує ослаблення та витончення хрящових кілець трахеї, внаслідок чого спостерігається пролапс задньої стінки трахеї у її просвіт.
Колапс шийного відділу трахеї найчастіше відбувається на вдиху, а колапс грудного відділу трахеї - на видиху.
Найкращий спосіб діагностики – візуальне обстеження дихальних шляхів. За допомогою бронхоскопії можна отримати зразки повітря із глибоких відділів дихальних шляхів.
Колапс трахеї є наслідком незворотної патології хрящових кілець трахеї. Лікування включає підтримку хорошого стану верхніх і нижніх дихальних шляхів.
Собакам з задишкою та важким кашлем, пов'язаним із колапсом шийного відділу трахеї, показано хірургічне втручання та протезування ділянки трахеї з пошкодженими хрящовими кільцями.
Вступ
Колапс трахеї досить часто зустрічається у ветеринарній практиці. Він є причиною кашлю та обструкції дихальних шляхів у собак дрібних порід. Іноді ця патологія трапляється і в молодих собак великих порід. Хоча причини розвитку колапсу трахеї до кінця не відомі, вважають, що дана патологія є наслідком вроджених відхилень, зокрема генетичного порушення хондрогенезу. Часто колапс трахеї розвивається внаслідок хронічних захворювань дихальних шляхів, дегенерації хряща, травми та недостатності іннервації трахейного м'яза. (Musculus trachealis dorsatis).Найчастіше колапс трахеї розвивається у дорзовентральному напрямку з пролапсом слабкої дорзальної трахеальної мембрани у просвіт трахеї.
Розпізнати колапс трахеї у клінічних умовах досить просто. Виявлення ступеня утруднення дихання у тварини, факторів, що сприяють посиленню кашлю, та раннє втручання допомагають підібрати пацієнтові відповідне лікування, що покращує результат захворювання та знижує ймовірність виникнення тяжких ускладнень.
Фізіологія та патофізіологія
Стінки трахеї укріплені 30-45 кільцями із гіалінового хряща. Кінці хрящових утворень скріплені з боку дорзального боку трахеї з формуванням повного кільця (Малюнок 1). Трахеальні кільця пов'язані один з одним кільцевими зв'язками. Зсередини трахея вистелена псевдостратифікованим, війчастим і стовпчастим епітелієм. У верхньому відділі дихальних шляхів у шарі епітелію зустрічаються клітини Гоблета, що продукують слиз, що вистилає епітелій. Цей слиз і війчастий апарат епітеліоцитів є частиною механізму захисту легень від ушкоджень.
Трахея є унікальною структурою: у її шийному відділі внутрішній тиск атмосферний, тоді як у грудному відділі – негативний (що відповідає тиску у плевральній порожнині) (Малюнок 2а). На вдиху грудна клітка розширюється, а діафрагма зміщується у бік черевної порожнини. В результаті обсяг плевральної порожнини збільшується, а тиск у ній падає (Малюнок 26). Хвиля зниженого тиску передається по дихальних шляхах, у результаті повітря надходить у легені. При видиху тиск у плевральній порожнині зростає, і градієнт тиску змушує повітря виходити назовні з дихальних шляхів. У здорових тварин трахейні хрящові кільця повністю запобігають значним змінам діаметра трахеї в ході фаз дихального циклу.
У собак з колапсом трахеї хрящові кільця втрачають свою пружність і втрачають здатність запобігати зміні діаметра трахеї при диханні через коливання тиску. У деяких собак дрібних порід з колапсом трахеї виявляються недостатня кількість хондроцитів, зниження вмісту хондроїтинсульфату та кальцію у хрящі дихальних шляхів. Вважають, що недолік глікопротеїнів і глюкозаміногліканів викликає суттєве зниження кількості зв'язаної води в хрящовій тканині, усихання та стоншення хряща. Патологічні зміни, що виявляються у хрящі дихальних шляхів у собак з колапсом трахеї, можуть бути пов'язані як з порушенням хондрогенезу, так і дегенерацією гіалінового хряща. Причиною недостатньої кількості хондроцитів можуть бути і генетичні фактори, і відхилення в харчуванні.
У хворих собак колапси трахеї відбуваються у різних відділах трахеї залежно від фази дихального циклу (Малюнок 2, б та в). Ослаблені хрящові кільця в шийному відділі трахеї втрачають здатність витримувати негативний тиск на вдиху, через що відбувається падіння трахеї (колапс) в дорзо-вентральному напрямку. При повторних чи постійних колапсах хрящові кільця деформуються, розтягуючи при цьому дорзальну стінку трахеї. Ця стінка прогинається в просвіт, подразнює протилежну стінку, викликаючи пошкодження та запалення трахеального епітелію. Через запалення посилюється секреція слизу, збільшується кількість клітин, що продукують мукоїдний слиз. Кількість слизово-гнійного секрету може бути настільки великою, що утворюється плівка, подібна до тієї, що формується при дифтерії. Все це викликає у пацієнта кашель, порушує роботу війчастого апарату дихальних шляхів та суттєво збільшує ризик їх інфікування.

Малюнок 1.
Ендоскопічна картина нормальної трахеї. Помітні С-подібні хрящові кільця, кінці яких з'єднані трахеальною дорзальною мембраною (на цій фотографії- вгорі). Через дихальний епітелій просвічують кровоносні судини.
У багатьох хворих собак колапси захоплюють не лише шийний, а й грудний відділ трахеї, головні бронхи та навіть дрібні дихальні шляхи. При інтенсивних видихах іди при кашлі в плевральній порожнині виникає позитивний тиск, що передається на дихальні шляхи. Тому колапси грудних відділів дихальних шляхів зазвичай відбуваються на видиху (Малюнок 2, в). Невідомо, чи знижується кількість хондроцитів у хрящових кільцях грудного відділу трахеї у собак із трахеальними колапсами. Іноді у собак зустрічаються і генералізовані колапси всього грудного відділу дихальних шляхів.
Анамнез та симптоматика захворювання
Найчастіше колапс трахеї виникає у собак дрібних та карликових порід: чихуа хуа. померанських шпіців, той-пуделів, йоркширських тер'єрів, мальтійських болонок та мопсів. Вік собак, у яких вперше виявляються ознаки захворювання, варіює від 1 до 15 років. Проте найчастіше хвороба проявляється у дорослому віці. Статевої схильності до захворювання не виявлено. Рідко спостерігається колапс трахеї і у молодих собак великих порід (наприклад, золотистих ретріверів або лабрадор-ретріверів).
У більшості собак із колапсом трахеї протягом тривалого часу спостерігаються напади тяжкого кашлю. Загалом власники тварин описують цей кашель як "сухий", "гучний", що поступово наростає. Часто власники вказують на те, що напади кашлю у собаки починаються після їжі чи пиття. Внаслідок цього деяких собак починає нудити, тварини можуть подавитися кормом, може виникнути лаже блювання. У деяких випадках подібні напади кашлю розвиваються настільки гостро, що у власників виникає становище, що собаці в трахею потрапило стороннє тіло. Кашель поступово стає пароксизмальним і супроводжується вторинним ушкодженням дихальних шляхів. Розвивається задишка, збільшується частота дихання, знижується фізична витривалість. При підвищенні навантаження на дихальну систему (наприклад, внаслідок фізичного навантаження, підвищеної температури чи вологості довкілля) спостерігаються ознаки дихальної недостатності. Часто після інтрарахеальної інтубації тяжкість клінічної симптоматики збільшується. Загострення симптоматики може спричинити також фізичне навантаження або різкий ривок нашийника. Власники тварин, побоюючись погіршення стану вихованців, нерідко обмежують їх фізичну активність. В результаті цього, багато собак набирають надмірну вагу, і у них суттєво знижується витривалість до фізичного навантаження. За спостереженнями автора, саме у собак із надмірною вагою особливо високе навантаження на дихальну систему. У тварин, які страждають на ожиріння, тяжкість клінічної симптоматики колапсу трахеї (особливо кашель) буває дуже яскраво виражена. Проте, за даними літератури, серед собак, які зазнавали хірургічного втручання у зв'язку з колапсом трахеї, лише у 9% спостерігалося сильне ожиріння (4).
За наявності колапсу шийного відділу трахеї у собак спостерігається задишка на вдиху. Тварина сильно пихкає, насилу втягуючи повітря. При аускультації виявляється стридор та інші великопухирчасті хрипи в дихальних шляхах. Така аускультативна симптоматика характерна для колапсу шийного відділу трахеї та супутнього паралічу гортані. При розвитку набряку мішечків гортані може виникнути симптоматика обструкції верхніх дихальних шляхів. Вона проявляється у вигляді минущого "вивертає" кашлю і високого тиску на вдиху.

Малюнок 2а. Відділи трахеї та тиск, що діє на окремі ділянки дихальних шляхів: шийний відділ трахеї піддається впливу атмосферного тиску, а грудний- плеврального.

Малюнок 26. На вдиху діафрагма розширюється та зміщується назад. В результаті тиск у плевральній порожнині стає негативним. Хвиля негативного тиску передається дихальними шляхами і змушує атмосферне повітря входити в легкі. У собак з трахеальним колапсом трахея втрачає пружність та здатність протистояти перепадам тиску. В результаті при вдиху вона спадає у дорзо-вентральному напрямку.

Малюнок 2в. При форсованому видиху або кашлі плевральний тиск стає позитивним. Це забезпечує відкриття дихальних шляхів у грудній клітці. Однак якщо хрящові кільця недостатньо жорсткі, відбувається колапс.
Коли у собаки розвивається хронічний бронхіт, обтяжений колапсами шийного або грудного відділів трахеї, кашель стає жорстким, набуває постійного характеру і супроводжується виділенням мокротиння. Зрідка у собак з колапсами шийного або грудного відділів трахеї спостерігається минуща гіпоксемія, що призводить до непритомності. Часто такі непритомності відбуваються під час нападів кашлю. Однак у деяких собак непритомність бувають вторинними внаслідок розвитку легеневої гіпертензії та гіпоксії.
Клінічне обстеження
Собаки з колапсами трахеї у стані спокою зовні здаються здоровими. Навіть під час нападів кашлю їхній стан не викликає тривоги. Будь-який собака з ознаками системних захворювань слід обстежити на наявність патологій, що викликають напади кашлю (серцева недостатність, пневмонія, новоутворення вдихальних шляхах). Ретельне загальноклінічне обстеження дозволить уточнити причину кашлю та виявити супутні захворювання.

Малюнок 3.
Рентгенограма дихальних шляхів йоркширського тер'єра віком 10 років на вдиху. У собаки протягом 2 місяців спостерігалися напади кашлю, задишка, ціаноз. На отриманій в латеральній проекції рентгенограмі видно колапс шийного відділу трахеї, що поширюється до входу трахеї в грудну клітину. Грудний відділ аорти слабо розширений.Рентгенограма люб'язно надана д-ром Anne Babr)
Обстеження дихальної системи слід починати з ретельної аускультації та обережної пальпації трахеї та гортані. Наявність мішечків гортані, що пальпуються, вказує на порушення функції цього органу. За даними деяких дослідників подібна дисфункція розвивається у 20-30% собак з колапсами трахеї (5, 6). Турбулізація потоку повітря в звуженому ділянці трахеї призводить до генерування характерних звуків, які чують при аускультації трахеї. У деяких собак з колапсами трахеї трахея надзвичайно чутлива, тому для запобігання стимуляції нападу при обстеженні слід дотримуватись максимальної обережності. При пальпації трахеї часом колапсу вдається виявити надмірну податливість чи м'якість її хрящових кілець.
У собак із неускладненим колапсом великих дихальних шляхів дихальні звуки у легенях часто не змінені. Однак проводити аускультативне обстеження в подібних випадках через задишку, прискорене дихання та ожиріння (внаслідок цього дихальні шуми виявляються приглушеними) буває непросто. Крім того, сильні шуми у верхніх дихальних шляхах заглушають слабкі бронхоальвеолярні звуки. Патологічні шуми у легенях (хрипи та свисти) часто дозволяють діагностувати характер патології. Хрипи у легенях зазвичай вказують на проходження повітря через заповнені рідиною альвеоли або перекриті слизом дихальні шляхи. М'які хрипи на вдиху можуть бути ознакою набряку легень; більш жорсткі та гучні хрипи характерні для собак з пневмонією та пневмофіброзом. Свисти - більш тривалі звуки, які зазвичай прослуховуються на видиху. Вони характерні для тварин із хронічним бронхітом. Характерною ознакою ураження дрібних дихальних шляхів є напруга черевного преса на видиху.
У собак дрібних порід нерідко має місце недостатність серцевих клапанів. Внаслідок цього через шуми в серці буває особливо складно проводити аускультаційну діагностику причин кашлю. Зазвичай, при застійній серцевій недостатності спостерігається тахікардія. При захворюваннях дихальних шляхів частота серцевих скорочень зазвичай зберігається, проте розвивається виражена синусова аритмія. При навантаженнях на дихальну систему і таких тварин може з'явитися тахікардія, що суттєво ускладнює діагностику. Особливо складно діагностувати захворювання у дрібних собак, які страждають на застійну серцеву недостатність і патології трахеї та бронхів. У таких випадках показано рентгенологічне обстеження.
Діагностика
Хоча діагноз колапсу трахеї може бути поставлений на підставі даних анамнезу та клінічної симптоматики, для визначення супутніх захворювань та призначення індивідуального лікування необхідно провести загальноклінічне обстеження хворої тварини. Для діагностики супутніх захворювань рекомендується зробити повний аналіз крові, що включає визначення кількості клітин та біохімічних показників сироватки, та аналіз сечі.
Візуалізуючі методи
Для уточнення діагнозу колапсу трахеї та виявлення супутніх захворювань легень та серця показано застосування рентгенографії. Зазвичай отримують рентгенограми у стандартних проекціях, але краще - рентгенограми у вентродорзальній проекції при вдиху та видиху. На рентгенограмах, отриманих на повному вдиху, добре помітний колапс у шийному відділі трахеї. Грудна ділянка трахеї при цьому може бути розширена (Малюнок 3, 4а). Колапси головних бронхів, грудного відділу трахеї чи комбінації, зазвичай помітні на рентгенограмах, отриманих повному видиху. Шийна частина трахеї при цьому роздута (Малюнок 46).
Точність діагностики зростає, якщо під час рентгенографічного обстеження провокується напад кашлю. На жаль, правильно інтерпретувати динаміку дихальних шляхів за статичними рентгенограмами складно. Згідно з даними деяких досліджень, за рентгенограмами вдається виявити колапс трахеї лише у 60-84% випадків (4, 5). Часто рентгенографічна візуалізація трахеї утруднюється через накладання зображень стравоходу чи шийних м'язів. У таких випадках при рентгенографічному обстеженні ефективним є застосування нестандартної проекції, знизу вгору. Ця проекція дозволяє виявити спали ділянки в шийному відділі трахеї, хоча правильно направити пучок рентгенівського випромінювання буває складно. При масових флуороскопічних обстеженнях в розплідниках для собак вдається виявити випадки тимчасових колапсів дихальних шляхів. Цим методом можна виявити фазу дихального циклу, коли він розвиваються колапси.
Малюнки 4. Рентгенограми дихальних шляхів пуделя у віці 13 років, що тривалий час страждає на напади кашлю.

4а. Рентгенограма, одержана на вдиху. Шийний та грудний відділи трахеї вільні. Вільні також головні бронхи, хоча діаметр лівого бронха дещо менший.

46. Рентгенограма на видиху. Добре помітний колапс грудного відділу трахеї. Колапс захоплює також головні бронхи та дихальні шляхи дистальніше за грудину.
Нещодавно для діагностики колапсу трахеї стали використовувати ультразвукове дослідження (7). При розташуванні джерела ультразвуку на шиї вдається обстежити діаметр просвіту шийного відділу трахеї та документувати динаміку його зміни під час дихального циклу. У випадках, коли неможливо зробити флуороскопію, призначається саме ультразвукове дослідження як найбільш вдалий метод діагностики колапсів трахеї. На жаль, ультразвукове обстеження зазвичай ефективне лише при колапсах шийного відділу трахеї. Крім того, воно не дозволяє діагностувати супутні запальні процеси та інфікування нижніх відділів дихальних шляхів.
У собак дрібних порід через особливості статури або ожиріння буває складно виявити відхилення в тканинах легень і серця рентгенографічно. Наприклад, у собак з надмірною вагою жирові відкладення в грудній клітці та в медіастспії можуть дати хибне уявлення про інфільтрати та легені. Накопичення жиру в перикарді та обмежена рухливість легень, пов'язана з ожирінням, можуть ввести в оману з приводу наявності кардіомегалії. Таким чином, потрібно обережно інтерпретувати зміни інтерстиціальної щільності та розмірів серця у собак із колапсами трахеї. За наявності у тваринного шумів у серці особливу увагу слід приділити обстеженню контуру серця – можлива гіпертрофія лівого передсердя через нее стискання лівим бронхом. За вентролорзальними рентгенограмами можна не тільки досліджувати стан серця та легень собаки, але й оцінити ступінь її ожиріння. Власнику собаки слід обов'язково вказати на товстий жировий прошарок, що покриває грудну клітку. Це допоможе переконати його у необхідності зниження ваги тварини.
Отримання зразків з дихальних шляхів
Для отримання зразків з дихальних шляхів застосовується або промивання трахеї, або бронхоскопія. Обидві ці процедури потребують анестезії. Однак проводити їх дуже корисно, так як це дозволяє отримати зразки рідини з нижніх відділів дихального тракту для цитологічного або бактеріологічного дослідження. За допомогою даних методів можна діагностувати інфікування дихальних шляхів та оцінити внесок запальних реакцій у клінічну симптоматику, що спостерігається. Перед проведенням лаважування чи бронхоскопії необхідно ретельне обстеження верхніх відділів дихальних шляхів. Обструкція верхніх дихальних шляхів може посилити симптоматику, пов'язану із трахеальним колапсом. При обстеженні верхніх дихальних шляхів особливу увагу слід звернути на стан функції гортані, довжину м'якого піднебіння та відсутність набряку мішечків гортані.
Для проведення лаважування трахеї зручніше використовувати трансоральний підхід (див. Протокол 1). При такому підході менший ризик пошкодження хрящових кілець трахеї та слизової оболонки. Для полегшення інтубації краще застосувати загальну анестезію чи сильні селативні препарати. Для мінімізації подразнення слизової оболонки потрібно використовувати тонкі стерильні інтратрахеальні зонди. При проведенні зонда в трахею потрібно стежити за тим, щоб не забруднити зразки, що отримуються, бактеріальною мікрофлорою і клітинами слизової верхніх відділів дихальних шляхів. Використовувати манжетку зонда при цій процедурі не потрібно. Отримані зразки лаваж слід обов'язково відправити на бактеріологічне культивування для виявлення аеробних бактерій. Можна також здійснити посіви на інфікування мікоплазмою.
Інтерпретація результатів бактеріологічних тестів значно полегшується після цитологічного обстеження лаважу. Наприклад, у здорових собак ковтка не стерильна, через що при бактеріологічному обстеженні у посівах лаважа можна виявити зростання бактерій (8) (Таблиця 1). При виявленні в лаважі лускатих клітин ротової порожнини та бактерій Simonsiellaв ході гістологічного обстеження очікується зростання цих бактерій і мікоплазм і в бактеріологічних посівах. При бактеріологічному культивуванні лаваж собак з колапсами трахеї зазвичай виявляється багато бактерій різних видів (Таблиця 1). Тим не менш, роль бактеріального інфікування у розвитку клінічної симптоматики даного захворювання досі не зрозуміла.
Результати бактеріологічного дослідження мікрофлори здорових собак та собак з колапсами трахеї
Ступені тяжкості колапсу трахеї
| Ступінь I | Хрящові кільця трахеї зберігають кільцеву структуру майже в нормі. Є слабкий прогин дорзальної трахеальної мембрани в просвіт трахеї, що знижує діаметр цього просвіту трохи більше, ніж 25%. |
| Ступінь II | Хрящові кільця сплющуються. Через прогинання дорзальної трахеальної мембрани, що розтягнулася, діаметр просвіту трахеї знижується приблизно на 50%. |
| Ступінь III | Хрящові кільця дуже сплющені. М'язи трахеальної мембрани стосуються внутрішньої частини кілець. Діаметр просвіту трахеї знижений на 75%. |
| Ступінь IV | М'язи трахеальної мембрани повністю перекривають просвіт трахеї. У важких випадках просвіт трахеї стає подвійним. |
Для одержання зразків мікрофлори, що заселяє нижні відділи дихальних шляхів, краще застосувати бронхоскопію. За допомогою бронхоскопа можна отримати зразки без ризику їх обсіменіння бактеріями із верхніх дихальних шляхів. Крім того, за допомогою бронхоскопії можна підтвердити діагноз колапсу трахеї у тих випадках, коли дані рентгенографії та флуороскопії не дозволяють зробити твердого висновку. Бронхоскопія дає можливість прямо оцінити місце розташування та ступінь ослаблення пошкоджених хрящових колії трахеї чи бронхів (Таблиця 2). які характеризують тяжкість колапсу трахеї, що особливо важливо під час підготовки до хірургічного втручання. Бронхоскопія дозволяє також досліджувати динаміку та характер ушкоджень, виявити ділянки запалення та подразнення слизових оболонок, підтвердити або спростувати діагноз колапсу грудного відділу трахеї. Таким чином, бронхоскопія - один із найефективніших методів оцінки ролі захворювання дихальних шляхів у розвитку легеневої недостатності.
Протокол отримання трахеального лаважу у собак
- Дати собаці кисневу маску для преоксигенації.
- Ввести седативний препарат для проведення обстеження структури та функції верхніх дихальних шляхів. Поспостерігати за функціонуванням гортані під час дихання. У нормі у собак під час вдиху черпалоподібні хрящі відходять убік.
— Інтубувати тварину тонким стерильним ендотрахеальним зондом. Під час інтубації переконайтеся, що зонд при проходженні в дихальні шляхи не торкнувся горлянки.
— Через зонд рівня грудини введіть у дихальні шляхи тонкий поліпропіленовий стерильний катетер (можна застосувати трубку для парентерального харчування). Довжина катетера має бути такою, щоб можна було досягти рівня 4-го ребра.
- Введіть через катетер за допомогою шприца 4-6 мл стерильного фізіологічного розчину. Під час відсмоктування введеної рідини викличте у собаки кашель або помасажуйте їй грудну клітину - це збільшить об'єм лаважу, що відсмоктується.
— За необхідності повторіть введення та відсмоктування фізіологічного розчину. Необхідно одержати 0,5-1 мл лаважу. Лаваж потрібно відправити на бактеріологічне (в т.ч. визначення присутності мікоплазм) і цитологічне обстеження.
- Перед завершенням процедури введіть у трахеальний катетер 1 мл 1% розчину лідокаїну. Це послабить кашльовий рефлекс.
— За потреби помістіть пацієнта у кисневу камеру.
Під час підготовки собак до дослідження дихальних шляхів слід обов'язково преоксигенировать протягом 5 хв. до початку анестезії. Для анестезії можна застосовувати різні способи. Мета анестезії в даному випадку – попередити кашльовий рефлекс та пошкодження ендоскопу під час бронхоскопії. При доборі методу анестезії слід орієнтуватися на загальний стан здоров'я собаки та особливості анестетика (його побічні ефекти). Оскільки більшість собак із колапсами трахеї відносяться до дрібних пород, краще використовувати брохоскопи діаметром не більше 4,5-5 мм. Іноді собака буває настільки маленькою, що не можна застосовувати анестезію газоподібними анестетиками та неможливо провести бронхоскоп через інтратрахеальну трубку. У цьому випадку при застосуванні анестезії газоподібними анестетиками в ході бронхоскопічного обстеження трахеї та нижніх дихальних шляхів собаку слід екстубувати.
Для проведення бронхоскопії собаку слід укласти спиною догори, а під підборіддя підкласти невелику подушку. Для фіксації рота у відкритому положенні під час проведення процедури використовуються 2 великі роторозширювачі. На початку за допомогою бронхоскопа обстежується горло та верхні відділи дихальних шляхів. Після його введення в трахею визначається ступінь та динаміка її колапсу (Малюнок 5). За допомогою міток на частині бронхоскопа, що залишилася зовні, можна визначити і протяжність колапсуючого ділянки трахеї або число хрящових кілець, структура яких порушена. Після запровадження бронхоскопа в загрудинну частина дихальних шляхів обстежуються основні бронхи. Здорові бронхи відкриті та мають круглий або еліптичний перетин

(Малюнок 6). Діаметр дихальних шляхів у ході дихання повинен змінюватись незначно, а кількість секретів у них має бути мінімально. У собак із генералізованими колапсами дихальних шляхів форма просвітів цих шляхів варіабельна. Крім того, у них добре помітне замикання цих просвітів навіть за нефорсованого дихання (Малюнок 7).

У всіх собак, яким проводиться бронхоскопія, слід обов'язково забирати бронхоальвеолярний лаваж (БАЛ). Його одержують за допомогою бронхоскопа і направляють для обстеження з метою виявлення інфікування бактеріями або мікоілазмами, а також ознак запалення. На підставі результатів бактеріологічного та гістологічного дослідження отриманого БАЛ можна призначити тварині відповідну антибіотикотерапію та/або протизапальне лікування (9). Для одержання БАЛ бронхоскоп обережно вводять у дрібні бронхи та через його біопсійний канал ін'єктують 10-20 мл стерильного фізіологічного розчину. Відсмоктування введеної рідини можна проводити вручну, дотримуючись особливої обережності, або за допомогою механічного відсмоктування з пасткою для зразків. Зазвичай вдається відсмоктувати 40-60% обсягу введеної рідини. У нормі БАЛ містить близько 300 лейкоцитів у I мл, з яких 70-80% посідає альвеолярні макрофаги, 5-6% - лімфоцити. 5-6% - на нейтрофіли та 5-6% - на еозинофіли. Ознакою запальної реакції є значне збільшення кількості нейтрофілів. Факт інфікування може бути встановлений на підставі виявлення септичних нейтрофілів та за наявності фагоцитованих бактерій у клітинах.

Малюнок 5. II-III ступеня. Для забезпечення надходження кисню під час бронхоскопії було застосовано стерильний гумовий катетер. Хрящові кільця сплющені, внаслідок чого дорсальна частина трахеї (під міткою на знімку) розтягнута.
Знімок люб'язно наданий JeffD. Bay, DVM. MS, університет штату Міссурі, Колумбія. США
Бронхоскопія у собак із трахеальними колапсами – процедура ризикована. Особливо великий ризик ускладнень у собак з ожирінням, що відрізняються підвищеною чутливістю трахеї. Для зниження ризику виникнення ускладнень виводити тварину з анестезії слід повільно, забезпечивши збагачене киснем середовище. У дистальний відділ трахеї перед вилученням бронхоскопа можна запровадити 1 мл 1% розчину лідокаїну. Це послабить кашльовий рефлекс.
Медикаментозне лікування
Якщо у собаки виявляється сильна задишка, пов'язана з обструкцією дихальних шляхів, стресуючий вплив діагностичного обстеження слід скоротити до мінімуму. У таких випадках для виведення тварини з небезпечного стану потрібно помістити її в кисневу камеру та застосувати м'які седативпі препарати. Наприклад, підшкірне введення бутофанолу (0.05-1 мг/кг) та ацепромазину (0,01-0.1 мг/кг) кожні 4-6 годин дозволяє не лише заспокоїти собаку, а й зупинити у неї напад кашлю. Слід зазначити, що застосування цих лікарських засобів у комбінації потребує певної обережності, оскільки може викликати різке зниження артеріального тиску. На початку застосування слід використовувати мінімальну дозу лікарських засобів для визначення чутливості до них даної тварини. Якщо небажаних наслідків не настає, надалі за необхідності дозування можна збільшити. Якщо у собаки сильне запалення трахеї або набряк гортані, слід ввести їй одноразово короткодіючий кортикостероїд, який має протизапальну дію.
Тривала терапія при колапсах трахеї у собак має бути спрямована на ослаблення тих факторів, які можуть спровокувати посилення клінічної симптоматики захворювання. На жаль, специфічних способів лікування порушення обміну речовин у хрящовій тканині трахеальних кілець не існує, тому ризик загострення захворювання у хворого собаки зберігається протягом усього життя. При виявленні інфікування дихальних шляхів слід призначити антибіотикотерапію. Вибір антибіотиків складає підстави визначення чутливості до них посіяної мікрофлори пацієнта. Якщо виявлено інфікування мікоплазмою, слід застосовувати антибіотики, ефективні проти мікроорганізмів, позбавлених клітинної стінки. Найбільш ефективні в цьому випадку доксіїіклін, хлорамфенікол та енрофлоксацин. Для стерилізації дихальних шляхів зазвичай буває достатньо 7-10-денного курсу застосування антибіотиків, проте за наявності пневмонії тривалість антибіотикотсрапії може становити від 3 до 6 тижнів.
При вираженому трахеїті потрібне нетривале лікування кортикостероїдними препаратами. Зазвичай пацієнту вводять преднізон або преднізолон у дозах 0,5 мг/кг/добу протягом 3-7 днів. За наявності у собаки на тлі колапсів трахеї хронічного бронхіту призначають триваліший курс терапії кортикостероїдами. Препарати застосовують у великих дозуваннях. Після зняття запалення та усунення інфекції призначаються препарати проти кашлю. Його придушення необхідне обриву циклу повторних ушкоджень дихальних шляхів. Зазвичай придушення кашлю у собак із колапсами трахеї потребує застосування наркотичних засобів. Ефективно пригнічувати кашель можна за допомогою гідроколону (0,22 мг/кг 2-3 рази на день) або буторфанолу (0,55-1,1 мг/кг за потреби), що застосовуються per os(10). На початку курсу дозування цих препаратів підбирається для кожного собаки індивідуально таким чином, щоб домогтися максимального пригнічення кашлю норецепторів не відносяться до бронхорозширювальних засобів, проте вони викликають дилятацію дрібних дихальних шляхів і полегшують повітрообмін у них на видиху. В результаті ймовірність колапсу грудних відділів трахеї знижується. Спеціальні фармакокінетичні дослідження різних форм теофіліну показали, що два препарати теофіліну, що випускаються різними фірмами, пролонгованої дії забезпечують підтримку досить високої концентрації препарату в крові у собак протягом тривалого часу. Звичайні форми теофіліну також можуть бути ефективними, але їх ефективність значно нижча, ніж у згаданих препаратів пролонгованої дії. При колапсах трахеї у собак застосовують також агоністи р-адренорецепторів: тербуталін (1,25-5 мг/кгр<гол- 2-3 раза вдень) и альбутерол (50 мкг/кг 3 раза в день). Следует помнить, что применение бронхорасширяющих средств любого типа может привести к побочным эффектам, например, повышенной нервозности и возбудимости животных, тахикардии, желудочно-кишечным расстройствам.
Усім собакам із колапсами трахеї показано дієтотерапію. Зниження ваги тіла, наприклад, суттєво знижує навантаження на дихальну систему. Для досягнення цієї мети тварин зазвичай переводять на готові низькокалорійні раціони, що забезпечує надходження в організм приблизно 60% енергетичних потреб здорових собак. Ідеальна швидкість зниження ваги (2-3% ваги тіла на тиждень) дозволяє власникові швидко нормалізувати вагу собаки. Корисно також поступово збільшувати фізичне навантаження тварини – це полегшує та прискорює досягнення нормальної ваги тіла. Слід зазначити, що фізичне навантаження у спекотну та вологу погоду краще знизити до мінімуму, а нашийник замінити на шлейку. Це дозволить уникнути раптового загострення захворювання.
Хірургічне лікування
При колапсах шийного відділу трахеї ефективне протезування уражених хряшевих кілець. Хірургічне втручання показано в тих випадках, коли терапевтичне лікування виявляється неефективним або через порушення дихання у тварин спостерігаються ослаблення умовних рефлексів та непритомність. Хірургічне втручання суттєво послаблює клінічну симптоматику: зникає кашель, вільнішим стає дихання. В одному дослідженні було встановлено, що зазвичай власники собак задоволені результатом хірургічної операції, навіть якщо післяопераційний параліч гортані зажадав трахеостомії.
Для собак з обструкцією верхніх дихальних шляхів потрібне хірургічне усунення причин обструкції. Наприклад, показано, що скорочення м'якого піднебіння та звільнення черпалоподібного хряща гортані полегшує клінічну симптоматику при колапсах трахеї.
Колапс трахеї часто зустрічаються у собак дрібних порід і вимагають тривалого лікування. Хворим тваринам показано зниження ваги тіла та застосування препаратів проти кашлю. У кожному конкретному випадку важливо також виявити та усунути супутні захворювання верхніх та нижніх дихальних шляхів, що ускладнюють перебіг колапсів трахеї.
– це бронхоскопічний спосіб отримання змиву з поверхні найдрібніших бронхів (бронхіол) та альвеолярних структур легень для цитологічного, мікробіологічного, біохімічного та імунологічного досліджень. Іноді застосовується з лікувальною метою для очищення запалених дихальних шляхів від надлишкового секреторного гнійного вмісту, що відокремлюється.
У ветеринарній практиці ми використовуємо цей діагностичний метод для проведення цитологічного аналізу отриманого матеріалу, а також для бактеріологічного дослідження. Таким чином, в діагностику входить якісна/кількісна оцінка клітин, що входять до складу бронхіального слизу (наприклад, переважає у пацієнта еозинофільне або нейтрофільне запалення). Також отриманий матеріал висівається на живильні середовища для визначення, який саме збудник колонізує поверхню бронхів і титрується чутливість знайденого мікроорганізму до антибіотиків.
Коли саме проводиться дослідження
Дуже часто на прийом до ветеринарного лікаря наводять тварин з хронічними кашльовими нападами в анамнезі (поява симптомів відмічено більше 1 місяця тому), що періодично виникає шумним диханням, нападами ядухи і так далі.
Цікаво, що ні рентген грудної клітки, ні клінічний аналіз крові або взяття змивів з поверхні носових ходів/кон'юнктиви не можуть допомогти диференціювати астму та бронхіт кішок. Зміни на рентгенограмі грудної клітини неспецифічні: зазвичай це однотипне посилення бронхіального чи бронхо-интерстициального рисунка. Що стосується змивів з поверхні верхніх дихальних шляхів, слід пам'ятати, що мікробний пейзаж на рівні бронхіол і слизових носових ходів дуже різний, і при виявленні мікоплазми на поверхні кон'юнктиви ока ми не маємо права стверджувати, що цей збудник викликає незворотні зміни на рівні бронхів.
Що стосується собак, то діагностика хронічного кашлю також може здійснюватися за допомогою балу. Так, кашель собак може бути симптомом дуже різних захворювань. Наприклад, інфекційний та ідіопатичний бронхіт дають однакові зміни при рентгенографії грудної клітки, проте вимагають абсолютно різного лікування. Дуже цінний метод для підбору терапії при розвитку у цуценят та молодих собак важких, рефрактерних (стійких) до лікування антибіотиками пневмоній. Адже бактеріологічне дослідження дозволяє точно визначити який саме збудник стійкий до стандартної антибактеріальної схеми. Також є можливість точно та швидко підібрати необхідний та специфічний антибіотик.
Крім того, за допомогою методу ми можемо виключити синдром еозинофільної інфільтрації легень, що розвиває у молодих тварин і вимагає агресивної стероїдної терапії для усунення нападів, тоді як стероїди, призначені при активному бактеріальному процесі, здатні занапастити пацієнта.
Як саме проводиться дослідження
Для забору змивів із поверхні бронхів ми використовуємо метод бронхоскопії. Приблизно рівня бронхів 2-3 порядку вводиться бронхоскоп, що дозволяє досліджувати поверхню бронхіального дерева, і навіть виключити можливі сторонні предмети, які у дихальні шляхи, наприклад, при активному бігу. Далі за допомогою бронхоскопа ми вводимо невеликий об'єм стерильного розчину та дуже швидко забираємо його назад. Отриманий матеріал досліджується під мікроскопом та висівається на спеціальних середовищах.
Безпека методу
Бронхоальвеолярний лаваж вважається безпечним, дуже ефективним у постановці діагнозу і часто надає лікувальний ефект. Характерним є зникнення кашлю на короткий час після проведення процедури. Потребує мінімальної анестезії (седації). При проведенні специфічної підготовки не чинить побічних ефектів.
Навіщо потрібно проводити це дослідження
Дуже важливо розуміти, що тривалий хронічний прогресуючий кашель часто говорить про розвиток незворотних, важких бронхо-легеневих проблем, які навіть при грамотно підібраної терапії можуть недостатньо добре відповісти на лікування. Котяча астма характеризується високим ризиком раптового смерті. Тож своєчасно поставлений діагноз та підібрана терапія дозволяють позбавити проблем на ранній стадії та суттєво покращити якість життя Вашого вихованця.
Ветеринарний лікар
Філімонова Д.М.