Ziemeļrietumu universitātes Feinbergas Medicīnas skolas (ASV) zinātnieku pētījuma rezultāti parādīja, ka cilvēka neironos sāk nogulsnēties beta-amiloīds, patoloģisks proteīns, kura uzkrāšanās ir galvenā Alcheimera slimības attīstības pazīme. no 20 gadu vecuma . Pētījuma rezultāti tika publicēti žurnālā Smadzenes.
Saskaņā ar vadošā pētnieka Changiz Geula teikto, pētnieks no Ziemeļrietumu universitātes Feinbergas Kognitīvās neiroloģijas centra un Alcheimera slimības centra tika iegūti bezprecedenta dati, ka amiloīds cilvēka smadzenēs sāk uzkrāties jau no mazotnes.Pēc Geula teiktā, tam ir liela nozīme, jo ir zināms, ka, ja amiloīds ilgu laiku atrodams cilvēka organismā, tas negatīvi ietekmē viņa veselību.
Amerikāņu zinātnieki pētīja holīnerģiskos neironus bazālajās priekšsmadzenēs, mēģinot izskaidrot to agrīnā bojājuma cēloni un to, kāpēc šīs šūnas ir vienas no pirmajām, kas mirst dabiskās novecošanas un Alcheimera slimības laikā. Šie sensorie neironi nepieciešamas atmiņas un uzmanības uzturēšanai.
Geula un viņa kolēģi pārbaudīja neironus, kas iegūti no trīs cilvēku smadzenēm dažādas grupas pacienti - 13 kognitīvi veseliem cilvēkiem vecumā no 20-66 gadiem, 16 gados veci cilvēki vecumā no 70-99 gadiem bez demences, 21 pacients ar Alcheimera slimību vecumā no 60-95 gadiem.
Pētījuma rezultāti parādīja, ka amiloīda molekulas sāk nogulsnēties šajos neironos jaunībā, un šis process turpinās visu cilvēka dzīvi. Līdzīga amiloīda nogulsnēšanās netika novērota nervu šūnās citos smadzeņu apgabalos. Pētītajās šūnās amiloīda molekulas veidoja sīkas toksiskas plāksnītes, amiloīda oligomērus, ko var noteikt pat 20 gadus veciem jauniešiem. Gados vecākiem cilvēkiem un pacientiem ar Alcheimera slimību amiloido plāksnīšu izmērs palielinājās.
Saskaņā ar Geul teikto, atklājumi sniedz ieskatu priekšējās smadzeņu bazālo neironu agrīnā nāvē, ko var izraisīt mazas amiloīda plāksnes. Pēc viņa domām, amiloīda uzkrāšanās šajos neironos laikā cilvēka dzīve, iespējams, padara šīs šūnas jutīgas pret patoloģiskiem procesiem novecošanas laikā un neironu zudumu Alcheimera slimības gadījumā.
Ar lielu varbūtības pakāpi augošās plāksnes var bojāt neironus un pat izraisīt to nāvi – tās var izraisīt pārmērīgu kalcija ieplūšanu šūnā, kas var izraisīt tās nāvi. Plāksnes var kļūt tik lielas, ka šūnas degradācijas mehānisms nevar tās izšķīdināt un tās aizsprosto neironu, saka Geuls.
Turklāt plāksnes var izraisīt bojājumus, izdalot amiloīdu ārpus šūnas, izraisot lielu amiloīda plāksnīšu veidošanos, kas atrodamas Alcheimera slimībā.
Oriģinālais raksts:
Alaina Baker-Nigh, Shahrooz Vahedi, Elena Goetz Davis, Sandra Weintraub, Eileen H. Bigio, William L. Klein, Changiz Geula. Neironu amiloīda-β uzkrāšanās holīnerģiskajā bazālajā priekšsmadzenēs novecošanas un Alcheimera slimības gadījumā. Brain, 2015. gada marts DOI:
Tikai slinkie nav dzirdējuši par “slikto” holesterīnu. Ikviens zina, ka tas var nogulsnēties uz asinsvadu sieniņām un novest pie dažādas slimības ka holesterīns var izraisīt insultu vai sirdslēkmi. Tāpēc, sasniedzot apzinātu pilngadību, daudzi cilvēki brīnās, kā attīrīt asinsvadus no aterosklerozes plāksnēm, lai izvairītos no šīm sekām. Parunāsim par to no nevis tradicionālās, bet oficiālās medicīnas viedokļa.
Kas ir holesterīna plāksnes
Katrs cilvēka orgāns saņem uzturu no traukiem, kuru ķermenī ir milzīgs un plašs tīkls. Asinis, kas plūst cauri traukiem, nav šķīdums, bet suspensija, kad šķidrumā peld šūnu suspensija, ko sauc par veidotiem elementiem. Asins šķidrā daļa nemaz nelīdzinās ūdenim, kas izskaidrojams ar tajā izšķīdinātajām molekulām, kas galvenokārt ir proteīna raksturs. Bet tie arī “peld” asinīs dažādi produkti tauku metabolisms, jo īpaši holesterīns, triglicerīdi, lipoproteīni.
Saskaņā ar fizikas likumiem, asinis pārvietojas pa traukiem tā, ka centrā plūst “sūkšanās” praktiski bez šūnām, un lielākā daļa izveidoto elementu “iet” gar malām, pārstāvot sava veida “ātri”. reaģēšanas nodaļa”: reaģējot uz asinsvadu bojājumiem, tie nekavējoties nolaižas no šejienes trombocīti, “aizverot” plaisu.
Asins šķidrā daļa arī nonāk saskarē ar asinsvadu sienas. Kā atceramies, tajā izšķīst tauku vielmaiņas produkti. Ir vairāki dažādi, holesterīns ir tikai viena no sastāvdaļām. Šī sistēma ir strukturēta šādi: parasti “sliktie” tauki ir līdzsvarā ar to antagonistiem, “labajiem” taukiem (“labo” holesterīnu). Ja šis līdzsvars tiek izjaukts - vai nu palielinās "slikto" skaits, vai samazinās "labo" apjoms - uz sienām arteriālie trauki sāk nogulsnēties taukainie tuberkuli - plāksnes. Šādu plāksnīšu nogulsnēšanās risks tiek vērtēts pēc labo tauku (tos sauc par “augsta blīvuma lipoproteīniem” — ABL) attiecības un zema blīvuma lipoproteīnu (ZBL) un ļoti zema blīvuma lipoproteīnu (VLDL) summas. To var izdarīt, izmantojot asins analīzi no vēnas, ko sauc par lipīdu profilu.
Šāda plāksne ir bīstama šādos veidos:
- Tas var atdalīties un, ar asinīm nonākot “piemērota” diametra traukā, to aizsprosto, tādējādi atņemot no turienes barojošajai vietai kaut kādu uztura orgānu. Jo mazāks trauks, jo mazāka platība iet bojā, jo mazāk tiek traucēta šī orgāna un ķermeņa darbība kopumā (notiek “dublēšanās” katra orgāna audos, pateicoties kam katrs “gabaliņš” saņem uzturu no vairākus maza diametra traukus vienlaikus).
- Asinis ir spiestas apiet aplikumu, kā rezultātā vienmērīgas plūsmas vietā traukā rodas “virpuļi”, kad daļai asins, kas plūst pie sienas, kas klāta ar aplikumu, ir jāatgriežas atpakaļ. Asins plūsmas turbulence pasliktina orgānu asins piegādes uzturu. Šeit attiecības ir tādas pašas kā iepriekšējā punktā: jo lielāks ir plāksnes bojātās artērijas diametrs, jo vairāk cieš orgāns.
- Ja asins sastāvs nemainās un nepalielinās ABL un enzīmu daudzums, kam vajadzētu “nolauzt” aplikumu, organisms cenšas to ierobežot. Lai to paveiktu, viņš uz aplikuma nogulsnēšanās vietu nosūta imūnās šūnas, kuru uzdevums ir “nokost” plāksnes gabalus un tos sagremot. Bet šūnas to nespēj: tā vietā, lai sagremotu, imūnās šūnas tiek bojātas ar holesterīnu un taukiem, un tās paliek “guļ” ap holesterīnu. Tad ķermenis nolemj pārklāt šo veidojumu ar saistaudiem, un aplikums palielinās vēl vairāk, tagad pasliktinot orgāna asins piegādi ne tikai turbulences, bet arī trauka lūmena samazināšanās dēļ.
- Pārklājums ar saistaudiem ir labvēlīgs aplikumam un kaitē asinsvadam. Tagad, ja kaut kas sabojās aplikumu, tas “sauks” pie sevis trombocītus, kas uz tās virsmas veidos asins recekli. Šī parādība, pirmkārt, vēl vairāk samazinās asinsvada diametru un, otrkārt, palielinās risku (īpaši traukos ar “aktīvu” asins plūsmu), ka asins receklis atdalīsies un bloķēs mazāku trauku.
- Ilgi pastāvoša plāksne tiek pārklāta ar kalcija sāļiem. Šāds sienas veidojums jau ir stabils un bez iejaukšanās neatkāpsies. Bet tam ir tendence augt un samazināt kuģa lūmenu.
Aplikuma veidošanās ātrumu ietekmē:
- dzīvnieku tauku patēriņš;
- smēķēšana;
- cukura diabēts;
- liekais svars;
- fiziskā neaktivitāte;
- augsts asinsspiediens;
- ēšanas mānija;
- ēdot lielu daudzumu vienkāršo ogļhidrātu kopā ar pārtiku.
Plāksnīšu nogulsnēšanās lokalizācija ir neparedzama: tās var būt vai nu smadzenes apgādājošās artērijas, vai arī nieru, ekstremitāšu vai citu orgānu artērijas. Atkarībā no tā tie var izraisīt:
- išēmisks insults;
- stenokardija;
- miokarda infarkts;
- zarnu gangrēna;
- aortas aneirisma;
- discirkulācijas encefalopātija, kas izpaužas kā atmiņas pasliktināšanās, galvassāpes, samazināta spēja analizēt notiekošo;
- asins piegādes pasliktināšanās lielākā vai mazākā ekstremitātes zonā līdz tās gangrēnai;
- ja plāksne nosprosto aortu apgabalā, kur no tās rodas lieli asinsvadi, uz katru no apakšējo ekstremitāšu, abas kājas cietīs tikai no išēmijas vai gangrēnas.
Kā noteikt, vai ir holesterīna plāksnes
Pirms asinsvadu attīrīšanas no holesterīna plāksnēm un trombiem, jums jānoskaidro, vai tie ir vai nav. Ja lipīdu profils parāda aplikuma veidošanās risku, koagulogramma parāda trombu veidošanās risku, tad instrumentālie pētījumi palīdzēs atklāt tūlītēju “sastrēgumu” traukos:
- Īpašs ultraskaņas veids ir krāsa abpusējā skenēšana . Tādā veidā ir ļoti ērti izmeklēt arteriālo un vēnu trauki augšējās un apakšējās ekstremitātes, aorta, asinsvadi, kas iet uz smadzenēm, un tie, kas baro tīkleni;
- Trīskāršā skenēšana ir vēl viena ultraskaņas iespēja. To izmanto, lai pārbaudītu smadzeņu traukus un artēriju, kas to apgādā - tos, kas atrodas ārpus galvaskausa dobuma;
- Visprecīzākā pētījuma metode ir angiogrāfija. To izmanto, lai noskaidrotu plāksnīšu/trombu atrašanās vietu ekstremitāšu asinsvados, kas tika identificēti dupleksās vai tripleksās skenēšanas laikā, kā arī, lai noteiktu asins recekļus/plāksnes tajos orgānos, kas nav redzami ultraskaņas izmeklēšanas laikā.
Kad tīrīt traukus
Jums ir jāiztīra holesterīns no asinsvadiem, ja:
- saskaņā ar instrumentālās metodes aterosklerozes plāksnes vai
- kad jau ir pārkāpums iekšējie orgāni, pret kuru tika konstatēts augsts aterogēnais indekss (pēc lipīdu profila). Šis:
- holesterīns virs 6,19 mmol/l;
- ZBL – vairāk par 4,12 mmol/l;
- ABL: zem 1,04 vīriešiem, zem 1,29 mmol/l sievietēm.
Šādos gadījumos ir jādara viss iespējamais, lai novērstu holesterīna nogulsnēšanos uz asinsvadu sieniņām:
- vīrieši vecāki par 40 gadiem;
- sievietes, kas vecākas par 55 gadiem;
- ja jums ir slikti ieradumi;
- ja cilvēks ēd daudz kūpinātu, ceptu, sāļu pārtiku, gaļu;
- ja radiniekiem ir ateroskleroze, išēmiska vai hipertensija;
- cieš no cukura diabēta;
- tie, kas atzīmē liekā svara klātbūtni;
- tiem, kuri ir cietuši no streptokoku infekcijas komplikācijām, piemēram, reimatisma;
- ja vismaz vienu reizi ir bijis vienas ekstremitātes vai ķermeņa puses nejutīgums, kas nesekoja to saspiešanai, bet radās “pats no sevis”;
- ja vismaz vienu reizi bija redzes traucējumi vienā acī, kas pēc tam pārgāja;
- kad bija pēkšņa vispārēja vājuma lēkme;
- ja ir nepamatotas sāpes nabas rajonā, ko pavada meteorisms un aizcietējums;
- kad atmiņa pasliktinās un vēlme atpūsties izraisa arvien mazāku garīgo stresu;
- ja kļūst arvien grūtāk staigāt, kājas sāp ar mazāku slodzi;
- ja ir sāpes krūtīs vai sirdī, ko nevar mazināt nitroglicerīns;
- ja mati uz kājām izkrīt un pašas kājas kļūst bālas un sasalst;
- ja apakšējās ekstremitātēs sāk parādīties čūlas, apsārtums vai pietūkums.
Kas jums jādara, pirms sākat tīrīt asinsvadus no plāksnēm
Lai nesaskartos ar to, ka, veicot asinsvadu attīrīšanu mājās, no sienām atdalīsies asins recekļi vai plāksnes ar atbilstošām sekām, pirms tās veikšanas ir jāpārbauda:
- veikt koagulogrammu, lai laboratorija varētu noteikt ne tikai standarta rādītājus, bet arī INR indeksu;
- veikt lipīdu profilu;
- noteikti veic elektrokardiogrammu.
Kā attīrīt asinsvadus no aterosklerozes plāksnēm
Asinsvadu tīrīšanas programma no holesterīna nogulsnēm uz to sienām jāatstāj ārstam, pamatojoties uz laboratorijas un instrumentālās studijas. Tajā jāiekļauj:
- dzīvesveida izmaiņas, ja tās izraisa aplikumu veidošanos;
- diētas ievērošana, kas normalizēs gremošanas orgānu darbību, lai “labais” holesterīns tiktu vislabāk absorbēts;
- diēta, kas novērsīs asins recekļu veidošanos.
Saskaņā ar indikācijām var izrakstīt:
- zāles, kas samazina holesterīna līmeni asinīs;
- zāles, kas samazina asins viskozitāti;
- tautas aizsardzības līdzekļi, kuru mērķis ir normalizēt asins viskozitāti vai samazināt holesterīna līmeni.
1. solis. Neļaujiet "sliktajam" holesterīnam palielināties
Bez šīs darbības visi turpmākie pasākumi - vai tautas receptes, zāles - nedos vēlamo efektu, jo cilvēks turpinās piesātināt organismu ar holesterīnu.
To var izdarīt tikai ar diētu:
- kad ēdienus gatavo cepot vai vārot;
- ir pietiekams labības daudzums;
- ar daudziem dārzeņiem un augļiem;
- ar produktiem, kas satur polinepiesātinātās omega-3 taukskābes;
- kad ir pietiekami daudz jūras velšu;
- piena produkti ir ar zemu tauku saturu.
Jums ir jāizslēdz:
2. solis. Diēta, lai apturētu asins recekļu veidošanos
Lai novērstu asins recekļu veidošanos uz aterosklerozes plāksnēm, kas ir bīstamas, jo tās jebkurā laikā var noplīst, ievērojiet šādu diētu (tā ir gandrīz identiska tai, kas ierobežo holesterīna uzņemšanu:
3. solis. Dzīvesveida izmaiņas
Bez šādiem pasākumiem turpmākās darbības ir neefektīvas. Pretējā gadījumā asinis stagnēs traukos, kas ir ļoti populāri ar asins recekļu veidošanos un aterosklerozes plāksnēm. Lai veiktu asinsvadu “tīrīšanu”, jums ir nepieciešams:
- gulēt pietiekami daudz laika, kā to nosaka endokrīnās un nervu sistēmas. Kad orgāni, kas tos veido, nonāk līdzsvarā, viņi arī centīsies nodrošināt normālu līdzsvaru starp koagulācijas un antikoagulācijas, aterosklerozes un anti-aterosklerozes sistēmām;
- pārvietoties vairāk, novēršot asins stagnāciju;
- pavadīt vairāk laika svaigā gaisā, nodrošinot pietiekamu skābekļa plūsmu;
- novērst liekā svara veidošanos;
- kontrolēt glikozes līmeni asinīs, kuru paaugstināts līmenis bojā asinsvadus;
- novērstu ilgstošu arteriālās hipertensijas pastāvēšanu, kas arī deformē asinsvadu sienu;
- ievērojiet iepriekš aprakstītās diētas principus.
4. solis. Zāles asinsvadu attīrīšanai no trombiem
Lai novērstu asins recekļu veidošanos, tabletes lieto, lai novērstu trombocītu nogulsnēšanos uz asinsvadu sieniņām. Tie ir "Thrombo-Ass", "CardioMagnil", "Plavix", "Clopidogrel", "Aspecard", "Curantil" un citi.
Ja saskaņā ar koagulogrammu INR ir zems, tiek nozīmēti antikoagulanti un ir aterosklerozes plāksnes vai trombi, tiek nozīmēti ne tikai iepriekš minētie prettrombocītu līdzekļi uz aspirīna bāzes, bet arī zāles, kas ietekmē asins koagulācijas sistēmu. Šis injicējamās zāles"Clexan", "Fragmin", "Fraxiparin", sliktākajā gadījumā - injicējamais "Heparīns". Varat arī lietot zāles "Varfarīns". Devas izvēlas ārsts. Pēc šādu zāļu lietošanas sākšanas noteikti jāuzrauga INR, pielāgojot zāļu devu, pretējā gadījumā var sākties asiņošana.
5. solis. Hirudoterapija
Ārstēšana ar ārstniecisko dēles kodumiem novērš asins recekļu veidošanos asinsvados. Tas notiek tāpēc, ka šis tārps, sūcot, izdala dažādus enzīmus asinīs. Tiem vajadzētu nodrošināt, ka, kamēr dēle dzer asinis, tā nesarecē. Tā rezultātā hirudīns un citi enzīmi nonāk sistēmiskajā cirkulācijā, izšķīdinot esošos mazos asins recekļus un novēršot turpmāku trombu veidošanos.
Hirudoterapiju nevar veikt visi, bet tikai tad, ja nav:
- asinsreces traucējumi;
- izsīkums;
- grūtniecība;
- ķeizargrieziens vai cita operācija, kas veikta pirms 4 mēnešiem;
- paaugstināta jutība pret kādu no dēles “siekalu” sastāvdaļām;
- pastāvīgi zems asinsspiediens.
Pirms tīrāt asinsvadus ar tautas līdzekļiem, konsultējieties ar savu kardiologu vai terapeitu, lai uzzinātu, vai varat lietot šo vai citu novārījumu.
- pīlādži;
- baltā vītola miza;
- biškrēsliņi;
- nātre;
- zemeņu lapas;
Tam pašam mērķim augu aptiekās var iegādāties sertificētus uztura bagātinātājus: vilkābeļu un mežrozīšu sīrupu, “Bietes ar seleriju”, “Vilkābele Premium”. Ja jums nepatīk ķiploku garša, iegādājieties Solgar uztura bagātinātāju “Ķiploku pulveris”. Ginkgo biloba, kas ražots uztura bagātinātāju veidā, ļoti labi atšķaida asinis.
Populāras tautas receptes
Šeit ir 2 visizplatītākās receptes.
- Jums vajag ķiploku un citronu. Jums tie jāņem pēc svara vienādos daudzumos un jāsasmalcina gaļas mašīnā. Tagad pievienojiet tādu pašu medus daudzumu kā šim maisījumam, samaisiet. Atstāj uz nedēļu noslēgtā traukā, ik pa laikam apmaisot. Dzert maisījumu reizi dienā, 4 tējkarotes.
- Ņem 5 ēd.k. priežu skujas, 3 ēd.k. rožu gurniem, 1 ēd.k. sīpolu mizas. Šo maisījumu ielej 1 litrā auksts ūdens, pēc tam uzlējumu uzvāra un vāra uz lēnas uguns 10 minūtes. Pēc tam izslēdz uguni, pārklāj pannu un atstāj uz nakti. No rīta maisījumu izkāš un dzer mazās porcijās visas dienas garumā.
Iespējamais solis ir zāles holesterīna plāksnīšu šķīdināšanai
Dažos gadījumos ar augstu aterogēno indeksu (nosaka lipīdu asins analīzi) ieteicams izrakstīt zāles, kas izšķīdinās aterosklerozes plāksnes. Tikai kardiologs vai terapeits izraksta šādu recepti, jo tikai viņš spēj novērtēt līdzsvaru starp blakusparādību risku un šo zāļu iespējamo ieguvumu.
Ir noteikti 2 galvenie holesterīna līmeni pazeminošo zāļu veidi. Tie ir statīni (Atorvacard, Simvastatin, Lovastatin un citi) un fibrāti (Clofibrate, Tycolor, Esklip).
Statīni
Statīni ir zāles, kas pazemina holesterīna līmeni, bloķējot fermentu ceļu, pa kuru tas tiek sintezēts. Lai gan šīs zāles ir iekļautas plānā piespiedu ārstēšana aterosklerozi, ko noteikusi Veselības ministrija, taču lielā blakņu skaita dēļ ārsts domās, vai ir vērts tās izrakstīt, vai ārstēšanu var veikt bez to lietošanas. Tie ir obligāti jāizmanto šādām personu kategorijām:
- laikā akūts periods miokarda infarkts;
- tiem, kam ir bijusi sirdslēkme vai insults;
- pirms un pēc sirds operācijas;
- izteikts išēmiska slimība sirds, kad miokarda infarkta līmenis ir augsts.
Ar zemu sirdslēkmes attīstības risku, ja tāds ir cukura diabēts, kā arī sievietēm pirms menopauzes šādu zāļu lietošana var izraisīt blakus efekti no jebkuras ķermeņa sistēmas. Ja ar statīniem mēģināt ārstēt tikai augstu holesterīna līmeni, kad cilvēka sirds, nieres un aknas ir veselas, tas ir diezgan riskanti, jo īpaši tāpēc, ka kaitīgā ietekme šeit attīstās pakāpeniski, pakāpeniski. Bet, ja jau esat nolēmis šādā veidā tīrīt asinsvadus, jums katru mēnesi jāuzrauga asins bioķīmiskie parametri, īpaši tā sauktie "aknu testi". Nav arī vērts patstāvīgi samazināt vai palielināt devu.
Fibrāti
Tās ir zāles, kas samazina holesterīna veidošanos: Klofibrāts, Gemfibrozils, Tycolor un citi. Tie nav tik labi holesterīna līmeņa pazemināšanā kā statīni, taču tie nav arī tik toksiski. Šīs 2 zāļu grupas visbiežāk tiek kombinētas, lai samazinātu blakusparādību skaitu.
Citas narkotiku grupas
Dažos gadījumos zāles, kuru mērķis ir samazināt holesterīna uzņemšanu, ir efektīvas. Tie ir Orlistat, Xenical, Ezetrol. To efektivitāte nav tik augsta kā statīniem vai fibrātiem, jo lielāko daļu “slikto” lipoproteīnu joprojām ražo pats organisms, un tie netiek absorbēti no pārtikas.
Ja nav indikāciju statīnu lietošanai, bet ja ir cukura diabēts, hipertensija, hronisks holecistīts vai holelitiāze, tāds slikts ieradums piemēram, smēķēšana, var lietot uztura bagātinātājus. Šādi produkti, kas tiek piegādāti kapsulās vai tabletēs un netiek uzskatīti par “īstām” zālēm, dažkārt ir tikpat efektīvi aplikumu attīrīšanā no asinsvadiem, neizraisot milzīgs apjoms nepatīkama blakus simptomi. Tie ir “Tykveol”, “Lipoic acid”, “Omega Forte”, “Doppelgerts omega 3”, “CardioActive Hawthorn”, “Golden mumiyo”.
Iespējamais solis – operācija
Kad aterosklerozes aplikums ir “aizaugts” ar kalcija sāļiem tā, ka neviens medikaments nesasniedz tā holesterīna kodolu vai tautas līdzeklis. Tajā pašā laikā tas nesniedz uzturu nevienam orgānam vai apdraud insulta vai gangrēnas attīstību. Šajā gadījumā vienīgais risinājums ir operācija, lai noņemtu aplikumu no traukiem. Tajā pašā laikā tiek izveidots "apvedceļš" asins piegādei slimajam orgānam, piemēram, koronāro artēriju šuntēšanas operācija, kad tiek izveidots papildu "ceļš" no pārklājošās zonas uz asinsvadu, kas iet tieši uz audiem. nepieciešams. Tādējādi asinis plūst garām kuģa “aizsērētajai” zonai. Dažreiz tiek veikta stentēšanas operācija, kad sašaurinātās artērijas zonā tiek ievietota "caurule" (stents), kas atgriež asinsvadu sākotnējā lūmena diametrā.
Pēc šādas iejaukšanās ir nepieciešama ilgstoša asins recekļu veidošanos mazinošu zāļu lietošana kopā ar zālēm, kas uzturēs normālu holesterīna līmeni, lai novērstu aplikumu atkārtotu veidošanos.
Tādējādi, ja vēlaties pasargāt savus asinsvadus no iespējamām aplikuma nogulsnēm, jāpielāgo dzīvesveids, jāizdzer kurss, pēc konsultēšanās ar terapeitu, novārījumi vai uzlējumi, kas pagatavoti atbilstoši tautas recepte. Tas pats attiecas uz cilvēkiem, kuri nesūdzas par sirds problēmām un atklāj, ka viņu asinīs ir augsts holesterīna līmenis. Ja, ejot, veicot fiziskā aktivitāte vai, pieceļoties no gultas, sāpes vai diskomforts parādās aiz krūšu kaula vai krūškurvja kreisajā pusē; ja Jums ir augsts asinsspiediens vai iepriekš ir diagnosticēts sirds defekts, Jums jākonsultējas ar savu ārstu par zāļu lietošanas lietderīgumu. holesterīna līmeni pazeminošas zāles.
Atcerieties: pārāk neaizraujieties ar holesterīna līmeņa pazemināšanu. Šis elements ir nepieciešams katras mūsu šūnas membrānai, ar nelielu tā daudzumu palielinās vēža un slimību attīstības risks. nervu sistēma, tostarp insults, kā arī stāvoklis, kurā ir zems hemoglobīna līmenis asinīs – anēmija.
2016. gada 22. jūlijsCaurspīdīgas smadzenes un amiloīda plāksnīšu 3D atlants
Pētnieki no Rokfellera universitātes (ASV) izmantoja jaunizveidotu attēlveidošanas tehniku, kas padara smadzeņu audus caurspīdīgus. Tas ļāva viņiem redzēt trīsdimensiju attēlu par patoloģisku proteīnu, beta-amiloīda plāksnīšu, uzkrāšanās vietu mirušo cilvēku smadzenēs ar Alcheimera slimību.
Patoloģisku amiloid-beta proteīnu uzkrāšanās esamība un izplatība smadzenēs, kas tiek uzskatīta par notikumu ķēdes “ierosni”, kas izraisa neironu nāvi, vēl nesen tika noteikta, analizējot smadzeņu šķēles. Šķēles sagatavošana ir laikietilpīga, un turpmākā 3D rekonstrukcija ir darbietilpīga un var būt neprecīza. Jebkurā gadījumā iegūtais ieskats būs ierobežots, jo smadzenes ir sarežģīta trīsdimensiju struktūra ar daudzām savstarpēji saistītām sastāvdaļām, kuras ir grūti pilnībā rekonstruēt no šķēluma datiem. Mums bija nepieciešams veids, kā redzēt kopējo ainu.
Tādas telpiskās smadzeņu attēlveidošanas metodes kā pozitronu emisija un funkcionālā magnētiskās rezonanses attēlveidošana parāda dažādu smadzeņu zonu aktivitāti, taču nav piemērotas beta-amiloīda izplatības pētīšanai. Taču noderēja nesen izstrādātā metode, ko sauc par iDISCO (ar imunozīmi iespējotu šķīdinātāju attīrītu orgānu 3D attēlveidošanu).
Smadzeņu audos ir aptuveni 60% tauku. Ja tās tiek noņemtas, smadzenes, pēc zinātnieku domām, kļūst cietas un caurspīdīgas, gandrīz "kā stikls". Izmantojot iDISCO metodi, smadzenes tiek piesūcinātas ar kompozīciju, kas dod taukus elektriskais lādiņš, un pēc tam pakļauti elektriskā lauka iedarbībai ar pretēju lādiņu. Izrādās, ka tas ir "magnēts", kas "izvelk" taukus no smadzenēm.
Pašas plāksnes tika iekrāsotas ar imunoloģiskām metodēm, pēc tam tās kļuva redzamas apjomā - visā peles smadzeņu puslodē un nelielos cilvēka smadzeņu fragmentos. Izrādījās, ka Alcheimera slimības peļu modeļos plāksnes ir diezgan mazas, vienāda izmēra un formas, un nav sagrupētas, atšķirībā no cilvēka smadzenēm, kur ir redzama neviendabība, plāksnes ir lielākas un tiek novērotas sarežģītas trīsdimensiju amiloīda struktūras. .
Beta-amiloīda gabaliņi ir purpursarkanā krāsā
Zinātnieki cer, ka, salīdzinot pacienta simptomus un beta-amiloīda izplatības pēcnāves modeli viņa smadzenēs, izdosies iemācīties atšķirt Alcheimera slimības veidus, kas var būt nevis viens, bet vairāki stāvokļi, jo amiloīda plāksnīšu skaits ne vienmēr atbilst slimības smagumam. Dažreiz aplikumu ir daudz, bet demence nenotiek, un dažreiz šķiet, ka aplikumu nav, bet ir slimības simptomi. Varbūt tas ir iemesls, kāpēc viņi neizdodas klīniskie pētījumi tiek izstrādātas zāles: jo tām ir dažāda efektivitāte plkst dažādas iespējas slimības. Pagaidām šīs iespējas nevar atšķirt, un plāksnīšu trīsdimensiju vizualizācija, to atrašanās vieta un to veidoto struktūru analīze var palīdzēt to uzzināt.
2014. gada 16. septembrisSmadzenes spēj kompensēt amiloīda plāksnīšu kaitīgo ietekmi
Ieslēgts agrīnās stadijas Ar Alcheimera slimību cilvēka smadzenes var pārkārtoties īpašā veidā, kas aizkavē slimības simptomu parādīšanos.
lasīts 2014. gada 22. augustāAlcheimera slimība: cik tuvu mēs esam problēmas risināšanai?
Ir ļoti maz dienu, kad medicīnas ziņu plūsmās nav neviena ziņojuma par Alcheimera slimības izpēti. Tomēr kādā attīstības stadijā tas ir pētniecības virziens?
lasīts 2014. gada 25. martāVēl viens pretdiabēta līdzeklis palīdzēs ar Alcheimera slimību?
Pretdiabēta līdzeklis pramlintīds samazina beta-amiloīda plāksnes smadzeņu audos un uzlabo mācīšanos un atmiņu divos eksperimentālos Alcheimera slimības modeļos.
lasīts 2012. gada 26. decembrīVai imūnās atbildes nomākšana palīdzēs ar Alcheimera slimību?
Imūnkompleksa inaktivācija, kas izraisa iekaisuma reakcijas smadzeņu audos, nomāc Alcheimera slimības gaitu.
Vecāks vecums un amiloīda beta proteīna plāksnīšu uzkrāšanās smadzeņu audos veicina postošas demences formas attīstību, kas pazīstama kā Alcheimera slimība. Pētījuma rezultāti sniegti pierādījumi zinātniekiem Fakts, ka D vitamīns ietekmē olbaltumvielu transportēšanas procesu, kas palīdz dabiski attīrīt smadzenes no to uzkrāšanās.
D vitamīns var būtiski mainīt daudzu slimību, tostarp vēža, sirds slimību un diabēta, attīstību un progresēšanu. vegānu receptes vietnē likelida.com Šodien zinātnieki uzskata, ka šajā sarakstā var iekļaut arī Alcheimera slimību. D vitamīna iegūšana, uzturoties zem saules stari vai lietojot prohormona piedevas, jāuzskata par obligātu visiem cilvēkiem, kas to vēlas.
D vitamīns palīdz attīrīt smadzenes no nāvējošām amiloīda proteīna plāksnēm
Eksperimenta laikā zinātnieki izmantoja datus par to laboratorijas peļu veselību, kurām ir ģenētiska nosliece uz demences attīstību. Tajā pašā laikā dzīvniekiem tika veiktas D vitamīna injekcijas. Tika konstatēts, ka šis vitamīns selektīvi novērš beta-amiloīda uzkrāšanos, un īpašie transporta proteīni attīra šūnas no destruktīvajiem amiloīdiem, pirms tie var uzkrāties. Smadzenēs ir vairāki īpaši transporta proteīni, kas pazīstami kā LRP-1 un P-GP, kas pavada amiloīda proteīnus cauri hematoencefālisko barjerai, pirms tie var nodarīt kaitējumu.
Pētnieki uzskata, ka D vitamīns uzlabo beta-amiloīda kustību caur hematoencefālisko barjeru, regulējot olbaltumvielu ekspresiju caur receptoriem. Tajā pašā laikā D vitamīns regulē arī šūnu impulsu pārraidi pa MEK vielmaiņas ceļu. Šo eksperimentu rezultāti parādīja zinātniekiem jaunus veidus, kā atrisināt problēmas, kas saistītas ar Alcheimera slimības ārstēšanu un profilaksi.
D vitamīna līmeņa kontrole asinīs samazina Alcheimera demences attīstības risku
Pētnieki uzskata, ka D vitamīns palīdz transportēt beta-amiloīda proteīna struktūras caur jutīgo hematoencefālisko barjeru, palīdzot atdalīt cerebrospinālā šķidruma kopas turpmākai eliminācijai. Ir zināms, ka šī spēja samazinās līdz ar vecumu, ļaujot lipīgām proteīnu kopām uzkrāties ap neironu sinapsēm. Zinātnieki ir atklājuši, ka gados vecākiem pieaugušajiem, kuriem diagnosticēta Alcheimera slimība, parasti ir zems D vitamīna līmenis B Šis brīdis Pētnieki ir noskaidrojuši saistību starp asins piesātinājuma līmeni ar šo vitamīnu un slimību attīstību.
Pētījuma autori nesaka, kādam jābūt optimālajam D vitamīna līmenim, tomēr daudzu iepriekšējo eksperimentu rezultāti liecina, ka vislabākais šīs vielas līmenis asinīs ir 50-80 ng/ml. Lielākajai daļai cilvēku, kas apzinās veselību, ir jālieto D vitamīna piedevas uz eļļas bāzes, lai pilnībā pasargātu sevi no šīs letālās demences formas.
Augstskolu, institūtu, augstskolu, akadēmiju dokumenti. Iegādājieties diplomu Maskavā vietnē diplomzakaz.com
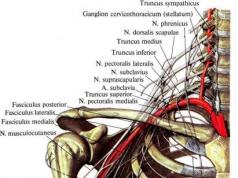
 Amiloidoze (amiloido distrofija, latīņu amiloidoze, grieķu amilona ciete + eidos sugas + ōsis) ir slimību grupa, kas izceļas ar plašu klīnisko izpausmju klāstu un ko raksturo ārpusšūnu (ārpusšūnu matricā) nogulsnēšanās (sistēmiska vai lokāla). nešķīstoši patoloģiski fibrilāri proteīni (olbaltumvielu- polisaharīdu komplekss - amiloīds) orgānos un audos, kas veidojas sarežģītu vielmaiņas izmaiņu (olbaltumvielu distrofijas) rezultātā. Galvenie mērķa orgāni ir sirds, nieres, nervu sistēma [centrālā un perifērā] un aknas, tomēr sistēmiskās formās var tikt ietekmēti gandrīz visi audi (retas lokalizācijas ir virsnieru amiloidoze). Tos sauca par amiloīdiem, jo, reaģējot ar jodu, tie atgādināja cieti. Amiloīds organismā saglabājas ilgu laiku un pat pēc nāves ilgstoši nepūst (I.V. Davydovskis, 1967). Amiloidoze var rasties neatkarīgi vai “sekundāri” citas slimības rezultātā.
Amiloidoze (amiloido distrofija, latīņu amiloidoze, grieķu amilona ciete + eidos sugas + ōsis) ir slimību grupa, kas izceļas ar plašu klīnisko izpausmju klāstu un ko raksturo ārpusšūnu (ārpusšūnu matricā) nogulsnēšanās (sistēmiska vai lokāla). nešķīstoši patoloģiski fibrilāri proteīni (olbaltumvielu- polisaharīdu komplekss - amiloīds) orgānos un audos, kas veidojas sarežģītu vielmaiņas izmaiņu (olbaltumvielu distrofijas) rezultātā. Galvenie mērķa orgāni ir sirds, nieres, nervu sistēma [centrālā un perifērā] un aknas, tomēr sistēmiskās formās var tikt ietekmēti gandrīz visi audi (retas lokalizācijas ir virsnieru amiloidoze). Tos sauca par amiloīdiem, jo, reaģējot ar jodu, tie atgādināja cieti. Amiloīds organismā saglabājas ilgu laiku un pat pēc nāves ilgstoši nepūst (I.V. Davydovskis, 1967). Amiloidoze var rasties neatkarīgi vai “sekundāri” citas slimības rezultātā.
Pašlaik amiloidoze tiek uzskatīta par slimību grupu, kurai raksturīga fibrilārā amiloidproteīna (AFA) nogulsnēšanās audos un orgānos - īpaša proteīna struktūra ar diametru 5 - 10 nm un garumu līdz 800 nm, kas sastāv. no 2 vai vairākiem paralēliem daudzvirzienu (pretparalēliem) pavedieniem, kas veidojas krusteniskā β loksnes uzbūve(skat. attēlu pa kreisi). Tieši tas nosaka amiloīda specifisko optisko īpašību – spēju iziet divkāršu laušanu (konstatēts ar Kongo sarkano krāsojumu [= metode amiloīda noteikšanai audos]). Saskaņā ar mūsdienu datiem amiloidozes izplatība populācijā svārstās no 0,1 līdz 6,6%.

Olbaltumvielu nosaukumu amiloīds ierosināja Rūdolfs Virčovs, kurš to aizguva no botānikas, kur šis vārds nozīmēja celulozi vai cieti. Savā struktūrā amiloīds ir sarežģīts glikoproteīns, kurā fibrilāri un lodveida proteīni ir atrodami struktūrā ar polisaharīdiem (galaktozi, glikozi, glikozamīnu, galaktozamīnu, mannozi un fruktozi). Amiloīds satur proteīnus, kas pēc īpašībām ir līdzīgi α1-, β- un γ-globulīniem, albumīnam, fibrinogēnam, un tas satur neiramīnskābi. Saites starp olbaltumvielām un polisaharīdiem ir ļoti spēcīgas, kas saglabā tās stabilitāti. Amiloīda struktūra satur arī P komponentu, kas veido līdz 15% no kopējā amiloīda daudzuma un ir identisks seruma proteīnam SAP (seruma amiloīds P). SAP ir aknu šūnu ražots proteīns, kas klasificēts kā akūtā fāze (SAP ir pastāvīga amiloido nogulšņu sastāvdaļa visu amiloidozes formu gadījumā).
Amiloidoze ir polietioloģiska. Galvenā nozīme ir galvenā amiloido prekursora proteīna (BPA) amiloidogenitātei, kas ir raksturīga katrai amiloidozes formai. Amiloidogenitāti nosaka izmaiņas APA primārajā struktūrā, kas fiksētas ģenētiskajā kodā vai iegūtas dzīves laikā mutāciju dēļ. Lai realizētu BPA amiloidogēno potenciālu, ir nepieciešams pakļauties vairākiem faktoriem, piemēram, iekaisumam, vecumam un fizikāli ķīmiskajiem apstākļiem in situ.
TABULA: amiloidozes klasifikācija (visos amiloidozes veidu nosaukumos pirmais burts ir lielie burti"A" apzīmē vārdu "amiloīds", kam seko specifiskā AAD apzīmējums - A [amiloīda A proteīns; veidojas no seruma prekursora proteīna SAA - akūtās fāzes proteīna, ko parasti sintezē hepatocīti, neitrofīli un fibroblasti nelielā daudzumā], L [imūnglobulīna vieglās ķēdes], TTR [transtiretīns], 2M [β2-mikroglobulīns], B [ B proteīns ], IAPP [saliņu amiloīda polipeptīds] utt.).

Piezīme! Amiloīda strukturālās un ķīmiski fizikālās īpašības nosaka galvenais BPA, kura saturs fibrilā sasniedz 80% un ir katra amiloidozes veida īpatnība. Katram proteīnam (AP) ir ievērojami atšķirīgi sintēzes, izmantošanas un bioloģisko funkciju mehānismi, kas nosaka atšķirības amiloidozes klīniskajās izpausmēs un pieejās. Šī iemesla dēļ dažādas amiloidozes formas tiek uzskatītas par dažādām slimībām (skatīt tabulu).
Neskatoties uz progresu, kas panākts dažādu amiloīda veidu izpētē, amiloidoģenēzes pēdējais posms - amiloidālo fibrilu veidošanās BPA starpšūnu matricā - joprojām ir neskaidrs. Acīmredzot tas ir daudzfaktoru process, kam ir savas īpašās iezīmes, kad dažādas formas amiloidoze. Apskatīsim amiloidoģenēzes procesu, izmantojot AA amiloidozes piemēru. Tiek uzskatīts, ka, veidojot AA no SAA, notiek SAA nepilnīgas šķelšanās process, ko veic proteāzes, kas saistītas ar monocītu-makrofāgu virsmas membrānu, un šķīstošā AA proteīna polimerizācija fibrilās, kas, domājams, notiek arī, piedaloties membrānas enzīmi, ir svarīgi. AA amiloīda veidošanās intensitāte audos ir atkarīga no SAA koncentrācijas asinīs. Dažāda veida šūnu (hepatocītu, neitrofilu, fibroblastu) sintezētā SAA daudzums daudzkārt palielinās iekaisuma procesu un audzēju laikā (AA amiloidozes patoģenēzē liela nozīme ir paaugstinātam SAA līmenim asinīs). Tomēr amiloidozes attīstībai nepietiek tikai ar augstu SAA koncentrāciju, ir nepieciešama arī amiloidogenitātes klātbūtne BPA (t.i., SAA). Amiloidozes attīstība cilvēkiem ir saistīta ar SAA1 nogulsnēšanos. Pašlaik ir zināmi 5 SAA1 izotipi, no kuriem vislielākā amiloidogenitāte tiek attiecināta uz 1.1 un 1.5 izotipu. Pēdējais amiloidoģenēzes posms - amiloido fibrilu veidošanās no BPA - notiek monocītu-makrofāgu nepilnīgas šķelšanās laikā ar proteāžu palīdzību. Amiloīda fibrilas stabilizācija un šī makromolekulārā kompleksa šķīdības strauja samazināšanās lielā mērā ir saistīta ar mijiedarbību ar intersticiālajiem polisaharīdiem.
Neskatoties uz atšķirībām amiloīda proteīna veidos, pastāv kopēja dažādu veidu patoģenēze klīniskās formas amiloidoze. Galvenais slimības attīstības cēlonis ir noteikta, bieži palielināta amiloidogēnā APA daudzuma klātbūtne. Amiloidogenitātes parādīšanās vai pastiprināšanās var būt saistīta ar proteīnu variantu cirkulāciju ar paaugstinātu molekulas kopējo hidrofobitāti, virsmas molekulāro lādiņu attiecību nelīdzsvarotību, kas izraisa proteīna molekulas nestabilitāti un veicina tās agregāciju amiloīda fibrilā. Pēdējā amiloidoģenēzes stadijā amiloido proteīns mijiedarbojas ar asins plazmas olbaltumvielām un audu glikozaminoglikāniem. Izņemot strukturālās iezīmes, svarīgas ir arī starpšūnu matricas, kurā ir samontēta amiloīda fibrila, fizikāli ķīmiskās īpašības. Daudzas amiloidozes formas var kombinēt arī, pamatojoties uz to rašanos vecā un senīlā vecumā (AL, ATTR, AIAPP, AApoA1, AFib, ALys, AANF, A-beta), kas norāda uz ar vecumu saistītu evolūcijas mehānismu klātbūtni. noteiktu olbaltumvielu struktūru, lai palielinātu amiloidogenitāti un ļauj uzskatīt amiloidozi par vienu no ķermeņa novecošanas modeļiem.
Amiloidozes neiroloģiskie aspekti :
ATTR amiloidoze. ATTR amiloidoze ietver ģimenes amiloido polineuropatiju, kas tiek mantota autosomāli dominējošā veidā, un sistēmisku senilu amiloidozi. Šīs amiloidozes formas prekursorproteīns ir transtiretīns, prealbumīna molekulas sastāvdaļa, ko sintezē aknas un veic tiroksīna transportproteīna funkcijas. Ir konstatēts, ka iedzimta ATTR amiloidoze ir transtiretīnu kodējošā gēna mutācijas rezultāts, kas izraisa aminoskābju aizstāšanu TTR molekulā. Ir vairāki iedzimtas amiloidālās neiropātijas veidi: portugāļu, zviedru, japāņu un vairāki citi. Visizplatītākajā ģimenes variantā (portugāļu valodā) 30. pozīcijā no transtiretīna molekulas N-gala metionīns tiek aizstāts ar valīnu, kas palielina prekursora proteīna amiloidogenitāti un atvieglo tā polimerizāciju amiloīda fibrilās. Ir zināmi vairāki transtiretīnu varianti, kas rada dažādas iedzimtas neiropātijas klīniskās formas. Klīniski šai slimībai raksturīga progresējoša perifēra un autonoma neiropātija, kas kombinējas ar sirds, nieru un citu orgānu bojājumiem. dažādas pakāpes. Sistēmiskā senils amiloidoze attīstās pēc 70 gadu vecuma, ko izraisa ar vecumu saistītas konformācijas izmaiņas normālā transtiretīnā, acīmredzami palielinot tā amiloidogenitāti. Senils amiloidozes mērķa orgāni ir sirds, smadzeņu asinsvadi un aorta.
izlasi arī ziņu: Transtiretīna amiloīdā polineuropatija(uz vietni)
lasiet arī rakstu “Perifērās nervu sistēmas bojājumi sistēmiskas amiloidozes gadījumā” Safiulina E.I., Zinovjeva O.E., Rameev V.V., Kozlovskaya-Lysenko L.V.; Federālā valsts autonomā augstākās izglītības iestāde "Pirmā Maskavas valsts medicīnas universitāte viņiem. VIŅI. Sechenov" Krievijas Federācijas Veselības ministrija, Maskava (žurnāls "Neiroloģija, neiropsihiatrija, psihosomatika" Nr. 3, 2018) [lasīt]
Alcheimera slimība(AD) ir ģenētiski noteikta progresējoša neirodeģeneratīva slimība, kuras pamatā ir smadzeņu pusložu neironu bojāeja; klīniskās izpausmes slimības ir atmiņas un citu kognitīvo funkciju (inteliģence, prakse, gnoze, runa) samazināšanās. Šobrīd ir identificēti 4 galvenie gēni, kas ir atbildīgi par attīstību no šīs slimības: gēns, kas kodē amiloīda prekursoru proteīnu (APP, 21. hromosoma), gēni, kas kodē enzīmus [alfa-, beta-, gamma-sekretāzi], kas metabolizē APP: presenilīns-1 (14. hromosoma), presenilīns -2 (1. hromosoma). Īpašu lomu spēlē apolipoproteīna E (APOE 4) ceturtās izoformas hetero- vai homozigots pārvadātājs.
Parasti amiloīda prekursorproteīnu (APP) alfa-sekretāze sadala šķīstošos (vienāda izmēra) polipeptīdos, kas nav patogēni, un (APP) tiek izvadīts no organisma; par APP metabolismu atbildīgo gēnu patoloģijas gadījumā pēdējo beta un gamma sekrēcijas sadala dažāda garuma fragmentos. Šajā gadījumā veidojas nešķīstoši gari amiloīda proteīna (alfa-beta-42) fragmenti, kas pēc tam tiek nogulsnēti smadzeņu vielā (parenhīmā) un smadzeņu asinsvadu sieniņās (difūzās cerebrālās amiloidozes stadija). noved pie nāves nervu šūnas. Tālāk smadzeņu parenhīmā nešķīstošo fragmentu agregācija notiek patoloģiskā proteīnā - amiloīdā beta (šī proteīna "ligzdas" nogulsnes smadzeņu parenhīmā sauc par senilām plāksnēm). Amiloīda proteīna nogulsnēšanās iekšā smadzeņu trauki izraisa cerebrālās amiloido angiopātijas attīstību, kas ir viens no hroniskas cerebrālās išēmijas cēloņiem.

izlasi rakstu: Smadzeņu amiloido angiopātija(uz vietni)
Beta-amiloīdam un nešķīstošām difūzā amiloīda proteīna frakcijām ir neirotoksiskas īpašības. Eksperiments parādīja, ka uz smadzeņu amiloidozes fona aktivizējas audu iekaisuma mediatori, palielinās stimulējošu mediatoru (glutamāta, aspartāta u.c.) izdalīšanās, pastiprinās brīvo radikāļu veidošanās. Visas šīs sarežģītās notikumu kaskādes rezultāts ir neironu membrānu bojājums, par ko liecina neirofibrilāru samezglojumu (NFT) veidošanās šūnās. NSF ir bioķīmiski izmainītas neirona iekšējās membrānas fragmenti un satur hiperfosforilētu tau proteīnu. Parasti tau proteīns ir viens no galvenajiem proteīniem neironu iekšējā membrānā. Intracelulāro NSF klātbūtne norāda uz neatgriezeniskiem šūnas bojājumiem un tās ātru nāvi, pēc kuras NSF iziet starpšūnu telpā (“NPS-spoki”). Pirmie un visvairāk skartie ir neironi, kas ieskauj senils plāksnes.

No amiloīda proteīna nogulsnēšanās sākuma smadzenēs līdz pirmo slimības simptomu - vieglas aizmāršības - parādīšanās paiet 10-15 gadi. Lielā mērā astmas progresēšanas ātrumu nosaka vienlaicīgas somatiskās patoloģijas smagums, asinsvadu riska faktori, kā arī pacienta intelektuālā attīstība. Pacientiem ar augsts līmenis izglītība un pietiekama intelektuālā slodze, slimība progresē lēnāk nekā pacientiem ar vidējo vai pamatizglītība un nepietiekama intelektuālā darbība. Šajā sakarā tika izstrādāta kognitīvās rezerves teorija, saskaņā ar kuru intelektuālās darbības laikā cilvēka smadzenes veido jaunas starpneironu sinapses un izziņas procesā tiek iesaistītas arvien lielākas neironu populācijas. Tas ļauj vieglāk kompensēt kognitīvos defektus pat ar progresējošu neirodeģenerāciju.
Amiloidozes diagnostika. Amiloidozes aizdomas, pamatojoties uz klīniskiem un laboratorijas datiem, ir jāapstiprina morfoloģiski, nosakot amiloīdu audu biopsijās. Ja ir aizdomas par AL tipa amiloidozi, ieteicams veikt punkciju kaulu smadzenes. Visbiežāk, lai diagnosticētu dažāda veida amiloidozi, tiek veikta taisnās zarnas, nieru un aknu gļotādas biopsija. Taisnās zarnas gļotādu un submukozālo slāņu biopsija amiloīdu var noteikt 70% pacientu, bet nieru biopsija - gandrīz 100% gadījumu. Pacientiem ar karpālā kanāla sindromu karpālā kanāla dekompresijas operācijas laikā izņemtajos audos jāpārbauda amiloīds. Lai noteiktu amiloīdu, biopsijas materiāls jāiekrāso ar Kongo sarkano krāsu, kam seko polarizētās gaismas mikroskopija, lai noteiktu divreizējo lūzumu.
Mūsdienu amiloidozes morfoloģiskā diagnostika ietver ne tikai amiloīda noteikšanu, bet arī tipizēšanu, jo nosaka amiloīda veids. terapeitiskā taktika. Rakstīšanai bieži izmanto testu ar kālija permanganātu. Apstrādājot Kongo sarkani nokrāsotos preparātus ar 5% kālija permanganāta šķīdumu, AA tipa amiloīds zaudē krāsu un zaudē savas divkāršās laušanas īpašības, bet AL tipa amiloīds tās saglabā. Sārmaina guanidīna lietošana ļauj precīzāk atšķirt AA un AL amiloidozi. Lielākā daļa efektīva metode Amiloīda tipizēšanu veic imūnhistoķīmiskos pētījumos, izmantojot antiserumus pret galvenajiem amiloidproteīna veidiem (specifiskas antivielas pret AA proteīnu, imūnglobulīna vieglās ķēdes, transtiretīnu un beta-2-mikroglobulīnu).
Piezīme! Amiloidoze ir daudzsistēmu slimība, tikai viena orgāna bojājumi tiek novēroti reti. Ja anamnēzē ir minēta simptomu kombinācija, piemēram, vispārējs vājums, novājēšana, viegls izskats zilumi, agrīna aizdusa attīstība, perifēra tūska, maņu izmaiņas (karpālā kanāla sindroms) vai ortostatiska hipotensija, amiloidozi. Iedzimtu amiloidozi raksturo apgrūtināta ģimenes anamnēze ar nezināmas etioloģijas “neiromuskulāriem” bojājumiem vai demenci, Aβ2M amiloidozi raksturo hemodialīzes izmantošana, un AA amiloidozi raksturo hroniska iekaisuma procesa klātbūtne. Tāpat ir jāizslēdz amiloidoze pacientiem ar nezināmas izcelsmes nieru slimībām, īpaši ar nefrotiskais sindroms, t.sk. pacientiem ar ierobežojošu kardiomiopātiju. Amiloidoze ir lielāka iespējamība abu šo sindromu klātbūtnē. AA amiloidozes gadījumā dominējošais mērķa orgāns papildus nierēm ir aknas, tādēļ, kad diferenciāldiagnoze smagas hepatomegālijas cēloņiem kombinācijā ar nieru bojājumiem jāizslēdz amiloidoze.
papildu literatūra:
raksts “Grūtības AL amiloidozes diagnostikā un ārstēšanā: literatūras apskats un pašu novērojumi” V.V. Rižko, A.A. Klodzinskis, E.Ju. Varlamova, O.M. Sorkina, M.S. Sataeva, I.I. Kaļiņina, M.Ž. Aleksanjans; Hematoloģijas pētnieks RAMS centrs, Maskava (žurnāls “Clinical Oncohematology” Nr. 1, 2009) [