LABORATORISKIE EKSPERIMENTI PAR TĒMU: “OGĻŪDEŅRAŽU, SPIRTOJU, ALDEHĪDU UN SKĀBJU ĢENĒTISKĀS SAISTĪBAS”
Piesātinātie ogļūdeņraži
No piesātinātajiem ogļūdeņražiem skolā detalizēti tiek pētīts metāns kā pēc sastāva un struktūras vienkāršākā, praktiskai iepazīšanai pieejamākā viela, kam ir liela ekonomiska nozīme kā ķīmiskai izejvielai un degvielai.
Eksperimenti ar pirmo pētīja organiskā ķīmija viela, jāpiegādā pietiekamā daudzumā un ar īpašu piesardzību metodiskā ziņā, jo tiem jāparāda jauni eksperimenta aspekti organiskās ķīmijas izpētē. Šeit būs iespējams eksperimentāli noteikt sastāvu un molekulārā formula vielām, kas ir pirmais solis struktūrformulu noteikšanā organiskie savienojumi.
METĀNS.
Eksperimentu secība ar metānu var būt atšķirīga. Pamatā to noteiks tas, vai skolotājs tēmu sāks ar metāna iegūšanu un pēc tam veiks eksperimentus tā īpašību izpētei, izmantojot nodarbībā iegūto vielu, vai arī izmantos iepriekš sagatavotu metānu, lai skaidri ievērotu metāna apguves secību. jautājumi - vispirms apsveriet fizikālās īpašības vielas, tad Ķīmiskās īpašības, pielietojot vielu un beidzot to iegūstot. Pēdējā gadījumā metāna ražošanas pieredze tiks prezentēta tikai tēmas beigās.
Pirmais veids, kā pētīt tēmu un līdz ar to arī izveidot eksperimentu, ir metodoloģiski sarežģītāks, taču tas ietaupa vairāk laika. Otrā metode prasīs vairāk laika, taču tā ir metodoloģiski vienkāršāka un vērtīga arī ar to, ka ļaus beidzot atkārtot un nostiprināt zināšanas par pamateksperimentiem ar vielu, kad tās tiks apgūtas stundā.
Pētot metānu, nav īpašas vajadzības pēc laboratorijas eksperimentiem. Būtībā tos šeit varētu reducēt tikai līdz metāna ražošanai un tā sadedzināšanai. Bet metāna ražošanu no nātrija acetāta un tā sadegšanu var viegli parādīt uz demonstrācijas tabulas.
Pēc visas tēmas “Ogļūdeņraži” apguves būtu vēlams novadīt īpašu praktisko nodarbību. Šajā nodarbībā skolēni atveidos metāna ražošanas pieredzi un varēs pārliecināties, vai metāns neizmaina broma ūdeni un kālija permanganāta šķīdumu.
Metāna ražošana laboratorijā. Ērtākā laboratorijas metode metāna iegūšanai ir nātrija acetāta mijiedarbība ar nātrija kaļķi.
Karbonskābju sāļu mijiedarbība ar sārmiem ir vispārīgā veidā ogļūdeņražu iegūšana. Reakcija iekšā vispārējs skats attēlots ar vienādojumu:
ja R = CH 3, tad veidojas metāns.
Tā kā kaustiskā soda ir higroskopiska viela, un mitruma klātbūtne traucē veiksmīga pabeigšana reakcija, tad tam pievieno kalcija oksīdu. Nātrija hidroksīda un kalcija oksīda maisījumu sauc par nātrija kaļķi.
Lai reakcija noritētu veiksmīgi, ir nepieciešama diezgan liela karsēšana, tomēr pārmērīga maisījuma pārkaršana izraisa blakus procesus un nevēlamu produktu, piemēram, acetona, veidošanos:
Pirms eksperimenta nātrija acetāts ir jādehidrē. Pirms maisījuma pagatavošanas arī sodas kaļķi jākalcinē. Ja nav gatavā soda kaļķa, to gatavo šādi. Dzelzs vai porcelāna glāzē ielej labi kalcinētu smalcinātu kaļķu CaO ar pusi no daudzuma piesātināta sārma NaOH ūdens šķīduma. Maisījumu iztvaicē līdz sausumam, kalcinē un sasmalcina. Vielas uzglabā eksikatorā.
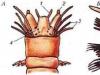
Lai demonstrētu metāna ražošanu, vislabāk ir izmantot nelielu kolbu ar izplūdes cauruli un līdz praktiskā nodarbība-- mēģene (1. un 2. att.).
Salieciet ierīci, kā parādīts attēlā. 1 vai 2. Sārma šķīdumu ielej mazgāšanas pudelē, lai notvertu piemaisījumus (I zīm.). Nātrija acetāta un nātrija kaļķa maisījumu ievieto reakcijas kolbā vai mēģenē. Lai to izdarītu, smalki samaltas vielas rūpīgi sajauc tilpuma attiecībā 1:3, t.i. ar ievērojamu kaļķa pārpalikumu, lai piespiestu nātrija acetātu reaģēt pēc iespējas pilnīgāk.

Rīsi.

Kolbu karsē ar degli caur azbesta sietu, un mēģeni karsē uz tukšas liesmas. Metānu savāc mēģenē, izspiežot ūdeni. Lai pārbaudītu iegūtās gāzes tīrību, izņemiet mēģeni no ūdens un aizdedziet gāzi, to neapgriežot.
Tā kā metāna ražošanas procesu pārtraukt ir nepraktiski un visus citus eksperimentus pabeigt reakcijas laikā nav iespējams, gāzi turpmākajiem eksperimentiem ieteicams savākt vairākos cilindros (mēģenēs) vai gazometrā.
Piepildītos balonus kādu laiku atstāj vannā vai pārklāj zem ūdens ar stikla plāksni (aizbāzni) un novieto otrādi uz galda.
Metāns ir vieglāks par gaisu. Lai iepazītos ar metāna fizikālajām īpašībām, skolotājs demonstrē balonu ar savākto gāzi. Studenti atzīmē, ka metāns ir bezkrāsaina gāze. Metāna savākšana ar ūdens izspiešanas metodi liecina, ka šī gāze acīmredzot ūdenī nešķīst. Skolotājs apstiprina šo secinājumu.
Uz svariem ir sabalansētas divas identiskas kolbas ar lielāko iespējamo ietilpību. Viena no kolbām ir pakārta otrādi (3. att.). Metāns no ierīces kādu laiku tiek ievadīts šajā kolbā. Svari paceļas uz augšu. Lai skolēni nedomātu, ka svara izmaiņas rodas gāzes plūsmas spiediena dēļ uz kolbas dibenu, pievērsiet uzmanību tam, ka nelīdzsvarotība saglabājas arī pēc metāna pārejas pārtraukšanas.
Pēc tam, kad svari ir atgriezti līdzsvarā (lai to izdarītu, uz brīdi apgrieziet pudeli ar metānu otrādi), salīdzinājumam un pārliecinošākiem secinājumiem metāns tiek ievadīts kolbā, kas parasti stāv uz svariem. Svaru līdzsvars netiek traucēts.

Parādījis, ka metāns ir vieglāks par gaisu, skolotājs stāsta, cik tas sver normāli apstākļi litrs metāna. Šī informācija būs nepieciešama vēlāk, atvasinot vielas molekulāro formulu.
Metāna sadedzināšana. Apsverot metāna fizikālās īpašības, var rasties jautājums par to, kāda ir metāna molekulārā formula. Skolotāja ziņo, ka, lai tiktu skaidrībā ar šo jautājumu, vispirms būs jāiepazīstas ar vienu no metāna ķīmiskajām īpašībām – degšanu.
Metāna sadegšanu var parādīt divos veidos.
1. Uz galda novieto ar metānu pildītu stikla cilindru (ar tilpumu, piemēram, 250 ml), no tā noņem plāksni vai atver korķi un ar šķembu nekavējoties aizdedzina gāzi. Metānam degot, liesma nolaižas cilindrā.

Lai liesma visu laiku paliktu virs balona un būtu skaidri redzama skolēniem, balonā var pakāpeniski ieliet ūdeni ar degošu metānu, tādējādi izspiežot gāzi (4. att.).
2. Metāns tiek aizdedzināts tieši pie ierīces izplūdes caurules, lai ražotu gāzi vai gāzes skaitītāju (abos gadījumos ir nepieciešama tīrības pārbaude!). Pirmajā gadījumā liesmas lielumu kontrolē sildīšanas intensitāte un otrajā gadījumā izspiežošā šķidruma kolonnas augstums. Ja metānā nav piemaisījumu, tas deg ar gandrīz bezkrāsainu liesmu. Lai novērstu daļu no liesmas spožuma (dzeltenas krāsas), ko izraisa nātrija sāļi mēģenes stiklā, caurules galā var piestiprināt metāla galu.
ALDEHĪDI UN KETONI
Studējot aldehīdus, studenti eksperimentu ceļā iepazīstas ar oksidēšanās pakāpenisko būtību. organisko vielu, ar svarīgu ķīmiju ražošanas procesiem un ar sintētisko sveķu iegūšanas principu.
Lai skolēniem būtu skaidra aldehīdu vieta ogļūdeņražu oksidācijas produktu sērijā, veidojot ķīmiskos vienādojumus, nevajadzētu izvairīties no to skābju nosaukumu un formulu izmantošanas, kurās pārvēršas aldehīdi. Skābju formulas var dot dogmatiski iepriekš; Nākotnē studenti saņems tiem eksperimentālu pamatojumu.
Pētot aldehīdus, lielākā daļa eksperimentu tiek veikti ar formaldehīdu kā vielu, kas ir vispieejamākā skolām un kurai ir liela rūpnieciska nozīme. Saskaņā ar to formaldehīdam šajā nodaļā ir piešķirta galvenā vieta. Attiecībā uz acetaldehīdu tiek ņemtas vērā tikai sagatavošanas reakcijas. Ketonus skolā īpaši nemāca; tāpēc šeit tiek ņemts tikai viens no tiem pārstāvis - acetons, un eksperimenti ar to tiek doti galvenokārt par ārpusklases pasākumi studenti.
FORMALDEHĪDS (METANĀLS)
Šīs vielas izpētes plānu vēlams veidot tā, lai uzreiz pēc iepazīšanās ar aldehīdu fizikālajām īpašībām studenti pētītu tās iegūšanas metodes, pēc tam ķīmiskās īpašības utt. Nedaudz vairāk agrīna ieviešana ar aldehīda iegūšanas metodēm dos iespēju turpmāk, pētot ķīmiskās īpašības (oksidācijas reakcijas), uzskatīt aldehīdus par saiti ogļūdeņražu oksidācijas ķēdē.
Iepazīstoties ar formaldehīda īpašībām, kā paraugu varat izmantot formaldehīdu. Šajā gadījumā jums nekavējoties jāpārliecinās, ka studenti skaidri saprot atšķirību starp formaldehīdu un formaldehīdu.
Formaldehīda smarža. No formaldehīda fizikālajām īpašībām praksē vispieejamākā ir smarža. Šim nolūkam skolēniem tiek izdalītas mēģenes ar 0,5-1 ml formaldehīda. Kad skolēni ir iepazinušies ar smaržu, formaldehīdu var savākt un izmantot turpmākiem eksperimentiem. Iepazīstoties ar formaldehīda smaržu, studenti varēs noteikt šo vielu citos eksperimentos.
Formaldehīda uzliesmojamība. Karsē formaldehīdu mēģenē un aizdedzina izdalītos tvaikus; tie deg ar gandrīz bezkrāsainu liesmu. Liesmu var redzēt, ja tajā iededzina šķembu vai papīra gabalu. Eksperiments tiek veikts velkmes pārsegā.
Formaldehīda iegūšana. Tā kā formaldehīdu var noteikt tikai pēc smaržas pirms iepazīšanās ar tā ķīmiskajām īpašībām, pirmā pieredze tā iegūšanai būtu jāveic laboratorijas darbu veidā.
1. Mēģenē ielej dažus pilienus metanola. Degļa liesmā neliels vara sieta gabals vai trubiņā velmēta vara stieples spirāle tiek uzkarsēta un ātri nolaista metanolā.
Kalcinējot, varš oksidējas un tiek pārklāts ar melnu vara oksīda pārklājumu; spirtā tas atkal tiek reducēts un kļūst sarkans:

Tiek konstatēta asa aldehīda smaka. Ja oksidēšanas procesu atkārto 2-3 reizes, var iegūt ievērojamu formaldehīda koncentrāciju un šķīdumu var izmantot turpmākajiem eksperimentiem.
2. Formaldehīda iegūšanai papildus vara oksīdam var izmantot arī citus skolēniem pazīstamus oksidētājus.
Demonstrācijas mēģenē vājam kālija permanganāta šķīdumam pievieno 0,5 ml metanola un maisījumu uzkarsē līdz vārīšanās temperatūrai. Parādās formaldehīda smarža, un permanganāta purpursarkanā krāsa pazūd.
Mēģenē ielej 2-3 ml piesātināta kālija dihromāta K 2 Cr 2 O 7 šķīduma un tādu pašu tilpumu koncentrētas sērskābes. Pilienu pa pilienam pievieno metanolu un ļoti uzmanīgi karsē maisījumu (mēģenes atvere ir vērsta uz sāniem!). Pēc tam reakcija turpinās ar siltuma izdalīšanos. Hroma maisījuma dzeltenā krāsa pazūd, un parādās hroma sulfāta zaļā krāsa

Reakcijas vienādojums nav jāapspriež ar skolēniem. Tāpat kā iepriekšējā gadījumā, viņi tiek informēti tikai par to, ka kālija dihromāts oksidē metilspirtu par aldehīdu, tādējādi pārvēršoties par trīsvērtīgo hroma sāli Cr 2 (SO 4) 3.
Formaldehīda reakcija ar sudraba oksīdu(sudraba spoguļa reakcija). Šī pieredze ir jādemonstrē skolēniem tā, lai tā vienlaikus kalpotu kā instrukcija turpmākajai praktiskajai nodarbībai.
Fenola-formaldehīda sveķu sagatavošana. Lielākā daļa rūpniecībā saražotā formaldehīda tiek izmantota fenola formaldehīda un citu plastmasas ražošanai nepieciešamo sveķu sintēzei. Fenola-formaldehīda sveķu ražošanas pamatā ir polikondensācijas reakcija.
Fenola-formaldehīda sveķu sintēze ir vispieejamākā skolas apstākļos. Šajā laikā studenti jau ir iepazinušies ar abām sveķu ražošanas sākotnējām vielām - fenolu un formaldehīdu; eksperiments ir salīdzinoši vienkāršs un norit raiti; procesa ķīmija studentiem nesagādā īpašas grūtības, ja tā ir attēlota šādi:

Atkarībā no fenola un formaldehīda kvantitatīvās attiecības, kā arī no izmantotā katalizatora (skābā vai sārmainā), var iegūt novolaku vai rezola sveķus. Pirmais no tiem ir termoplastisks, un tam ir lineāra struktūra, kas parādīta iepriekš. Otrais ir termoreaktīvs, jo tā lineārās molekulas satur brīvas spirta grupas - CH2OH, kas var reaģēt ar citu molekulu kustīgajiem ūdeņraža atomiem, kā rezultātā veidojas trīsdimensiju struktūra.
ACETALDEHĪDS (ETANĀLS)
Pēc detalizēta formaldehīda īpašību apskata šajā tēmas sadaļā augstākā vērtība apgūt eksperimentus, kas saistīti ar acetaldehīda ražošanu. Šos eksperimentus var veikt ar mērķi: a) parādīt, ka visus aldehīdus var iegūt, oksidējot atbilstošos vienvērtīgos spirtus, b) parādīt, kā eksperimentāli var pamatot aldehīdu struktūru, c) iepazīstināt ar rūpnieciskās metodes ķīmiju. acetaldehīda ražošanai saskaņā ar Kučsrovu.
Acetaldehīda iegūšana, oksidējot etanolu. Vara (II) oksīdu var uzskatīt par spirta oksidētāju. Reakcija norit līdzīgi metanola oksidēšanai:
- 1. Mēģenē ielej ne vairāk kā 0,5 ml etilspirta un iegremdē karstu vara stiepli. Tiek konstatēta augļiem līdzīga acetaldehīda smaka un tiek novērota vara samazināšanās. Ja spirta oksidēšanu veic 2-3 reizes, katru reizi karsējot varu, līdz veidojas vara oksīds, tad, savācot mēģenēs studentu iegūtos šķīdumus, aldehīdu varēs izmantot eksperimentiem ar to. .
- 2. Nelielā kolbā ar izplūdes cauruli ievieto 5 g sasmalcināta kālija dihromāta K2Cr2O7, ielej 20 ml atšķaidītas sērskābes (1:5) un pēc tam 4 ml etilspirta. Kolbai ir pievienots ledusskapis un karsēts uz nelielas liesmas caur azbesta sietu. Tiek ievietots destilāta uztvērējs ledus ūdens vai sniegs. Uztvērējā ielej nedaudz ūdens un ledusskapja galu nolaiž ūdenī. Tas tiek darīts, lai samazinātu acetaldehīda tvaiku iztvaikošanu (viršanas temperatūra 21 ° C). Kopā ar etanālu uztvērējā tiek destilēts noteikts ūdens un nereaģējušā spirta daudzums. etiķskābe un citi reakcijas blakusprodukti. Tomēr nav nepieciešams izolēt tīru acetaldehīdu, jo iegūtais produkts labi reaģē ar parastajām aldehīda reakcijām. Aldehīda klātbūtni nosaka smarža un sudraba spoguļa reakcija.
Skolēnu uzmanība tiek pievērsta krāsas maiņai kolbā. Iegūtā hroma (III) sulfāta Cr 2 (SO 4) 3 zaļā krāsa kļūst īpaši izteikta, ja pēc eksperimenta kolbas saturu atšķaida ar ūdeni. Jāatzīmē, ka kālija bihromāta krāsas maiņa notika spirta oksidēšanās dēļ.
Acetaldehīda iegūšana, hidratējot acetilēnu. Krievu ķīmiķa M.G. Kučerova ievērojamais atklājums - ūdens pievienošana acetilēnam dzīvsudraba sāļu klātbūtnē veidoja pamatu plaši izplatītai rūpnieciskai acetaldehīda iegūšanas metodei.
Neskatoties uz liela nozīme un pieejamība skolai, šī metode ķīmijas stundās tiek demonstrēta reti.
Rūpniecībā process tiek veikts, acetilēnu ievadot ūdenī, kas satur divvērtīgos dzīvsudraba sāļus un sērskābi 70°C temperatūrā. Iegūtais acetaldehīds šajos apstākļos tiek destilēts un kondensēts, pēc tam tas nonāk īpašos torņos oksidēšanai etiķskābē. Acetilēnu iegūst no kalcija karbīda parastajā veidā un attīra no piemaisījumiem.
Nepieciešamība attīrīt acetilēnu un uzturēt temperatūru reakcijas traukā, no vienas puses, un nenoteiktība vēlamā produkta iegūšanai, no otras puses, parasti samazina interesi par šo eksperimentu. Tikmēr eksperimentu var veikt pavisam vienkārši un droši gan vienkāršotā veidā, gan apstākļos, kas tuvojas industriālajiem.
1. Attēlā redzamajā ierīcē var veikt eksperimentu, kas zināmā mērā atspoguļo reakcijas apstākļus ražošanā un ļauj iegūt pietiekami koncentrētu aldehīda šķīdumu. 29.

Pirmais posms ir acetilēna ražošana. Kolbā ievieto kalcija karbīda gabalus un no pilināmās piltuves lēnām pievieno ūdeni vai piesātinātu galda sāls šķīdumu. Piespraušanas ātrums tiek noregulēts tā, lai tiktu izveidota vienmērīga acetilēna plūsma, aptuveni viens burbulis 1-2 sekundēs. Acetilēnu attīra veļas mašīnā ar vara sulfāta šķīdumu:
CuSO 4 + H 2 S H 2 SO 4
Pēc attīrīšanas gāzi ievada kolbā ar katalizatora šķīdumu (15-20 ml ūdens, 6-7 ml koncentrētas sērskābes un apmēram 0,5 g dzīvsudraba (II) oksīda. Kolba, kurā notiek acetilēna hidratācija, tiek uzkarsēts ar degli (spirta lampu), un iegūtais acetaldehīds gāzveida veidā nonāk mēģenēs ar ūdeni, kur tas tiek absorbēts.
Pēc 5-7 minūtēm mēģenē ir iespējams iegūt ievērojamas koncentrācijas etanāla šķīdumu. Lai pabeigtu eksperimentu, vispirms pārtrauciet ūdens padevi kalcija karbīdam, pēc tam atvienojiet ierīci un bez jebkādas papildu aldehīda destilācijas no reakcijas kolbas izmantojiet iegūtos šķīdumus mēģenēs attiecīgajiem eksperimentiem.
2. Visvienkāršākajā veidā M. G. Kučerova reakciju var veikt šādi.
Mazā apaļkolbā ielej 30 ml ūdens un 15 ml konc. sērskābe. Maisījumu atdzesē un tam (lāpstiņas galā) pievieno nedaudz dzīvsudraba (II) oksīda. Uzmanīgi karsējiet maisījumu caur azbesta sietu, līdz tas vārās, un dzīvsudraba oksīds pārvēršas dzīvsudraba (II) sulfātā.
1. iespēja
1. Uzrakstiet reakcijas vienādojumus, ar kuriem var veikt šādas pārvērtības: metāns → hlors-metāns → metanols → formaldehīds → skudrskābe. Norādiet reakcijas apstākļus.
2. Uzrakstiet struktūrformulu vielai ar sastāvu C3H₆O2, ja ir zināms, ka tā ūdens šķīdums maina metiloranža krāsu uz sarkanu; ar hloru šī viela veido savienojumu C3H5ClO2 un karsējot nātrija sāls Etāns veidojas ar nātrija hidroksīdu. Nosauciet vielu. 
3. Aprēķiniet katra produkta vielas masu (gramos) un vielas daudzumu (molos), veicot šādas pārvērtības: brometāns → etanols → etānskābe. Brometāns tika ņemts ar masu 218 g. 
2. iespēja
1. Uzrakstiet reakcijas vienādojumus, ar kuriem var veikt šādas pārvērtības: acetilēns → etilēns → etanols → acetaldehīds → etiķskābe. Norādiet reakcijas apstākļus. 
2. Uzrakstiet struktūrformulu vielai ar sastāvu C₄H₈O, ja ir zināms, ka tā reaģē ar vara (II) hidroksīdu un oksidējoties veidojas 2-metilpropānskābe. Nosauciet šo vielu. 
3. Aprēķiniet katra produkta vielas masu (gramos) un vielas daudzumu (molos) šādu pārvērtību laikā: propāns → 2-hlorpropāns → 2-propanols. Propāns tika ņemts ar masu 22 g. 
3. iespēja
1. Uzrakstiet reakcijas vienādojumus, ar kuriem var veikt šādas pārvērtības: metāns → acetilēns → acetaldehīds → etilspirts → etānskābe. Norādiet reakcijas apstākļus. 
2. Uzrakstiet struktūrformulu vielai ar sastāvu C₅H₁₀O, ja ir zināms, ka tā pievieno ūdeņradi katalizatora klātbūtnē un, karsējot ar svaigi pagatavotu vara (II) hidroksīdu, veidojas sarkanas nogulsnes. Nosauciet šo vielu. 
3. Aprēķiniet katra produkta vielas masu (gramos) un vielas daudzumu (molos) šādu pārvērtību laikā: benzols → hlorbenzols → fenols. Tika ņemts benzols ar masu 156 g. 
4. iespēja
1. Uzrakstiet reakcijas vienādojumus, ar kuriem var veikt šādas pārvērtības: metāns → formaldehīds → metanols → skudrskābe → ogļskābe. Norādiet reakcijas apstākļus. 
2. Uzrakstiet struktūrformulu vielai ar sastāvu C2H₆O2, ja ir zināms, ka tā reaģē ar nātriju, izdalot ūdeņradi, un ar vara (II) hidroksīdu tā veido spilgti zilu vielu. Nosauciet šo vielu. 
3. Aprēķiniet katra produkta vielas masu (gramos) un vielas daudzumu (molos), veicot šādas pārvērtības: hlormetāns → metanols → metanolskābe. Hlormetāns tika ņemts ar masu 202 g. 
Tažibajeva Asemgula Isintajevna
Skolotājs Kamennobrodas vidusskolā
Ķīmijas stunda 11. klasē
Nodarbības tēma: Ģenētiskā saikne starp ogļūdeņražiem, spirtiem, aldehīdiem, spirtiem, karbonskābēm.
Nodarbības veids: zināšanu vispārināšanas nodarbība.
Nodarbības mērķi: konsolidēt, vispārināt un sistematizēt zināšanas par skābekli saturošiem organiskajiem savienojumiem, tostarp pamatojoties uz ģenētiskajām saiknēm starp šo vielu klasēm. Stiprināt spēju prognozēt nepazīstamu organisko vielu ķīmiskās īpašības, pamatojoties uz zināšanām funkcionālās grupas. Attīstīt skolēnos demonstratīvu runu, prasmi lietot ķīmisko terminoloģiju, veikt, novērot un aprakstīt ķīmisko eksperimentu. Izkopt vajadzību pēc zināšanām par vielām, ar kurām saskaramies dzīvē.
Metodes: verbālā, vizuālā, praktiskā, problēmu meklēšana, zināšanu kontrole.
Reaģenti: acetilsalicilskābe(aspirīns), ūdens, dzelzs(III) hlorīds, glikozes šķīdums, universālais indikators, vara(II) sulfāta šķīdums, nātrija hidroksīda šķīdums, olu baltums, etanols, 1-butanols, etiķskābe, stearīnskābe.
Aprīkojums: dators, ekrāns, projektors, galds “Skābekli saturošo organisko vielu klasifikācija”, pavadzīme “Funkcionālā grupa nosaka vielas īpašības”, java un piesta, stikla stienis, spirta lampa, mēģenes turētājs, piltuve, filtrs, glāzes, statīvs ar mēģenēm, pipete, graduēts cilindrs uz 10 ml.
I. Organizatoriskais moments.
Šodien klasē:
1) Stiprināsi spēju prognozēt nepazīstamu organisko vielu ķīmiskās īpašības, balstoties uz zināšanām par funkcionālajām grupām.
2) Jūs uzzināsiet, kādas funkcionālās grupas ir iekļautas slavenākajos pretdrudža medikamentos.
3) Funkcionālās grupas atradīsiet vielā ar saldu garšu, ko izmanto medicīnā kā uzturvielu un asins aizstājēju šķidrumu sastāvdaļa.
4) Jūs redzēsiet, kā jūs varat iegūt tīru sudrabu.
5) Mēs runāsim par fizioloģiskā ietekme etilspirts.
6) Apspriedīsim grūtnieču alkoholisko dzērienu lietošanas sekas.
7) Būsi patīkami pārsteigts: izrādās, ka tu jau zini tik daudz!
II. Studentu iegūto zināšanu atkārtošana un vispārināšana.
1. Skābekli saturošu organisko savienojumu klasifikācija.
Materiāla vispārināšanu sākam ar skābekli saturošu organisko vielu klasifikāciju. Lai to izdarītu, mēs izmantosim tabulu “Skābekli saturošu organisko savienojumu klasifikācija”. Frontālā darba laikā atkārtosim skābekli saturošas funkcionālās grupas.
Organiskajā ķīmijā ir trīs vissvarīgākās funkcionālās grupas, tostarp skābekļa atomi:hidroksilgrupa, karbonilgrupa Unkarboksilgrupa. Pēdējo var uzskatīt par iepriekšējo divu kombināciju. Atkarībā no tā, ar kādiem atomiem vai atomu grupām šīs funkcionālās grupas ir saistītas, skābekli saturošās vielas iedala spirtos, fenolos, aldehīdos, ketonos un karbonskābēs.
Apskatīsim šīs funkcionālās grupas un to ietekmi uz vielu fizikālajām un ķīmiskajām īpašībām.
Videoklipa skatīšanās.
Jūs jau zināt, ka tas nav vienīgais iespējamā zīme klasifikācijas. Molekulā var būt vairākas identiskas funkcionālās grupas, un pievērsiet uzmanību atbilstošajai tabulas rindai.
Nākamā rinda atspoguļo vielu klasifikāciju pēc ar funkcionālo grupu saistītā radikāļu veida. Gribu vērst uzmanību uz to, ka atšķirībā no spirtiem, aldehīdiem, ketoniem un karbonskābēm hidroksiarēni tiek klasificēti atsevišķā savienojumu klasē – fenolos.
Funkcionālo grupu skaits un radikāļu struktūra nosaka vielu vispārējo molekulāro formulu. Šajā tabulā tie ir norādīti tikai ierobežotajiem klašu pārstāvjiem ar vienu funkcionālo grupu.
Visas savienojumu klases, kas “iederas” tabulā, irmonofunkcionāls, i., tiem ir tikai viena skābekli saturoša funkcija.
Lai konsolidētu materiālu par skābekli saturošu vielu klasifikāciju un nomenklatūru, es dodu vairākas savienojumu formulas un aicinu studentus noteikt “savu vietu” dotajā klasifikācijā un dot nosaukumu.
Vārds | Vielu klase | |
Propīnskābe | Nepiesātināta vienbāziska skābe |
|
| Butāndiols-1,4 | Limits, divvērtīgais alkohols |
| 1,3-dihidroksibenzols | Diatomiskais fenols |
| 3-metilbutanāls | Piesātināts aldehīds |
| Butēns-3-viens-2 | Nepiesātināts ketons |
| 2-metilbutanols-2 | Limits, vienvērtīgs spirts |
Saistība starp skābekli saturošu savienojumu uzbūvi un īpašībām.
Funkcionālās grupas raksturs būtiski ietekmē šīs klases vielu fizikālās īpašības un lielā mērā nosaka to ķīmiskās īpašības.
Jēdziens “fizikālās īpašības” ietver vielu agregācijas stāvokli.
Dažādu klašu lineāro savienojumu kopējais stāvoklis:
Alkoholi | Aldehīdi | Karbonskābes | |
1 | un. | G. | un. |
2 | un. | un. | un. |
3 | un. | un. | un. |
4 | un. | un. | un. |
5 | un. | un. | un. |
Homoloģiskā aldehīdu sērija sākas ar gāzveida vielu istabas temperatūrā - formaldehīdu, un starp vienvērtīgajiem spirtiem un karbonskābēm gāzu nav. Ar ko tas ir saistīts?
Spirtu un skābju molekulas ir papildus savienotas viena ar otru ar ūdeņraža saitēm.
Skolotājs lūdz skolēnus formulēt “ūdeņraža saites” definīciju.(šī ir starpmolekulāra saite starp vienas molekulas skābekli un citas molekulas hidroksilūdeņradi) , to izlabo un, ja nepieciešams, diktē rakstīšanai: ķīmiskā saite starp ūdeņraža atomu ar elektronu deficītu un ar elektroniem bagātu elementa atomu ar augstu elektronegativitāti (F , O , N ) tiek sauktsūdeņradis.
Tagad salīdziniet trīs klašu vielu pirmo piecu homologu viršanas punktus (°C).
Alkoholi | Aldehīdi | Karbonskābes | |
1 | +64,7 | -19 | +101 |
2 | +78,3 | +21 | +118 |
3 | +97,2 | +50 | +141 |
4 | +117,7 | +75 | +163 |
5 | +137,8 | +120 | +186 |
Ko jūs varat teikt, apskatot tabulas?
Spirtu un karbonskābju homologajā sērijā nav gāzveida vielu, un vielu viršanas temperatūras ir augstas. Tas ir saistīts ar ūdeņraža saišu klātbūtni starp molekulām. Ūdeņraža saišu ietekmē molekulas kļūst asociētas (it kā šķērssavienotas), tādēļ, lai molekulas atbrīvotos un iegūtu nepastāvību, ir nepieciešams tērēt papildu enerģiju šo saišu pārraušanai.
Ko var teikt par spirtu, aldehīdu un karbonskābju šķīdību ūdenī? (Spirtu - etil, propil, butilskābes un skābju - skudrskābes, etiķskābes, propionskābes, sviestskābes un stearīnskābes šķīdības ūdenī demonstrējums. Parādīts arī skudrskābes aldehīda šķīdums ūdenī.)
Atbildot, tiek izmantota ūdeņraža saišu veidošanās shēma starp skābes un ūdens, spirtu un skābju molekulām.


Jāņem vērā, ka, palielinoties molekulmasai, spirtu un skābju šķīdība ūdenī samazinās. Jo lielāks ir ogļūdeņraža radikālis spirta vai skābes molekulā, jo OH grupai ir grūtāk noturēt molekulu šķīdumā, jo veidojas vājas ūdeņraža saites.
3. Ģenētiskā saistība starp dažādām skābekli saturošo savienojumu klasēm.
Es uz tāfeles uzzīmēju vairāku savienojumu formulas, kas satur vienu oglekļa atomu:
CH 4 → CH 3 OH → HCOH → HCOOH → CO 2
Kāpēc organiskās ķīmijas kursā tos apgūst šādā secībā?
Kā mainās oglekļa atoma oksidācijas pakāpe?
Studenti diktē rindu: -4, -2, 0, +2, +4
Tagad kļūst skaidrs, ka katrs nākamais savienojums ir arvien vairāk oksidēta iepriekšējā forma. No šejienes ir skaidrs, ka ir jāpārvietojas pa ģenētisko sēriju no kreisās uz labo, izmantojot oksidācijas reakcijas, un pretējā virzienā, izmantojot reducēšanas procesus.
Vai ketoni izkrīt no šī “radinieku loka”? Protams, nē. Viņu priekšgājēji ir sekundārie spirti.
Katras vielu klases ķīmiskās īpašības tika detalizēti apspriestas attiecīgajās nodarbībās. Lai apkopotu šo materiālu, es ierosināju kā mājasdarbs uzdevumi par savstarpējām pārvērtībām nedaudz neierastā formā.
1. Savienojums ar molekulāro formuluC 3 H 8 O pakļauts dehidrogenēšanai, kā rezultātā tiek iegūts produkts ar sastāvuC 3 H 6 O . Šī viela tiek pakļauta “sudraba spoguļa” reakcijai, veidojot savienojumuC 3 H 6 O 2 . Pēdējo vielu apstrādājot ar kalcija hidroksīdu, tika iegūta viela, kas tika izmantota kā pārtikas piedevas ar kodu E 282. Tas novērš pelējuma veidošanos maizes izstrādājumos un konditorejas izstrādājumos, kā arī ir atrodams tādos pārtikas produktos kā Šveices siers. Nosakiet piedevas E 282 formulu, uzrakstiet minēto reakciju vienādojumus un nosauciet visas organiskās vielas.
Risinājums :
CH 3 – CH 2 – CH 2 –OH → CH 3 – CH 2 - COH + H 2 ( kaķis. - Cu, 200-300 °C)
CH 3 – CH 2 – COH + Ag 2 O → CH 3 – CH 2 – COOH + 2Ag (vienkāršots vienādojums, sudraba oksīda amonjaka šķīdums)
2CH 3 – CH 2 -COOH+ARa (OH) 2 → (CH 3 – CH 2 - DŪDOT) 2 Ca+2H 2 O.
Atbilde: kalcija propionāts.
2. Sastāva savienojumsC 4 H 8 Cl 2 ar taisnu oglekļa skeletu, kas karsēts ar ūdens šķīdumuNaOH un iegūta organiska viela, kas, oksidējotiesCu(OH) 2 pārvērtās parC 4 H 8 O 2 . Nosakiet sākotnējā savienojuma struktūru.
Risinājums: ja 2 hlora atomi atrodas pie dažādiem oglekļa atomiem, tad apstrādājot ar sārmu mēs iegūtu divvērtīgu spirtu, kas neoksidētuCu(OH) 2 . Ja ķēdes vidū pie viena oglekļa atoma atrastos 2 hlora atomi, tad apstrādājot ar sārmu, tiktu iegūts ketons, kas neoksidējas.Cu(OH) 2. Tad vēlamais savienojums ir1,1-dihlorbutāns.
CH 3 – CH 2 – CH 2 – CHCl 2 + 2NaOH → CH 3 – CH 2 – CH 2 – COH + 2NaCl + H 2 O
CH 3 – CH 2 – CH 2 – COH + 2Cu(OH) 2 → CH 3 – CH 2 – CH 2 – COOH + Cu 2 O+2H 2 O
3. Karsējot ar nātrija hidroksīdu 19,2 g piesātinātās vienvērtīgās skābes nātrija sāls, izveidojās 21,2 g nātrija karbonāta. Nosauciet skābi.
Risinājums:
Sildot, notiek dekarboksilēšana:
R-COONa + NaOH → RH + Na 2 CO 3
υ (Na 2 CO 3 ) = 21,2 / 106 = 0,2 kurmis
υ (R-COONa) = 0,2kurmis
M(R-COONa) = 19,2/0,2 = 96G/ kurmis
M(R-COOH) =M(R-COONa) —M(Na) + M(H) = 96-23+1 = 74G/ kurmis
Saskaņā ar vispārējā formula piesātināto vienbāzisko karbonskābju, lai noteiktu oglekļa atomu skaitu, ir jāatrisina vienādojums:
12n + 2n + 32 = 74
n=3
Atbilde: propionskābe.
Lai nostiprinātu zināšanas par skābekli saturošu organisko vielu ķīmiskajām īpašībām, veiksim testu.
1 variants
Piesātinātajiem vienvērtīgajiem spirtiem atbilst šādas formulas:
A)
CH
2
O
B)
C
4
H
10
O
IN)
C
2
H
6
O
G)
CH
4
O
D)
C
2
H
4
O
2
Tas satur divu principu kombināciju,
Viens no tiem ir spoguļu dzimšana.
Protams, ne pārdomām,
Un izpratnes zinātnei.
...Un meža valstībā viņa tiek atrasta,
Mazie brāļi ir viņas draugi šeit,
Viņu sirdis viņiem ir pilnībā atdotas...
opcijas:
A) pikrīnskābe
B) skudrskābe
B) etiķskābe
D) karboksilgrupa
D) benzoskābe
Etanols reaģē ar vielām:
A)
NaOH
B)
Na
IN)
HCl
G)
CH
3
COOH
D)
FeCl
3
Kvalitatīva reakcija uz fenoliem ir reakcija ar
A)
NaOH
B)
Cu(OH)
2
IN)
CuO
G)
FeCl
3
D)
HNO
3
Etanāls reaģē ar vielām
A) metanols
B) ūdeņradis
B) sudraba oksīda amonjaka šķīdums
D) vara (II) hidroksīds
D) hlorūdeņradis
2. iespēja
Aldehīdus var iegūt
A) alkēnu oksidēšana
B) spirtu oksidēšana
B) alkīnu hidratācija
D) karsējot karbonskābju kalcija sāļus
D) alkēnu hidratācija
Alkoholu funkcionālā grupa ir
A)
COH
B)
Ak!
IN)
COOH
G)
N.H.
2
D)
NĒ
2
2-metilbutanols-2
A) nepiesātinātais alkohols
B) alkohola ierobežošana
B) vienvērtīgais spirts
D) terciārais alkohols
D) aldehīds
Vai jūs novērojāt reakciju?
A) daudzvērtīgajiem spirtiem
B) spirta oksidēšana
B) fenola mijiedarbība ar dzelzs (III) hlorīdu
D) "sudraba spogulis"
D) "vara spogulis"
Etiķskābe reaģē ar vielām
A) ūdeņradis
B) hlors
B) propanols
D) nātrija hidroksīds
D) metanalēms
Skolēni savas atbildes aizpilda tabulā:
A | b | V | G | d | |
1 | + | + | + | ||
2 | + | ||||
3 | + | + | + | ||
4 | + | ||||
5 | + | + | + |
Ja savienojat pareizās atbildes ar nepārtrauktu līniju, jūs saņemat skaitli “5”.
Studentu grupu darbs.
Uzdevums 1. grupai

Mērķi:
Reaģenti un aprīkojums: acetilsalicilskābe (aspirīns), ūdens, dzelzs(III) hlorīds; java un piesta, stikla stienis, spirta lampa, mēģenes turētājs, piltuve, filtrs, glāzes, statīvs ar mēģenēm, pipete, 10 ml mērcilindrs.
1. eksperiments. Pierādījumi par fenola hidroksilgrupas neesamību acetilsalicilskābē (aspirīnā).
Mēģenē ievieto 2-3 acetila graudus salicilskābe, pievieno 1 ml ūdens un enerģiski krata. Iegūtajam šķīdumam pievieno 1-2 pilienus dzelzs(III) hlorīda šķīduma. Ko jūs novērojat? Izdariet secinājumus.
Violeta krāsa neparādās. Tāpēc acetilsalicilskābēNOOS-S 6 N 4 -O-CO-CH 3 nav brīvas fenola grupas, jo šī viela ir esteris, ko veido etiķskābe un salicilskābe.
2. eksperiments. Acetilsalicilskābes hidrolīze.
Sasmalcinātu acetilsalicilskābes tableti ievieto mēģenē un pievieno 10 ml ūdens. Mēģenes saturu uzkarsē līdz vārīšanās temperatūrai un vāra 0,5-1 minūti. Filtrējiet šķīdumu. Pēc tam iegūtajam filtrātam pievieno 1-2 pilienus dzelzs(III) hlorīda šķīduma. Ko jūs novērojat? Izdariet secinājumus.
Pierakstiet reakcijas vienādojumu:

Pabeidziet darbu, aizpildot tabulu, kurā ir šādas ailes: veiktā darbība, reaģents, novērojumi, secinājums.
Parādās purpursarkana krāsa, kas norāda uz salicilskābes izdalīšanos, kas satur brīvu fenola grupu. Kā esteris, acetilsalicilskābe ir viegli hidrolizējama, vārot ar ūdeni.
Uzdevums 2. grupai
1. Apsveriet vielu strukturālās formulas, nosauciet funkcionālās grupas.

2. Veikt laboratorijas darbus"Funkcionālo grupu noteikšana glikozes molekulā".
Mērķi: nostiprināt studentu zināšanas par organisko savienojumu kvalitatīvajām reakcijām, attīstīt prasmes funkcionālo grupu eksperimentālā noteikšanā.
Reaģenti un aprīkojums: risinājums glikoze, universāls indikators, vara (II) sulfāta šķīdums, nātrija hidroksīda šķīdums, spirta lampa, mēģenes turētājs, sērkociņi, 10 ml mērcilindrs.
2.1. Mēģenē ielej 2 ml glikozes šķīduma. Izmantojot universālo indikatoru, izdariet secinājumu par karboksilgrupas esamību vai neesamību.
2.2. Pagatavo vara (II) hidroksīdu: mēģenē ielej 1 ml vara (II) sulfāta un pievieno tai nātrija hidroksīdu. Iegūtajām nogulsnēm pievieno 1 ml glikozes un sakrata. Ko jūs novērojat? Kurām funkcionālajām grupām tas ir raksturīgs? šī reakcija?
2.3. Uzkarsē eksperimentā Nr.2 iegūto maisījumu. Ņemiet vērā izmaiņas. Kurai funkcionālajai grupai šī reakcija ir raksturīga?
2.4. Pabeidziet darbu, aizpildot tabulu, kurā ir šādas ailes: veiktā darbība, reaģents, novērojumi, secinājums.
Demonstrēšanas pieredze. Glikozes šķīduma mijiedarbība ar sudraba oksīda amonjaka šķīdumu.
Darba rezultāti:
- nav karboksilgrupas, jo šķīdumam ir neitrāla reakcija uz indikatoru;
- vara (II) hidroksīda nogulsnes izšķīst un parādās spilgti zila krāsa, kas raksturīga daudzvērtīgajiem spirtiem;
- karsējot šo šķīdumu, izgulsnējas dzeltenas vara (I) hidroksīda nogulsnes, kas pēc turpmākas karsēšanas kļūst sarkanas, norādot uz aldehīda grupas klātbūtni.
Secinājums. Tādējādi glikozes molekula satur karbonilgrupas un vairākas hidroksilgrupas un ir aldehīda spirts.
Uzdevums 3. grupai
Etanola fizioloģiskā iedarbība
1. Kāda ir etanola ietekme uz dzīviem organismiem?
2. Izmantojot uz galda pieejamo aprīkojumu un reaģentus, demonstrējiet etanola ietekmi uz dzīviem organismiem. Komentējiet redzēto.
Pieredzes mērķis: pārliecināt skolēnus, ka alkohols denaturē olbaltumvielas un neatgriezeniski izjauc to struktūru un īpašības.
Aprīkojums un reaģenti: statīvs ar mēģenēm, pipete, 10 ml mērcilindrs, olu baltums, etanols, ūdens.
Eksperimenta gaita: Ielejiet 2 ml olu baltuma 2 mēģenēs. Vienam pievieno 8 ml ūdens, bet otram tādu pašu daudzumu etanola.
Pirmajā mēģenē proteīns izšķīst un organismā labi uzsūcas. Otrajā mēģenē veidojas blīvas baltas nogulsnes - olbaltumvielas nešķīst spirtā, alkohols atņem ūdeni no olbaltumvielām. Rezultātā tiek izjaukta proteīna struktūra un īpašības un tās funkcijas.
3. Pastāstiet par etilspirta ietekmi uz dažādi orgāni un cilvēka orgānu sistēmas.
Izskaidrojiet grūtniecēm alkohola lietošanas sekas.
Studentu priekšnesumi.
Kopš seniem laikiem cilvēks ir pazinis lielu skaitu toksisku vielu, kuras visas atšķiras pēc to ietekmes uz ķermeni. To vidū izceļas viela, kas medicīnā pazīstama kā spēcīga protoplazmas inde – etilspirts. Mirstība no alkoholisma pārsniedz visu izraisīto nāves gadījumu skaitu infekcijas slimības paņemti kopā.
Dedzinot mutes dobuma, rīkles, barības vada gļotādu, tas nokļūst kuņģa-zarnu trakta. Atšķirībā no daudzām citām vielām, alkohols ātri un pilnībā uzsūcas kuņģī. Viegli šķērso bioloģiskās membrānas, aptuveni pēc stundas sasniedz maksimālo koncentrāciju asinīs.
Alkohola molekulas ātri iekļūst bioloģiskajās membrānās asinīs, salīdzinot ar ūdens molekulām. Etilspirta molekulas var viegli šķērsot bioloģiskās membrānas to mazā izmēra, vājās polarizācijas, ūdeņraža saišu veidošanās ar ūdens molekulām un spirta labās šķīdības dēļ taukos.
Alkohols ātri uzsūcas asinīs un labi izšķīst starpšūnu šķidrumā, iekļūst visās ķermeņa šūnās. Zinātnieki noskaidrojuši, ka, izjaucot šūnu funkcijas, tas izraisa to nāvi: izdzerot 100 g alus, iet bojā ap 3000 smadzeņu šūnu, 100 g vīna – 500, 100 g degvīna – 7500, sarkano asins šūnu kontaktā ar alkohola molekulas noved pie asins šūnu koagulācijas.
Aknas neitralizē toksiskas vielas, kas nonāk asinīs. Ārsti šo orgānu sauc par alkohola mērķi, jo tajā tiek neitralizēti 90% etanola. Notiek aknās ķīmiskie procesi etilspirta oksidēšana.
Mēs ar studentiem atceramies alkohola oksidācijas procesa posmus:

Etilspirts oksidējas līdz galīgajiem sadalīšanās produktiem tikai tad, ja etanola patēriņš dienā nepārsniedz 20 g.Ja tiek pārsniegta deva, tad organismā uzkrājas starpprodukti.
Tas izraisa vairākas negatīvas blakusparādības: pastiprināta tauku veidošanās un to uzkrāšanās aknu šūnās; peroksīda savienojumu uzkrāšanās, kas var iznīcināt šūnu membrānas, kā rezultātā šūnu saturs izplūst pa izveidotajām porām; ļoti nevēlamas parādības, kuru kombinācija izraisa aknu iznīcināšanu - cirozi.
Acetaldehīds ir 30 reizes toksiskāks nekā etilspirts. Turklāt dažādu bio ķīmiskās reakcijas audos un orgānos, arī smadzenēs, iespējama tetrahidropapaverolīna veidošanās, kura struktūra un īpašības atgādina labi zināmas psihotropās zāles - morfīnu un kanabinolu. Ārsti ir pierādījuši, ka tieši acetaldehīds izraisa mutācijas un dažādas deformācijas embrijos.
Etiķskābe uzlabo sintēzi taukskābes un izraisa aknu tauku deģenerāciju.
Pētot spirtu fizikālās īpašības, mēs pievērsāmies jautājumam par to toksicitātes izmaiņām homologajā vienvērtīgo spirtu sērijā. Palielinoties vielu molekulu molekulmasai, palielinās to narkotiskās īpašības. Ja salīdzinām etilspirtus un pentilspirtus, pēdējo molekulmasa ir 2 reizes lielāka, un tā toksicitāte ir 20 reizes lielāka. Spirti, kas satur trīs līdz piecus oglekļa atomus, veido tā sauktās fūzu eļļas, kuru klātbūtne alkoholiskajos dzērienos palielina to toksiskās īpašības.
Šajā sērijā izņēmums ir metanols - spēcīgākā inde. Kad organismā nonāk 1-2 tējkarotes, tas tiek ietekmēts redzes nervs, kas noved pie pilnīga akluma, un 30-100 ml patēriņš noved pie letāls iznākums. Bīstamību pastiprina līdzības metilspirts Ar etilspirts pēc īpašībām, izskats, smarža.
Kopā ar skolēniem cenšamies atrast šīs parādības cēloni. Viņi izvirzīja dažādas hipotēzes. Mēs kavējamies pie tā, ka faktori, kas palielina metilspirta toksicitāti, ir molekulu mazais izmērs ( liels ātrums izplatību), kā arī to, ka tā oksidēšanās starpprodukti - skudrskābes aldehīds un skudrskābe - ir spēcīgas indes.
Alkohols, ko neitralizē aknas, un to sadalīšanās toksiskie produkti no jauna nonāk asinsritē un izplatās pa visu organismu, paliekot tajā ilgu laiku. Piemēram, alkohols smadzenēs tiek konstatēts neizmainītā veidā 20 dienas pēc tā lietošanas.
Vēršam skolēnu uzmanību uz to, kā alkohols un tā sadalīšanās produkti tiek izvadīti no organisma.
10% nemainās caur plaušām, nierēm un ādu | ||
90% formā CO 2 Un N 2 PAR caur plaušām un nierēm |
Diemžēl iekšā Nesen Alkohola lietošana, tāpat kā smēķēšana, ir izplatīta sieviešu vidū. Alkohola ietekme uz pēcnācējiem ir divos virzienos.
Pirmkārt, alkohola lietošanu pavada pamatīgas izmaiņas gan vīriešu, gan sieviešu seksuālajā sfērā. Alkohols un tā sadalīšanās produkti var ietekmēt gan sieviešu, gan vīriešu reproduktīvās šūnas jau pirms apaugļošanas – mainās to ģenētiskā informācija (sk. att. “Veseli (1) un patoloģiski (2) spermatozoīdi”).

Ja alkoholu lieto ilgstoši, tiek traucēta reproduktīvās sistēmas darbība, tā sāk ražot defektīvas dzimumšūnas.
Otrkārt, alkohols tieši ietekmē embriju. Pastāvīga 75-80 g degvīna, konjaka vai 120-150 g vājāku alkoholisko dzērienu (alus) lietošana var izraisīt augļa alkohola sindromu. Caur placentu augli apņemošajos ūdeņos nonāk ne tikai alkohols, bet arī tā sadalīšanās produkti, jo īpaši acetaldehīds, kas ir desmit reizes bīstamāks par pašu alkoholu.
Alkohola intoksikācija ir kaitīga ietekme uz augli, jo tā aknās, kurās vispirms nonāk asinis no placentas, vēl nav īpaša enzīma, kas sadala alkoholu, un tas, neitralizēts, izplatās pa visu ķermeni un izraisa neatgriezeniskas izmaiņas. Alkohols ir īpaši bīstams 7-11 grūtniecības nedēļā, kad tie sāk attīstīties iekšējie orgāni. Tas negatīvi ietekmē to attīstību, izraisot traucējumus un izmaiņas. Īpaši tiek ietekmētas smadzenes. Sakarā ar alkohola ietekmi, demenci, epilepsiju, neirozēm, sirds un nieru darbības traucējumi, tiek bojāti ārējie un iekšējie dzimumorgāni.
Dažkārt psihes un intelekta bojājumi tiek novēroti jau agrā bērnībā, bet visbiežāk tie tiek atklāti, bērniem sākot mācīties. Šāds bērns ir intelektuāli novājināts un agresīvs. Alkohols uz bērna organismu iedarbojas daudz spēcīgāk nekā uz pieauguša cilvēka organismu. Īpaši jutīgs un viegli ievainojams nervu sistēma un bērna smadzenes.
Tātad, apskatīsim tabulu “Alkohola ietekme uz bērnu iedzimtību un veselību” un izdarīsim secinājumus .
Dzērāju vecāku ģimenēs | Nedzerošu vecāku ģimenēs | |
Miris pirmajos dzīves mēnešos | 44% | 8% |
Izrādījās nepilnvērtīgs, slims | 39% | 10% |
Vesels fiziski un garīgi | 17% | 82% |
Ilgstoša alkoholisko dzērienu lietošana izraisa garozas mīkstināšanu. Tiek novēroti daudzi precīzi asinsizplūdumi; ierosmes pārraide no viena nervu šūna citam. Neaizmirstiet lakoniskos V.V. Majakovska brīdinājuma vārdus:
Nelietojiet alkoholu.
Tiem, kas to dzer, ir inde, apkārtējiem tā ir spīdzināšana.
Tādējādi esat nostiprinājis spēju prognozēt nepazīstamu organisko vielu ķīmiskās īpašības, balstoties uz zināšanām par funkcionālajām grupām, atkārtojis skābekli saturošu organisko vielu fizikālās un ķīmiskās īpašības un nostiprinājis spēju noteikt organisko savienojumu piederību klasēm. vielām.
III. Mājasdarbs.
1. Veiciet transformācijas:

2. Izpētiet iespējamie iemesli piesārņojums vidi tuvu ražošanai: metanols, fenols, formaldehīds, etiķskābe. Analizēt šo vielu ietekmi uz dabas objektiem: atmosfēru, ūdens avotiem, augsni, augiem, dzīvniekiem un cilvēkiem. Aprakstiet pirmās palīdzības pasākumus saindēšanās gadījumā
Cepkova E.I.,
ķīmijas skolotājs
MAOU "SSOSH Nr. 2"
ķīmija
10. klase
UMK.Ķīmija.10.klase Mācību grāmata vispārējās izglītības organizācijām: pamata
līmenis/G.E.Rudzitiis, F.G.Feldman - 2.izdevums - M.: Izglītība, 2012.g.
Apmācības līmenis ir pamata.
Nodarbības tēma:Piesātināto vienvērtīgo spirtu ģenētiskā saistība ar ogļūdeņražiem.
Kopā tēmas apguvei atvēlētās stundas: 6 stundas.
Nodarbības vieta - 4. nodarbība par tēmu
Nodarbības veids: zināšanu vispārināšanas nodarbība.
Nodarbības mērķi: konsolidēt, vispārināt un sistematizēt zināšanas par skābekli saturošiem organiskajiem savienojumiem, tostarp pamatojoties uz ģenētiskajām saiknēm starp šo vielu klasēm.
Uzdevumi:
izglītojošs: atkārtojiet pamatjēdzienus un jēdzienus par tēmu, nostiprinājiet zināšanas par spirtu sastāvu, struktūru un īpašībām;
attīstot: spēju analizēt, salīdzināt, noteikt savienojumu uzbūvi un īpašības, attīstīt studentu radošās spējas un izziņas interesi par ķīmiju;
izglītojošs: dot Īpaša uzmanība lietas, ko lietojam dzīvē.
Metodes: verbālā, vizuālā, problēmu meklēšana, zināšanu kontrole.
Aprīkojums: dators, ekrāns, projektors, tabula “Skābekli saturošu organisko vielu klasifikācija”, atbalstošais kopsavilkums “Funkcionālā grupa nosaka vielas īpašības”.
Plānotie mācību rezultāti
Priekšmets. Zināt saistību starp vielu sastāvu, struktūru un īpašībām. Prast sniegt piemērus un sastādīt ķīmisko reakciju vienādojumus, kas atklāj
ģenētiskie savienojumi starp spirtiem un ogļūdeņražiem. Praktizējiet spēju veikt aprēķinus, izmantojot ķīmiskie vienādojumi, ja kāds no reaģentiem tiek uzņemts pārāk daudz.
Metasubjekts. Prast organizēt izglītojošu sadarbību un kopīgus pasākumus ar skolotāju un vienaudžiem, strādāt individuāli un grupā (atrast kopīgs lēmums un risina konfliktus, balstoties uz nostāju saskaņošanu un ņemot vērā intereses), formulē, argumentē un aizstāv savu viedokli.
Personīgi. Veidot holistisku pasaules uzskatu, kas atbilst mūsdienu zinātnes attīstības līmenim, balstoties uz priekšstatiem par ģenētisko saistību starp dažādām
organisko vielu klases. Attīstīt komunikācijas kompetenci.
Nodarbību laikā.
I. Organizatoriskais moments.
II. Puiši, šodien nodarbībā risināsim ģenētiskas problēmas, par kurām nostiprināsim tēmu apguvē iegūtās zināšanas.
Ogļūdeņražu īpašības ir atkarīgas no ķīmiskās, telpiskās, elektroniskā struktūra molekulas un ķīmisko saišu būtība.
Ogļūdeņražu struktūras, ķīmisko īpašību un iegūšanas metožu izpēte dažādas grupas parāda, ka viņi visi ir ģenētiski saistīti savā starpā, t.i. Ir iespējama dažu ogļūdeņražu transformācija citos:
Tas ļauj veikt noteiktu savienojumu mērķtiecīgu sintēzi, izmantojot virkni nepieciešamo ķīmisko reakciju (pārvērtību ķēde).
1. uzdevums. Nosauciet starpproduktus transformācijas shēmā:
Etilspirts H 2 SO 4 (k), t X HBr Y Na Z Cr 2 O 3 Al 2 O 3 butadiēns-1,3
Risinājums.Šajā transformāciju ķēdē, ieskaitot 4 reakcijas, no etilspirta AR 2
N 5
VIŅŠ jāiegūst butadiēns-1,3 CH 2
=CH–CH=CH 2
.
1. Karsējot spirtus ar koncentrētu sērskābi
Rodas H 2 SO 4 (ūdeni atdalošs līdzeklis). dehidratācija veidojoties alkēnam. Ūdens izvadīšana no etilspirta noved pie etilēna veidošanās:
2. Etilēns ir alkēnu pārstāvis. Tā kā tas ir nepiesātināts savienojums, tas spēj iesaistīties pievienošanas reakcijās. Rezultātā hidrobromēšana etilēns:
3. Sildot brometānu klātbūtnē nātrija metāls (Wurtz reakcija, veidojas n-butāns (viela Z):
4.Dehidrogenēšana n-butāns katalizatora klātbūtnē ir viena no metodēm butadiēna-1,3 iegūšanai. CH 2
=CH–CH=CH 2
(Sadaļa 5.4. Alkadiēnu sagatavošana).
Atbilde: 
1. Veiciet transformācijas:

Vingrinājumu veikšana zināšanu nostiprināšanai.
Studenti pilda uzdevumus savās darba burtnīcās.
Izmantojot ģenētisko saistību diagrammu, norādiet, no kurām vielām, kuru formulas dotas uzdevumā, vienā posmā var iegūt spirtus? Pierakstiet atbilstošo reakciju vienādojumus. Nosauciet reakcijas izejvielas un produktus. Attiecībā uz sufiksiem ogļūdeņražu un halogenēto ogļūdeņražu nosaukumos, attiecīgi pasvītrojiet saites daudzveidību.
Nosauciet vielu klasi un izveidojiet ģenētiskas attiecības (parādiet to ar bultiņām).
Veiciet transformācijas:
CaC2 → A → B → H3 C-CH2-Cl → B → H3 C-CH2-O-C3H7
CaC 2 + 2H 2 O → HC≡CH + Ca(OH) 2 A
2) HC≡CH + 2H2 → H3 C-CH3B
3) H3C-CH3 + C12 → H3C-CH2-C1 + HC1
4) H3C-CH2-C1 + KOH (ūdens) → H3C-CH2-OH + KS1B
5) H3C-CH2-OH + HO-C3H7 → H3C-CH2-O-C3H7 + H2O
Tagad nedaudz sarežģīsim savu uzdevumu. . Izveidojiet transformāciju ķēdi no piedāvātie savienojumi. Starp vielu formulām ir “papildus”. Kā šis uzdevums ir salīdzināms ar iepriekšējo?
a ) C 6H5- ak, b) C 4H8, c) C 6H5- Br, d) C 5H11-Cl, e) C 6H6, f) C 3H6, g )HC≡CH, h)H2C =CH2i) CH 4 .
CH4 → HC≡CH → C6H6 → C6H5-Br → C6H5-OH
2CH 4 → HC≡CH + 3H 2
3HC≡CH → C6H6
3. C 6 H 6 + Br 2 → C 6 H 5 Br + HBr
4. C6H5-Br + KOH → C6H5-OH + KBr
Ogļūdeņražu īpašību pastiprināšana spēles “Nē-jā” veidā»
1. Vai no etēna var iegūt alkoholu? (Jā)
2. Vai augu lapās ir atrodams etanols? (Nē)
3. Cukurotu vielu raudzēšana rada metanolu? (Nē)
4. No koka skaidas Vai ir iespējams ražot etanolu fermentācijas ceļā? (Nē)
5. Ja sasaldē kartupeļus, vai var dabūt etilspirtu? (Jā)
.Atstarojošais tests:
1. Tas man dzīvē noderēs.
2. Nodarbības laikā bija daudz ko pārdomāt.
3. Saņēmu atbildes uz visiem man radušajiem jautājumiem.
4. Nodarbības laikā strādāju apzinīgi.
Mājasdarbs. Pov.§20-21, transformācijas shēmu vingrinājumi 14,15*,
Veiciet transformācijas:
C2H5OH-C2H5CL-C2H5OH-C2H5OC2H5
CO2
Bibliogrāfija
Ķīmija.Organiskā ķīmija.10.klase: mācību grāmata. vispārējai izglītībai iestādes: pamatlīmenis G.E. Rudzītis, F.G. Feldmanis. – 13. izd.-M.: Izglītība, 2009.g.
Ķīmija 8-11 klase ( tematiskā plānošana pēc G.E.Rudzīša, F.G.Feldmaņa mācību grāmatas) / sast. Breigers L.M.-Volgograda: Skolotājs-AST, 1999
Ķīmija. Liela uzziņu grāmata, lai sagatavotos vienotajam valsts eksāmenam: izglītojoša Rīku komplekts/ Rediģēja V.N. Doronkina. - 2. izdevums, pārskatīts - Rostova n/D: Leģions, 2016.
Surovceva R.P. un citi.Ķīmija.10-11.klases: Metodiskā rokasgrāmata.- M.:Bustards,2000.
Tažibajeva Asemgula Isintajevna
Skolotājs Kamennobrodas vidusskolā
Ķīmijas stunda 11. klasē
Nodarbības tēma: Ģenētiskās attiecības starp ogļūdeņražiem, spirtiem, aldehīdiem, spirtiem, karbonskābēm.
Nodarbības veids: zināšanu vispārināšanas nodarbība.
Nodarbības mērķi: konsolidēt, vispārināt un sistematizēt zināšanas par skābekli saturošiem organiskajiem savienojumiem, tostarp pamatojoties uz ģenētiskajām saiknēm starp šo vielu klasēm. Stiprināt spēju prognozēt nepazīstamu organisko vielu ķīmiskās īpašības, pamatojoties uz zināšanām par funkcionālajām grupām. Attīstīt skolēnos demonstratīvu runu, prasmi lietot ķīmisko terminoloģiju, veikt, novērot un aprakstīt ķīmisko eksperimentu. Izkopt vajadzību pēc zināšanām par vielām, ar kurām saskaramies dzīvē.
Metodes: verbālā, vizuālā, praktiskā, problēmu meklēšana, zināšanu kontrole.
Reaģenti: acetilsalicilskābe (aspirīns), ūdens, dzelzs hlorīds (III), glikozes šķīdums, universālais indikators, vara (II) sulfāta šķīdums, nātrija hidroksīda šķīdums, olu baltums, etanols, 1-butanols, etiķskābe, stearīnskābe.
Aprīkojums: dators, ekrāns, projektors, galds “Skābekli saturošo organisko vielu klasifikācija”, pavadzīme “Funkcionālā grupa nosaka vielas īpašības”, java un piesta, stikla stienis, spirta lampa, mēģenes turētājs, piltuve, filtrs, glāzes, statīvs ar mēģenēm, pipete, graduēts cilindrs uz 10 ml.
I. Organizatoriskais moments.
Šodien klasē:
1) Stiprināsi spēju prognozēt nepazīstamu organisko vielu ķīmiskās īpašības, balstoties uz zināšanām par funkcionālajām grupām.
2) Jūs uzzināsiet, kādas funkcionālās grupas ir iekļautas slavenākajos pretdrudža medikamentos.
3) Funkcionālās grupas atradīsiet saldas garšas vielā, ko medicīnā izmanto kā uzturvielu un asinsaizvietojošo šķidrumu sastāvdaļu.
4) Jūs redzēsiet, kā jūs varat iegūt tīru sudrabu.
5) Mēs runāsim par etilspirta fizioloģisko ietekmi.
6) Apspriedīsim grūtnieču alkoholisko dzērienu lietošanas sekas.
7) Būsi patīkami pārsteigts: izrādās, ka tu jau zini tik daudz!
II. Studentu iegūto zināšanu atkārtošana un vispārināšana.
1. Skābekli saturošu organisko savienojumu klasifikācija.
Materiāla vispārināšanu sākam ar skābekli saturošu organisko vielu klasifikāciju. Lai to izdarītu, mēs izmantosim tabulu “Skābekli saturošu organisko savienojumu klasifikācija”. Frontālā darba laikā atkārtosim skābekli saturošas funkcionālās grupas.
Organiskajā ķīmijā ir trīs vissvarīgākās funkcionālās grupas, tostarp skābekļa atomi:hidroksilgrupa, karbonilgrupa Unkarboksilgrupa. Pēdējo var uzskatīt par iepriekšējo divu kombināciju. Atkarībā no tā, ar kādiem atomiem vai atomu grupām šīs funkcionālās grupas ir saistītas, skābekli saturošās vielas iedala spirtos, fenolos, aldehīdos, ketonos un karbonskābēs.
Apskatīsim šīs funkcionālās grupas un to ietekmi uz vielu fizikālajām un ķīmiskajām īpašībām.
Videoklipa skatīšanās.
Jūs jau zināt, ka šī nav vienīgā iespējamā klasifikācijas zīme. Molekulā var būt vairākas identiskas funkcionālās grupas, un pievērsiet uzmanību atbilstošajai tabulas rindai.
Nākamā rinda atspoguļo vielu klasifikāciju pēc ar funkcionālo grupu saistītā radikāļu veida. Gribu vērst uzmanību uz to, ka atšķirībā no spirtiem, aldehīdiem, ketoniem un karbonskābēm hidroksiarēni tiek klasificēti atsevišķā savienojumu klasē – fenolos.
Funkcionālo grupu skaits un radikāļu struktūra nosaka vielu vispārējo molekulāro formulu. Šajā tabulā tie ir norādīti tikai ierobežotajiem klašu pārstāvjiem ar vienu funkcionālo grupu.
Visas savienojumu klases, kas “iederas” tabulā, irmonofunkcionāls, i., tiem ir tikai viena skābekli saturoša funkcija.
Lai konsolidētu materiālu par skābekli saturošu vielu klasifikāciju un nomenklatūru, es dodu vairākas savienojumu formulas un aicinu studentus noteikt “savu vietu” dotajā klasifikācijā un dot nosaukumu.
formula
Saistība starp skābekli saturošu savienojumu uzbūvi un īpašībām.
Funkcionālās grupas raksturs būtiski ietekmē šīs klases vielu fizikālās īpašības un lielā mērā nosaka to ķīmiskās īpašības.
Jēdziens “fizikālās īpašības” ietver vielu agregācijas stāvokli.
Dažādu klašu lineāro savienojumu kopējais stāvoklis:
Atomu skaits C molekulā
Homoloģiskā aldehīdu sērija sākas ar gāzveida vielu istabas temperatūrā - formaldehīdu, un starp vienvērtīgajiem spirtiem un karbonskābēm gāzu nav. Ar ko tas ir saistīts?
Spirtu un skābju molekulas ir papildus savienotas viena ar otru ar ūdeņraža saitēm.
Skolotājs lūdz skolēnus formulēt “ūdeņraža saites” definīciju. (šī ir starpmolekulāra saite starp vienas molekulas skābekli un citas molekulas hidroksilūdeņradi), to izlabo un, ja nepieciešams, diktē rakstīšanai: ķīmiskā saite starp ūdeņraža atomu ar elektronu deficītu un ar elektroniem bagātu elementa atomu ar augstu elektronegativitāti (F , O , N ) tiek sauktsūdeņradis.
Tagad salīdziniet trīs klašu vielu pirmo piecu homologu viršanas punktus (°C).
Atomu skaits C molekulā
Ko jūs varat teikt, apskatot tabulas?
Spirtu un karbonskābju homologajā sērijā nav gāzveida vielu, un vielu viršanas temperatūras ir augstas. Tas ir saistīts ar ūdeņraža saišu klātbūtni starp molekulām. Ūdeņraža saišu ietekmē molekulas kļūst asociētas (it kā šķērssavienotas), tādēļ, lai molekulas atbrīvotos un iegūtu nepastāvību, ir nepieciešams tērēt papildu enerģiju šo saišu pārraušanai.
Ko var teikt par spirtu, aldehīdu un karbonskābju šķīdību ūdenī? (Spirtu - etil, propil, butilskābes un skābju - skudrskābes, etiķskābes, propionskābes, sviestskābes un stearīnskābes šķīdības ūdenī demonstrējums. Parādīts arī skudrskābes aldehīda šķīdums ūdenī.)
Atbildot, tiek izmantota ūdeņraža saišu veidošanās shēma starp skābes un ūdens, spirtu un skābju molekulām.


Jāņem vērā, ka, palielinoties molekulmasai, spirtu un skābju šķīdība ūdenī samazinās. Jo lielāks ir ogļūdeņraža radikālis spirta vai skābes molekulā, jo OH grupai ir grūtāk noturēt molekulu šķīdumā, jo veidojas vājas ūdeņraža saites.
3. Ģenētiskā saistība starp dažādām skābekli saturošo savienojumu klasēm.
Es uz tāfeles uzzīmēju vairāku savienojumu formulas, kas satur vienu oglekļa atomu:
CH 4 → CH 3 OH → HCOH → HCOOH → CO 2
Kāpēc organiskās ķīmijas kursā tos apgūst šādā secībā?
Kā mainās oglekļa atoma oksidācijas pakāpe?
Studenti diktē rindu: -4, -2, 0, +2, +4
Tagad kļūst skaidrs, ka katrs nākamais savienojums ir arvien vairāk oksidēta iepriekšējā forma. No šejienes ir skaidrs, ka ir jāpārvietojas pa ģenētisko sēriju no kreisās uz labo, izmantojot oksidācijas reakcijas, un pretējā virzienā, izmantojot reducēšanas procesus.
Vai ketoni izkrīt no šī “radinieku loka”? Protams, nē. Viņu priekšgājēji ir sekundārie spirti.
Katras vielu klases ķīmiskās īpašības tika detalizēti apspriestas attiecīgajās nodarbībās. Lai apkopotu šo materiālu, es piedāvāju mājasdarbus par savstarpējām pārvēršanām nedaudz neparastā formā.
1. Savienojums ar molekulāro formuluC 3 H 8 O pakļauts dehidrogenēšanai, kā rezultātā tiek iegūts produkts ar sastāvuC 3 H 6 O . Šī viela tiek pakļauta “sudraba spoguļa” reakcijai, veidojot savienojumuC 3 H 6 O 2 . Pēdējo vielu apstrādājot ar kalcija hidroksīdu, tika iegūta viela, ko izmanto kā pārtikas piedevu ar kodu E 282. Tā novērš pelējuma veidošanos maizes un konditorejas izstrādājumos un turklāt ir atrodama tādos produktos kā Šveices siers. . Nosakiet piedevas E 282 formulu, uzrakstiet minēto reakciju vienādojumus un nosauciet visas organiskās vielas.
Risinājums :
CH 3 – CH 2 – CH 2 –OH → CH 3 – CH 2 - COH + H 2 ( kaķis. - Cu, 200-300 °C)
CH 3 – CH 2 – COH + Ag 2 O → CH 3 – CH 2 – COOH + 2Ag (vienkāršots vienādojums, sudraba oksīda amonjaka šķīdums)
2CH 3 – CH 2 -COOH+ARa (OH) 2 → (CH 3 – CH 2 - DŪDOT) 2 Ca+2H 2 O.
Atbilde: kalcija propionāts.
2. Sastāva savienojumsC 4 H 8 Cl 2 ar taisnu oglekļa skeletu, kas karsēts ar ūdens šķīdumuNaOH un iegūta organiska viela, kas, oksidējotiesCu(OH) 2 pārvērtās parC 4 H 8 O 2 . Nosakiet sākotnējā savienojuma struktūru.
Risinājums: ja 2 hlora atomi atrodas pie dažādiem oglekļa atomiem, tad apstrādājot ar sārmu mēs iegūtu divvērtīgu spirtu, kas neoksidētuCu(OH) 2 . Ja ķēdes vidū pie viena oglekļa atoma atrastos 2 hlora atomi, tad apstrādājot ar sārmu, tiktu iegūts ketons, kas neoksidējas.Cu(OH) 2. Tad vēlamais savienojums ir1,1-dihlorbutāns.
CH 3 – CH 2 – CH 2 – CHCl 2 + 2NaOH → CH 3 – CH 2 – CH 2 – COH + 2NaCl + H 2 O
CH 3 – CH 2 – CH 2 – COH + 2Cu(OH) 2 → CH 3 – CH 2 – CH 2 – COOH + Cu 2 O+2H 2 O
3. Karsējot ar nātrija hidroksīdu 19,2 g piesātinātās vienvērtīgās skābes nātrija sāls, izveidojās 21,2 g nātrija karbonāta. Nosauciet skābi.
Risinājums:
Sildot, notiek dekarboksilēšana:
R-COONa + NaOH → RH + Na 2 CO 3
υ (Na 2 CO 3 ) = 21,2 / 106 = 0,2 kurmis
υ (R-COONa) = 0,2 kurmis
M(R-COONa) = 19,2/0,2 = 96 G/ kurmis
M(R-COOH) = M(R-COONa) —M(Na) + M(H) = 96-23+1 = 74G/ kurmis
Saskaņā ar piesātināto vienbāzisko karbonskābju vispārīgo formulu, lai noteiktu oglekļa atomu skaitu, ir jāatrisina vienādojums:
12n + 2n + 32 = 74
n=3
Atbilde: propionskābe.
Lai nostiprinātu zināšanas par skābekli saturošu organisko vielu ķīmiskajām īpašībām, veiksim testu.
1 variants
Piesātinātajiem vienvērtīgajiem spirtiem atbilst šādas formulas:
A)
CH
2
O
B)
C
4
H
10
O
IN)
C
2
H
6
O
G)
CH
4
O
D)
C
2
H
4
O
2
Tas satur divu principu kombināciju,
Viens no tiem ir spoguļu dzimšana.
Protams, ne pārdomām,
Un izpratnes zinātnei.
...Un meža valstībā viņa tiek atrasta,
Mazie brāļi ir viņas draugi šeit,
Viņu sirdis viņiem ir pilnībā atdotas...
opcijas:
A) pikrīnskābe
B) skudrskābe
B) etiķskābe
D) karboksilgrupa
D) benzoskābe
Etanols reaģē ar vielām:
A)
NaOH
B)
Na
IN)
HCl
G)
CH
3
COOH
D)
FeCl
3
Kvalitatīva reakcija uz fenoliem ir reakcija ar
A)
NaOH
B)
Cu(OH)
2
IN)
CuO
G)
FeCl
3
D)
HNO
3
Etanāls reaģē ar vielām
A) metanols
B) ūdeņradis
B) sudraba oksīda amonjaka šķīdums
D) vara (II) hidroksīds
D) hlorūdeņradis
2. iespēja
Aldehīdus var iegūt
A) alkēnu oksidēšana
B) spirtu oksidēšana
B) alkīnu hidratācija
D) karsējot karbonskābju kalcija sāļus
D) alkēnu hidratācija
Alkoholu funkcionālā grupa ir
A)
COH
B)
Ak!
IN)
COOH
G)
N.H.
2
D)
NĒ
2
2-metilbutanols-2
A) nepiesātinātais alkohols
B) alkohola ierobežošana
B) vienvērtīgais spirts
D) terciārais alkohols
D) aldehīds
Vai jūs novērojāt reakciju?
A) daudzvērtīgajiem spirtiem
B) spirta oksidēšana
B) fenola mijiedarbība ar dzelzs (III) hlorīdu
D) "sudraba spogulis"
D) "vara spogulis"
Etiķskābe reaģē ar vielām
A) ūdeņradis
B) hlors
B) propanols
D) nātrija hidroksīds
D) metanalēms
Skolēni savas atbildes aizpilda tabulā:
1, 2 var.
Ja savienojat pareizās atbildes ar nepārtrauktu līniju, jūs saņemat skaitli “5”.
Studentu grupu darbs.
Uzdevums 1. grupai

Mērķi:
Reaģenti un aprīkojums: acetilsalicilskābe (aspirīns), ūdens, dzelzs(III) hlorīds; java un piesta, stikla stienis, spirta lampa, mēģenes turētājs, piltuve, filtrs, glāzes, statīvs ar mēģenēm, pipete, 10 ml mērcilindrs.
1. eksperiments. Pierādījumi par fenola hidroksilgrupas neesamību acetilsalicilskābē (aspirīnā).
Ievietojiet mēģenē 2-3 acetilsalicilskābes graudus, pievienojiet 1 ml ūdens un enerģiski sakratiet. Iegūtajam šķīdumam pievieno 1-2 pilienus dzelzs(III) hlorīda šķīduma. Ko jūs novērojat? Izdariet secinājumus.
Violeta krāsa neparādās. Tāpēc acetilsalicilskābēNOOS-S 6 N 4 -O-CO-CH 3 nav brīvas fenola grupas, jo šī viela ir esteris, ko veido etiķskābe un salicilskābe.
2. eksperiments. Acetilsalicilskābes hidrolīze.
Sasmalcinātu acetilsalicilskābes tableti ievieto mēģenē un pievieno 10 ml ūdens. Mēģenes saturu uzkarsē līdz vārīšanās temperatūrai un vāra 0,5-1 minūti. Filtrējiet šķīdumu. Pēc tam iegūtajam filtrātam pievieno 1-2 pilienus dzelzs(III) hlorīda šķīduma. Ko jūs novērojat? Izdariet secinājumus.
Pierakstiet reakcijas vienādojumu:

Pabeidziet darbu, aizpildot tabulu, kurā ir šādas ailes: veiktā darbība, reaģents, novērojumi, secinājums.
Parādās purpursarkana krāsa, kas norāda uz salicilskābes izdalīšanos, kas satur brīvu fenola grupu. Kā esteris, acetilsalicilskābe ir viegli hidrolizējama, vārot ar ūdeni.
Uzdevums 2. grupai
1. Apsveriet vielu strukturālās formulas, nosauciet funkcionālās grupas.

2. Veikt laboratorijas darbus"Funkcionālo grupu noteikšana glikozes molekulā".
Mērķi: nostiprināt studentu zināšanas par organisko savienojumu kvalitatīvajām reakcijām, attīstīt prasmes funkcionālo grupu eksperimentālā noteikšanā.
Reaģenti un aprīkojums: risinājums glikoze, universāls indikators, vara (II) sulfāta šķīdums, nātrija hidroksīda šķīdums, spirta lampa, mēģenes turētājs, sērkociņi, 10 ml mērcilindrs.
2.1. Mēģenē ielej 2 ml glikozes šķīduma. Izmantojot universālo indikatoru, izdariet secinājumu par karboksilgrupas esamību vai neesamību.
2.2. Pagatavo vara (II) hidroksīdu: mēģenē ielej 1 ml vara (II) sulfāta un pievieno tai nātrija hidroksīdu. Iegūtajām nogulsnēm pievieno 1 ml glikozes un sakrata. Ko jūs novērojat? Kurām funkcionālajām grupām šī reakcija ir raksturīga?
2.3. Uzkarsē eksperimentā Nr.2 iegūto maisījumu. Ņemiet vērā izmaiņas. Kurai funkcionālajai grupai šī reakcija ir raksturīga?
2.4. Pabeidziet darbu, aizpildot tabulu, kurā ir šādas ailes: veiktā darbība, reaģents, novērojumi, secinājums.
Demonstrēšanas pieredze. Glikozes šķīduma mijiedarbība ar sudraba oksīda amonjaka šķīdumu.
Darba rezultāti:
- nav karboksilgrupas, jo šķīdumam ir neitrāla reakcija uz indikatoru;
- vara (II) hidroksīda nogulsnes izšķīst un parādās spilgti zila krāsa, kas raksturīga daudzvērtīgajiem spirtiem;
- karsējot šo šķīdumu, izgulsnējas dzeltenas vara (I) hidroksīda nogulsnes, kas pēc turpmākas karsēšanas kļūst sarkanas, norādot uz aldehīda grupas klātbūtni.
Secinājums. Tādējādi glikozes molekula satur karbonilgrupas un vairākas hidroksilgrupas un ir aldehīda spirts.
Uzdevums 3. grupai
Etanola fizioloģiskā iedarbība
1. Kāda ir etanola ietekme uz dzīviem organismiem?
2. Izmantojot uz galda pieejamo aprīkojumu un reaģentus, demonstrējiet etanola ietekmi uz dzīviem organismiem. Komentējiet redzēto.
Pieredzes mērķis: pārliecināt skolēnus, ka alkohols denaturē olbaltumvielas un neatgriezeniski izjauc to struktūru un īpašības.
Aprīkojums un reaģenti: statīvs ar mēģenēm, pipete, 10 ml mērcilindrs, olu baltums, etanols, ūdens.
Eksperimenta gaita: Ielejiet 2 ml olu baltuma 2 mēģenēs. Vienam pievieno 8 ml ūdens, bet otram tādu pašu daudzumu etanola.
Pirmajā mēģenē proteīns izšķīst un organismā labi uzsūcas. Otrajā mēģenē veidojas blīvas baltas nogulsnes - olbaltumvielas nešķīst spirtā, alkohols atņem ūdeni no olbaltumvielām. Rezultātā tiek izjaukta proteīna struktūra un īpašības un tās funkcijas.
3. Pastāstiet par etilspirta ietekmi uz dažādiem cilvēka orgāniem un orgānu sistēmām.
Izskaidrojiet grūtniecēm alkohola lietošanas sekas.
Studentu priekšnesumi.
Kopš seniem laikiem cilvēks ir pazinis lielu skaitu toksisku vielu, kuras visas atšķiras pēc to ietekmes uz ķermeni. To vidū izceļas viela, kas medicīnā pazīstama kā spēcīga protoplazmas inde – etilspirts. Mirstība no alkoholisma pārsniedz visu infekcijas slimību izraisīto nāves gadījumu skaitu kopā.
Dedzinot mutes, rīkles un barības vada gļotādu, tas nonāk kuņģa-zarnu traktā. Atšķirībā no daudzām citām vielām, alkohols ātri un pilnībā uzsūcas kuņģī. Viegli šķērso bioloģiskās membrānas, aptuveni pēc stundas sasniedz maksimālo koncentrāciju asinīs.
Alkohola molekulas ātri iekļūst bioloģiskajās membrānās asinīs, salīdzinot ar ūdens molekulām. Etilspirta molekulas var viegli šķērsot bioloģiskās membrānas to mazā izmēra, vājās polarizācijas, ūdeņraža saišu veidošanās ar ūdens molekulām un spirta labās šķīdības dēļ taukos.
Alkohols ātri uzsūcas asinīs un labi izšķīst starpšūnu šķidrumā, iekļūst visās ķermeņa šūnās. Zinātnieki noskaidrojuši, ka, izjaucot šūnu funkcijas, tas izraisa to nāvi: izdzerot 100 g alus, iet bojā ap 3000 smadzeņu šūnu, 100 g vīna – 500, 100 g degvīna – 7500, sarkano asins šūnu kontaktā ar alkohola molekulas noved pie asins šūnu koagulācijas.
Aknas neitralizē toksiskas vielas, kas nonāk asinīs. Ārsti šo orgānu sauc par alkohola mērķi, jo tajā tiek neitralizēti 90% etanola. Etilspirta oksidācijas ķīmiskie procesi notiek aknās.
Mēs ar studentiem atceramies alkohola oksidācijas procesa posmus:

Etilspirts oksidējas līdz galīgajiem sadalīšanās produktiem tikai tad, ja etanola patēriņš dienā nepārsniedz 20 g.Ja tiek pārsniegta deva, tad organismā uzkrājas starpprodukti.
Tas izraisa vairākas negatīvas blakusparādības: pastiprināta tauku veidošanās un to uzkrāšanās aknu šūnās; peroksīdu savienojumu uzkrāšanās, kas var iznīcināt šūnu membrānas, kā rezultātā šūnu saturs izplūst caur izveidotajām porām; ļoti nevēlamas parādības, kuru kombinācija izraisa aknu iznīcināšanu - cirozi.
Acetaldehīds ir 30 reizes toksiskāks nekā etilspirts. Turklāt dažādu bioķīmisko reakciju rezultātā audos un orgānos, tostarp smadzenēs, iespējama tetrahidropapaverolīna veidošanās, kura pēc uzbūves un īpašībām atgādina labi zināmas psihotropās zāles – morfīnu un kanabinolu. Ārsti ir pierādījuši, ka tieši acetaldehīds izraisa mutācijas un dažādas deformācijas embrijos.
Etiķskābe uzlabo taukskābju sintēzi un izraisa aknu tauku deģenerāciju.
Pētot spirtu fizikālās īpašības, mēs pievērsāmies jautājumam par to toksicitātes izmaiņām homologajā vienvērtīgo spirtu sērijā. Palielinoties vielu molekulu molekulmasai, palielinās to narkotiskās īpašības. Ja salīdzinām etilspirtus un pentilspirtus, pēdējo molekulmasa ir 2 reizes lielāka, un tā toksicitāte ir 20 reizes lielāka. Spirti, kas satur trīs līdz piecus oglekļa atomus, veido tā sauktās fūzu eļļas, kuru klātbūtne alkoholiskajos dzērienos palielina to toksiskās īpašības.
Šajā sērijā izņēmums ir metanols - spēcīgākā inde. Kad organismā nonāk 1-2 tējkarotes, tiek ietekmēts redzes nervs, kas noved pie pilnīga akluma, bet 30-100 ml patēriņš noved pie nāves. Bīstamību pastiprina metilspirta līdzība etilspirtam pēc īpašībām, izskata un smaržas.
Kopā ar skolēniem cenšamies atrast šīs parādības cēloni. Viņi izvirzīja dažādas hipotēzes. Pakavējamies pie tā, ka faktori, kas palielina metilspirta toksicitāti, ir molekulu mazais izmērs (liels izkliedes ātrums), kā arī fakts, ka tā oksidācijas starpprodukti – skudrskābes aldehīds un skudrskābe – ir spēcīgi. indes.
Alkohols, ko neitralizē aknas, un to sadalīšanās toksiskie produkti no jauna nonāk asinsritē un izplatās pa visu organismu, paliekot tajā ilgu laiku. Piemēram, alkohols smadzenēs tiek konstatēts neizmainītā veidā 20 dienas pēc tā lietošanas.
Vēršam skolēnu uzmanību uz to, kā alkohols un tā sadalīšanās produkti tiek izvadīti no organisma.
C 2 H 5 Ak!
Diemžēl pēdējā laikā alkohola lietošana, tāpat kā smēķēšana, ir kļuvusi plaši izplatīta sieviešu vidū. Alkohola ietekme uz pēcnācējiem ir divos virzienos.
Pirmkārt, alkohola lietošanu pavada pamatīgas izmaiņas gan vīriešu, gan sieviešu seksuālajā sfērā. Alkohols un tā sadalīšanās produkti var ietekmēt gan sieviešu, gan vīriešu reproduktīvās šūnas jau pirms apaugļošanas – mainās to ģenētiskā informācija (sk. att. “Veseli (1) un patoloģiski (2) spermatozoīdi”).

Ja alkoholu lieto ilgstoši, tiek traucēta reproduktīvās sistēmas darbība, tā sāk ražot defektīvas dzimumšūnas.
Otrkārt, alkohols tieši ietekmē embriju. Pastāvīga 75-80 g degvīna, konjaka vai 120-150 g vājāku alkoholisko dzērienu (alus) lietošana var izraisīt augļa alkohola sindromu. Caur placentu augli apņemošajos ūdeņos nonāk ne tikai alkohols, bet arī tā sadalīšanās produkti, jo īpaši acetaldehīds, kas ir desmit reizes bīstamāks par pašu alkoholu.
Alkohola intoksikācija nelabvēlīgi ietekmē augli, jo tā aknās, kurās vispirms nonāk asinis no placentas, vēl nav īpaša enzīma, kas sadala alkoholu, un tas, neitralizēts, izplatās pa visu ķermeni un izraisa neatgriezeniskas izmaiņas. Alkohols ir īpaši bīstams 7-11 grūtniecības nedēļā, kad sāk attīstīties iekšējie orgāni. Tas negatīvi ietekmē to attīstību, izraisot traucējumus un izmaiņas. Īpaši tiek ietekmētas smadzenes. Alkohola ietekmes dēļ var attīstīties demence, epilepsija, neirozes, sirds un nieru darbības traucējumi, var rasties ārējo un iekšējo dzimumorgānu bojājumi.
Dažkārt psihes un intelekta bojājumi tiek novēroti jau agrā bērnībā, bet visbiežāk tie tiek atklāti, bērniem sākot mācīties. Šāds bērns ir intelektuāli novājināts un agresīvs. Alkohols uz bērna organismu iedarbojas daudz spēcīgāk nekā uz pieauguša cilvēka organismu. Bērna nervu sistēma un smadzenes ir īpaši jutīgas un neaizsargātas.
Tātad, apskatīsim tabulu “Alkohola ietekme uz bērnu iedzimtību un veselību” un izdarīsim secinājumus .
Bērnu likteņi
Ilgstoša alkoholisko dzērienu lietošana izraisa garozas mīkstināšanu. Tiek novēroti daudzi precīzi asinsizplūdumi; tiek traucēta ierosmes pārnešana no vienas nervu šūnas uz otru. Neaizmirstiet lakoniskos V.V. Majakovska brīdinājuma vārdus:
Nelietojiet alkoholu.
Tiem, kas to dzer, ir inde, apkārtējiem tā ir spīdzināšana.
Tādējādi esat nostiprinājis spēju prognozēt nepazīstamu organisko vielu ķīmiskās īpašības, balstoties uz zināšanām par funkcionālajām grupām, atkārtojis skābekli saturošu organisko vielu fizikālās un ķīmiskās īpašības un nostiprinājis spēju noteikt organisko savienojumu piederību klasēm. vielām.
III. Mājasdarbs.
1. Veiciet transformācijas:

2. Izpētīt iespējamos vides piesārņojuma cēloņus ražošanas tuvumā: metanols, fenols, formaldehīds, etiķskābe. Analizēt šo vielu ietekmi uz dabas objektiem: atmosfēru, ūdens avotiem, augsni, augiem, dzīvniekiem un cilvēkiem. Aprakstiet pirmās palīdzības pasākumus saindēšanās gadījumā