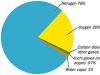
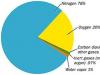
ارسال کار خوب خود در پایگاه دانش ساده است. از فرم زیر استفاده کنید
دانشجویان، دانشجویان تحصیلات تکمیلی، دانشمندان جوانی که از دانش پایه در تحصیل و کار خود استفاده می کنند از شما بسیار سپاسگزار خواهند بود.
نوشته شده در http://allbest.ru
معرفی
تشخیص تشعشع- علم استفاده از تابش برای مطالعه ساختار و عملکرد اندام ها و سیستم های طبیعی و آسیب شناسی انسان به منظور پیشگیری و شناخت بیماری ها.
تمام درمان های مورد استفاده در تشخیص پرتو به دو دسته غیر یونیزه کننده و یونیزه کننده تقسیم می شوند.
تشعشعات غیریونیزان تابش الکترومغناطیسی با فرکانس های مختلف است که باعث یونیزاسیون اتم ها و مولکول ها نمی شود. تجزیه آنها به ذرات باردار مخالف - یونها. اینها شامل تشعشعات حرارتی (مادون قرمز - IR) و تشعشعات رزونانسی است که در یک جسم (بدن انسان) که در یک میدان مغناطیسی پایدار تحت تأثیر پالس های الکترومغناطیسی با فرکانس بالا قرار می گیرد، رخ می دهد. همچنین شامل امواج اولتراسونیک، که ارتعاشات الاستیک محیط هستند.
پرتوهای یونیزان می توانند اتم ها را یونیزه کنند محیطاز جمله اتم هایی که بافت انسان را می سازند. همه این تشعشعات به دو گروه تقسیم می شوند: کوانتومی (یعنی متشکل از فوتون) و جسمی (متشکل از ذرات). این تقسیم تا حد زیادی دلخواه است، زیرا هر تابش دارای ماهیت دوگانه است و تحت شرایط خاص، یا خواص یک موج یا خواص یک ذره را نشان می دهد. تشعشعات یونیزان کوانتومی شامل تابش برمسترالونگ (اشعه ایکس) و تابش گاما است. تابش هسته ای شامل پرتوهای الکترون، پروتون، نوترون، مزون و سایر ذرات است.
برای به دست آوردن یک تصویر متمایز از بافت هایی که تشعشعات را تقریباً یکسان جذب می کنند، از کنتراست مصنوعی استفاده می شود.
دو راه برای کنتراست اندام ها وجود دارد. یکی از آنها ورود مستقیم (مکانیکی) ماده حاجب به داخل حفره اندام - به مری، معده، روده، به مجاری اشکی یا بزاقی، مجاری صفراوی، مجاری ادراری، به داخل حفره رحم، برونش ها، خون و لنفاوی است. عروق یا داخل فضای سلولی، اطراف اندام مورد مطالعه (به عنوان مثال، به بافت خلفی صفاقی که کلیه ها و غدد فوق کلیوی را احاطه کرده است)، یا با سوراخ کردن پارانشیم اندام.
روش دوم کنتراست بر اساس توانایی برخی از اندام ها برای جذب ماده وارد شده به بدن از خون، تغلیظ و ترشح آن است. این اصل - غلظت و حذف - در کنتراست اشعه ایکس سیستم دفع و مجاری صفراوی استفاده می شود.
الزامات اساسی برای مواد رادیو کنتراست واضح است: ایجاد کنتراست تصویر بالا، بی ضرر بودن هنگام وارد شدن به بدن بیمار و حذف سریع از بدن.
مواد حاجب زیر در حال حاضر در عمل رادیولوژی استفاده می شود.
1. آماده سازی سولفات باریم (BaSO4). سوسپانسیون آبی سولفات باریم آماده سازی اصلی برای مطالعه کانال گوارشی است. در آب و شیره های گوارشی نامحلول است و بی ضرر است. به عنوان سوسپانسیون در غلظت 1:1 یا بالاتر - تا 5:1 استفاده می شود. برای دادن خواص اضافی به دارو (کاهش ته نشین شدن ذرات باریم جامد، افزایش چسبندگی به غشای مخاطی)، مواد شیمیایی فعال (تانن، سیترات سدیم، سوربیتول و غیره) به سوسپانسیون آبی اضافه می شود؛ ژلاتین و سلولز غذایی برای افزایش ویسکوزیته اضافه می شود. آماده سازی رسمی آماده از سولفات باریم وجود دارد که تمام الزامات فوق را برآورده می کند.
2. محلول های حاوی ید از ترکیبات آلی. این گروه بزرگی از داروها است که عمدتاً مشتقات اسیدهای معطر خاصی هستند - بنزوئیک، آدیپیک، فنیل پروپیونیک و غیره. این داروها برای متضاد عروق خونی و حفره های قلب استفاده می شوند. این داروها شامل اوروگرافین، ترازوگراف، تریومبراست و غیره است. این داروها توسط سیستم ادراری ترشح می شوند، بنابراین می توان از آنها برای مطالعه مجموعه پیلوکالیسیال کلیه ها، حالب ها استفاده کرد. مثانه. که در اخیرانسل جدیدی از ترکیبات آلی حاوی ید ظاهر شد - ترکیبات غیر یونی (اول مونومرها - Omnipaque، Ultravist، سپس dimers - iodixanol، iotrolan). اسمولاریته آنها به طور قابل توجهی کمتر از اسمولاریته یونی است و به اسمولاریته پلاسمای خون نزدیک می شود (300 من). در نتیجه، سمیت آنها به طور قابل توجهی کمتر از مونومرهای یونی است. تعدادی از داروهای حاوی ید توسط کبد از خون گرفته شده و در صفرا دفع می شوند، بنابراین برای ایجاد کنتراست مجاری صفراوی استفاده می شوند. برای مقابله با کیسه صفرا، از آماده سازی یدید استفاده می شود که در روده جذب می شود (cholevid).
3. روغن های یددار. این فرآورده ها امولسیونی از ترکیبات ید در روغن های گیاهی (هلو، خشخاش) هستند. آنها به عنوان ابزارهای مورد استفاده در مطالعه برونش ها، عروق لنفاوی، حفره رحم و مجاری فیستول محبوبیت پیدا کرده اند.روغن های یددار فوق مایع (لیپویدول) به ویژه خوب هستند که با کنتراست بالا مشخص می شوند و تحریک کمی برای بافت ها دارند. داروهای حاوی ید، به ویژه گروه یونی، می توانند واکنش های آلرژیک ایجاد کرده و اثر سمی بر بدن داشته باشند.
معمول هستند تظاهرات آلرژیکمشاهده شده از پوست و غشاهای مخاطی (التهاب ملتحمه، رینیت، کهیر، تورم غشای مخاطی حنجره، برونش، نای)، قلب سیستم عروقی(نزول کردن فشار خون، فروپاشی)، سیستم عصبی مرکزی (تشنج، گاهی فلج)، کلیه ها (اختلال عملکرد دفعی). این واکنش ها معمولا گذرا هستند، اما می توانند به درجه بالایی از شدت رسیده و حتی منجر به مرگ شوند. در این راستا، قبل از وارد کردن داروهای حاوی ید به خون، به ویژه داروهای دارای اسمولار بالا از گروه یونی، لازم است یک آزمایش بیولوژیکی انجام شود: 1 میلی لیتر از داروی رادیو کنتراست را با دقت به صورت داخل وریدی تزریق کنید و 2 تا 3 دقیقه صبر کنید. نظارت بر وضعیت بیمار تنها در صورت عدم وجود واکنش آلرژیک، دوز اصلی تجویز می شود که در مطالعات مختلف از 20 تا 100 میلی لیتر متغیر است.
4. گازها (اکسید نیتروژن، دی اکسید کربن، هوای معمولی). فقط دی اکسید کربن را می توان برای تزریق در خون به دلیل حلالیت بالا استفاده کرد. هنگامی که در حفره های بدن و فضاهای سلولی تجویز می شود، اکسید نیتروژن نیز برای جلوگیری از آمبولی گاز استفاده می شود. ورود هوای معمولی به مجرای گوارش جایز است.
1. روش های اشعه ایکس
اشعه ایکس در 8 نوامبر 1895 کشف شد. ویلهلم کنراد رونتگن (1845-1923) استاد فیزیک دانشگاه وورزبورگ.
روش اشعه ایکس روشی برای مطالعه ساختار و عملکرد اندام ها و سیستم های مختلف است که بر اساس تجزیه و تحلیل کیفی و/یا کمی پرتو پرتو ایکس که از بدن انسان عبور می کند، می باشد. تابش اشعه ایکس تولید شده در آند لوله اشعه ایکس به سمت بیمار هدایت می شود که در بدن او تا حدی جذب و پراکنده می شود و تا حدی از آن عبور می کند.
اشعه ایکس یکی از انواع امواج الکترومغناطیسی با طول تقریبی 80 تا 10 تا 5 نانومتر است که در طیف موج عمومی بین پرتوهای فرابنفش و پرتوهای - قرار دارد. سرعت انتشار پرتوهای ایکس برابر با سرعت نور 300000 کیلومتر بر ثانیه است.
اشعه ایکس در لحظه برخورد جریانی از الکترون های شتاب گرفته با ماده آند تشکیل می شود. هنگامی که الکترون ها با یک هدف تعامل دارند، 99٪ از انرژی جنبشی آنها به انرژی گرمایی و تنها 1٪ به تابش اشعه ایکس تبدیل می شود. یک لوله اشعه ایکس از یک استوانه شیشه ای تشکیل شده است که در آن 2 الکترود لحیم شده است: یک کاتد و یک آند. هوا از بالون شیشه ای خارج شده است: حرکت الکترون ها از کاتد به آند فقط در شرایط خلاء نسبی امکان پذیر است. کاتد دارای یک رشته است که یک مارپیچ تنگستن محکم پیچ خورده است. هنگامی که جریان الکتریکی به رشته اعمال می شود، انتشار الکترون رخ می دهد، که در آن الکترون ها از رشته جدا شده و یک ابر الکترونی در نزدیکی کاتد تشکیل می دهند. این ابر در فنجان متمرکز کاتد متمرکز شده است که جهت حرکت الکترون را تعیین می کند. فنجان یک فرورفتگی کوچک در کاتد است. آند به نوبه خود حاوی یک صفحه فلزی تنگستن است که الکترون ها روی آن متمرکز می شوند - اینجا جایی است که اشعه ایکس تولید می شود. 2 ترانسفورماتور متصل به لوله الکترونیکی وجود دارد: یک مرحله به پایین و یک پله بالا. یک ترانسفورماتور کاهنده سیم پیچ تنگستن را با ولتاژ پایین (5-15 ولت) گرم می کند و در نتیجه انتشار الکترون ایجاد می کند. ترانسفورماتور استپ آپ یا ولتاژ بالا مستقیماً به کاتد و آند که با ولتاژ 20 تا 140 کیلو ولت عرضه می شوند، قرار می گیرد. هر دو ترانسفورماتور در بلوک ولتاژ بالا دستگاه اشعه ایکس قرار می گیرند که با روغن ترانسفورماتور پر شده است که خنک شدن ترانسفورماتورها و عایق قابل اعتماد آنها را تضمین می کند. پس از اینکه یک ابر الکترونی با استفاده از ترانسفورماتور کاهنده تشکیل شد، ترانسفورماتور افزایش دهنده روشن می شود و ولتاژ ولتاژ بالا به هر دو قطب مدار الکتریکی اعمال می شود: یک پالس مثبت به آند و یک پالس منفی به آند. کاتد الکترون های با بار منفی از کاتد با بار منفی دفع می شوند و به آند با بار مثبت تمایل دارند - به دلیل این اختلاف پتانسیل، سرعت حرکت بالایی حاصل می شود - 100 هزار کیلومتر بر ثانیه. در این سرعت، الکترون ها صفحه تنگستن آند را بمباران می کنند و یک مدار الکتریکی را تکمیل می کنند و در نتیجه اشعه ایکس و انرژی حرارتی ایجاد می شود. تابش اشعه ایکس به دو دسته bremsstrahlung و مشخصه تقسیم می شود. Bremsstrahlung به دلیل کاهش شدید سرعت الکترون های ساطع شده توسط مارپیچ تنگستن رخ می دهد. تشعشع مشخصه در لحظه بازسازی پوسته الکترونیکی اتم ها رخ می دهد. هر دوی این نوع ها در لحظه برخورد الکترون های شتاب گرفته با اتم های ماده آند در لوله اشعه ایکس تشکیل می شوند. طیف گسیل یک لوله اشعه ایکس برهم نهی برمسترالانگ و پرتوهای X مشخصه است.
خواص اشعه ایکس
1. قابلیت نفوذ; اشعه ایکس به دلیل طول موج کوتاه خود می تواند به اجسامی که در برابر نور مرئی غیر قابل نفوذ هستند نفوذ کند.
2. قابلیت جذب و پراکندگی; هنگامی که جذب می شود، بخشی از اشعه ایکس با طولانی ترین طول موج ناپدید می شود و انرژی خود را به طور کامل به ماده منتقل می کند. هنگامی که پراکنده می شود، از جهت اصلی منحرف می شود و اطلاعات مفیدی را حمل نمی کند. برخی از پرتوها با تغییر در خصوصیات خود به طور کامل از جسم عبور می کنند. بنابراین، یک تصویر تشکیل می شود.
3. باعث فلورسانس (درخشش) شود. این پدیده برای ایجاد صفحه های نورانی ویژه به منظور مشاهده بصری تابش اشعه ایکس، گاهی اوقات برای افزایش اثر اشعه ایکس بر روی صفحه عکاسی استفاده می شود.
4. یک اثر فتوشیمیایی داشته باشد. به شما امکان می دهد تصاویر را روی مواد حساس به نور ضبط کنید.
5. باعث یونیزه شدن ماده شود. این ویژگی در دزیمتری برای تعیین کمیت اثر این نوع تابش استفاده می شود.
6. آنها در یک خط مستقیم پخش می شوند، که امکان به دست آوردن یک تصویر اشعه ایکس را که از شکل ماده مورد مطالعه پیروی می کند، فراهم می کند.
7. قابلیت پلاریزاسیون.
8. اشعه ایکس با پراش و تداخل مشخص می شود.
9. نامرئی هستند.
انواع روش های اشعه ایکس.
1. اشعه ایکس (X-ray).
رادیوگرافی روشی برای بررسی اشعه ایکس است که در آن یک تصویر اشعه ایکس ثابت از یک جسم بر روی یک محیط جامد به دست می آید. چنین رسانه هایی می تواند فیلم اشعه ایکس، فیلم عکاسی، آشکارساز دیجیتال و غیره باشد.
رادیوگرافی فیلم یا بر روی یک دستگاه اشعه ایکس جهانی یا بر روی پایه مخصوصی که فقط برای این نوع تحقیقات طراحی شده است انجام می شود. دیواره های داخلی کاست با صفحه های تشدید کننده پوشانده شده است که فیلم اشعه ایکس بین آنها قرار می گیرد.
صفحات تشدید کننده حاوی فسفر هستند که تحت تاثیر تابش اشعه ایکس می درخشد و در نتیجه بر روی فیلم اثر می گذارد و اثر فتوشیمیایی آن را افزایش می دهد. هدف اصلی از تشدید غربالگری ها کاهش قرار گرفتن در معرض و در نتیجه قرار گرفتن در معرض تشعشع برای بیمار است.
بسته به هدف، صفحه های تشدید کننده به استاندارد، دانه ریز (دارای دانه فسفر ریز، خروجی نور کاهش یافته، اما وضوح فضایی بسیار بالا) تقسیم می شوند، که در استخوان شناسی استفاده می شوند، و پرسرعت (با دانه های فسفر بزرگ، خروجی نور بالا، اما وضوح کاهش یافته)، که هنگام انجام تحقیقات در کودکان و اشیاء با حرکت سریع مانند قلب استفاده می شود.
بخشی از بدن که مورد بررسی قرار می گیرد تا حد امکان نزدیک به نوار کاست قرار می گیرد تا اعوجاج طرح ریزی (در اصل بزرگنمایی) که به دلیل ماهیت واگرای پرتو اشعه ایکس رخ می دهد، کاهش یابد. علاوه بر این، این چیدمان وضوح تصویر لازم را فراهم می کند. قطره چکان به گونه ای نصب می شود که پرتو مرکزی از مرکز قسمتی که از بدن خارج می شود عبور کند و عمود بر فیلم باشد. در برخی موارد، به عنوان مثال، هنگام معاینه استخوان تمپورال، از یک موقعیت شیبدار امیتر استفاده می شود.
رادیوگرافی را می توان در وضعیت عمودی، افقی و شیب بیمار و همچنین در حالت جانبی انجام داد. فیلمبرداری در موقعیت های مختلف به ما اجازه می دهد تا در مورد جابجایی اندام ها قضاوت کنیم و برخی از علائم تشخیصی مهم را شناسایی کنیم، مانند انتشار مایع در حفره پلور یا سطح مایع در حلقه های روده.
تکنیک ثبت تابش اشعه ایکس.
طرح 1. شرایط رادیوگرافی معمولی (I) و تله رادیوگرافی (II): 1 - لوله اشعه ایکس. 2 - پرتو اشعه ایکس؛ 3 - موضوع مطالعه. 4 - کاست فیلم.
گرفتن تصویر بر اساس تضعیف تابش اشعه ایکس در هنگام عبور از بافت های مختلف و ثبت بعدی آن بر روی فیلم حساس به اشعه ایکس است. در نتیجه عبور از سازندهای با تراکم و ترکیبات مختلف، پرتو تابش پراکنده و کاهش می یابد و بنابراین تصویری با درجات مختلف شدت بر روی فیلم تشکیل می شود. در نتیجه، فیلم یک تصویر میانگین و جمعبندی از تمام بافتها (سایه) تولید میکند. از این نتیجه می شود که برای به دست آوردن اشعه ایکس کافی، لازم است سازندهای ناهمگن رادیولوژیکی مورد مطالعه قرار گیرند.
تصویری که قسمتی از بدن (سر، لگن و غیره) یا کل اندام (ریه ها، معده) را نشان می دهد، بررسی نامیده می شود. تصاویری که در آنها تصویری از قسمتی از اندام مورد علاقه پزشک به دست میآید که بیشترین سود را برای مطالعه یک جزئیات خاص دارد، هدفمند نامیده میشوند. تصاویر می توانند تک یا سریال باشند. این مجموعه ممکن است شامل 2-3 رادیوگرافی باشد که در آن ایالت های مختلفاندام (به عنوان مثال، پریستالیس معده).
یک عکس اشعه ایکس در رابطه با تصویری که در یک صفحه فلورسنت هنگام نوردهی قابل مشاهده است، یک نگاتیو است. بنابراین، نواحی شفاف در پرتو ایکس تاریک ("تاریک شدن") و مناطق تاریک روشن ("خالص") نامیده می شوند. تصویر اشعه ایکس خلاصه و مسطح است. این شرایط منجر به از بین رفتن تصویر بسیاری از عناصر شی می شود، زیرا تصویر برخی از قسمت ها بر سایه برخی دیگر قرار می گیرد. این منجر به قانون اساسی معاینه اشعه ایکس می شود: معاینه هر قسمت از بدن (ارگان) باید حداقل در دو برجستگی عمود بر هم انجام شود - جلویی و جانبی. علاوه بر آنها، ممکن است به تصاویری در طرح های مایل و محوری (محوری) نیاز باشد.
برای تجزیه و تحلیل تصویر اشعه ایکس، یک تصویر اشعه ایکس بر روی یک دستگاه روشنایی با یک صفحه نمایش روشن - یک نگاتوسکوپ ضبط می شود.
پیش از این، صفحات سلنیوم به عنوان گیرنده های تصویر اشعه ایکس مورد استفاده قرار می گرفتند که قبل از نوردهی بر روی دستگاه های خاصی شارژ می شدند. سپس تصویر به کاغذ تحریر منتقل شد. این روش الکترورادیوگرافی نامیده می شود.
با الکترون اپتیکال رادیوگرافی دیجیتالتصویر اشعه ایکس به دست آمده در دوربین تلویزیون، پس از تقویت، به یک آنالوگ دیجیتال منتقل می شود. تمام سیگنال های الکتریکی حامل اطلاعات مربوط به شی مورد مطالعه به یک سری اعداد تبدیل می شوند. سپس اطلاعات دیجیتال وارد رایانه می شود و در آنجا طبق برنامه های از پیش کامپایل شده پردازش می شود. با استفاده از رایانه، می توانید کیفیت تصویر را بهبود بخشید، کنتراست آن را افزایش دهید، آن را از نویز پاک کنید و جزئیات یا خطوط مورد علاقه پزشک را برجسته کنید.
از مزایای رادیوگرافی دیجیتال می توان به موارد زیر اشاره کرد: کیفیت بالاتصاویر، کاهش قرار گرفتن در معرض تشعشع، توانایی ذخیره تصاویر در رسانه های مغناطیسی با تمام عواقب متعاقب آن: سهولت ذخیره سازی، توانایی ایجاد آرشیوهای سازمان یافته با دسترسی سریع به داده ها و انتقال تصاویر در فواصل دور - هم در داخل بیمارستان و هم در خارج از آن.
معایب رادیوگرافی: وجود اشعه یونیزان که می تواند اثرات مضری بر بیمار داشته باشد. محتوای اطلاعات رادیوگرافی کلاسیک به طور قابل توجهی کمتر از روش های مدرن تصویربرداری پزشکی مانند CT، MRI، و غیره است. تصاویر اشعه ایکس معمولی لایه بندی ساختارهای تشریحی پیچیده را منعکس می کنند، یعنی سایه اشعه ایکس جمع آنها را بر خلاف مجموعه ای از تصاویر لایه به لایه به دست آمده با روش های مدرن توموگرافی. بدون استفاده از مواد حاجب، رادیوگرافی برای تجزیه و تحلیل تغییرات در بافتهای نرم که از نظر تراکم کمی متفاوت هستند (به عنوان مثال، هنگام مطالعه اندامهای شکم) به اندازه کافی آموزنده نیست.
2. فلوروسکوپی (اسکن اشعه ایکس)
فلوروسکوپی روشی برای بررسی اشعه ایکس است که در آن تصویری از یک جسم بر روی یک صفحه نورانی (فلورسنت) به دست می آید. شدت درخشش در هر نقطه از صفحه نمایش متناسب با تعداد کوانتای اشعه ایکس است که به آن برخورد می کند. در سمتی که رو به پزشک است، صفحه نمایش با شیشه سربی پوشانده شده است که از پزشک در برابر قرار گرفتن مستقیم در معرض اشعه ایکس محافظت می کند.
انتقال تلویزیون اشعه ایکس به عنوان یک روش بهبود یافته فلوروسکوپی استفاده می شود. این با استفاده از تشدید کننده تصویر اشعه ایکس (IIA) انجام می شود که شامل مبدل الکترون نوری اشعه ایکس (مبدل الکترون نوری اشعه ایکس) و یک سیستم تلویزیون مدار بسته است.
محدوده اشعه ایکس
REOP یک فلاسک خلاء است که در یک طرف آن یک صفحه فلورسنت اشعه ایکس و در طرف مقابل یک صفحه کاتدولومینسانس وجود دارد. یک میدان شتاب دهنده الکتریکی با اختلاف پتانسیل حدود 25 کیلوولت بین آنها اعمال می شود. تصویر نوری که در حین تابش نور روی صفحه فلورسنت ظاهر می شود، در فوتوکاتد به جریانی از الکترون تبدیل می شود. تحت تأثیر میدان شتاب دهنده و در نتیجه تمرکز (افزایش چگالی شار)، انرژی الکترون ها به طور قابل توجهی افزایش می یابد - چندین هزار بار. با قرار گرفتن بر روی صفحه کاتدولومینسانس، جریان الکترون یک تصویر قابل مشاهده روی آن ایجاد می کند، شبیه به تصویر اصلی، اما بسیار روشن.
این تصویر از طریق سیستمی از آینه ها و لنزها به یک لوله تلویزیونی فرستنده - یک vidicon منتقل می شود. سیگنال های الکتریکی ناشی از آن برای پردازش به واحد کانال تلویزیونی و سپس به صفحه یک دستگاه کنترل ویدیو یا به عبارت ساده تر به صفحه تلویزیون ارسال می شود. در صورت لزوم، می توان تصویر را با استفاده از یک ضبط کننده ویدئو ضبط کرد.
3. فلوروگرافی
فلوروگرافی روشی برای بررسی اشعه ایکس است که شامل عکسبرداری از یک صفحه فلورسنت اشعه ایکس یا صفحه مبدل نوری الکترون بر روی فیلم عکاسی با فرمت کوچک است.
فلوروگرافی یک تصویر کاهش یافته از یک شی را ارائه می دهد. تکنیک های فریم کوچک (مثلاً 24×24 میلی متر یا 35×35 میلی متر) و فریم بزرگ (به ویژه 70×70 میلی متر یا 100×100 میلی متر) وجود دارد. دومی به رادیوگرافی در قابلیت های تشخیصی نزدیک می شود. فلوروگرافی عمدتاً برای بررسی اندام ها استفاده می شود قفسه سینه، غدد پستانی، سیستم اسکلتی.
با متداول ترین روش فلوروگرافی، تصاویر کاهش یافته اشعه ایکس - فلوروگرام - با استفاده از دستگاه مخصوص اشعه ایکس - فلوئوروگراف به دست می آید. این دستگاه دارای صفحه نمایش فلورسنت و مکانیزم حرکت خودکار فیلم رول می باشد. عکاسی تصویر با استفاده از دوربین روی این فیلم رول با اندازه قاب 70X70 یا 100X100 میلی متر انجام می شود.
در فلوروگرام، جزئیات تصویر بهتر از فلوروسکوپی یا انتقال تلویزیون با اشعه ایکس گرفته میشود، اما در مقایسه با رادیوگرافیهای معمولی کمی بدتر (4-5%) ثبت میشود.
برای بررسی های تایید، از فلوروگرافی انواع ثابت و متحرک استفاده می شود. اولین ها در کلینیک ها، واحدهای پزشکی، داروخانه ها و بیمارستان ها قرار می گیرند. فلوئوروگراف های متحرک بر روی شاسی خودرو یا در واگن های راه آهن نصب می شوند. عکسبرداری در هر دو فلوئوروگراف روی فیلم رول انجام می شود که سپس در مخازن ویژه توسعه می یابد. گاستروفلوروگرافی های ویژه ای برای بررسی مری، معده و اثنی عشر ساخته شده است.
فلوروگرام های تمام شده با یک چراغ قوه مخصوص - یک فلوروسکوپ که تصویر را بزرگ می کند بررسی می شود. از جمعیت عمومی افراد مورد بررسی، افرادی انتخاب می شوند که فلوروگرام آنها تغییرات پاتولوژیک را نشان می دهد. آنها فرستاده می شوند معاینه اضافیکه بر روی واحدهای تشخیصی اشعه ایکس با استفاده از تمامی روش های تحقیق اشعه ایکس لازم انجام می شود.
مزایای مهم فلوروگرافی توانایی معاینه تعداد زیادی از افراد در مدت زمان کوتاه (بازده بالا)، مقرون به صرفه بودن، سهولت ذخیره سازی فلوروگرام ها و امکان تشخیص زودهنگام حداقل تغییرات پاتولوژیک در اندام ها است.
استفاده از فلوروگرافی برای شناسایی بیماریهای پنهان ریه، در درجه اول سل و سرطان، مؤثرترین کارآمد بود. فراوانی بررسی های تأیید با در نظر گرفتن سن افراد، ماهیت فعالیت کاری آنها، شرایط اپیدمیولوژیک محلی تعیین می شود.
4. توموگرافی
توموگرافی (از یونانی tomos - لایه) روشی برای بررسی لایه به لایه اشعه ایکس است.
در توموگرافی، به دلیل حرکت لوله اشعه ایکس با سرعت معین در حین عکسبرداری، فیلم تنها از ساختارهایی که در عمق مشخص و از پیش تعیین شده قرار دارند، تصویر واضحی تولید می کند. سایههای اندامها و سازههایی که در عمق کمتر یا بیشتر قرار گرفتهاند، "تار" هستند و با تصویر اصلی همپوشانی ندارند. توموگرافی شناسایی تومورها، نفوذهای التهابی و سایر تشکلات پاتولوژیک را تسهیل می کند.
اثر توموگرافی از طریق حرکت مداوم در طول تصویربرداری از دو جزء از سه جزء سیستم فرستنده اشعه ایکس-بیمار-فیلم به دست می آید. اغلب در حالی که بیمار بی حرکت می ماند، امیتر و فیلم حرکت می کنند. در این حالت، امیتر و فیلم در یک قوس، یک خط مستقیم یا یک مسیر پیچیده تر، اما همیشه در جهت مخالف حرکت می کنند. با چنین حرکتی، تصویر بیشتر جزئیات در تصویر اشعه ایکس نامشخص است، لکه دار است و تصویر فقط از آن تشکیلاتی واضح است که در سطح مرکز چرخش ساطع کننده قرار دارند. سیستم فیلم
از نظر ساختاری، توموگراف ها به شکل پایه های اضافی یا یک دستگاه ویژه برای پایه چرخان جهانی ساخته می شوند. اگر سطح مرکز چرخش سیستم امیتر فیلم را روی توموگراف تغییر دهید، سطح لایه انتخاب شده تغییر می کند. ضخامت لایه انتخاب شده بستگی به دامنه حرکت سیستم فوق دارد: هر چه بزرگتر باشد لایه توموگرافی نازکتر خواهد بود. مقدار معمول این زاویه از 20 تا 50 درجه است. اگر یک زاویه جابجایی بسیار کوچک، به ترتیب 3-5 درجه انتخاب شود، تصویری از یک لایه ضخیم، اساساً یک منطقه کامل، به دست می آید.
انواع توموگرافی
توموگرافی خطی (توموگرافی کلاسیک) روشی برای معاینه اشعه ایکس است که با آن می توانید از لایه ای که در عمق معینی از جسم مورد مطالعه قرار دارد عکس بگیرید. این نوع تحقیق بر اساس حرکت دو جزء از سه جزء (لوله اشعه ایکس، فیلم اشعه ایکس، موضوع مورد مطالعه) است. نزدیکترین سیستم به توموگرافی خطی مدرن توسط Maer پیشنهاد شد؛ او در سال 1914 پیشنهاد حرکت لوله اشعه ایکس را به موازات بدن بیمار داد.
توموگرافی پانورامیک روشی برای معاینه اشعه ایکس است که با استفاده از آن می توانید تصویری از یک لایه منحنی که در عمق مشخصی از جسم مورد مطالعه قرار دارد، بدست آورید.
در پزشکی، توموگرافی پانورامیک برای مطالعه جمجمه صورت، در درجه اول در تشخیص بیماری های سیستم دندانی استفاده می شود. با استفاده از حرکت تابش اشعه ایکس و کاست فیلم در طول مسیرهای خاص، تصویری به شکل یک سطح استوانه ای جدا می شود. این به شما امکان می دهد تصویری را که تمام دندان های بیمار را نشان می دهد، به دست آورید، که برای پروتز ضروری است و برای بیماری پریودنتال، در تروماتولوژی و تعدادی از موارد دیگر مفید است. مطالعات تشخیصی با استفاده از دستگاه های دندانپزشکی پانتوموگرافی انجام می شود.
توموگرافی کامپیوتری یک معاینه لایه به لایه اشعه ایکس است که بر اساس بازسازی کامپیوتری تصویر به دست آمده از اسکن دایره ای یک شی (Pє انگلیسی اسکن - اسکن سریع) با پرتو باریکی از تابش اشعه ایکس است.
دستگاه سی تی
تصاویر توموگرافی کامپیوتری (CT) با استفاده از یک پرتو باریک و چرخان از اشعه ایکس و سیستمی از حسگرها که در دایره ای به نام دروازه ای قرار گرفته اند تولید می شوند. با عبور از بافت، تابش با توجه به چگالی و ترکیب اتمی این بافت ها کاهش می یابد. در سمت دیگر بیمار یک سیستم دایرهای از حسگرهای اشعه ایکس وجود دارد که هر کدام انرژی تشعشع را به سیگنالهای الکتریکی تبدیل میکنند. پس از تقویت، این سیگنال ها به یک کد دیجیتال تبدیل می شوند که در حافظه کامپیوتر ذخیره می شود. سیگنالهای ثبتشده درجه تضعیف پرتو اشعه ایکس را در هر جهت منعکس میکنند.
تابش اشعه ایکس با چرخش در اطراف بیمار، بدن او را از زوایای مختلف، در مجموع 360 درجه مشاهده می کند. با پایان چرخش امیتر، تمام سیگنال های تمام سنسورها در حافظه کامپیوتر ثبت می شود. مدت زمان چرخش امیتر در توموگراف های مدرن بسیار کوتاه است، تنها 1-3 ثانیه، که امکان مطالعه اجسام متحرک را فراهم می کند.
در طول مسیر، تراکم بافت در نواحی جداگانه تعیین می شود که در واحدهای معمولی - واحد هاونسفیلد (HU) اندازه گیری می شود. چگالی آب صفر در نظر گرفته می شود. تراکم استخوان 1000+ HU، تراکم هوا 1000 HU است. تمام بافت های دیگر بدن انسان یک موقعیت متوسط را اشغال می کنند (معمولاً از 0 تا 200-300 HU).
بر خلاف اشعه ایکس معمولی که استخوان ها و ساختارهای حامل هوا (ریه ها) را به بهترین شکل نشان می دهد، توموگرافی کامپیوتری (CT) نیز به وضوح نشان می دهد. پارچه های نرم(مغز، کبد و غیره)، این امر امکان تشخیص بیماری ها را فراهم می کند مراحل اولیهبه عنوان مثال، برای تشخیص تومور در حالی که هنوز کوچک است و قابل درمان جراحی است.
با ظهور توموگرافی مارپیچی و چند مارپیچی، امکان انجام توموگرافی کامپیوتری قلب، رگ های خونی، برونش ها و روده ها فراهم شد.
مزایای توموگرافی کامپیوتری اشعه ایکس (CT):
وضوح بالای بافت H - به شما امکان می دهد تغییر ضریب تضعیف تابش را در 0.5٪ (در رادیوگرافی معمولی - 10-20٪) ارزیابی کنید.
هیچ همپوشانی اندام ها و بافت ها وجود ندارد - هیچ ناحیه بسته ای وجود ندارد.
H به شما امکان می دهد نسبت اندام ها را در ناحیه مورد مطالعه ارزیابی کنید
بسته ای از برنامه های کاربردی برای پردازش تصویر دیجیتالی به دست آمده به شما امکان می دهد اطلاعات بیشتری را به دست آورید.
معایب توموگرافی کامپیوتری (CT):
همیشه خطر کمی برای ابتلا به سرطان در اثر قرار گرفتن در معرض بیش از حد وجود دارد. با این حال، امکان تشخیص دقیق از این حداقل خطر بیشتر است.
هیچ منع مطلقی برای توموگرافی کامپیوتری (CT) وجود ندارد. موارد منع نسبی برای توموگرافی کامپیوتری (CT): بارداری و اوایل دوران کودکی، که با قرار گرفتن در معرض اشعه همراه است.
انواع سی تی اسکن
توموگرافی کامپیوتری اشعه ایکس اسپیرال (SCT).
اصل عملکرد روش.
اسکن اسپیرال شامل چرخاندن لوله اشعه ایکس به صورت مارپیچی و حرکت همزمان میز با بیمار است. CT اسپیرال با سی تی معمولی متفاوت است زیرا سرعت حرکت میز بسته به هدف مطالعه می تواند متفاوت باشد. در سرعت های بالاتر، منطقه اسکن بزرگتر است. این روش زمان عمل را به میزان قابل توجهی کاهش می دهد و قرار گرفتن در معرض تشعشعات بدن بیمار را کاهش می دهد.
اصل عملکرد توموگرافی کامپیوتری مارپیچی بر روی بدن انسان. تصاویر با استفاده از عملیات زیر به دست می آیند: عرض مورد نیاز پرتو اشعه ایکس در رایانه تنظیم می شود. اندام با پرتو اشعه ایکس اسکن می شود. حسگرها پالس ها را می گیرند و آنها را به اطلاعات دیجیتال تبدیل می کنند. اطلاعات توسط کامپیوتر پردازش می شود. کامپیوتر اطلاعات را در قالب یک تصویر روی صفحه نمایش می دهد.
مزایای توموگرافی کامپیوتری مارپیچی افزایش سرعت فرآیند اسکن. این روش منطقه مطالعه را در زمان کوتاه تری افزایش می دهد. کاهش دوز پرتو به بیمار. توانایی به دست آوردن تصویر واضح تر و با کیفیت بالاتر و تشخیص حتی حداقل ترین تغییرات در بافت های بدن. با ظهور توموگراف های نسل جدید، مطالعه مناطق پیچیده قابل دسترسی شده است.
توموگرافی کامپیوتری اسپیرال مغز عروق و تمام اجزای مغز را با دقت دقیق نشان می دهد. همچنین یک دستاورد جدید توانایی مطالعه برونش ها و ریه ها بود.
توموگرافی کامپیوتری چند برشی (MSCT).
در توموگراف های مولتی اسلایس، حسگرهای اشعه ایکس در اطراف کل محیط نصب قرار می گیرند و تصویر در یک چرخش به دست می آید. به لطف این مکانیسم، هیچ نویز وجود ندارد و زمان پروسه نسبت به نوع قبلی کاهش می یابد. این روش هنگام معاینه بیمارانی که نمی توانند برای مدت طولانی بی حرکت بمانند (کودکان کوچک یا بیماران در شرایط بحرانی) راحت است. Multispiral یک نوع بهبود یافته از مارپیچ است. توموگرافی اسپیرال و چند مارپیچ امکان انجام مطالعات عروق خونی، برونش ها، قلب و روده ها را فراهم می کند.
اصل عملیات توموگرافی کامپیوتری چند برش. مزایای روش CT مولتی اسلایس.
H وضوح بالا، اجازه می دهد تا حتی تغییرات جزئی را در جزئیات مشاهده کنید.
H سرعت تحقیق. اسکن از 20 ثانیه تجاوز نمی کند. این روش برای بیمارانی که نمی توانند برای مدت طولانی بی حرکت بمانند و در شرایط بحرانی هستند خوب است.
فرصت های نامحدود برای تحقیق در مورد بیماران در شرایط جدی که نیاز به تماس مداوم با پزشک دارند. توانایی ساخت تصاویر دو بعدی و سه بعدی که به شما امکان می دهد کامل ترین اطلاعات را در مورد اندام های مورد مطالعه به دست آورید.
بدون نویز در حین اسکن به لطف توانایی دستگاه برای تکمیل فرآیند در یک دور.
Ch دوز تابش کاهش یافته است.
سی تی آنژیوگرافی
سی تی آنژیوگرافی مجموعه ای لایه به لایه از تصاویر رگ های خونی را ارائه می دهد. بر اساس داده های به دست آمده، یک مدل سه بعدی از سیستم گردش خون از طریق پس پردازش کامپیوتری با بازسازی سه بعدی ساخته شده است.
5. آنژیوگرافی
آنژیوگرافی روشی برای بررسی رگ های خونی با اشعه ایکس حاجب است. آنژیوگرافی وضعیت عملکردی رگ های خونی، جریان خون مداری و وسعت فرآیند پاتولوژیک را مطالعه می کند.
آنژیوگرافی عروق مغزی.
آرتریوگرام
آرتریوگرافی با سوراخ کردن رگ یا کاتتریزاسیون آن انجام می شود. از سوراخ برای مطالعه شریان های کاروتید، سرخرگ ها و وریدها استفاده می شود اندام های تحتانی، آئورت شکمی و شاخه های بزرگ آن. با این حال، روش اصلی آنژیوگرافی در حال حاضر، البته کاتتریزاسیون رگ است که طبق تکنیک توسعه یافته توسط پزشک سوئدی سلدینگر انجام می شود.
رایج ترین روش کاتتریزاسیون شریان فمورال است.
تمام دستکاری ها در طول آنژیوگرافی تحت کنترل تلویزیون اشعه ایکس انجام می شود. یک ماده حاجب تحت فشار از طریق یک کاتتر به شریان مورد بررسی با استفاده از یک سرنگ خودکار (انژکتور) تزریق می شود. در همان لحظه، تصویربرداری با اشعه ایکس با سرعت بالا آغاز می شود. عکسها بلافاصله توسعه داده میشوند. پس از موفقیت آمیز بودن آزمایش، کاتتر خارج می شود.
شایع ترین عارضه آنژیوگرافی ایجاد هماتوم در ناحیه کاتتریزاسیون است که در آن تورم ظاهر می شود. یک عارضه شدید اما نادر ترومبوآمبولی شریان محیطی است که بروز آن با ایسکمی اندام مشخص می شود.
بسته به هدف و محل تجویز ماده حاجب، آئورتوگرافی، آنژیوگرافی عروق کرونر، آرتریوگرافی کاروتید و مهره، سلیاکوگرافی، مزانتریکوگرافی و غیره متمایز می شوند. برای انجام تمام این انواع آنژیوگرافی، انتهای یک کاتتر رادیوپاک در رگ مورد بررسی قرار داده می شود. ماده حاجب در مویرگ ها تجمع می یابد و باعث می شود که شدت سایه اندام های عرضه شده توسط رگ مورد مطالعه افزایش یابد.
ونوگرافی به روش مستقیم و غیر مستقیم قابل انجام است. در ونوگرافی مستقیم، یک ماده حاجب با رگگیری یا رگگیری وارد خون میشود.
کنتراست غیرمستقیم وریدها به یکی از سه روش انجام می شود: 1) با وارد کردن ماده حاجب به شریان ها که از طریق سیستم مویرگی به سیاهرگ ها می رسد. 2) تزریق ماده حاجب به فضای مغز استخوان که از آن وارد وریدهای مربوطه می شود. 3) با وارد کردن ماده حاجب به پارانشیم اندام با سوراخ کردن، در حالی که تصاویر وریدها را نشان می دهد که خون را از این اندام تخلیه می کنند. تعدادی نشانه خاص برای ونوگرافی وجود دارد: ترومبوفلبیت مزمن، ترومبوآمبولی، تغییرات پس از ترومبوفلبیتیک در وریدها، مشکوک به رشد غیر طبیعی تنه وریدی، اختلالات مختلف جریان خون وریدی، از جمله به دلیل نارسایی دستگاه دریچه ای وریدها، زخم ها. از وریدها، شرایط پس از مداخلات جراحی روی وریدها.
یک روش جدید برای بررسی رگ های خونی با اشعه ایکس، آنژیوگرافی تفریق دیجیتال (DSA) است. این بر اساس اصل تفریق (تفریق) رایانه ای از دو تصویر ثبت شده در حافظه رایانه است - تصاویر قبل و بعد از وارد کردن ماده کنتراست به رگ. در اینجا، تصویری از رگها را از تصویر کلی قسمتی از بدن که مورد مطالعه قرار میگیرد، اضافه کنید، به ویژه، سایههای مزاحم بافتهای نرم و اسکلت را حذف کنید و همودینامیک را به صورت کمی ارزیابی کنید. از ماده حاجب رادیواپاک کمتری استفاده می شود، بنابراین می توان با رقت زیاد ماده حاجب، تصاویری از رگ ها به دست آورد. این بدان معناست که میتوان ماده حاجب را به صورت داخل وریدی تزریق کرد و سایهای از شریانها را روی مجموعهای از تصاویر بعدی بدون استفاده از کاتتریزاسیون به دست آورد.
برای انجام لنفوگرافی، ماده حاجب مستقیماً به لومن رگ لنفاوی تزریق می شود. این کلینیک در حال حاضر عمدتاً لنفوگرافی اندام تحتانی، لگن و خلف صفاق را انجام می دهد. یک ماده کنتراست - یک امولسیون روغن مایع از یک ترکیب یدید - به داخل رگ تزریق می شود. اشعه ایکس از عروق لنفاوی بعد از 15-20 دقیقه و اشعه ایکس از غدد لنفاوی - پس از 24 ساعت گرفته می شود.
روش تحقیق رادیونوکلید
روش رادیونوکلئیدی روشی برای مطالعه وضعیت عملکردی و مورفولوژیکی اندام ها و سیستم ها با استفاده از رادیونوکلئیدها و شاخص هایی است که با آنها برچسب گذاری شده است. این شاخص ها - که رادیوداروها (RP) نامیده می شوند - به بدن بیمار وارد می شوند و سپس با استفاده از ابزارهای مختلف، سرعت و ماهیت حرکت، تثبیت و حذف آنها از اندام ها و بافت ها مشخص می شود.
علاوه بر این می توان از قطعات بافت، خون و ترشحات بیمار برای رادیومتری استفاده کرد. علیرغم معرفی مقادیر ناچیز شاخص (صدم ها و هزارم میکروگرم) که بر روند طبیعی فرآیندهای زندگی تأثیر نمی گذارد، این روش از حساسیت بسیار بالایی برخوردار است.
هنگام انتخاب یک رادیودارو برای تحقیق، پزشک قبل از هر چیز باید جهت گیری فیزیولوژیکی و فارماکودینامیک آن را در نظر بگیرد. در نظر گرفتن خواص فیزیکی هسته ای رادیونوکلئید موجود در ترکیب آن ضروری است. برای به دست آوردن تصاویر اندام ها، فقط از رادیونوکلئیدهایی استفاده می شود که پرتوهای Y یا پرتوهای x مشخصه ساطع می کنند، زیرا این تشعشعات را می توان با تشخیص خارجی ثبت کرد. هر چه کوانتوم های گاما یا کوانتوم های اشعه ایکس در طی واپاشی رادیواکتیو بیشتر تشکیل شوند، یک رادیوداروی معین از نظر تشخیصی مؤثرتر است. در عین حال، رادیونوکلئید باید تا حد ممکن تابش جسمی کمتری منتشر کند - الکترون هایی که در بدن بیمار جذب می شوند و در گرفتن تصاویر اندام ها شرکت نمی کنند. رادیونوکلئیدهایی که نیمه عمر آنها چند ده روز است طولانی مدت، چند روز - متوسط، چند ساعت - کوتاه مدت، چند دقیقه - فوق العاده کوتاه مدت در نظر گرفته می شوند. راه های مختلفی برای به دست آوردن رادیونوکلئیدها وجود دارد. برخی از آنها در راکتورها و برخی در شتاب دهنده ها تشکیل می شوند. با این حال، رایج ترین روش برای به دست آوردن رادیونوکلئیدها، ژنراتور است. تولید پرتوزا به طور مستقیم در آزمایشگاه تشخیص رادیونوکلئید با استفاده از ژنراتور.
یک پارامتر بسیار مهم یک رادیونوکلئید، انرژی کوانتوم تابش الکترومغناطیسی است. کوانتومی از انرژی های بسیار کم در بافت ها حفظ می شود و بنابراین به آشکارساز یک دستگاه رادیومتریک نمی رسد. کوانتومی از انرژی های بسیار بالا تا حدی از آشکارساز عبور می کند، بنابراین راندمان ثبت آنها نیز کم است. محدوده بهینه انرژی کوانتومی در تشخیص رادیونوکلئید 70-200 کو در نظر گرفته می شود.
تمام مطالعات تشخیصی رادیونوکلئید به دو گروه بزرگ تقسیم می شوند: مطالعاتی که در آنها رادیوداروها به بدن بیمار وارد می شوند - مطالعات in vivo، و مطالعات خون، قطعات بافت و ترشحات بیمار - مطالعات آزمایشگاهی.
SCINTIGRAPHY کبد - در حالت های ایستا و پویا انجام می شود. در حالت استاتیک، فعالیت عملکردی سلول های سیستم رتیکولواندوتلیال (RES) کبد تعیین می شود، در حالت پویا - وضعیت عملکردی سیستم کبدی صفراوی. دو گروه از رادیوداروها (RPs) استفاده می شود: برای مطالعه RES کبد - محلول های کلوئیدی بر اساس 99mTc. برای مطالعه ترکیب کبد صفراوی مبتنی بر اسید ایمیدودیاستیک 99mTc-HIDA، مزید.
هپاتوسینتیوگرافی تکنیکی برای تجسم کبد با استفاده از روش اسکن بر روی دوربین گاما به منظور تعیین فعالیت عملکردی و میزان عملکرد پارانشیم هنگام استفاده از رادیوداروهای کلوئیدی است. کلوئید 99mTc به صورت داخل وریدی با فعالیت 2 MBq/kg تجویز می شود. این تکنیک به شما امکان می دهد فعالیت عملکردی سلول های رتیکولواندوتلیال را تعیین کنید. مکانیسم تجمع رادیوداروها در چنین سلول هایی فاگوسیتوز است. هپاتوسینتی گرافی 0.5-1 ساعت پس از تجویز رادیودارو انجام می شود. هپاتوسنتی گرافی مسطح در سه برجستگی استاندارد قدامی، خلفی و جانبی راست انجام می شود.
این تکنیکی برای تجسم کبد با استفاده از روش سینتی گرافی روی دوربین گاما برای تعیین فعالیت عملکردی سلولهای کبدی و سیستم صفراوی با استفاده از یک رادیودارو مبتنی بر اسید ایمیدودیاستیک است.
هپاتوبیلیستیک گرافی
99mTc-HIDA (mesida) به صورت داخل وریدی با فعالیت 0.5 MBq/kg پس از خوابیدن بیمار تجویز می شود. بیمار به پشت زیر ردیاب دوربین گاما دراز می کشد که تا حد امکان نزدیک به سطح شکم تعبیه شده است تا کل کبد و بخشی از روده در میدان دید آن قرار گیرد. مطالعه بلافاصله پس از تجویز داخل وریدی رادیودارو شروع می شود و 60 دقیقه طول می کشد. همزمان با معرفی رادیوداروها، سیستم های ضبط فعال می شوند. در دقیقه 30 مطالعه به بیمار یک صبحانه کلرتیک (2 زرده مرغ خام) داده می شود. سلول های کبدی طبیعی به سرعت دارو را از خون گرفته و با صفرا دفع می کنند. مکانیسم تجمع رادیوداروها انتقال فعال است. عبور رادیودارو از طریق سلولهای کبدی معمولاً 2-3 دقیقه طول می کشد. اولین قسمت های آن پس از 10-12 دقیقه در مجرای صفراوی مشترک ظاهر می شود. در 2-5 دقیقه، سینتیگرام مجرای کبدی و صفراوی مشترک و بعد از 2-3 دقیقه - کیسه صفرا را نشان می دهد. حداکثر رادیواکتیویته روی کبد معمولاً تقریباً 12 دقیقه پس از تجویز رادیودارو ثبت می شود. در این زمان، منحنی رادیواکتیویته به حداکثر خود می رسد. سپس شخصیت یک فلات را به خود می گیرد: در این دوره، میزان جذب و حذف رادیوداروها تقریباً متعادل است. همانطور که رادیودارو در صفرا دفع می شود، رادیواکتیویته کبد کاهش می یابد (50٪ در 30 دقیقه)، و شدت تابش بالای کیسه صفرا افزایش می یابد. اما رادیوداروهای بسیار کمی در روده ها آزاد می شوند. برای القای تخلیه کیسه صفرا و ارزیابی باز بودن مجاری صفراوی، به بیمار صبحانه کلرتیک داده می شود. پس از این، تصویر کیسه صفرا به تدریج کاهش می یابد و افزایش رادیواکتیویته در بالای روده ها ثبت می شود.
بررسی رادیوایزوتوپ کلیه ها و مجاری ادراری رادیو ایزوتوپی اسکن کبد صفراوی.
این شامل ارزیابی عملکرد کلیه است، بر اساس یک تصویر بصری و تجزیه و تحلیل کمی از تجمع و دفع رادیوداروها توسط پارانشیم کلیه ترشح شده توسط اپیتلیوم لوله ای (Hippuran-131I، Technemag-99mTc) انجام می شود یا توسط دستگاه فیلتر می شود. گلومرول کلیه (DTPA-99mTc).
سینتی گرافی دینامیک کلیه
تکنیکی برای تجسم کلیه ها و مجاری ادراری با استفاده از روش سینتی گرافی روی دوربین گاما به منظور تعیین پارامترهای تجمع و حذف رادیوداروهای نفروتروپیک از طریق مکانیسم های حذف لوله ای و گلومرولی. رنوسنتی گرافی دینامیک مزایای تکنیک های ساده تر را ترکیب می کند و به دلیل استفاده از سیستم های کامپیوتری برای پردازش داده های به دست آمده از قابلیت های بیشتری برخوردار است.
اسکن کلیه
برای تعیین ویژگی های آناتومیکی و توپوگرافی کلیه ها، محلی سازی ضایعه و میزان روند پاتولوژیک در آنها استفاده می شود. بر اساس تجمع انتخابی 99mTc - سیتون (200 MBq) توسط پارانشیم کلیه با عملکرد طبیعی. زمانی که مشکوک به فرآیند حجمی در کلیه ناشی از تومور بدخیم، کیست، حفره و غیره باشد، برای شناسایی ناهنجاری های مادرزادی کلیه، انتخاب میزان مداخله جراحی و ارزیابی قابلیت حیات کلیه پیوندی استفاده می شود.
رنوگرافی ایزوتوپی
این بر اساس ثبت خارجی تابش g در ناحیه کلیه از 131I - هیپوران داخل وریدی (0.3-0.4 MBq) است که به طور انتخابی توسط کلیه ها گرفته و دفع می شود. در صورت وجود سندرم ادراری (هماچوری، لکوسیتوری، پروتئینوری، باکتریوری و غیره)، درد در ناحیه کمر، پاسوزیته یا تورم روی صورت، پاها، آسیب کلیه و غیره. امکان ارزیابی جداگانه برای هر کلیه از سرعت را فراهم می کند. و شدت عملکرد ترشحی و دفعی، باز بودن مجرای ادرار را تعیین می کند و با پاکسازی خون - وجود یا عدم وجود نارسایی کلیه.
مطالعه رادیوایزوتوپ قلب، سینتی گرافی میوکارد.
این روش مبتنی بر ارزیابی توزیع یک رادیوداروی تزریقی داخل وریدی در عضله قلب است که متناسب با جریان خون کرونر و فعالیت متابولیکی میوکارد در قلبهای دست نخورده ترکیب میشود. بنابراین، توزیع رادیودارو در میوکارد وضعیت جریان خون کرونر را منعکس می کند. مناطقی از میوکارد با خون رسانی طبیعی یک تصویر ایجاد می کنند توزیع یکنواخترادیودارو مناطقی از میوکارد با جریان خون کرونری محدود به دلایل مختلف به عنوان مناطقی با کاهش جذب رادیو ردیاب، یعنی نقص پرفیوژن تعریف می شوند.
این روش مبتنی بر توانایی ترکیبات فسفات نشاندار شده با رادیونوکلئید (مونوفسفات ها، دی فسفونات ها، پیروفسفات) در متابولیسم مواد معدنی و تجمع در ماتریکس آلی (کلاژن) و بخش معدنی (هیدروکسی لاپاتیت) است. بافت استخوانی. توزیع رادیوفسفات ها متناسب با جریان خون و شدت متابولیسم کلسیم است. تشخیص تغییرات پاتولوژیک در بافت استخوانی بر اساس تجسم کانون های هیپرفیکساسیون یا، به طور معمول، نقص در تجمع ترکیبات استئوتروپیک نشاندار در اسکلت است.
5. مطالعه رادیوایزوتوپ سیستم غدد درون ریز، سینتی گرافی غده تیروئید
این روش مبتنی بر تجسم بافت عملکرد تیروئید (از جمله محل غیرطبیعی) با استفاده از رادیوداروها (Na131I، تکنسیوم پرتکنتات) است که جذب میشوند. سلول های اپیتلیالغده تیروئید در مسیر جذب غیر آلی ید. شدت گنجاندن ردیاب های رادیونوکلئید در بافت غده، فعالیت عملکردی آن و همچنین بخش های جداگانه پارانشیم آن (گره های "گرم" و "سرد") را مشخص می کند.
سینتی گرافی غدد پاراتیروئید
تجسم سینتی گرافی غدد پاراتیروئیدی که از نظر پاتولوژیک تغییر یافته اند بر اساس تجمع رادیوداروهای تشخیصی در بافت آنها است که دارای افزایش تروپیسم برای سلول های تومور هستند. تشخیص بزرگ شدن غدد پاراتیروئید با مقایسه تصاویر سینتی گرافی به دست آمده با حداکثر تجمع رادیودارو در غده تیروئید (مرحله تیروئید مطالعه) و با حداقل محتوای آن در غده تیروئید با حداکثر تجمع در غدد پاراتیروئیدی با تغییر پاتولوژیک (پاراتیروئید) انجام می شود. مرحله مطالعه).
اسکن سینه (ماموسینتی گرافی)
تشخیص نئوپلاسم های بدخیم غدد پستانی با یک تصویر بصری از توزیع رادیوداروهای تشخیصی در بافت غده انجام می شود که به دلیل افزایش نفوذپذیری سد هیستوهماتیک در ترکیب با تراکم سلولی بالاتر، جهت سلول های تومور افزایش یافته است. و عروق و جریان خون بالاتر، در مقایسه با بافت پستان بدون تغییر. ویژگی های متابولیسم بافت تومور - افزایش فعالیت غشا Na+-K+ ATPase. بیان آنتی ژن ها و گیرنده های خاص در سطح سلول تومور. افزایش سنتز پروتئین در سلول سرطانی در طول تکثیر در تومور. پدیده های انحطاط و آسیب سلولی در بافت سرطان پستان که به ویژه محتوای Ca2+ آزاد، محصولات آسیب به سلول های تومور و مواد بین سلولی بیشتر است.
حساسیت و ویژگی بالای ماموسسینتی گرافی ارزش اخباری بالای نتیجه گیری منفی این روش را تعیین می کند. آن ها عدم تجمع رادیودارو در غدد پستانی مورد مطالعه نشان دهنده عدم وجود بافت تکثیر شونده زنده تومور در آنها است. در این راستا، با توجه به ادبیات جهانی، بسیاری از نویسندگان انجام مطالعه پنچری بر روی بیمار را در غیاب تجمع 99mTc-Technetril در یک تشکیل پاتولوژیک "مشکوک" ندولار کافی می دانند، بلکه فقط برای مشاهده پویایی شرایط برای 4-6 ماه.
مطالعه رادیوایزوتوپ سیستم تنفسی
سینتی گرافی پرفیوژن ریه
اصل روش مبتنی بر تجسم بستر مویرگی ریه ها با استفاده از ماکروآگرگات های آلبومین نشاندار شده با تکنسیوم (MAA) است، که وقتی به صورت داخل وریدی تجویز می شود، قسمت کوچکی از مویرگ های ریه را آمبولیزه می کند و متناسب با جریان خون توزیع می شود. ذرات MAA به پارانشیم ریه نفوذ نمی کنند (بینابینی یا آلوئولی)، اما به طور موقت جریان خون مویرگی را مسدود می کنند، در حالی که 1:10000 از مویرگ های ریوی آمبولیزه می شوند، که همودینامیک و تهویه ریوی را تحت تاثیر قرار نمی دهد. آمبولیزاسیون 5-8 ساعت طول می کشد.
تهویه ریه ها با آئروسل
این روش مبتنی بر استنشاق ذرات معلق بهدستآمده از رادیوداروها (RPs) است که به سرعت از بدن حذف میشوند (اغلب محلول 99m-Technetium DTPA). توزیع رادیوداروها در ریه ها متناسب با تهویه ریوی منطقه ای است؛ افزایش تجمع موضعی رادیوداروها در مناطق تلاطم مشاهده می شود. جریان هوا. استفاده از توموگرافی کامپیوتری تابشی (ECT) این امکان را فراهم می کند که بخش برونکوپولمونری آسیب دیده را بومی سازی کند، که به طور متوسط دقت تشخیصی را 1.5 برابر افزایش می دهد.
نفوذپذیری غشای آلوئولی
این روش بر اساس تعیین ترخیص کالا از گمرک یک محلول رادیودارویی (RP) 99m-Technetium DTPA از کل ریه یا یک بخش برونکوپولمونری جدا شده پس از تهویه آئروسل است. سرعت حذف رادیوداروها با نفوذپذیری اپیتلیوم ریوی نسبت مستقیم دارد. این روش غیر تهاجمی است و انجام آن آسان است.
تشخیص رادیونوکلئید در شرایط آزمایشگاهی (از لاتین vitrum - شیشه، زیرا تمام مطالعات در لوله های آزمایش انجام می شود) به میکروآنالیز اشاره دارد و یک موقعیت مرزی بین رادیولوژی و بیوشیمی بالینی را اشغال می کند. اصل روش رادیوایمونولوژیک، اتصال رقابتی مواد نشاندار شده پایدار و مشابه با یک سیستم ادراکی خاص است.
سیستم اتصال (اغلب اینها آنتی بادی های خاص یا آنتی سرم هستند) به طور همزمان با دو آنتی ژن تعامل می کند که یکی از آنها مورد نظر است و دیگری آنالوگ نشاندار شده آن است. محلول هایی استفاده می شود که همیشه حاوی آنتی ژن نشاندار بیشتری نسبت به آنتی بادی ها هستند. در این مورد، یک مبارزه واقعی بین آنتی ژن های نشاندار و بدون برچسب برای اتصال با آنتی بادی ها رخ می دهد.
تجزیه و تحلیل رادیونوکلئید در شرایط آزمایشگاهی رادیو ایمونولوژیک نامیده می شود، زیرا بر اساس استفاده از واکنش های آنتی ژن-آنتی بادی ایمونولوژیک است. بنابراین، اگر یک آنتی بادی به جای آنتی ژن به عنوان ماده نشاندار استفاده شود، آنالیز را ایمونورادیومتریک می نامند. اگر گیرنده های بافتی به عنوان سیستم اتصال در نظر گرفته شوند، می گویند آنالیز orradioreceptor.
تحقیقات رادیونوکلئید در شرایط آزمایشگاهی شامل 4 مرحله است:
1. مرحله اول مخلوط کردن نمونه بیولوژیکی در حال تجزیه و تحلیل با واکنشگرهای کیت حاوی آنتی سرم (آنتی بادی) و یک سیستم اتصال است. تمام دستکاری ها با محلول ها با میکروپیپت های نیمه اتوماتیک ویژه انجام می شود؛ در برخی از آزمایشگاه ها با استفاده از ماشین های اتوماتیک انجام می شود.
2. مرحله دوم انکوباسیون مخلوط است. تا رسیدن به تعادل پویا ادامه می یابد: بسته به ویژگی آنتی ژن، مدت زمان آن از چند دقیقه تا چند ساعت و حتی روزها متغیر است.
3. مرحله سوم جداسازی مواد رادیواکتیو آزاد و محدود است. برای این منظور از جاذب های موجود در کیت (رزین های تبادل یونی، کربن و غیره) استفاده می شود که کمپلکس های آنتی ژن-آنتی بادی سنگین تری را رسوب می دهند.
4. مرحله چهارم رادیومتری نمونه ها، ساخت منحنی های کالیبراسیون، تعیین غلظت ماده مورد نظر است. تمام این کارها به صورت خودکار با استفاده از رادیومتر مجهز به ریزپردازنده و دستگاه چاپ انجام می شود.
روش های تحقیق سونوگرافی
معاینه اولتراسوند (اولتراسوند) یک روش تشخیصی مبتنی بر اصل بازتاب امواج مافوق صوت (اکولوکاسیون) است که از یک حسگر ویژه - منبع اولتراسوند - در محدوده فرکانس سونوگرافی مگاهرتز (MHz) به بافت ها منتقل می شود، از سطوح با نفوذپذیری متفاوت برای اولتراسونیک. امواج . درجه نفوذپذیری بستگی به تراکم و خاصیت ارتجاعی بافت دارد.
امواج اولتراسونیک ارتعاشات الاستیک یک محیط با فرکانس بالاتر از محدوده صداهای قابل شنیدن برای انسان - بالای 20 کیلوهرتز است. حد بالایی فرکانس های اولتراسونیک را می توان 1 تا 10 گیگاهرتز در نظر گرفت. امواج اولتراسوند پرتوهای غیریونیزان هستند و در محدوده مورد استفاده در تشخیص، اثرات بیولوژیکی قابل توجهی ایجاد نمی کنند.
برای تولید سونوگرافی از دستگاه هایی به نام امیتر اولتراسوند استفاده می شود. گسترده ترین آنها قطره چکان های الکترومکانیکی بر اساس پدیده اثر پیزوالکتریک معکوس هستند. اثر پیزوالکتریک معکوس شامل تغییر شکل مکانیکی اجسام تحت تأثیر میدان الکتریکی است. بخش اصلی چنین قطره چکانی صفحه یا میله ای است که از ماده ای با خواص پیزوالکتریک کاملاً مشخص (کوارتز، نمک روشل، مواد سرامیکی بر پایه تیتانات باریم و غیره) ساخته شده است. الکترودها به صورت لایه های رسانا بر روی سطح صفحه اعمال می شوند. اگر یک ولتاژ الکتریکی متناوب از یک ژنراتور به الکترودها اعمال شود، صفحه، به لطف اثر پیزوالکتریک معکوس، شروع به ارتعاش می کند و یک موج مکانیکی با فرکانس مربوطه منتشر می کند.
اسناد مشابه
تشخیص اشعه ایکس روشی برای مطالعه ساختار و عملکرد اندام ها و سیستم های انسان است. روش های تحقیق: فلوروگرافی، دیجیتال و الکترورادیوگرافی، فلوروسکوپی، توموگرافی کامپیوتری. اثر شیمیایی اشعه ایکس
چکیده، اضافه شده در 2011/01/23
روشهای تشخیصی مبتنی بر ثبت تابش ایزوتوپهای رادیواکتیو و ترکیبات نشاندار. طبقه بندی انواع توموگرافی. اصول استفاده از رادیوداروها در تشخیص مطالعه رادیوایزوتوپی یورودینامیک کلیه
راهنمای آموزشی، اضافه شده در 12/09/2010
محاسبه قدرت یک امیتر اولتراسونیک، که امکان ثبت مطمئن مرزهای بافت های بیولوژیکی را فراهم می کند. قدرت جریان آند و بزرگی ولتاژ اشعه ایکس در لوله الکترونی کولیج. یافتن میزان پوسیدگی تالیم
تست، اضافه شده در 06/09/2012
اصل به دست آوردن تصویر اولتراسوند، روش های ثبت و بایگانی آن. علائم تغییرات پاتولوژیک در سونوگرافی. تکنیک اولتراسوند. کاربردهای بالینی تصویربرداری رزونانس مغناطیسی دستگاه های تشخیص رادیونوکلئید، ضبط.
ارائه، اضافه شده در 2016/09/08
معرفی اشعه ایکس به عمل پزشکی. روشهای تشخیص رادیولوژیک سل: فلوروگرافی، فلوروسکوپی و رادیوگرافی، طولی، رزونانس مغناطیسی و توموگرافی کامپیوتری، سونوگرافی و روشهای رادیونوکلئیدی.
چکیده، اضافه شده در 1390/06/15
روش های ابزاری تشخیص پزشکی برای معاینات اشعه ایکس، آندوسکوپی و سونوگرافی. ماهیت و توسعه روش ها و روش های تحقیق برای انجام آنها. قوانین آماده سازی بزرگسالان و کودکان برای روش معاینه.
چکیده، اضافه شده در 1394/02/18
تعیین نیاز و ارزش تشخیصی روشهای تحقیق رادیولوژی. ویژگی های رادیوگرافی، توموگرافی، فلوروسکوپی، فلوروگرافی. ویژگی های خاص روش های آندوسکوپیتحقیق در مورد بیماری های اندام های داخلی
ارائه، اضافه شده در 2016/03/09
انواع معاینه اشعه ایکس. الگوریتمی برای توصیف ریه های سالم، نمونه هایی از تصاویر ریه های مبتلا به ذات الریه. اصل توموگرافی کامپیوتری. کاربرد آندوسکوپی در پزشکی روش انجام فیبروگاسترودئودنوسکوپی، نشانه هایی برای استفاده از آن.
ارائه، اضافه شده در 2016/02/28
بیوگرافی و فعالیت علمی V.K. رونتگن، تاریخچه کشف اشعه ایکس. مشخصات و مقایسه دو روش اصلی در تشخیص پزشکی اشعه ایکس: فلوروسکوپی و رادیوگرافی. معاینه اندام دستگاه گوارشو ریه ها
چکیده، اضافه شده در 1392/03/10
بخش های اصلی تشخیص تشعشع. پیشرفت فنی در رادیولوژی تشخیصی کنتراست مصنوعی اصل به دست آوردن یک تصویر اشعه ایکس و همچنین یک صفحه مقطعی در طول توموگرافی. تکنیک تحقیق سونوگرافی
2.1. تشخیص اشعه ایکس
(رادیولوژی)
تقریباً همه مؤسسات پزشکی به طور گسترده از دستگاه های معاینه اشعه ایکس استفاده می کنند. نصب اشعه ایکس ساده، قابل اعتماد و مقرون به صرفه است. این سیستم ها هستند که همچنان به عنوان مبنایی برای تشخیص آسیب های اسکلتی، بیماری های ریه، کلیه ها و مجرای گوارشی عمل می کنند. علاوه بر این، روش اشعه ایکس نقش مهمی در انجام اقدامات مداخله ای مختلف (اعم از تشخیصی و درمانی) دارد.
2.1.1. مشخصات مختصر تابش اشعه ایکس
تابش اشعه ایکس امواج الکترومغناطیسی است (جریان کوانتوم، فوتون) که انرژی آن در مقیاس انرژی بین تابش فرابنفش و تابش گاما قرار دارد (شکل 2-1). فوتون های پرتو ایکس دارای انرژی از 100 eV تا 250 کو هستند که مربوط به تابش با فرکانس 3×10 16 هرتز تا 6×10 19 هرتز و طول موج 0.005-10 نانومتر است. طیف الکترومغناطیسی اشعه ایکس و تابش گاما تا حد زیادی با هم همپوشانی دارند.
برنج. 2-1.مقیاس تابش الکترومغناطیسی
تفاوت اصلی این دو نوع تشعشع در نحوه تولید آنهاست. پرتوهای ایکس با مشارکت الکترون ها تولید می شوند (مثلاً وقتی جریان آنها کند می شود) و پرتوهای گاما در طی واپاشی رادیواکتیو هسته های عناصر خاص تولید می شوند.
پرتوهای ایکس می توانند با کاهش سرعت جریان ذرات باردار تولید شوند (به اصطلاح bremsstrahlung) یا زمانی که انتقال انرژی بالا در لایه های الکترونی اتم ها اتفاق می افتد (تابش مشخصه). دستگاه های پزشکی از لوله های اشعه ایکس برای تولید اشعه ایکس استفاده می کنند (شکل 2-2). اجزای اصلی آنها یک کاتد و یک آند عظیم است. الکترونهایی که به دلیل اختلاف پتانسیل الکتریکی بین آند و کاتد گسیل میشوند، شتاب میگیرند، به آند میرسند و در برخورد با ماده، سرعت آنها کاهش مییابد. در نتیجه، bremsstrahlung اشعه ایکس رخ می دهد. در هنگام برخورد الکترون ها با آند، فرآیند دوم نیز رخ می دهد - الکترون ها از لایه های الکترونی اتم های آند خارج می شوند. مکان آنها توسط الکترون های دیگر لایه های اتم گرفته شده است. در طی این فرآیند، نوع دوم تابش اشعه ایکس تولید می شود - به اصطلاح تابش پرتو ایکس مشخصه، که طیف آن تا حد زیادی به مواد آند بستگی دارد. آندها اغلب از مولیبدن یا تنگستن ساخته می شوند. دستگاه های خاصی برای فوکوس و فیلتر کردن اشعه ایکس برای بهبود تصاویر به دست آمده در دسترس هستند.

برنج. 2-2.نمودار دستگاه تیوب اشعه ایکس:
1 - آند؛ 2 - کاتد; 3 - ولتاژ وارد شده به لوله; 4 - تابش اشعه ایکس
خواص اشعه ایکس که کاربرد آنها را در پزشکی تعیین می کند، توانایی نفوذ، اثرات فلورسنت و فتوشیمیایی است. قابلیت نفوذ اشعه ایکس و جذب آن توسط بافت های بدن انسان و مواد مصنوعی از مهمترین ویژگی هایی است که کاربرد آنها را در تشخیص تشعشع تعیین می کند. هر چه طول موج کوتاهتر باشد، قدرت نفوذ اشعه ایکس بیشتر است.
پرتوهای ایکس "نرم" با انرژی و فرکانس تابش کم (با توجه به طولانی ترین طول موج) و پرتوهای "سخت" با انرژی فوتون و فرکانس تابش بالا و طول موج کوتاه وجود دارد. طول موج تابش اشعه ایکس (بر این اساس، "سختی" و توانایی نفوذ آن) به ولتاژ اعمال شده به لوله اشعه ایکس بستگی دارد. هر چه ولتاژ روی لوله بیشتر باشد، سرعت و انرژی جریان الکترون بیشتر و طول موج اشعه ایکس کوتاهتر می شود.
هنگامی که تابش اشعه ایکس که از یک ماده نفوذ می کند، برهمکنش می کند، تغییرات کمی و کیفی در آن رخ می دهد. درجه جذب اشعه ایکس توسط بافت ها متفاوت است و با چگالی و وزن اتمی عناصر تشکیل دهنده جسم تعیین می شود. هر چه چگالی و وزن اتمی ماده تشکیل دهنده جسم (ارگان) مورد مطالعه بیشتر باشد، اشعه ایکس بیشتری جذب می شود. بدن انسان دارای بافتها و اندامهایی با تراکمهای مختلف (ریهها، استخوانها، بافتهای نرم و غیره) است، این موضوع جذب متفاوت اشعه ایکس را توضیح میدهد. تجسم اندام ها و ساختارهای داخلی بر اساس تفاوت های مصنوعی یا طبیعی در جذب اشعه ایکس توسط اندام ها و بافت های مختلف است.
برای ثبت تشعشع عبوری از یک جسم، از توانایی آن در ایجاد فلورسانس برخی ترکیبات و تأثیر فتوشیمیایی بر روی فیلم استفاده می شود. برای این منظور از صفحه نمایش های مخصوص فلوروسکوپی و فیلم های عکاسی برای رادیوگرافی استفاده می شود. در دستگاه های اشعه ایکس مدرن، از سیستم های ویژه آشکارسازهای الکترونیکی دیجیتال - پانل های الکترونیکی دیجیتال - برای ثبت تشعشعات ضعیف استفاده می شود. در این حالت روش های اشعه ایکس دیجیتال نامیده می شوند.
با توجه به اثرات بیولوژیکی اشعه ایکس، محافظت از بیماران در هنگام معاینه ضروری است. این محقق می شود
کوتاه ترین زمان قرار گرفتن در معرض ممکن، جایگزینی فلوروسکوپی با رادیوگرافی، استفاده کاملا موجه از روش های یونیزاسیون، محافظت از طریق محافظت از بیمار و پرسنل در برابر اشعه.
2.1.2. رادیوگرافی و فلوروسکوپی
فلوروسکوپی و رادیوگرافی روش های اصلی معاینه اشعه ایکس هستند. تعدادی دستگاه و روش ویژه برای مطالعه اندام ها و بافت های مختلف ایجاد شده است (شکل 2-3). رادیوگرافی هنوز به طور گسترده ای در این زمینه استفاده می شود عمل بالینی. فلوروسکوپی به دلیل دوز نسبتاً بالای تابش کمتر مورد استفاده قرار می گیرد. آنها مجبورند به فلوروسکوپی متوسل شوند که رادیوگرافی یا روش های غیر یونیزه کننده برای به دست آوردن اطلاعات کافی نیست. در ارتباط با پیشرفت سی تی، نقش توموگرافی لایه به برش کلاسیک کاهش یافته است. تکنیک توموگرافی لایه ای برای مطالعه ریه ها، کلیه ها و استخوان ها در جایی که اتاق سی تی وجود ندارد استفاده می شود.
اشعه ایکس (یونانی) scopeo- بررسی، مشاهده) - مطالعه ای که در آن یک تصویر اشعه ایکس بر روی یک صفحه فلورسنت (یا سیستم آشکارسازهای دیجیتال) پخش می شود. این روش امکان انجام مطالعات عملکردی استاتیک و همچنین پویای اندام ها (به عنوان مثال، فلوروسکوپی معده، گذر از دیافراگم) و نظارت بر روش های مداخله ای (به عنوان مثال، آنژیوگرافی، استنت گذاری) را فراهم می کند. در حال حاضر، هنگام استفاده از سیستم های دیجیتال، تصاویر بر روی مانیتور کامپیوتر به دست می آید.
معایب اصلی فلوروسکوپی شامل دوز نسبتاً بالای تابش و مشکلات در افتراق تغییرات "لطیف" است.
رادیوگرافی (یونانی) greapho- نوشتن، به تصویر کشیدن) - مطالعه ای که در آن یک تصویر اشعه ایکس از یک شی به دست می آید، بر روی فیلم (رادیوگرافی مستقیم) یا بر روی دستگاه های دیجیتال خاص (رادیوگرافی دیجیتال) ثابت می شود.
گزینه های مختلف رادیوگرافی ( رادیوگرافی سادهرادیوگرافی هدفمند، رادیوگرافی تماسی، رادیوگرافی کنتراست، ماموگرافی، اوروگرافی، فیستولوگرافی، آرتروگرافی و غیره) برای بهبود کیفیت و افزایش کمیت تشخیص های به دست آمده استفاده می شود.

برنج. 2-3.دستگاه اشعه ایکس مدرن
اطلاعات فنی در هر موقعیت بالینی خاص به عنوان مثال، رادیوگرافی تماسی برای عکس های دندان و رادیوگرافی کنتراست برای اوروگرافی دفعی استفاده می شود.
تکنیک های اشعه ایکس و فلوروسکوپی را می توان با وضعیت عمودی یا افقی بدن بیمار در بخش های بستری یا بخش استفاده کرد.
رادیوگرافی سنتی با استفاده از فیلم اشعه ایکس یا رادیوگرافی دیجیتال یکی از تکنیک های تحقیقاتی اصلی و پرکاربرد است. این به دلیل کارایی بالا، سادگی و محتوای اطلاعاتی تصاویر تشخیصی به دست آمده است.
هنگام عکاسی از یک شی از یک صفحه فلورسنت روی فیلم (معمولاً در اندازه کوچک - فیلم عکاسی با فرمت خاص) تصاویر اشعه ایکس به دست می آید که معمولاً برای معاینه انبوه استفاده می شود. این تکنیک فلوروگرافی نامیده می شود. در حال حاضر به دلیل جایگزینی با رادیوگرافی دیجیتال به تدریج از استفاده خارج می شود.
نقطه ضعف هر نوع معاینه اشعه ایکس وضوح پایین آن در هنگام بررسی بافت های با کنتراست کم است. توموگرافی کلاسیک که قبلاً برای این منظور استفاده می شد، نتیجه مطلوب را به همراه نداشت. برای رفع این نقص بود که CT ایجاد شد.
2.2. تشخیص اولتراسونیک (سونوگرافی، سونوگرافی)
تشخیص اولتراسوند (سونوگرافی، سونوگرافی) روشی برای تشخیص تشعشع بر اساس گرفتن تصاویر از اندام های داخلی با استفاده از امواج اولتراسونیک است.
سونوگرافی به طور گسترده در تشخیص استفاده می شود. در طول 50 سال گذشته، این روش به یکی از رایج ترین و مهم ترین روش ها تبدیل شده است که تشخیص سریع، دقیق و ایمن بسیاری از بیماری ها را ارائه می دهد.
اولتراسوند به امواج صوتی با فرکانس بالای 20000 هرتز اطلاق می شود. این شکلی از انرژی مکانیکی است که ماهیت موجی دارد. امواج اولتراسونیک در محیط های بیولوژیکی منتشر می شود. سرعت انتشار امواج مافوق صوت در بافت ثابت و 1540 متر بر ثانیه است. تصویر با تجزیه و تحلیل سیگنال (سیگنال اکو) منعکس شده از مرز دو رسانه به دست می آید. در پزشکی بیشترین استفاده از فرکانس ها در محدوده 2 تا 10 مگاهرتز است.
اولتراسوند توسط یک سنسور ویژه با کریستال پیزوالکتریک تولید می شود. پالس های الکتریکی کوتاه باعث ایجاد ارتعاشات مکانیکی در کریستال می شود و در نتیجه تابش اولتراسونیک تولید می شود. فرکانس سونوگرافی با فرکانس تشدید کریستال تعیین می شود. سیگنال های منعکس شده ضبط، تجزیه و تحلیل و به صورت بصری بر روی صفحه ابزار نمایش داده می شوند و تصاویری از ساختارهای مورد بررسی ایجاد می کنند. بنابراین، سنسور به صورت متوالی به عنوان یک تابشگر و سپس به عنوان گیرنده امواج مافوق صوت عمل می کند. اصل عملکرد سیستم اولتراسونیک در شکل نشان داده شده است. 2-4.

برنج. 2-4.اصل عملکرد سیستم اولتراسونیک
هرچه مقاومت صوتی بیشتر باشد، انعکاس سونوگرافی بیشتر است. هوا امواج صوتی را هدایت نمی کند، بنابراین برای بهبود نفوذ سیگنال در رابط هوا/پوست، یک ژل اولتراسوند ویژه روی سنسور اعمال می شود. این کار باعث از بین رفتن فاصله هوایی بین پوست بیمار و سنسور می شود. مصنوعات شدید در طول مطالعه می توانند از ساختارهای حاوی هوا یا کلسیم (میدان های ریه، حلقه های روده، استخوان ها و کلسیفیکاسیون ها) ناشی شوند. به عنوان مثال، هنگام معاینه قلب، قلب می تواند تقریباً به طور کامل توسط بافت هایی که اولتراسوند را منعکس می کنند یا انجام نمی دهند (ریه ها، استخوان ها) پوشیده شود. در این مورد، معاینه اندام فقط از طریق مناطق کوچک روی آن امکان پذیر است
سطح بدن که در آن ارگان مورد مطالعه با بافت نرم در تماس است. این ناحیه "پنجره" اولتراسوند نامیده می شود. اگر "پنجره" اولتراسوند ضعیف باشد، مطالعه ممکن است غیرممکن یا بی اطلاع باشد.
دستگاه های سونوگرافی مدرن دستگاه های دیجیتال پیچیده ای هستند. آنها از سنسورهای بلادرنگ استفاده می کنند. تصاویر پویا هستند، روی آنها می توانید فرآیندهای سریعی مانند تنفس، انقباضات قلب، ضربان رگ های خونی، حرکت دریچه ها، پریستالسیس و حرکات جنین را مشاهده کنید. موقعیت سنسور متصل به دستگاه اولتراسونیک با کابل انعطاف پذیر، در هر سطح و در هر زاویه ای قابل تغییر است. سیگنال الکتریکی آنالوگ تولید شده در سنسور دیجیتالی شده و یک تصویر دیجیتال ایجاد می شود.
تکنیک داپلر در معاینه سونوگرافی بسیار مهم است. داپلر اثر فیزیکی را تشریح کرد که بر اساس آن فرکانس صدای تولید شده توسط یک جسم متحرک زمانی که توسط گیرنده ثابت درک می شود، بسته به سرعت، جهت و ماهیت حرکت تغییر می کند. روش داپلر برای اندازه گیری و تجسم سرعت، جهت و ماهیت حرکت خون در عروق و حفره های قلب و همچنین حرکت هر مایع دیگر استفاده می شود.
در طول معاینه داپلر رگهای خونی، امواج امواج فراصوت پیوسته یا پالس از ناحیه مورد بررسی عبور میکند. هنگامی که پرتو اولتراسوند از یک رگ یا اتاقک قلب عبور می کند، سونوگرافی تا حدی توسط گلبول های قرمز منعکس می شود. بنابراین، برای مثال، فرکانس سیگنال پژواک منعکس شده از خون در حال حرکت به سمت سنسور بیشتر از فرکانس اصلی امواج ساطع شده توسط سنسور خواهد بود. برعکس، فرکانس پژواک منعکس شده از خون در حال دور شدن از مبدل کمتر خواهد بود. تفاوت بین فرکانس سیگنال اکو دریافتی و فرکانس اولتراسوند تولید شده توسط مبدل، شیفت داپلر نامیده می شود. این تغییر فرکانس متناسب با سرعت جریان خون است. دستگاه اولتراسوند به طور خودکار تغییر داپلر را به سرعت نسبی جریان خون تبدیل می کند.
مطالعاتی که سونوگرافی دوبعدی بلادرنگ و سونوگرافی داپلر پالسی را ترکیب می کنند، دوبلکس نامیده می شوند. در یک مطالعه دوبلکس، جهت پرتو داپلر بر روی یک تصویر دو بعدی حالت B قرار میگیرد.
توسعه مدرن فناوری تحقیقات دوبلکس منجر به ظهور نقشه داپلر رنگی از جریان خون شده است. در حجم کنترل، جریان خون رنگی بر روی تصویر دو بعدی قرار می گیرد. در این حالت خون رنگی و بافت بی حرکت در مقیاس خاکستری نمایش داده می شود. هنگامی که خون به سمت سنسور حرکت می کند، از رنگ های قرمز-زرد استفاده می شود، در هنگام دور شدن از سنسور از رنگ های آبی-فیروزه ای استفاده می شود. این تصویر رنگی حاوی اطلاعات اضافی نیست، اما ایده بصری خوبی از ماهیت حرکت خون می دهد.
در بیشتر موارد، برای هدف سونوگرافی، استفاده از پروب های پوستی کافی است. با این حال، در برخی موارد لازم است سنسور را به جسم نزدیک کنید. به عنوان مثال، در بیماران بزرگ، از پروب هایی که در مری قرار می گیرند (اکوکاردیوگرافی ترانس مری) برای مطالعه قلب استفاده می شود؛ در موارد دیگر از پروب های داخل رکتوم یا داخل واژینال برای به دست آوردن تصاویر با کیفیت بالا استفاده می شود. در طول عمل، آنها به استفاده از سنسورهای جراحی متوسل می شوند.
که در سال های گذشتهسونوگرافی سه بعدی به طور فزاینده ای مورد استفاده قرار می گیرد. دامنه سیستم های اولتراسوند بسیار گسترده است - دستگاه های قابل حمل، دستگاه هایی برای سونوگرافی حین عمل و سیستم های اولتراسوند کلاس متخصص وجود دارد (شکل 2-5).
در عمل بالینی مدرن، روش معاینه اولتراسوند (سونوگرافی) بسیار گسترده است. این با این واقعیت توضیح داده می شود که هنگام استفاده از روش هیچ تشعشع یونیزه ای وجود ندارد، امکان انجام تست های عملکردی و استرس وجود دارد، روش آموزنده و نسبتاً ارزان است، دستگاه ها فشرده و آسان برای استفاده هستند.

برنج. 2-5.دستگاه سونوگرافی مدرن
اما روش سونوگرافی محدودیت هایی دارد. این موارد شامل فرکانس بالای مصنوعات در تصویر، عمق کم نفوذ سیگنال، میدان دید کم، و وابستگی زیاد تفسیر نتایج به اپراتور است.
با توسعه تجهیزات اولتراسونیک، محتوای اطلاعاتی این روش در حال افزایش است.
2.3. توموگرافی کامپیوتری (CT)
سی تی یک روش معاینه اشعه ایکس است که بر اساس بدست آوردن تصاویر لایه به لایه در صفحه عرضی و بازسازی کامپیوتری آنها انجام می شود.
ایجاد دستگاه های سی تی گام انقلابی بعدی در به دست آوردن تصاویر تشخیصی پس از کشف اشعه ایکس است. این نه تنها به دلیل تطبیق پذیری و وضوح بی نظیر روش هنگام بررسی کل بدن است، بلکه به دلیل الگوریتم های تصویربرداری جدید نیز می باشد. در حال حاضر، همه دستگاههای تصویربرداری تا حدی از تکنیکها و روشهای ریاضی که اساس CT را تشکیل میدهند، استفاده میکنند.
CT هیچ منع مصرف مطلقی برای استفاده از آن ندارد (به جز محدودیت های مرتبط با پرتوهای یونیزان) و می تواند برای تشخیص اورژانسی، غربالگری و همچنین به عنوان روشی برای شفاف سازی تشخیص استفاده شود.
سهم اصلی در ایجاد توموگرافی کامپیوتری توسط دانشمند بریتانیایی گادفری هانسفیلد در اواخر دهه 60 انجام شد. قرن XX.
در ابتدا، توموگرافی های کامپیوتری بسته به نحوه طراحی سیستم آشکارساز لوله اشعه ایکس به نسل ها تقسیم شدند. علیرغم تفاوت های متعدد در ساختار، همه آنها توموگرافی "گام" نامیده می شدند. این به این دلیل بود که پس از هر مقطع توموگرافی متوقف شد، میز با بیمار یک "گام" چند میلی متری برداشت و سپس بخش بعدی انجام شد.
در سال 1989، توموگرافی کامپیوتری مارپیچی (SCT) ظاهر شد. در مورد SCT، یک لوله اشعه ایکس با آشکارساز به طور مداوم در اطراف یک میز متحرک با بیمار می چرخد.
جلد. این اجازه می دهد تا نه تنها زمان معاینه را کاهش دهید، بلکه از محدودیت های تکنیک "گام به گام" - پرش از بخش ها در طول معاینه به دلیل عمق های مختلف تنفس توسط بیمار جلوگیری کنید. نرم افزار جدید علاوه بر این امکان تغییر عرض برش و الگوریتم بازیابی تصویر را پس از پایان مطالعه فراهم کرد. این امر امکان دستیابی به اطلاعات تشخیصی جدید را بدون معاینه مجدد فراهم کرد.
از این نقطه به بعد، CT استاندارد و جهانی شد. امکان همگام سازی معرفی ماده حاجب با شروع حرکت میز در طی SCT وجود داشت که منجر به ایجاد سی تی آنژیوگرافی شد.
در سال 1998، CT چند برشی (MSCT) ظاهر شد. سیستم ها نه با یک (مانند SCT)، بلکه با 4 ردیف آشکارساز دیجیتال ایجاد شدند. از سال 2002، توموگرافی با 16 ردیف عنصر دیجیتال در آشکارساز شروع به استفاده کرد و از سال 2003 تعداد ردیف های عناصر به 64 رسید. در سال 2007، MSCT با 256 و 320 ردیف عناصر آشکارساز ظاهر شد.
با چنین توموگراف هایی می توان صدها و هزاران توموگرام را تنها در چند ثانیه با ضخامت هر برش 0.5-0.6 میلی متر به دست آورد. این پیشرفت فنی امکان انجام این مطالعه را حتی بر روی بیماران متصل به دستگاه تنفس مصنوعی فراهم کرد. علاوه بر تسریع معاینه و بهبود کیفیت آن، مشکل پیچیده ای مانند تجسم عروق کرونر و حفره های قلب با استفاده از سی تی حل شد. مطالعه عروق کرونر، حجم حفره ها و عملکرد قلب و پرفیوژن میوکارد در یک مطالعه 20-5 ثانیه امکان پذیر شد.
یک نمودار شماتیک از دستگاه CT در شکل نشان داده شده است. 2-6، و شکل ظاهری در شکل. 2-7.
مزایای اصلی سی تی مدرن عبارتند از: سرعت گرفتن تصاویر، ماهیت لایه به لایه (توموگرافی) تصاویر، توانایی به دست آوردن مقاطع با هر جهت، وضوح مکانی و زمانی بالا.
از معایب سی تی می توان به دوز تابش نسبتاً بالا (در مقایسه با رادیوگرافی)، امکان ظهور آرتیفکت از ساختارهای متراکم، حرکات و وضوح نسبتاً کم کنتراست بافت نرم اشاره کرد.

برنج. 2-6.نمودار دستگاه MSCT

برنج. 2-7.توموگرافی کامپیوتری 64 مارپیچی مدرن
2.4. تشدید مغناطیسی
توموگرافی (MRI)
تصویربرداری تشدید مغناطیسی (MRI) روشی برای تشخیص تشعشع است که بر اساس به دست آوردن تصاویر لایه به لایه و حجمی از اندام ها و بافت ها با هر جهتی با استفاده از پدیده تشدید مغناطیسی هسته ای (NMR) است. اولین کار روی تصویربرداری با استفاده از NMR در دهه 70 ظاهر شد. قرن آخر. تا به امروز، این روش تصویربرداری پزشکی فراتر از تشخیص تغییر کرده است و به تکامل خود ادامه می دهد. سختافزار و نرمافزار در حال بهبود هستند و تکنیکهای جمعآوری تصویر در حال بهبود هستند. پیش از این، استفاده از MRI به مطالعه سیستم عصبی مرکزی محدود می شد. اکنون این روش با موفقیت در سایر زمینه های پزشکی از جمله مطالعات عروق خونی و قلب استفاده می شود.
پس از گنجاندن NMR در بین روش های تشخیص تشعشع، از صفت "هسته ای" دیگر استفاده نمی شود تا باعث ایجاد ارتباط در بیماران دارای سلاح های هسته ای یا انرژی هسته ای نشود. بنابراین امروزه اصطلاح تصویربرداری رزونانس مغناطیسی (MRI) به طور رسمی مورد استفاده قرار می گیرد.
NMR یک پدیده فیزیکی است که بر اساس ویژگیهای هستههای اتمی خاصی است که در یک میدان مغناطیسی قرار میگیرند تا انرژی خارجی را در محدوده فرکانس رادیویی (RF) جذب کرده و پس از حذف پالس RF منتشر کنند. قدرت میدان مغناطیسی ثابت و فرکانس پالس فرکانس رادیویی کاملاً با یکدیگر مطابقت دارند.
هسته های مهم برای استفاده در تصویربرداری رزونانس مغناطیسی 1H، 13C، 19F، 23Na و 31P هستند. همه آنها دارای خواص مغناطیسی هستند که آنها را از ایزوتوپ های غیر مغناطیسی متمایز می کند. پروتون های هیدروژن (1H) بیشترین فراوانی را در بدن دارند. بنابراین، برای MRI، سیگنال هسته های هیدروژن (پروتون ها) است که استفاده می شود.
هسته های هیدروژن را می توان به عنوان آهنرباهای کوچک (دوقطبی) با دو قطب در نظر گرفت. هر پروتون حول محور خود می چرخد و یک گشتاور مغناطیسی کوچک دارد (بردار مغناطیسی). گشتاورهای مغناطیسی در حال چرخش هسته ها را اسپین می گویند. هنگامی که چنین هسته هایی در یک میدان مغناطیسی خارجی قرار می گیرند، می توانند امواج الکترومغناطیسی با فرکانس های خاص را جذب کنند. این پدیده به نوع هسته ها، قدرت میدان مغناطیسی و محیط فیزیکی و شیمیایی هسته ها بستگی دارد. با این رفتار
حرکت هسته را می توان با یک چرخش بالا مقایسه کرد. تحت تأثیر یک میدان مغناطیسی، هسته دوار دستخوش حرکت پیچیده ای می شود. هسته حول محور خود می چرخد و محور چرخش خود حرکات دایره ای مخروطی شکل انجام می دهد که از جهت عمودی منحرف می شود.
در یک میدان مغناطیسی خارجی، هسته ها می توانند در حالت انرژی پایدار یا در حالت برانگیخته باشند. تفاوت انرژی بین این دو حالت به قدری کم است که تعداد هسته ها در هر یک از این سطوح تقریباً یکسان است. بنابراین، سیگنال NMR حاصل که دقیقاً به تفاوت جمعیت این دو سطح توسط پروتون ها بستگی دارد، بسیار ضعیف خواهد بود. برای تشخیص این مغناطش ماکروسکوپی، باید بردار آن را از محور یک میدان مغناطیسی ثابت منحرف کرد. این با استفاده از یک پالس تابش فرکانس رادیویی خارجی (الکترومغناطیسی) به دست می آید. هنگامی که سیستم به حالت تعادل باز می گردد، انرژی جذب شده ساطع می شود (سیگنال MR). این سیگنال ضبط شده و برای ساخت تصاویر MR استفاده می شود.
سیم پیچ های مخصوص ( گرادیان ) واقع در داخل آهنربای اصلی میدان های مغناطیسی اضافی کوچکی ایجاد می کنند به طوری که قدرت میدان به صورت خطی در یک جهت افزایش می یابد. با ارسال پالس های فرکانس رادیویی با محدوده فرکانس باریک از پیش تعیین شده، می توان سیگنال های MR را تنها از یک لایه انتخاب شده از بافت به دست آورد. جهت شیب میدان مغناطیسی و بر این اساس، جهت برش ها را می توان به راحتی در هر جهت مشخص کرد. سیگنال های دریافتی از هر عنصر تصویر حجمی (وکسل) دارای کد منحصر به فرد و قابل تشخیص خود هستند. این کد فرکانس و فاز سیگنال است. بر اساس این داده ها می توان تصاویر دو بعدی یا سه بعدی ساخت.
برای به دست آوردن سیگنال تشدید مغناطیسی، از ترکیب پالس های فرکانس رادیویی با مدت زمان و اشکال مختلف استفاده می شود. با ترکیب پالس های مختلف به اصطلاح توالی پالس تشکیل می شود که برای به دست آوردن تصاویر استفاده می شود. توالیهای خاص پالس شامل هیدروگرافی MR، MR میلوگرافی، MR کلانژیوگرافی و MR آنژیوگرافی است.
بافتهایی با بردارهای کل مغناطیسی بزرگ سیگنال قوی القا میکنند (روشن به نظر میرسند) و بافتهایی با بردارهای کوچک
با بردارهای مغناطیسی - یک سیگنال ضعیف (تاریک به نظر می رسند). نواحی تشریحی با تعداد کم پروتون (مانند هوا یا استخوان فشرده) سیگنال MR بسیار ضعیفی را القا می کنند و بنابراین همیشه در تصویر تیره به نظر می رسند. آب و سایر مایعات دارای سیگنال قوی هستند و در تصویر روشن به نظر می رسند، با شدت های متفاوت. تصاویر بافت نرم نیز شدت سیگنال متفاوتی دارند. این به این دلیل است که علاوه بر چگالی پروتون، ماهیت شدت سیگنال در MRI توسط پارامترهای دیگر تعیین می شود. این موارد عبارتند از: زمان استراحت اسپین-شبکه (طولی) (T1)، آرامش اسپین-چرخش (عرضی) (T2)، حرکت یا انتشار محیط مورد مطالعه.
زمان شل شدن بافت - T1 و T2 - ثابت است. در MRI، عبارات "تصویر با وزن T1"، "تصویر وزن T2"، "تصویر وزن پروتون" برای نشان دادن اینکه تفاوت بین تصاویر بافتی عمدتاً به دلیل عملکرد غالب یکی از این عوامل است استفاده می شود.
با تنظیم پارامترهای توالی نبض، رادیوگراف یا پزشک می تواند بر کنتراست تصاویر بدون استفاده از مواد حاجب تأثیر بگذارد. بنابراین، در تصویربرداری MR نسبت به رادیوگرافی، سی تی یا اولتراسوند، فرصت بسیار بیشتری برای تغییر کنتراست در تصاویر وجود دارد. با این حال، معرفی مواد حاجب خاص می تواند کنتراست بین بافت های طبیعی و پاتولوژیک را بیشتر تغییر دهد و کیفیت تصویربرداری را بهبود بخشد.
نمودار شماتیک سیستم MR و ظاهر دستگاه در شکل نشان داده شده است. 2-8
و 2-9.
به طور معمول، اسکنرهای MRI بر اساس قدرت میدان مغناطیسی طبقه بندی می شوند. قدرت میدان مغناطیسی بر حسب تسلا (T) یا گاوس (1T = 10000 گاوس) اندازه گیری می شود. قدرت میدان مغناطیسی زمین از 0.7 گاوس در قطب ها تا 0.3 گاوس در استوا متغیر است. برای کلی-

برنج. 2-8.نمودار دستگاه MRI

برنج. 2-9.سیستم مدرن MRI با میدان 1.5 تسلا
MRI nical از آهنرباهایی با میدان های 0.2 تا 3 تسلا استفاده می کند. در حال حاضر، سیستم های MR با میدان های 1.5 و 3 تسلا بیشتر برای تشخیص استفاده می شوند. چنین سیستم هایی تا 70 درصد از ناوگان تجهیزات جهان را تشکیل می دهند. هیچ رابطه خطی بین قدرت میدان و کیفیت تصویر وجود ندارد. با این حال، دستگاه هایی با چنین قدرت میدانی کیفیت تصویر بهتری را ارائه می دهند و تعداد برنامه های بیشتری را در عمل بالینی مورد استفاده قرار می دهند.
منطقه اصلی کاربرد MRI مغز و سپس نخاع شد. توموگرام مغز بدون نیاز به کنتراست اضافی تصاویر بسیار خوبی از تمام ساختارهای مغز ارائه می دهد. به لطف توانایی فنی این روش برای به دست آوردن تصاویر در همه سطوح، MRI انقلابی در مطالعه نخاع و دیسک های بین مهره ای ایجاد کرده است.
در حال حاضر، MRI به طور فزاینده ای برای مطالعه مفاصل، اندام های لگن، غدد پستانی، قلب و عروق خونی استفاده می شود. برای این منظور، سیم پیچ های ویژه اضافی و روش های ریاضی برای ساخت تصاویر توسعه یافته است.
تجهیزات ویژه به شما امکان می دهد تصاویری از قلب را در آن ضبط کنید فازهای مختلفچرخه قلبی. اگر مطالعه در
همزمان با ECG، می توان تصاویری از عملکرد قلب را به دست آورد. این مطالعه Cine MRI نام دارد.
طیف سنجی تشدید مغناطیسی (MRS) یک روش تشخیصی غیر تهاجمی است که به شما امکان می دهد ترکیب شیمیایی اندام ها و بافت ها را با استفاده از رزونانس مغناطیسی هسته ای و پدیده شیفت شیمیایی به طور کمی و کیفی تعیین کنید.
طیف سنجی MR اغلب برای به دست آوردن سیگنال از هسته های فسفر و هیدروژن (پروتون ها) انجام می شود. با این حال، به دلیل مشکلات فنی و زمان بر بودن روش، هنوز به ندرت در عمل بالینی استفاده می شود. نباید فراموش کرد که افزایش استفاده از MRI نیازمند توجه ویژه به مسائل ایمنی بیمار است. هنگام معاینه با استفاده از طیف سنجی MR، بیمار در معرض پرتوهای یونیزان قرار نمی گیرد، اما در معرض تابش الکترومغناطیسی و فرکانس رادیویی قرار می گیرد. اجسام فلزی (گلوله ها، قطعات، ایمپلنت های بزرگ) و کلیه وسایل الکترونیکی-مکانیکی (مثلاً ضربان ساز قلب) که در بدن فرد مورد معاینه قرار دارند می توانند به دلیل جابجایی یا اختلال (قطع) عملکرد طبیعی به بیمار آسیب برسانند.
بسیاری از بیماران ترس از فضاهای بسته را تجربه می کنند - کلاستروفوبیا، که منجر به ناتوانی در تکمیل معاینه می شود. بنابراین کلیه بیماران باید از عواقب نامطلوب احتمالی مطالعه و ماهیت عمل مطلع شوند و پزشکان معالج و رادیولوژیست ها موظفند قبل از مطالعه از بیمار در خصوص وجود موارد فوق، جراحات و عمل ها سؤال کنند. قبل از مطالعه، بیمار باید به طور کامل لباس مخصوص خود را به تن کند تا از ورود اقلام فلزی به کانال آهنربا از جیب لباس جلوگیری کند.
دانستن موارد منع مصرف نسبی و مطلق مطالعه مهم است.
موارد منع مطلق مطالعه شامل شرایطی است که در آن انجام آن یک وضعیت تهدید کننده زندگی برای بیمار ایجاد می کند. این دسته شامل کلیه بیماران با وجود وسایل الکترونیکی-مکانیکی در بدن (پیس میکر) و بیماران با وجود گیره فلزی بر روی عروق مغز می شود. موارد منع نسبی مطالعه شامل شرایطی است که می تواند خطرات و مشکلات خاصی را هنگام انجام MRI ایجاد کند، اما در بیشتر موارد هنوز امکان پذیر است. چنین موارد منع مصرف هستند
وجود منگنه های هموستاتیک، گیره ها و گیره های موضعی دیگر، جبران نارسایی قلبی، سه ماهه اول بارداری، کلاستروفوبیا و نیاز به نظارت فیزیولوژیکی. در چنین مواردی، تصمیم گیری در مورد امکان انجام MRI به صورت موردی بر اساس نسبت بزرگی خطر احتمالی و سود مورد انتظار از مطالعه گرفته می شود.
بیشتر اشیاء فلزی کوچک (دندانهای مصنوعی، مواد بخیههای جراحی، برخی از انواع دریچههای مصنوعی قلب، استنتها) منع مصرفی برای مطالعه نیستند. کلاستروفوبیا در 1-4 درصد موارد مانعی برای تحقیق است.
مانند سایر تکنیک های تشخیص پرتو، MRI نیز بدون اشکال نیست.
معایب قابل توجه MRI شامل زمان نسبتا طولانی معاینه، عدم توانایی در تشخیص دقیق سنگ ها و کلسیفیکاسیون ها، پیچیدگی تجهیزات و عملکرد آن و الزامات ویژه برای نصب دستگاه ها (محافظت در برابر تداخل) است. ارزیابی بیمارانی که نیاز به تجهیزات حیاتی دارند، MRI دشوار است.
2.5. تشخیص رادیونوکلید
تشخیص رادیونوکلئید یا پزشکی هسته ای روشی برای تشخیص تشعشع بر اساس ثبت تشعشعات مواد رادیواکتیو مصنوعی وارد شده به بدن است.
برای تشخیص رادیونوکلئید، طیف گسترده ای از ترکیبات نشاندار شده (رادیوداروها (RP)) و روش های ثبت آنها با سنسورهای سوسوزن ویژه استفاده می شود. انرژی تشعشعات یونیزان جذب شده، فلاش های نور مرئی را در کریستال حسگر تحریک می کند، که هر کدام توسط مولتی پلایرهای نوری تقویت شده و به یک پالس جریان تبدیل می شوند.
تجزیه و تحلیل قدرت سیگنال به ما امکان می دهد تا شدت و موقعیت مکانی هر سوسوزن را تعیین کنیم. این داده ها برای بازسازی یک تصویر دو بعدی از انتشار رادیودارو استفاده می شود. تصویر را می توان مستقیماً روی صفحه مانیتور، روی عکس یا فیلم چند فرمتی ارائه کرد یا روی رسانه رایانه ضبط کرد.
بسته به روش و نوع ثبت تشعشع، چندین گروه از دستگاه های تشخیص رادیویی وجود دارد:
رادیومترها ابزاری برای اندازه گیری رادیواکتیویته در سراسر بدن هستند.
رادیوگرافی ابزاری برای ثبت دینامیک تغییرات رادیواکتیویته است.
اسکنر - سیستم هایی برای ضبط توزیع فضایی رادیوداروها؛
دوربین های گاما دستگاه هایی برای ثبت استاتیک و دینامیک توزیع حجمی یک ردیاب رادیواکتیو هستند.
که در کلینیک های مدرناکثر دستگاه های تشخیص رادیونوکلئید دوربین های گاما از انواع مختلف هستند.
دوربین های گاما مدرن مجموعه ای متشکل از 1-2 سیستم آشکارساز با قطر بزرگ، یک جدول برای موقعیت یابی بیمار و یک سیستم کامپیوتری برای ذخیره و پردازش تصاویر هستند (شکل 2-10).
گام بعدی در توسعه تشخیص رادیونوکلئید، ایجاد یک دوربین گامای چرخشی بود. با کمک این دستگاه ها، امکان استفاده از تکنیک لایه به لایه برای مطالعه توزیع ایزوتوپ ها در بدن - توموگرافی کامپیوتری انتشار تک فوتون (SPECT) وجود داشت.

برنج. 2-10.نمودار دستگاه دوربین گاما
SPECT از دوربین های گاما چرخشی با یک، دو یا سه آشکارساز استفاده می کند. سیستمهای توموگرافی مکانیکی این امکان را میدهند که آشکارسازها در اطراف بدن بیمار در مدارهای مختلف بچرخند.
وضوح فضایی SPECT مدرن حدود 5-8 میلی متر است. شرط دوم برای انجام مطالعه رادیوایزوتوپ، علاوه بر در دسترس بودن تجهیزات ویژه، استفاده از ردیاب های رادیواکتیو ویژه - رادیوداروها (RP) است که به بدن بیمار وارد می شود.
رادیودارو یک ترکیب شیمیایی رادیواکتیو با ویژگی های فارماکولوژیک و فارماکوکینتیک شناخته شده است. رادیوداروهای مورد استفاده در تشخیص پزشکی مشمول الزامات نسبتاً سختی هستند: تمایل به اندام ها و بافت ها، سهولت آماده سازی، نیمه عمر کوتاه، انرژی تابش گاما بهینه (100-300 کیلو ولت) و سمیت رادیویی کم در دوزهای نسبتاً مجاز بالا. یک رادیودارو ایده آل باید فقط به اندام ها یا کانون های پاتولوژیک در نظر گرفته شده برای تحقیق تحویل داده شود.
درک مکانیسم های محلی سازی رادیودارو به عنوان مبنایی برای تفسیر کافی از مطالعات رادیونوکلئید عمل می کند.
استفاده از ایزوتوپ های رادیواکتیو مدرن در تشخیص پزشکی بی خطر و بی ضرر است. مقدار ماده فعال (ایزوتوپ) به قدری کم است که با وارد شدن به بدن اثرات فیزیولوژیکی یا واکنش های آلرژیک ایجاد نمی کند. در پزشکی هسته ای از رادیوداروهایی که پرتوهای گاما ساطع می کنند استفاده می شود. منابع آلفا (هسته هلیوم) و ذرات بتا (الکترون) در حال حاضر در تشخیص به دلیل درجه بالای جذب بافتی و قرار گرفتن در معرض تابش زیاد استفاده نمی شوند.
بیشترین ایزوتوپ مورد استفاده در عمل بالینی تکنسیوم-99t (نیمه عمر - 6 ساعت) است. این رادیونوکلئید مصنوعی بلافاصله قبل از مطالعه از دستگاه های مخصوص (ژنراتورها) به دست می آید.
یک تصویر تشخیص رادیویی، صرف نظر از نوع آن (استاتیک یا دینامیک، مسطح یا توموگرافی)، همیشه عملکرد خاص اندام مورد بررسی را منعکس می کند. در اصل، این نشان دهنده بافت عملکردی است. در جنبه عملکردی است که وجه تمایز اساسی تشخیص رادیونوکلئید از سایر روش های تصویربرداری نهفته است.
رادیوداروها معمولاً به صورت داخل وریدی تجویز می شوند. برای مطالعات تهویه ریوی، دارو به صورت استنشاقی تجویز می شود.
یکی از تکنیک های جدید رادیوایزوتوپ توموگرافی در پزشکی هسته ای، توموگرافی گسیل پوزیترون (PET) است.
روش PET بر اساس خاصیت برخی از رادیونوکلئیدهای کوتاه مدت برای انتشار پوزیترون در طول واپاشی است. پوزیترون ذره ای است که جرم آن برابر با یک الکترون است، اما دارای بار مثبت است. یک پوزیترون که 1-3 میلی متر در ماده سفر کرده و انرژی جنبشی دریافتی در لحظه تشکیل را در برخورد با اتم ها از دست داده است، از بین می رود و دو کوانتا گاما (فوتون) با انرژی 511 کو تشکیل می دهد. این کوانتوم ها در جهت مخالف پراکنده می شوند. بنابراین، نقطه فروپاشی روی یک خط مستقیم قرار دارد - مسیر حرکت دو فوتون نابود شده. دو آشکارساز واقع در مقابل یکدیگر فوتون های نابودی ترکیبی را ثبت می کنند (شکل 2-11).
PET امکان ارزیابی کمی غلظت رادیونوکلئید را فراهم می کند و نسبت به سینتی گرافی که با استفاده از دوربین های گاما انجام می شود، توانایی بیشتری برای مطالعه فرآیندهای متابولیک دارد.
برای PET از ایزوتوپ های عناصری مانند کربن، اکسیژن، نیتروژن و فلوئور استفاده می شود. رادیوداروهایی که با این عناصر برچسب گذاری شده اند، متابولیت های طبیعی بدن هستند و در متابولیسم قرار می گیرند.

برنج. 2-11.نمودار دستگاه PET
مواد در نتیجه، مطالعه فرآیندهایی که در سطح سلولی اتفاق میافتند امکانپذیر است. از این دیدگاه، PET تنها تکنیک (علاوه بر طیفسنجی MR) برای ارزیابی فرآیندهای متابولیک و بیوشیمیایی در داخل بدن است.
تمام رادیونوکلئیدهای پوزیترون مورد استفاده در پزشکی بسیار کوتاه مدت هستند - نیمه عمر آنها در دقیقه یا ثانیه اندازه گیری می شود. استثنا فلوئور 18 و روبیدیم 82 است. در این راستا، دئوکسی گلوکز نشاندار شده با فلوئور 18 (fluorodeoxyglucose - FDG) بیشتر مورد استفاده قرار می گیرد.
علیرغم این واقعیت که اولین سیستم های PET در اواسط قرن بیستم ظاهر شدند، استفاده بالینی آنها به دلیل محدودیت های خاصی با مشکل مواجه شده است. اینها مشکلات فنی هستند که هنگام راهاندازی شتابدهندهها در کلینیکها برای تولید ایزوتوپهای کوتاهمدت، هزینه بالای آنها و مشکل در تفسیر نتایج به وجود میآیند. یکی از محدودیتها - وضوح فضایی ضعیف - با ترکیب سیستم PET با MSCT برطرف شد، که با این حال، هزینههای سیستم را بیشتر افزایش میدهد (شکل 2-12). در این راستا، مطالعات PET با توجه به نشانه های دقیق زمانی که سایر روش ها بی اثر هستند، انجام می شود.
مزایای اصلی روش رادیونوکلئید حساسیت بالای آن به انواع مختلف فرآیندهای پاتولوژیک، توانایی ارزیابی متابولیسم و زنده ماندن بافت است.
معایب کلی روش های رادیوایزوتوپی شامل تفکیک فضایی کم است. استفاده از داروهای رادیواکتیو در عمل پزشکی با مشکلاتی در حمل، نگهداری، بسته بندی و تجویز آنها به بیماران همراه است.

برنج. 2-12.سیستم مدرن PET-CT
ساخت آزمایشگاه های رادیوایزوتوپ (مخصوصاً برای PET) نیازمند مکان های خاص، امنیت، آلارم و سایر اقدامات احتیاطی است.
2.6. آنژیوگرافی
آنژیوگرافی روشی برای معاینه اشعه ایکس است که با وارد کردن مستقیم ماده حاجب به عروق به منظور مطالعه آنها همراه است.
آنژیوگرافی به دو دسته آرتریوگرافی، ونوگرافی و لنفوگرافی تقسیم می شود. دومی، به دلیل توسعه روش های اولتراسوند، CT و MRI، در حال حاضر عملاً استفاده نمی شود.
آنژیوگرافی در اتاق های تخصصی اشعه ایکس انجام می شود. این اتاق ها تمامی الزامات اتاق عمل را برآورده می کنند. برای آنژیوگرافی از دستگاه های تخصصی اشعه ایکس (واحدهای آنژیوگرافی) استفاده می شود (شکل 2-13).
تزریق ماده حاجب به بستر عروقی با تزریق با سرنگ یا (بیشتر) با یک انژکتور خودکار ویژه پس از سوراخ کردن عروق انجام می شود.

برنج. 2-13.واحد آنژیوگرافی مدرن
روش اصلی کاتتریزاسیون عروقی، روش کاتتریزاسیون عروقی سلدینگر است. برای انجام آنژیوگرافی مقدار مشخصی ماده حاجب از طریق کاتتر به داخل رگ تزریق می شود و عبور دارو از رگ ها ثبت می شود.
یک نوع آنژیوگرافی آنژیوگرافی عروق کرونر (CAG) است - تکنیکی برای مطالعه عروق کرونر و اتاق های قلب. این یک تکنیک تحقیقاتی پیچیده است که به آموزش خاص رادیولوژیست و تجهیزات پیچیده نیاز دارد.
در حال حاضر، آنژیوگرافی تشخیصی عروق محیطی (به عنوان مثال، آئورتوگرافی، آنژیوپلمونوگرافی) کمتر و کمتر مورد استفاده قرار می گیرد. با در دسترس بودن دستگاه های سونوگرافی مدرن در کلینیک ها، تشخیص CT و MRI فرآیندهای پاتولوژیک در عروق خونی به طور فزاینده ای با استفاده از تکنیک های کم تهاجمی (CT آنژیوگرافی) یا غیر تهاجمی (سونوگرافی و MRI) انجام می شود. به نوبه خود، با آنژیوگرافی، روش های جراحی کم تهاجمی (کانالیزاسیون مجدد بستر عروق، آنژیوپلاستی با بالون، استنت گذاری) به طور فزاینده ای انجام می شود. بنابراین، توسعه آنژیوگرافی منجر به تولد رادیولوژی مداخله ای شد.
2.7 رادیولوژی مداخله ای
رادیولوژی مداخله ای رشته ای از پزشکی است که مبتنی بر استفاده از روش های تشخیص پرتو و ابزار ویژه برای انجام مداخلات کم تهاجمی به منظور تشخیص و درمان بیماری ها است.
مداخلات مداخلهای در بسیاری از زمینههای پزشکی رایج شدهاند، زیرا اغلب میتوانند جایگزین مداخلات جراحی بزرگ شوند.
اولین درمان از راه پوست برای تنگی شریان محیطی توسط پزشک آمریکایی چارلز داتر در سال 1964 انجام شد. در سال 1977، پزشک سوئیسی آندریاس گرونزیگ یک کاتتر بالونی طراحی کرد و روشی را برای گشاد کردن شریان کرونری تنگی انجام داد. این روش به آنژیوپلاستی بالونی معروف شد.
آنژیوپلاستی با بالون عروق کرونر و محیطی در حال حاضر یکی از روش های اصلی درمان تنگی و گرفتگی عروق است. در صورت عود تنگی ها می توان این روش را بارها تکرار کرد. برای جلوگیری از تنگی های مکرر، در پایان قرن گذشته آنها شروع به استفاده از اندو کردند.
پروتزهای عروقی - استنت. استنت یک ساختار فلزی لولهای است که پس از اتساع بالون در ناحیهای باریک نصب میشود. استنت کشیده از ایجاد تنگی مجدد جلوگیری می کند.
استنت گذاری پس از آنژیوگرافی تشخیصی و تعیین محل باریک شدن بحرانی انجام می شود. استنت با توجه به طول و اندازه آن انتخاب می شود (شکل 2-14). با استفاده از این تکنیک می توان عیوب سپتوم دهلیزی و بین بطنی را بدون آن بستند عملیات بزرگیا بالون پلاستی تنگی دریچه های آئورت، میترال و تریکوسپید را انجام دهید.
تکنیک نصب فیلترهای مخصوص در ورید اجوف تحتانی (فیلترهای کاوا) اهمیت خاصی پیدا کرده است. این برای جلوگیری از ورود آمبولی به عروق ریوی در هنگام ترومبوز وریدهای اندام تحتانی ضروری است. فیلتر ورید اجوف یک ساختار مشبک است که با باز شدن در مجرای ورید اجوف تحتانی، لختههای خون صعودی را به دام میاندازد.
یکی دیگر از مداخلات اندوواسکولار مورد تقاضا در عمل بالینی آمبولیزاسیون (انسداد) عروق خونی است. آمبولیزاسیون برای توقف خونریزی داخلی، درمان آناستوموز عروقی پاتولوژیک، آنوریسم، یا بستن عروق تغذیه کننده یک تومور بدخیم استفاده می شود. در حال حاضر از مواد مصنوعی موثر، بالون های متحرک و کویل های فولادی میکروسکوپی برای آمبولیزاسیون استفاده می شود. به طور معمول، آمبولیزاسیون به طور انتخابی انجام می شود تا باعث ایسکمی بافت های اطراف نشود.

برنج. 2-14.طرح بالون آنژیوپلاستی و استنت گذاری
رادیولوژی مداخله ای همچنین شامل تخلیه آبسه ها و کیست ها، کنتراست حفره های پاتولوژیک از طریق مجاری فیستول، بازیابی مجاری ادراری در صورت اختلالات ادراری، بوژیناژ و بالون پلاستی برای تنگی (تنگی) مری و مجاری صفراوی یا بریدگی است. انجماد تومورهای بدخیم و سایر مداخلات.
پس از شناسایی یک فرآیند پاتولوژیک، اغلب لازم است که به یک گزینه رادیولوژی مداخله ای مانند بیوپسی پانکچر متوسل شوید. آگاهی از ساختار مورفولوژیکی سازند به شما امکان می دهد تاکتیک های درمانی مناسب را انتخاب کنید. بیوپسی پانکچر تحت کنترل اشعه ایکس، اولتراسوند یا سی تی انجام می شود.
در حال حاضر، رادیولوژی مداخله ای به طور فعال در حال توسعه است و در بسیاری از موارد امکان اجتناب از مداخلات جراحی بزرگ را فراهم می کند.
2.8 عوامل کنتراست برای تشخیص تشعشع
کنتراست کم بین اجسام مجاور یا تراکم مشابه بافت های مجاور (مانند خون، دیواره عروق و ترومبوز) تفسیر تصویر را دشوار می کند. در این موارد، تشخیص رادیولوژی اغلب به کنتراست مصنوعی متوسل می شود.
نمونه ای از افزایش کنتراست تصاویر اندام های مورد مطالعه، استفاده از سولفات باریم برای مطالعه اندام های کانال گوارشی است. چنین کنتراست برای اولین بار در سال 1909 اجرا شد.
ایجاد مواد حاجب برای تجویز داخل عروقی دشوارتر بود. برای این منظور پس از آزمایش های فراوان با جیوه و سرب، از ترکیبات ید محلول استفاده شد. اولین نسل از عوامل رادیو کنتراست ناقص بودند. استفاده از آنها باعث عوارض مکرر و شدید (حتی کشنده) شد. اما در حال حاضر در دهه 20-30. قرن XX تعدادی از داروهای حاوی ید محلول در آب بی خطرتر برای تجویز داخل وریدی ایجاد شده است. استفاده گسترده از داروها در این گروه از سال 1953 شروع شد، زمانی که دارویی سنتز شد که مولکول آن از سه اتم ید (دیاتریزوات) تشکیل شده بود.
در سال 1968، موادی توسعه یافتند که اسمولاریته پایینی داشتند (آنها به آنیون و کاتیون در محلول تجزیه نشدند) - عوامل کنتراست غیر یونی.
مواد کنتراست رادیویی مدرن ترکیبات جایگزین تری ید هستند که حاوی سه یا شش اتم ید هستند.
داروهایی برای تجویز داخل عروقی، داخل حفره ای و زیر عنکبوتیه وجود دارد. همچنین می توانید ماده حاجب را در حفره های مفاصل، اندام های حفره ای و زیر غشاها تزریق کنید. نخاع. به عنوان مثال، وارد کردن کنتراست از طریق حفره بدن رحم به لوله ها (هیستروسالپنگوگرافی) به فرد امکان می دهد سطح داخلی حفره رحم و باز بودن لوله های فالوپ را ارزیابی کند. در عمل عصبی، در غیاب MRI، از تکنیک میلوگرافی استفاده می شود - معرفی یک ماده کنتراست محلول در آب در زیر غشاهای نخاع. این به ما امکان می دهد باز بودن فضاهای زیر عنکبوتیه را ارزیابی کنیم. سایر تکنیک های کنتراست مصنوعی شامل آنژیوگرافی، اوروگرافی، فیستولوگرافی، فتق، سیالوگرافی و آرتروگرافی است.
پس از تزریق سریع (بولوس) وریدی ماده حاجب، به سمت راست قلب می رسد، سپس بولوس از بستر عروقی ریه ها عبور کرده و به سمت چپ قلب و سپس آئورت و شاخه های آن می رسد. انتشار سریع ماده حاجب از خون به داخل بافت رخ می دهد. در اولین دقیقه پس از تزریق سریع، غلظت بالایی از ماده حاجب در خون و رگ های خونی باقی می ماند.
تجویز داخل عروقی و داخل حفره ای مواد حاجب حاوی ید در مولکول آنها در موارد نادری می تواند بر بدن اثر نامطلوب داشته باشد. اگر چنین تغییراتی خود را به عنوان علائم بالینی نشان دهند یا مقادیر آزمایشگاهی بیمار را تغییر دهند، به آنها واکنش های نامطلوب می گویند. قبل از معاینه بیمار با استفاده از مواد حاجب، لازم است مشخص شود که آیا او واکنش های آلرژیک به ید، نارسایی مزمن کلیه، آسم برونش و سایر بیماری ها دارد یا خیر. بیمار باید در مورد واکنش احتمالی و مزایای چنین مطالعه ای هشدار داده شود.
در صورت واکنش به تجویز ماده حاجب، پرسنل مطب موظفند برای جلوگیری از عوارض شدید، طبق دستورالعملهای ویژه برای مقابله با شوک آنافیلاکتیک عمل کنند.
در MRI نیز از مواد حاجب استفاده می شود. استفاده از آنها در دهه های اخیر و پس از معرفی فشرده این روش به کلینیک آغاز شد.
استفاده از مواد حاجب در MRI با هدف تغییر خواص مغناطیسی بافت ها است. این تفاوت قابل توجه آنها با مواد حاجب حاوی ید است. در حالی که عوامل کنتراست اشعه ایکس به طور قابل توجهی پرتوهای نافذ را کاهش می دهند، داروهای MRI منجر به تغییراتی در ویژگی های بافت اطراف می شوند. آنها مانند مواد کنتراست اشعه ایکس در توموگرام مشاهده نمی شوند، اما شناسایی فرآیندهای پاتولوژیک پنهان را به دلیل تغییر در شاخص های مغناطیسی ممکن می کنند.
مکانیسم اثر این عوامل بر اساس تغییرات در زمان آرامش یک ناحیه بافتی است. بیشتر این داروها بر پایه گادولینیوم هستند. مواد کنتراست مبتنی بر اکسید آهن بسیار کمتر مورد استفاده قرار می گیرند. این مواد اثرات متفاوتی بر شدت سیگنال دارند.
موارد مثبت (کوتاه کردن زمان آرامش T1) معمولا بر اساس گادولینیم (Gd) و موارد منفی (کوتاه کردن زمان T2) بر اساس اکسید آهن هستند. مواد حاجب مبتنی بر گادولینیوم ترکیبات ایمن تری نسبت به ترکیبات حاوی ید در نظر گرفته می شوند. تنها گزارش های مجزایی از واکنش های آنافیلاکتیک جدی به این مواد وجود دارد. با وجود این، نظارت دقیق بیمار پس از تزریق و در دسترس بودن تجهیزات احیا در دسترس ضروری است. عوامل کنتراست پارامغناطیس در فضاهای داخل عروقی و خارج سلولی بدن توزیع می شوند و از سد خونی مغزی (BBB) عبور نمی کنند. بنابراین، در سیستم عصبی مرکزی، تنها مناطقی که فاقد این مانع هستند به طور معمول در تضاد قرار می گیرند، به عنوان مثال، غده هیپوفیز، غده هیپوفیز، سینوس های کاورنو، سخت افزار. مننژهاو غشاهای مخاطی بینی و سینوس های پارانازال. آسیب و تخریب BBB منجر به نفوذ عوامل کنتراست پارامغناطیس به فضای بین سلولی و تغییر موضعی در آرامش T1 می شود. این در تعدادی از فرآیندهای پاتولوژیک در سیستم عصبی مرکزی مانند تومورها، متاستازها، حوادث عروقی مغز و عفونت مشاهده می شود.
علاوه بر مطالعات MRI سیستم عصبی مرکزی، کنتراست برای تشخیص بیماری های سیستم اسکلتی عضلانی، قلب، کبد، پانکراس، کلیه ها، غدد فوق کلیوی، اندام های لگنی و غدد پستانی استفاده می شود. این مطالعات به طور قابل توجهی انجام می شود
به طور قابل توجهی کمتر از آسیب شناسی CNS. برای انجام آنژیوگرافی MR و مطالعه پرفیوژن اندام، لازم است ماده حاجب با استفاده از یک انژکتور غیر مغناطیسی خاص تجویز شود.
در سال های اخیر امکان استفاده از مواد حاجب برای معاینات سونوگرافی مورد بررسی قرار گرفته است.
برای افزایش اکوژنیک بستر عروقی یا اندام پارانشیمی، ماده حاجب اولتراسوند به صورت داخل وریدی تزریق می شود. اینها می توانند سوسپانسیون ذرات جامد، امولسیون قطرات مایع و اغلب میکرو حباب های گاز قرار گرفته در پوسته های مختلف باشند. مانند سایر مواد حاجب، مواد حاجب اولتراسوند باید سمیت کمی داشته باشند و به سرعت از بدن دفع شوند. داروهای نسل اول از بستر مویرگی ریه ها عبور نمی کردند و در آن از بین می رفتند.
عوامل کنتراست مورد استفاده در حال حاضر به گردش خون سیستمیک می رسند، که استفاده از آنها را برای بهبود کیفیت تصاویر اندام های داخلی، افزایش سیگنال داپلر و مطالعه پرفیوژن ممکن می سازد. در حال حاضر نظر قطعی در مورد توصیه استفاده از مواد حاجب اولتراسوند وجود ندارد.
عوارض جانبی در هنگام تجویز ماده حاجب در 1-5٪ موارد رخ می دهد. اکثریت قریب به اتفاق عوارض جانبی خفیف هستند و نیازی به درمان خاصی ندارند.
توجه ویژه باید به پیشگیری و درمان عوارض شدید شود. میزان بروز چنین عوارضی کمتر از 0.1 درصد است. بزرگترین خطر ایجاد واکنش های آنافیلاکتیک (ویژگی) با تجویز مواد حاوی ید و نارسایی حاد کلیه است.
واکنش ها به تجویز مواد حاجب را می توان به خفیف، متوسط و شدید تقسیم کرد.
در واکنش های خفیف، بیمار احساس گرما یا لرز و حالت تهوع خفیف را تجربه می کند. نیازی به اقدامات درمانی نیست.
با واکنش های متوسط، علائم فوق ممکن است با کاهش فشار خون، بروز تاکی کاردی، استفراغ و کهیر نیز همراه باشد. ارائه درمان علامتی ضروری است (معمولاً تجویز آنتی هیستامین ها، ضد استفراغ، سمپاتومیمتیک ها).
در واکنش های شدید ممکن است رخ دهد شوک آنافیلاکتیک. اقدامات احیای فوری ضروری است
پیوندهایی با هدف حفظ فعالیت اندام های حیاتی.
دسته بندی های زیر از بیماران در معرض خطر بیشتری هستند. این بیماران عبارتند از:
با اختلال شدید عملکرد کلیه و کبد؛
با سابقه آلرژیک سنگین، به ویژه کسانی که قبلاً واکنش های نامطلوب به مواد حاجب داشته اند.
با نارسایی شدید قلبی یا فشار خون ریوی؛
با اختلال شدید عملکرد غده تیروئید؛
با دیابت شدید، فئوکروموسیتوم، میلوم.
کودکان خردسال و افراد مسن نیز در معرض خطر ابتلا به عوارض جانبی هستند.
پزشكی كه مطالعه را تجویز میكند، باید هنگام انجام مطالعات با ماده حاجب، نسبت خطر/منفعت را به دقت ارزیابی كرده و احتیاطهای لازم را انجام دهد. رادیولوژیست که مطالعه ای را بر روی بیمار با خطر بالای واکنش های جانبی به ماده حاجب انجام می دهد، موظف است به بیمار و پزشک معالج در مورد خطرات استفاده از مواد حاجب هشدار دهد و در صورت لزوم، مطالعه دیگری را جایگزین کند که نیازی به آن ندارد. تضاد.
اتاق اشعه ایکس باید مجهز به همه چیز لازم برای انجام اقدامات احیا و مبارزه با شوک آنافیلاکتیک باشد.
روشهای تشخیص تشعشع
رادیولوژیروشهای تشخیص تشعشع
کشف اشعه ایکس آغاز دوره جدیدی در تشخیص پزشکی - عصر رادیولوژی - بود. متعاقبا، زرادخانه ابزارهای تشخیصی با روش های مبتنی بر انواع دیگر پرتوهای یونیزان و غیریونیزان (رادیوایزوتوپ، روش های اولتراسوند، تصویربرداری رزونانس مغناطیسی) پر شد. سال به سال، روش های تحقیق در مورد تشعشعات بهبود یافته است. در حال حاضر آنها نقش اصلی را در شناسایی و تعیین ماهیت اکثر بیماری ها ایفا می کنند.
در این مرحله از مطالعه، شما یک هدف (کلی) دارید: بتوانید اصول به دست آوردن تصویر تشخیصی پزشکی را با استفاده از روش های مختلف پرتو و هدف این روش ها تفسیر کنید.
دستیابی به یک هدف مشترک با اهداف خاص تضمین می شود:
قادر بودن به:
1) تفسیر اصول به دست آوردن اطلاعات با استفاده از اشعه ایکس، رادیوایزوتوپ، روش های تحقیق اولتراسوند و تصویربرداری رزونانس مغناطیسی.
2) هدف این روش های تحقیق را تفسیر کنید.
3) اصول کلی انتخاب روش تحقیق پرتو بهینه را تفسیر کنید.
تسلط بر اهداف فوق بدون دانش و مهارت های پایه ای که در گروه فیزیک پزشکی و بیولوژیکی تدریس می شود غیرممکن است:
1) اصول تولید و ویژگی های فیزیکی اشعه ایکس را تفسیر کنید.
2) رادیواکتیویته، تشعشعات حاصل و خصوصیات فیزیکی آنها را تفسیر کنید.
3) اصول تولید امواج اولتراسونیک و خصوصیات فیزیکی آنها را تفسیر کنید.
5) پدیده تشدید مغناطیسی را تفسیر کنید.
6) مکانیسم عمل بیولوژیکی انواع مختلف تابش را تفسیر کنید.
1. روش تحقیق اشعه ایکس
معاینه اشعه ایکس هنوز نقش مهمی در تشخیص بیماری های انسانی دارد. این بر اساس درجات مختلف جذب اشعه ایکس توسط بافت ها و اندام های مختلف بدن انسان است. اشعه ها به میزان بیشتری در استخوان ها، به میزان کمتری - در اندام های پارانشیم، ماهیچه ها و مایعات بدن، حتی کمتر - در بافت چربی جذب می شوند و تقریباً در گازها باقی نمی مانند. در مواردی که اندام های مجاور به طور مساوی اشعه ایکس را جذب می کنند، در طول معاینه اشعه ایکس قابل تشخیص نیستند. در چنین شرایطی به کنتراست مصنوعی متوسل می شود. در نتیجه، معاینه اشعه ایکس را می توان در شرایط کنتراست طبیعی یا کنتراست مصنوعی انجام داد. تکنیک های مختلف معاینه اشعه ایکس وجود دارد.
هدف (کلی) مطالعه این بخش این است که بتوانیم اصول به دست آوردن تصاویر اشعه ایکس و هدف روش های مختلف معاینه اشعه ایکس را تفسیر کنیم.
1) اصول اکتساب تصویر را با استفاده از فلوروسکوپی، رادیوگرافی، توموگرافی، فلوروگرافی، تکنیک های تحقیق کنتراست، توموگرافی کامپیوتری تفسیر کنید.
2) هدف از فلوروسکوپی، رادیوگرافی، توموگرافی، فلوروگرافی، تکنیک های تحقیق کنتراست، توموگرافی کامپیوتری را تفسیر کنید.
1.1. اشعه ایکس
فلوروسکوپی، یعنی به دست آوردن یک تصویر سایه بر روی صفحه نمایش نیمه شفاف (فلورسنت) در دسترس ترین و از نظر فنی ساده ترین روش تحقیق است. این به ما امکان می دهد شکل، موقعیت و اندازه اندام و در برخی موارد عملکرد آن را قضاوت کنیم. با معاینه بیمار در برجستگی ها و موقعیت های مختلف بدن، رادیولوژیست به درک سه بعدی از اندام های انسان و آسیب شناسی شناسایی شده دست می یابد. هر چه تشعشعات بیشتری توسط اندام یا تشکیلات پاتولوژیک مورد بررسی جذب شود، پرتوهای کمتری به صفحه نمایش برخورد می کند. بنابراین، چنین اندام یا سازندی بر صفحه فلورسنت سایه می اندازد. و بالعکس، اگر اندام یا آسیب شناسی چگالی کمتری داشته باشد، پرتوهای بیشتری از آنها عبور می کند و به صفحه نمایش برخورد می کند و باعث شفاف شدن (درخشش) آن می شود.
صفحه فلورسنت به طور ضعیف می درخشد. بنابراین، این مطالعه در یک اتاق تاریک انجام می شود و پزشک باید ظرف 15 دقیقه خود را با تاریکی وفق دهد. دستگاه های اشعه ایکس مدرن مجهز به مبدل های نوری الکترون هستند که تصویر اشعه ایکس را تقویت کرده و به مانیتور (صفحه تلویزیون) منتقل می کنند.
با این حال، فلوروسکوپی دارای معایب قابل توجهی است. اولاً باعث قرار گرفتن در معرض تابش قابل توجهی می شود. دوم اینکه وضوح آن بسیار کمتر از رادیوگرافی است.
این معایب در هنگام استفاده از اسکن تلویزیون با اشعه ایکس کمتر مشخص می شود. در مانیتور می توانید روشنایی و کنتراست را تغییر دهید و از این طریق ایجاد کنید شرایط بهتربرای مشاهده. وضوح چنین فلوروسکوپی بسیار بالاتر است و قرار گرفتن در معرض تابش کمتر است.
با این حال، هر غربالگری ذهنی است. همه پزشکان باید به تخصص رادیولوژیست تکیه کنند. در برخی موارد برای عینیت بخشیدن به مطالعه، رادیولوژیست در طول کپی رادیوگرافی می گیرد. برای همین منظور، یک ضبط ویدئویی از مطالعه با استفاده از اسکن تلویزیون اشعه ایکس نیز انجام شده است.
1.2. رادیوگرافی
رادیوگرافی روشی برای بررسی اشعه ایکس است که در آن تصویری بر روی فیلم اشعه ایکس به دست می آید. رادیوگرافی نسبت به تصویر قابل مشاهده در صفحه فلوروسکوپی منفی است. بنابراین، نواحی روشن روی صفحه با نواحی تیره روی فیلم (به اصطلاح برجسته) و بالعکس، نواحی تیره با مناطق روشن (سایه ها) مطابقت دارد. رادیوگرافی همیشه یک تصویر مسطح با مجموع تمام نقاط واقع در طول مسیر پرتو تولید می کند. برای به دست آوردن یک نمایش سه بعدی، لازم است حداقل 2 عکس در صفحات عمود بر یکدیگر گرفته شود. مزیت اصلی رادیوگرافی توانایی ثبت تغییرات قابل تشخیص است. علاوه بر این، وضوح قابل توجهی بیشتر از فلوروسکوپی دارد.
در سال های اخیر، رادیوگرافی دیجیتال کاربرد پیدا کرده است، که در آن صفحات ویژه به عنوان گیرنده اشعه ایکس عمل می کنند. پس از قرار گرفتن در معرض اشعه ایکس، تصویری نهفته از جسم روی آنها باقی می ماند. هنگام اسکن صفحات پرتو لیزرانرژی به شکل درخششی آزاد می شود که شدت آن متناسب با دوز تابش اشعه ایکس جذب شده است. این درخشش توسط یک ردیاب نوری ثبت شده و به فرمت دیجیتال تبدیل می شود. تصویر حاصل را می توان روی یک مانیتور نمایش داد، روی چاپگر چاپ کرد و در حافظه کامپیوتر ذخیره کرد.
1.3. توموگرافی
توموگرافی یک روش اشعه ایکس برای بررسی لایه به لایه اندام ها و بافت ها است. در توموگرام، برخلاف اشعه ایکس، تصاویری از ساختارهای واقع در هر صفحه به دست میآید، یعنی. اثر جمع حذف می شود. این از طریق حرکت همزمان لوله و فیلم اشعه ایکس حاصل می شود. ظهور توموگرافی کامپیوتری استفاده از توموگرافی را به شدت کاهش داده است.
1.4. فلوروگرافی
فلوروگرافی معمولاً برای انجام معاینات غربالگری انبوه اشعه ایکس، به ویژه برای تشخیص آسیب شناسی ریه استفاده می شود. ماهیت این روش عکاسی از یک تصویر از یک صفحه اشعه ایکس یا یک صفحه تقویت کننده نوری الکترونی بر روی فیلم عکاسی است. اندازه قاب معمولاً 70x70 یا 100x100 میلی متر است. در فلوروگرام، جزئیات تصویر بهتر از فلوروسکوپی، اما بدتر از رادیوگرافی قابل مشاهده است. دوز تابش دریافت شده توسط آزمودنی نیز بیشتر از رادیوگرافی است.
1.5. روش های معاینه اشعه ایکس در شرایط کنتراست مصنوعی
همانطور که در بالا ذکر شد، تعدادی از اندام ها، به ویژه اندام های توخالی، اشعه ایکس را تقریباً به طور مساوی با بافت های نرم اطراف جذب می کنند. بنابراین، آنها در طول معاینه اشعه ایکس شناسایی نمی شوند. برای تجسم، آنها را با تزریق ماده حاجب به طور مصنوعی کنتراست می کنند. اغلب برای این منظور از ترکیبات یدید مایع مختلف استفاده می شود.
در برخی موارد، به دست آوردن تصویری از برونش ها، به ویژه در موارد برونشکتازی، نقایص مادرزادی برونش، یا وجود فیستول داخلی برونش یا برونش پلورال مهم است. در چنین مواردی، مطالعه با استفاده از لوله های برونش متضاد - برونشوگرافی - به ایجاد تشخیص کمک می کند.
رگ های خونی به استثنای رگ های ریوی در اشعه ایکس معمولی قابل مشاهده نیستند. برای ارزیابی وضعیت آنها، آنژیوگرافی انجام می شود - معاینه اشعه ایکس رگ های خونی با استفاده از ماده حاجب. در طی آرتریوگرافی، ماده حاجب به داخل شریان ها و در طی ونوگرافی به داخل سیاهرگ ها تزریق می شود.
هنگامی که ماده حاجب به یک سرخرگ تزریق می شود، تصویر به طور معمول مراحل جریان خون را به صورت متوالی نشان می دهد: شریانی، مویرگی و وریدی.
هنگام مطالعه سیستم ادراری، مطالعات کنتراست از اهمیت ویژه ای برخوردار است.
اوروگرافی دفعی (دفعی) و پیلوگرافی رتروگراد (صعودی) وجود دارد. اوروگرافی دفعی بر اساس توانایی فیزیولوژیکی کلیه ها در جذب مواد یددار از خون است. ترکیبات آلی، آنها را غلیظ کرده و از طریق ادرار دفع کنید. قبل از مطالعه، بیمار نیاز به آماده سازی مناسب - پاکسازی روده دارد. مطالعه با معده خالی انجام می شود. معمولا 20-40 میلی لیتر از یکی از مواد اوروتروپیک به داخل ورید کوبیتال تزریق می شود. سپس بعد از 3-5، 10-14 و 20-25 دقیقه عکس گرفته می شود. اگر عملکرد ترشحی کلیه ها کاهش یابد، اوروگرافی انفوزیونی انجام می شود. در این مورد، مقدار زیادی ماده حاجب (60 تا 100 میلی لیتر)، رقیق شده با محلول گلوکز 5٪ به آرامی به بیمار تزریق می شود.
اوروگرافی دفعی امکان ارزیابی نه تنها لگن، کالیس ها، حالب ها، شکل کلیو اندازه کلیه ها و همچنین وضعیت عملکردی آنها.
در بیشتر موارد، اوروگرافی دفعی اطلاعات کافی در مورد سیستم کلیه- لگنی فراهم می کند. اما هنوز، در موارد جداگانه، زمانی که به دلایلی (به عنوان مثال، با کاهش قابل توجه یا عدم عملکرد کلیه)، پیلوگرافی صعودی (رتروگراد) انجام می شود. برای انجام این کار، یک کاتتر در حالب تا سطح مورد نظر، درست تا لگن وارد می شود، ماده حاجب (7-10 میلی لیتر) از طریق آن تزریق می شود و عکس گرفته می شود.
برای مطالعه مجاری صفراوی، در حال حاضر از کوله گرافی ترانس کبدی و کوله سیستوکولانژیوگرافی داخل وریدی استفاده می شود. در حالت اول، ماده حاجب از طریق کاتتر مستقیماً به مجرای صفراوی مشترک تزریق می شود. در حالت دوم، ماده حاجب به صورت داخل وریدی در سلول های کبدی با صفرا مخلوط شده و با آن دفع می شود و مجاری صفراوی و کیسه صفرا را پر می کند.
برای ارزیابی باز بودن لوله های فالوپ از هیستروسالپنگوگرافی (متروسلپنگوگرافی) استفاده می شود که در آن ماده حاجب با استفاده از یک سرنگ مخصوص از طریق واژن به داخل حفره رحم تزریق می شود.
یک روش کنتراست اشعه ایکس برای مطالعه مجاری غدد مختلف (پستانی، بزاقی و غیره) داکتوگرافی و مجاری فیستول های مختلف فیستولوگرافی نامیده می شود.
دستگاه گوارش تحت شرایط کنتراست مصنوعی با استفاده از سوسپانسیون سولفات باریم مورد مطالعه قرار می گیرد که بیمار هنگام معاینه مری، معده و روده کوچک به صورت خوراکی مصرف می کند و هنگام معاینه کولون به صورت رتروگراد تجویز می شود. ارزیابی وضعیت دستگاه گوارش لزوماً توسط فلوروسکوپی با یک سری رادیوگرافی انجام می شود. مطالعه روده بزرگ نام خاصی دارد - ایریگوسکوپی با ایریگوگرافی.
1.6. سی تی اسکن
توموگرافی کامپیوتری (CT) روشی برای بررسی لایه به لایه اشعه ایکس است که مبتنی بر پردازش کامپیوتری تصاویر پرتو ایکس متعدد از لایههای بدن انسان در مقطع است. در اطراف بدن انسان، چندین حسگر یونیزاسیون یا سوسوزن در اطراف محیط قرار دارند و تابش اشعه ایکس را که از سوژه عبور کرده است، می گیرند.
پزشک با استفاده از کامپیوتر می تواند تصویر را بزرگ کند، قسمت های مختلف آن را برجسته و بزرگ کند، ابعاد را تعیین کند و آنچه بسیار مهم است، تراکم هر ناحیه را در واحدهای معمولی تخمین بزند. اطلاعات مربوط به تراکم بافت را می توان به صورت اعداد و هیستوگرام ارائه کرد. برای اندازه گیری چگالی از مقیاس هاونسوایلد با دامنه بیش از 4000 واحد استفاده می شود. چگالی آب به عنوان سطح چگالی صفر در نظر گرفته می شود. تراکم استخوان ها از 800+ تا 3000+ واحد H (Hounswild)، بافت پارانشیمی - در 40-80 واحد H، هوا و گازها - حدود -1000 واحد H متغیر است.
سازندهای متراکم در CT سبکتر قابل مشاهده هستند و هیپر متراکم نامیده می شوند، سازندهای با متراکم کمتر سبکتر هستند و هیپودنس نامیده می شوند.
از عوامل کنتراست نیز برای افزایش کنتراست در سی تی اسکن استفاده می شود. ترکیبات یدید که به صورت داخل وریدی تجویز می شوند، تجسم کانون های پاتولوژیک در اندام های پارانشیمی را بهبود می بخشند.
مزیت مهم توموگرافی کامپیوتری مدرن، توانایی بازسازی یک تصویر سه بعدی از یک جسم با استفاده از مجموعه ای از تصاویر دو بعدی است.
2. روش های تحقیق رادیونوکلئید
امکان دستیابی به ایزوتوپ های رادیواکتیو مصنوعی، امکان گسترش دامنه کاربرد ردیاب های رادیواکتیو را در شاخه های مختلف علوم از جمله پزشکی فراهم کرده است. تصویربرداری رادیونوکلئید بر اساس ثبت تشعشعات ساطع شده از یک ماده رادیواکتیو در داخل بیمار است. بنابراین، آنچه بین تشخیص اشعه ایکس و رادیونوکلئید مشترک است، استفاده از پرتوهای یونیزان است.
مواد رادیواکتیو که رادیوداروها (RPs) نامیده می شوند، می توانند هم برای اهداف تشخیصی و هم برای اهداف درمانی استفاده شوند. همه آنها حاوی رادیونوکلئیدها هستند - اتم های ناپایدار که به طور خود به خود با آزاد شدن انرژی تجزیه می شوند. یک رادیودارو ایده آل فقط در اندام ها و ساختارهایی که برای تصویربرداری هدف گذاری شده اند تجمع می یابد. تجمع رادیوداروها می تواند به عنوان مثال توسط فرآیندهای متابولیکی (مولکول حامل ممکن است بخشی از یک زنجیره متابولیک باشد) یا توسط پرفیوژن موضعی اندام ایجاد شود. توانایی مطالعه توابع فیزیولوژیکی به موازات تعیین پارامترهای توپوگرافی و تشریحی مزیت اصلی روش های تشخیص رادیونوکلئیدی است.
برای تصویربرداری از رادیونوکلئیدهایی که پرتوهای گاما ساطع می کنند استفاده می شود، زیرا ذرات آلفا و بتا نفوذ کمی در بافت دارند.
بسته به میزان تجمع رادیودارو، بین کانون های "گرم" (با افزایش تجمع) و کانون های "سرد" (با کاهش یا بدون تجمع) تمایز قائل می شوند.
چندین روش مختلف برای آزمایش رادیونوکلئید وجود دارد.
هدف (کلی) مطالعه این بخش این است که بتوانیم اصول به دست آوردن تصاویر رادیونوکلئیدی و هدف روش های مختلف تحقیق رادیونوکلئید را تفسیر کنیم.
برای انجام این کار باید بتوانید:
1) تفسیر اصول اکتساب تصویر در طول اسکن، توموگرافی کامپیوتری انتشار (تک فوتون و پوزیترون).
2) اصول به دست آوردن منحنی های رادیوگرافی را تفسیر کنید.
2) هدف از سینتی گرافی، توموگرافی کامپیوتری انتشار، رادیوگرافی را تفسیر کنید.
سینتی گرافی رایج ترین روش تصویربرداری رادیونوکلئیدی است. این مطالعه با استفاده از دوربین گاما انجام شده است. جزء اصلی آن یک کریستال سوسوزن دیسکی شکل از یدید سدیم با قطر زیاد (حدود 60 سانتی متر) است. این کریستال یک آشکارساز است که تابش گامای ساطع شده از رادیودارو را می گیرد. در جلوی کریستال در سمت بیمار یک دستگاه محافظ سرب مخصوص وجود دارد - یک کولیماتور، که تابش تابش را بر روی کریستال تعیین می کند. سوراخهای موازی روی کولیماتور، نمایش دو بعدی توزیع رادیودارو در مقیاس 1:1 را بر روی سطح کریستال تسهیل میکند.
برخورد فوتون های گاما به کریستال سوسوزن باعث فلش نور (سوزن) روی آن می شود که به یک لوله فتو ضربی کننده منتقل می شود که سیگنال های الکتریکی تولید می کند. بر اساس ثبت این سیگنال ها، یک تصویر دو بعدی از توزیع رادیودارو بازسازی می شود. تصویر نهایی را می توان در قالب آنالوگ بر روی فیلم عکاسی ارائه کرد. با این حال، اکثر دوربین های گاما می توانند تصاویر دیجیتال نیز ایجاد کنند.
اکثر مطالعات سینتی گرافی پس از تجویز داخل وریدی یک رادیودارو انجام می شود (به استثنای استنشاق زنون رادیواکتیو در طی اسکن ریه استنشاقی).
در سینتی گرافی پرفیوژن ریه از ماکروآگرگات ها یا میکروسفرهای آلبومین با برچسب 99 mTc استفاده می شود که در کوچکترین شریان های ریوی باقی می مانند. تصاویر در برجستگی های مستقیم (قدامی و خلفی)، جانبی و مایل به دست می آیند.
سینتی گرافی اسکلتی با استفاده از دی فسفونات های نشاندار شده با Tc99m انجام می شود که در بافت استخوانی فعال متابولیکی تجمع می یابند.
برای مطالعه کبد از هپاتوبلیس سینتی گرافی و هپاتوسنتی گرافی استفاده می شود. روش اول به بررسی عملکرد صفراوی و صفراوی کبد و وضعیت مجاری صفراوی - باز بودن، ذخیره و انقباض کیسه صفرا آنها می پردازد و یک مطالعه سینتی گرافی پویا است. این بر اساس توانایی سلول های کبدی برای جذب برخی از مواد آلی از خون و انتقال آنها در صفرا است.
هپاتوسنتی گرافی - اسکن استاتیک - به شما امکان می دهد عملکرد مانع کبد و طحال را ارزیابی کنید و بر اساس این واقعیت است که رتیکولوسیت های ستاره ای کبد و طحال، تصفیه پلاسما، ذرات فاگوسیتوز محلول کلوئیدی رادیودارویی را انجام می دهند.
برای مطالعه کلیه ها از نفروسینتی گرافی استاتیک و دینامیک استفاده می شود. ماهیت روش به دست آوردن تصویری از کلیه ها با تثبیت رادیوداروهای نفروتروپیک در آنها است.
2.2. توموگرافی کامپیوتری گسیل
توموگرافی کامپیوتری با انتشار تک فوتون (SPECT) به طور گسترده ای در کاردیولوژی و عصب شناسی استفاده می شود. این روش مبتنی بر چرخش یک دوربین گاما معمولی در اطراف بدن بیمار است. ثبت تابش در نقاط مختلف دایره به فرد امکان می دهد یک تصویر مقطعی را بازسازی کند.
توموگرافی گسیل پوزیترون (PET)، بر خلاف سایر روش های بررسی رادیونوکلئید، مبتنی بر استفاده از پوزیترون های ساطع شده توسط رادیونوکلئیدها است. پوزیترون ها که جرمی برابر با الکترون ها دارند، بار مثبت دارند. پوزیترون گسیل شده بلافاصله با یک الکترون مجاور برهمکنش می کند (واکنشی که نابودی نامیده می شود) و در نتیجه دو فوتون پرتو گاما در جهت مخالف حرکت می کنند. این فوتون ها توسط آشکارسازهای مخصوص ثبت می شوند. سپس اطلاعات به کامپیوتر منتقل شده و به تصویر دیجیتال تبدیل می شود.
PET امکان تعیین کمیت غلظت پرتوزا و در نتیجه مطالعه فرآیندهای متابولیک در بافت ها را فراهم می کند.
2.3. رادیوگرافی
رادیوگرافی روشی برای ارزیابی عملکرد یک اندام از طریق ثبت گرافیکی خارجی تغییرات رادیواکتیویته بالای آن است. در حال حاضر، این روش عمدتا برای بررسی وضعیت کلیه ها - رادیورنوگرافی استفاده می شود. دو آشکارساز سینتی گرافی تشعشع را روی کلیه راست و چپ ثبت می کنند و سومی روی قلب. تجزیه و تحلیل کمی و کیفی از renograms به دست آمده انجام شده است.
3. روش های تحقیق اولتراسوند
اولتراسوند به امواج صوتی با فرکانس بالای 20000 هرتز، یعنی. بالاتر از آستانه شنوایی گوش انسان سونوگرافی در تشخیص برای به دست آوردن تصاویر مقطعی (برش) و اندازه گیری سرعت جریان خون استفاده می شود. رایج ترین فرکانس های مورد استفاده در رادیولوژی در محدوده 2-10 مگاهرتز (1 مگاهرتز = 1 میلیون هرتز) است. روش تصویربرداری اولتراسوند سونوگرافی نامیده می شود. فناوری اندازه گیری سرعت جریان خون داپلروگرافی نامیده می شود.
هدف (کلی) مطالعه این بخش، یادگیری تفسیر اصول به دست آوردن تصاویر اولتراسوند و هدف روش های مختلف تحقیق سونوگرافی است.
برای انجام این کار باید بتوانید:
1) تفسیر اصول به دست آوردن اطلاعات در طول سونوگرافی و داپلروگرافی.
2) هدف سونوگرافی و داپلروگرافی را تفسیر کنید.
3.1. سونوگرافی
سونوگرافی با عبور یک پرتو اولتراسوند با جهت باریک از بدن بیمار انجام می شود. سونوگرافی توسط یک مبدل مخصوص تولید می شود که معمولاً روی پوست بیمار در ناحیه آناتومیکی مورد بررسی قرار می گیرد. سنسور حاوی یک یا چند کریستال پیزوالکتریک است. اعمال پتانسیل الکتریکی به کریستال منجر به تغییر شکل مکانیکی آن می شود و فشرده سازی مکانیکی کریستال یک پتانسیل الکتریکی ایجاد می کند (اثر پیزوالکتریک معکوس و مستقیم). ارتعاشات مکانیکی کریستال اولتراسوند تولید می کند که از بافت های مختلف منعکس می شود و به صورت پژواک به مبدل باز می گردد و ارتعاشات مکانیکی کریستال و در نتیجه سیگنال های الکتریکی با فرکانس مشابه اکو ایجاد می کند. به این ترتیب اکو ضبط می شود.
شدت سونوگرافی با عبور از بافت بدن بیمار به تدریج کاهش می یابد. دلیل اصلی این امر جذب اولتراسوند به صورت گرما است.
بخش جذب نشده اولتراسوند ممکن است به صورت اکو توسط بافت به مبدل پراکنده یا منعکس شود. سهولت عبور اولتراسوند از بافت تا حدی به جرم ذرات (که چگالی بافت را تعیین می کند) و تا حدی به نیروهای الاستیکی که ذرات را به یکدیگر جذب می کنند بستگی دارد. چگالی و خاصیت ارتجاعی پارچه با هم، مقاومت آکوستیک آن را مشخص می کند.
هر چه تغییر امپدانس آکوستیک بیشتر باشد، انعکاس سونوگرافی بیشتر است. تفاوت زیادی در امپدانس صوتی در رابط بافت نرم-گاز وجود دارد و تقریباً تمام اولتراسوند از آن منعکس می شود. بنابراین از ژل مخصوصی برای از بین بردن هوای بین پوست بیمار و سنسور استفاده می شود. به همین دلیل، سونوگرافی اجازه تجسم نواحی واقع در پشت روده (از آنجایی که روده ها با گاز پر شده است) و بافت ریه حاوی هوا را نمی دهد. همچنین تفاوت نسبتا زیادی در امپدانس صوتی بین بافت نرم و استخوان وجود دارد. بنابراین اکثر ساختارهای استخوانی مانع از سونوگرافی می شوند.
ساده ترین راه برای نمایش اکو ضبط شده به اصطلاح حالت A (حالت دامنه) است. در این قالب، پژواک ها از اعماق مختلف به صورت قله های عمودی در یک خط عمق افقی نمایش داده می شوند. قدرت اکو ارتفاع یا دامنه هر یک از پیک های نشان داده شده را تعیین می کند. فرمت A-mode تنها یک تصویر یک بعدی از تغییرات امپدانس صوتی در امتداد خط عبور پرتو اولتراسوند ارائه می دهد و در تشخیص به میزان بسیار محدودی (در حال حاضر فقط برای بررسی کره چشم) استفاده می شود.
یک جایگزین برای حالت A، حالت M است (M - حرکت، حرکت). در این تصویر، محور عمق در مانیتور به صورت عمودی جهت گیری شده است. پژواک های مختلف به صورت نقطه منعکس می شوند که روشنایی آن ها با قدرت اکو تعیین می شود. این نقاط روشن در سراسر صفحه نمایش از چپ به راست حرکت می کنند، در نتیجه منحنی های روشن ایجاد می کنند که موقعیت تغییر ساختارهای بازتابنده را در طول زمان نشان می دهد. منحنی های حالت M اطلاعات دقیقی در مورد رفتار دینامیکی سازه های بازتابی واقع در امتداد پرتو اولتراسوند ارائه می دهند. این روش برای به دست آوردن تصاویر یک بعدی پویا از قلب (دیواره های محفظه و لت های دریچه قلب) استفاده می شود.
پرکاربردترین حالت در رادیولوژی حالت B (B - روشنایی) است. این اصطلاح به این معنی است که پژواک به صورت نقطههایی روی صفحه نمایش داده میشود که میزان روشنایی آنها با قدرت اکو مشخص میشود. حالت B یک تصویر آناتومیک مقطعی دو بعدی (برش) را در زمان واقعی ارائه می دهد. تصاویر به صورت مستطیل یا سکتور روی صفحه ایجاد می شوند. تصاویر پویا هستند و می توانند پدیده هایی مانند حرکات تنفسی، ضربان های عروقی، ضربان قلب و حرکات جنین را نشان دهند. دستگاه های سونوگرافی مدرن از فناوری دیجیتال استفاده می کنند. سیگنال الکتریکی آنالوگ تولید شده در سنسور دیجیتالی می شود. تصویر نهایی روی مانیتور با سایه های مقیاس خاکستری نشان داده می شود. نواحی روشن تر هیپراکویک و نواحی تیره تر هیپو و آنکوییک نامیده می شوند.
3.2. داپلروگرافی
اندازه گیری سرعت جریان خون با استفاده از اولتراسوند بر اساس این پدیده فیزیکی است که فرکانس صدای منعکس شده از یک جسم متحرک در مقایسه با فرکانس صدای ارسالی هنگام دریافت توسط گیرنده ثابت تغییر می کند (اثر داپلر).
در طول معاینه داپلر عروق خونی، یک پرتو اولتراسوند تولید شده توسط یک سنسور داپلر خاص از بدن عبور می کند. هنگامی که این پرتو از یک رگ یا اتاق قلب عبور می کند، بخش کوچکی از سونوگرافی از گلبول های قرمز منعکس می شود. فرکانس امواج پژواک منعکس شده از این سلول ها در حرکت به سمت سنسور بیشتر از امواج ساطع شده توسط خود سنسور خواهد بود. تفاوت بین فرکانس اکو دریافتی و فرکانس اولتراسوند تولید شده توسط مبدل را تغییر فرکانس داپلر یا فرکانس داپلر می گویند. این تغییر فرکانس با سرعت جریان خون نسبت مستقیم دارد. هنگام اندازه گیری جریان، تغییر فرکانس به طور مداوم توسط دستگاه اندازه گیری می شود. اکثر این سیستم ها به طور خودکار تغییر در فرکانس اولتراسوند را به سرعت جریان خون نسبی (مثلاً بر حسب متر بر ثانیه) تبدیل می کنند که با استفاده از آن می توان سرعت جریان خون واقعی را محاسبه کرد.
تغییر فرکانس داپلر معمولاً در محدوده فرکانسی قابل شنیدن برای گوش انسان قرار دارد. بنابراین، تمام تجهیزات داپلر مجهز به بلندگوهایی هستند که به شما امکان شنیدن تغییر فرکانس داپلر را می دهند. این "صدای جریان" هم برای تشخیص عروق و هم برای ارزیابی نیمه کمی ماهیت جریان خون و سرعت آن استفاده می شود. با این حال، چنین نمایشگر صوتی برای تخمین دقیق سرعت کاربرد کمی دارد. در این راستا، یک مطالعه داپلر نمایش بصری سرعت جریان را ارائه می دهد - معمولاً به شکل نمودار یا به شکل امواج، که در آن ترتیب سرعت و آبسیسا زمان است. در مواردی که جریان خون به سمت سنسور هدایت می شود، نمودار داپلروگرام در بالای ایزولین قرار می گیرد. اگر جریان خون از حسگر دور شود، نمودار زیر ایزولین قرار می گیرد.
دو گزینه اساساً متفاوت برای انتشار و دریافت اولتراسوند هنگام استفاده از اثر داپلر وجود دارد: موج ثابت و پالس. در حالت موج پیوسته، سنسور داپلر از دو کریستال مجزا استفاده می کند. یک کریستال به طور مداوم اولتراسوند منتشر می کند، در حالی که دیگری پژواک دریافت می کند و امکان اندازه گیری سرعت های بسیار بالا را فراهم می کند. از آنجایی که سرعت ها به طور همزمان در محدوده وسیعی از اعماق اندازه گیری می شوند، امکان اندازه گیری انتخابی سرعت در یک عمق خاص و از پیش تعیین شده وجود ندارد.
در حالت پالس، همان کریستال اولتراسوند منتشر می کند و دریافت می کند. اولتراسوند در پالس های کوتاه منتشر می شود و پژواک در طول دوره های انتظار بین ارسال پالس ثبت می شود. فاصله زمانی بین ارسال پالس و دریافت اکو عمق اندازه گیری سرعت را تعیین می کند. داپلر پالسی می تواند سرعت جریان را در حجم های بسیار کوچک (به نام حجم های کنترل) که در امتداد پرتو اولتراسوند قرار دارند اندازه گیری کند، اما بالاترین سرعت های موجود برای اندازه گیری به طور قابل توجهی کمتر از سرعت های قابل اندازه گیری با داپلر موج پیوسته است.
در حال حاضر رادیولوژی از اسکنرهای دوبلکس استفاده می کند که ترکیبی از سونوگرافی و داپلروگرافی پالس هستند. با اسکن دوبلکس، جهت پرتو داپلر بر روی تصویر حالت B قرار می گیرد و بنابراین با استفاده از نشانگرهای الکترونیکی می توان اندازه و مکان ولوم کنترل را در جهت پرتو انتخاب کرد. با حرکت مکان نما الکترونیکی به موازات جهت جریان خون، تغییر داپلر به طور خودکار اندازه گیری می شود و سرعت جریان واقعی نمایش داده می شود.
تجسم رنگی جریان خون - پیشرفتهای بعدیاسکن دوبلکس رنگ ها روی تصویر حالت B قرار می گیرند تا حضور خون متحرک را نشان دهند. بافتهای ثابت در سایههای مقیاس خاکستری و رگها به رنگ نمایش داده میشوند (سایههای آبی، قرمز، زرد، سبز که با سرعت نسبی و جهت جریان خون تعیین میشود). تصویر رنگی تصوری از وجود عروق مختلف و جریان خون می دهد، اما اطلاعات کمی که توسط این روش ارائه می شود نسبت به مطالعات داپلر موج پیوسته یا پالس دقت کمتری دارد. بنابراین، تجسم رنگی جریان خون همیشه با سونوگرافی داپلر پالس ترکیب می شود.
4. روش تحقیق رزونانس مغناطیسی
هدف (کلی) مطالعه این بخش، یادگیری تفسیر اصول به دست آوردن اطلاعات از روش های تحقیق تشدید مغناطیسی و تفسیر هدف آنها است.
برای انجام این کار باید بتوانید:
1) اصول به دست آوردن اطلاعات از تصویربرداری رزونانس مغناطیسی و طیف سنجی تشدید مغناطیسی را تفسیر کنید.
2) هدف از تصویربرداری رزونانس مغناطیسی و طیف سنجی تشدید مغناطیسی را تفسیر کنید.
4.1. تصویربرداری رزونانس مغناطیسی
تصویربرداری رزونانس مغناطیسی (MRI) "جوان ترین" روش رادیولوژی است. اسکنرهای تصویربرداری تشدید مغناطیسی به شما این امکان را می دهند که تصاویر مقطعی از هر قسمت از بدن را در سه صفحه ایجاد کنید.
اجزای اصلی یک اسکنر MRI یک آهنربای قوی، یک فرستنده رادیویی، یک سیم پیچ دریافت فرکانس رادیویی و یک کامپیوتر است. داخل آهنربا یک تونل استوانه ای شکل است که به اندازه کافی بزرگ است که یک فرد بالغ را داخل آن قرار دهد.
تصویربرداری MR از میدان های مغناطیسی از 0.02 تا 3 تسلا (تسلا) استفاده می کند. اکثر اسکنرهای MRI دارای میدان مغناطیسی موازی با محور طولانی بدن بیمار هستند.
هنگامی که بیمار در داخل یک میدان مغناطیسی قرار می گیرد، تمام هسته های هیدروژن (پروتون ها) در بدن او در جهت این میدان می چرخند (مانند یک سوزن قطب نما که با میدان مغناطیسی زمین هم تراز شده است). علاوه بر این، محورهای مغناطیسی هر پروتون شروع به چرخش در جهت میدان مغناطیسی خارجی می کنند. این حرکت چرخشیتقدم نامیده می شود و بسامد آن فرکانس تشدید نامیده می شود.
بیشتر پروتون ها به موازات میدان مغناطیسی خارجی آهنربا ("پروتون های موازی") جهت گیری می کنند. بقیه بر خلاف موازی میدان مغناطیسی خارجی ("پروتون های ضد موازی") قرار می گیرند. در نتیجه، بافت های بیمار مغناطیسی شده و مغناطیس آنها دقیقاً موازی با میدان مغناطیسی خارجی است. مقدار مغناطیس با بیش از حد پروتون های موازی تعیین می شود. مقدار اضافی متناسب با قدرت میدان مغناطیسی خارجی است، اما همیشه بسیار کوچک است (در حد 1-10 پروتون در هر 1 میلیون). مغناطیس نیز با تعداد پروتون در واحد حجم بافت متناسب است، یعنی. چگالی پروتون تعداد بسیار زیاد (حدود 1022 در هر میلی لیتر آب) هسته های هیدروژن موجود در بیشتر بافت ها مغناطیس کافی برای القای جریان الکتریکی در سیم پیچ دریافت کننده را فراهم می کند. ولی پيش نيازالقای جریان در سیم پیچ تغییر در قدرت میدان مغناطیسی است. این به امواج رادیویی نیاز دارد. هنگامی که پالس های فرکانس رادیویی الکترومغناطیسی کوتاه از بدن بیمار عبور می کنند، گشتاورهای مغناطیسی همه پروتون ها 90 درجه می چرخند، اما تنها در صورتی که فرکانس امواج رادیویی با فرکانس تشدید پروتون ها برابر باشد. این پدیده نامیده می شود تشدید مغناطیسی(رزونانس - نوسانات همزمان).
سیم پیچ حسگر در خارج از بیمار قرار دارد. مغناطیس بافت باعث القای جریان الکتریکی در سیم پیچ می شود و این جریان را سیگنال MR می نامند. بافتهایی با بردارهای مغناطیسی بزرگ سیگنالهای قوی را القا میکنند و بر روی تصویر درخشان به نظر میرسند، در حالی که بافتهایی با بردارهای مغناطیسی کوچک سیگنالهای ضعیفی را القاء میکنند و در تصویر تیره به نظر میرسند.
همانطور که قبلا گفته شد، کنتراست در تصاویر MR با تفاوت در خواص مغناطیسی بافت ها تعیین می شود. بزرگی بردار مغناطیسی در درجه اول توسط چگالی پروتون تعیین می شود. اجسام با تعداد کم پروتون، مانند هوا، سیگنال MR بسیار ضعیفی را القا می کنند و در تصویر تیره به نظر می رسند. آب و سایر مایعات باید در تصاویر MR به عنوان دارای چگالی پروتون بسیار بالا ظاهر شوند. با این حال، بسته به حالت مورد استفاده برای به دست آوردن تصویر MR، مایعات می توانند تصاویر روشن یا تاریک ایجاد کنند. دلیل این امر این است که کنتراست تصویر نه تنها با چگالی پروتون تعیین می شود. پارامترهای دیگر نیز نقش دارند. دو مهم ترین آنها T1 و T2 هستند.
چندین سیگنال MR برای بازسازی یک تصویر مورد نیاز است، به عنوان مثال. چندین پالس فرکانس رادیویی باید از طریق بدن بیمار منتقل شود. در فاصله بین اعمال پالس ها، پروتون ها تحت دو فرآیند آرام سازی متفاوت قرار می گیرند - T1 و T2. تضعیف سریع سیگنال القا شده تا حدی نتیجه آرامش T2 است. آرامش نتیجه ناپدید شدن تدریجی مغناطیس است. مایعات و بافتهای سیال مانند معمولاً دارای T2 طولانی هستند، در حالی که بافتها و مواد جامد معمولاً زمان T2 کوتاه دارند. هرچه T2 طولانی تر باشد، پارچه روشن تر (سبک تر) به نظر می رسد، یعنی. سیگنال شدیدتری می دهد. تصاویر MR که در آنها کنتراست عمدتاً با تفاوت در T2 تعیین می شود، تصاویر T2-weighted نامیده می شوند.
آرامش T1 در مقایسه با آرامش T2 فرآیند کندتر است، که شامل همراستایی تدریجی پروتون های منفرد در امتداد جهت میدان مغناطیسی است. به این ترتیب حالت قبل از پالس فرکانس رادیویی بازیابی می شود. مقدار T1 تا حد زیادی به اندازه مولکول ها و تحرک آنها بستگی دارد. به عنوان یک قاعده، T1 برای بافت هایی با مولکول هایی با اندازه متوسط و تحرک متوسط، به عنوان مثال، بافت چربی، حداقل است. مولکولهای کوچکتر، متحرکتر (مانند مایعات) و مولکولهای بزرگتر و کمتر متحرک (مانند مواد جامد) ارزش T1 بالاتری دارند.
بافت هایی با حداقل T1 قوی ترین سیگنال های MR (به عنوان مثال، بافت چربی) را القا می کنند. به این ترتیب این پارچه ها در تصویر درخشان خواهند بود. بافت هایی با حداکثر T1 بر این اساس ضعیف ترین سیگنال ها را القا می کنند و تاریک خواهند بود. تصاویر MR که در آنها کنتراست عمدتاً با تفاوت در T1 تعیین می شود، تصاویر T1-weighted نامیده می شوند.
تفاوت در قدرت سیگنال های MR به دست آمده از بافت های مختلف بلافاصله پس از قرار گرفتن در معرض یک پالس فرکانس رادیویی نشان دهنده تفاوت در چگالی پروتون است. در تصاویر وزندار با چگالی پروتون، بافتهایی با بالاترین چگالی پروتون قویترین سیگنال MR را القا میکنند و درخشانترین به نظر میرسند.
بنابراین، در MRI فرصت بسیار بیشتری برای تغییر کنتراست تصاویر نسبت به تکنیک های جایگزین مانند توموگرافی کامپیوتری و سونوگرافی وجود دارد.
همانطور که گفته شد، پالس های RF تنها در صورتی سیگنال های MR را القا می کنند که فرکانس پالس دقیقاً با فرکانس تشدید پروتون ها مطابقت داشته باشد. این واقعیت به دست آوردن سیگنال های MR از یک لایه نازک از پیش انتخاب شده از بافت را ممکن می کند. سیم پیچ های ویژه میدان های اضافی کوچکی ایجاد می کنند به طوری که قدرت میدان مغناطیسی به صورت خطی در یک جهت افزایش می یابد. فرکانس تشدید پروتون ها متناسب با قدرت میدان مغناطیسی است، بنابراین به صورت خطی نیز در همان جهت افزایش می یابد. با ارائه پالس های فرکانس رادیویی با محدوده فرکانس باریک از پیش تعیین شده، می توان سیگنال های MR را فقط از یک لایه نازک از بافت ضبط کرد که محدوده فرکانس های تشدید آن با محدوده فرکانس پالس های رادیویی مطابقت دارد.
در تصویربرداری MR، شدت سیگنال خون ساکن توسط "وزن" انتخابی تصویر تعیین می شود (در عمل، خون ساکن در بیشتر موارد به صورت روشن تجسم می شود). در مقابل، گردش خون عملا سیگنال MR تولید نمی کند، بنابراین یک ماده کنتراست "منفی" موثر است. مجرای رگهای خونی و حفرههای قلب تیره به نظر میرسند و به وضوح از بافتهای ثابت روشنتر اطرافشان جدا میشوند.
با این حال، تکنیکهای MRI خاصی وجود دارد که امکان نمایش خون در گردش را به صورت روشن و بافت ثابت تاریک میدهد. آنها در آنژیوگرافی MR (MRA) استفاده می شوند.
مواد کنتراست به طور گسترده در MRI استفاده می شود. همه آنها دارای خواص مغناطیسی هستند و شدت تصویر بافتهایی را که در آنها قرار دارند تغییر می دهند و آرامش (T1 و / یا T2) پروتونهای اطراف آنها را کوتاه می کنند. متداول ترین مواد کنتراست مورد استفاده حاوی یون فلزی پارامغناطیس گادولینیوم (Gd3+) است که به یک مولکول حامل متصل است. این مواد حاجب به صورت داخل وریدی تجویز می شوند و مشابه مواد حاجب اشعه ایکس محلول در آب در سراسر بدن توزیع می شوند.
4.2. طیف سنجی رزونانس مغناطیسی
یک واحد MR با شدت میدان مغناطیسی حداقل 1.5 تسلا امکان طیفسنجی تشدید مغناطیسی (MRS) را در داخل بدن فراهم میکند. MRS بر این واقعیت استوار است که هستهها و مولکولهای اتمی در یک میدان مغناطیسی باعث تغییرات موضعی در قدرت میدان میشوند. هستههای اتمهای هم نوع (مثلاً هیدروژن) دارای فرکانسهای تشدید هستند که بسته به آرایش مولکولی هستهها کمی متفاوت است. سیگنال MR القا شده پس از قرار گرفتن در معرض یک پالس فرکانس رادیویی حاوی این فرکانس ها خواهد بود. در نتیجه تجزیه و تحلیل فرکانس یک سیگنال MR پیچیده، یک طیف فرکانس ایجاد می شود، به عنوان مثال. مشخصه دامنه فرکانس که فرکانس های موجود در آن و دامنه های مربوطه را نشان می دهد. چنین طیف فرکانسی می تواند اطلاعاتی در مورد حضور و غلظت نسبی مولکول های مختلف ارائه دهد.
چندین نوع هسته را می توان در MRS استفاده کرد، اما دو مورد که بیشتر مورد مطالعه قرار می گیرند، هسته های هیدروژن (1H) و فسفر (31P) هستند. ترکیبی از تصویربرداری MR و طیف سنجی MR امکان پذیر است. In vivo MRS به فرد اجازه می دهد تا اطلاعاتی در مورد فرآیندهای متابولیکی مهم در بافت ها به دست آورد، اما این روش هنوز از استفاده معمول در عمل بالینی فاصله دارد.
5. اصول کلی برای انتخاب روش تحقیق پرتو بهینه
هدف از مطالعه این بخش با نام آن مطابقت دارد - یادگیری تفسیر اصول کلی انتخاب روش تحقیق پرتو بهینه.
همانطور که در بخش های قبلی نشان داده شد، چهار گروه از روش های تحقیق پرتو - اشعه ایکس، اولتراسوند، رادیونوکلئید و تشدید مغناطیسی وجود دارد. برای استفاده موثر آنها در تشخیص بیماری های مختلفپزشک باید بتواند از بین این انواع روش ها بهترین روش را برای یک وضعیت بالینی خاص انتخاب کند. در این مورد، باید با معیارهای زیر هدایت شود:
1) اطلاعاتی بودن روش؛
2) اثر بیولوژیکی تشعشعات مورد استفاده در این روش.
3) دسترسی و مقرون به صرفه بودن روش.
محتوای اطلاعاتی روشهای تحقیق پرتو، یعنی. توانایی آنها در ارائه اطلاعات به پزشک در مورد وضعیت مورفولوژیکی و عملکردی اندام های مختلف، معیار اصلی برای انتخاب روش تحقیق پرتو بهینه است و به طور مفصل در بخش های قسمت دوم کتاب درسی ما توضیح داده خواهد شد.
اطلاعات مربوط به اثر بیولوژیکی پرتوهای مورد استفاده در یک یا روش دیگر تحقیق پرتو به سطح اولیه دانش و مهارت های تسلط یافته در دوره فیزیک پزشکی و بیولوژیکی اشاره دارد. با این حال، با توجه به اهمیت این معیار هنگام تجویز روش پرتو برای بیمار، باید تاکید کرد که تمام روشهای اشعه ایکس و رادیونوکلئیدی با اشعه یونیزان همراه بوده و بر این اساس باعث یونیزاسیون در بافتهای بدن بیمار میشوند. اگر این روش ها به درستی انجام شود و اصول ایمنی در برابر تشعشعات رعایت شود، سلامت و زندگی انسان را تهدید نمی کند، زیرا تمام تغییرات ناشی از آنها برگشت پذیر هستند. در عین حال، استفاده مکرر غیر منطقی از آنها می تواند منجر به افزایش دوز کل تابش دریافتی توسط بیمار، افزایش خطر ابتلا به تومورها و ایجاد واکنش های پرتوهای موضعی و عمومی در بدن او شود که در ادامه با آن آشنا خواهید شد. جزئیات در دوره ها پرتو درمانیو بهداشت پرتو.
اثر بیولوژیکی اصلی اولتراسوند و تصویربرداری رزونانس مغناطیسی گرمایش است. این اثر با ام آر آی بارزتر است. بنابراین، سه ماه اول بارداری توسط برخی از نویسندگان به عنوان منع مطلق برای MRI به دلیل خطر گرم شدن بیش از حد جنین در نظر گرفته می شود. یکی دیگر از موارد منع مطلق استفاده از این روش وجود جسم فرومغناطیسی است که حرکت آن می تواند برای بیمار خطرناک باشد. مهمترین آنها گیره های فرومغناطیسی داخل جمجمه روی رگ های خونی و اجسام خارجی فرومغناطیسی داخل چشمی هستند. بزرگترین خطر بالقوه مرتبط با آنها خونریزی است. وجود ضربان ساز نیز یک منع مطلق برای MRI است. عملکرد این دستگاه ها ممکن است تحت تأثیر میدان مغناطیسی قرار گیرد و علاوه بر این، جریان های الکتریکی ممکن است در الکترودهای آنها القا شود که می تواند اندوکارد را گرم کند.
سومین معیار برای انتخاب روش تحقیق بهینه - دسترسی و مقرون به صرفه بودن - اهمیت کمتری نسبت به دو مورد اول دارد. با این حال، هنگام ارجاع بیمار برای معاینه، هر پزشکی باید به خاطر داشته باشد که باید با روشهای در دسترستر، رایجتر و کمهزینهتر شروع کند. رعایت این اصل قبل از هر چیز به نفع بیمار است که در زمان کوتاه تری تشخیص داده می شود.
بنابراین، هنگام انتخاب روش تحقیق پرتو بهینه، پزشک باید عمدتاً بر اساس محتوای اطلاعاتی آن هدایت شود و از چندین روش که از نظر محتوای اطلاعاتی مشابه هستند، روشی را تجویز کند که در دسترس تر است و تأثیر کمتری بر بدن بیمار دارد.
| ایجاد شده 21 دسامبر 2006 | |||||||||
تشخیص پرتو در سه دهه اخیر پیشرفت قابل توجهی داشته است، عمدتاً به دلیل معرفی توموگرافی کامپیوتری (CT)، اولتراسوند (US) و تصویربرداری رزونانس مغناطیسی (MRI). با این حال، معاینه اولیه بیمار همچنان بر اساس روش های تصویربرداری سنتی است: رادیوگرافی، فلوروگرافی، فلوروسکوپی. روشهای سنتی تحقیق در زمینه تشعشعاتبر اساس استفاده از پرتوهای ایکس کشف شده توسط ویلهلم کنراد رونتگن در سال 1895 است. او کسب سود مادی از نتایج تحقیقات علمی را ممکن نمی دانست، زیرا «... اکتشافات و اختراعات او متعلق به بشریت است، و. آنها نباید به هیچ وجه توسط اختراعات، مجوزها، قراردادها یا کنترل گروهی از افراد مانع شوند.» سنتی روش های اشعه ایکسروش های تجسم طرح ریزی نامیده می شود که به نوبه خود می توان آن را به سه گروه اصلی تقسیم کرد: روش های آنالوگ مستقیم. روش های آنالوگ غیر مستقیم؛ روشهای دیجیتال: در روشهای آنالوگ مستقیم، تصویر مستقیماً در یک محیط دریافت کننده تابش (فیلم اشعه ایکس، صفحه فلورسنت) تشکیل میشود که واکنش آن به تابش گسسته نیست، بلکه ثابت است. روش های اصلی تحقیق آنالوگ عبارتند از رادیوگرافی مستقیم و فلوروسکوپی مستقیم. رادیوگرافی مستقیم- روش اصلی تشخیص تشعشع. این شامل این واقعیت است که اشعه ایکس که از بدن بیمار عبور می کند تصویری را مستقیماً روی فیلم ایجاد می کند. فیلم اشعه ایکس با یک امولسیون عکاسی حاوی کریستال های برومید نقره پوشیده شده است که توسط انرژی فوتون یونیزه می شوند (هر چه دوز تابش بیشتر باشد، یون های نقره بیشتری تشکیل می شود). این به اصطلاح تصویر نهفته است. در طول فرآیند توسعه، نقره فلزی مناطق تیره ای را روی فیلم تشکیل می دهد و در طول فرآیند تثبیت، کریستال های برمید نقره شسته شده و مناطق شفاف روی فیلم ظاهر می شوند. رادیوگرافی مستقیم تصاویر ایستا را با بهترین وضوح فضایی ممکن تولید می کند. از این روش برای گرفتن عکس قفسه سینه استفاده می شود. در حال حاضر، رادیوگرافی مستقیم به ندرت برای به دست آوردن مجموعه ای از تصاویر تمام فرمت در مطالعات آنژیوگرافی قلب استفاده می شود. فلوروسکوپی مستقیم (ترانس ایلومینیشن)در این واقعیت نهفته است که پرتوهایی که از بدن بیمار می گذرد و با صفحه فلورسنت برخورد می کند، یک تصویر طرح ریزی پویا ایجاد می کند. در حال حاضر به دلیل روشنایی کم تصویر و دوز بالای تابش به بیمار، عملاً از این روش استفاده نمی شود. فلوروسکوپی غیر مستقیمتقریباً به طور کامل جایگزین transillumination شده است. صفحه نمایش فلورسنت بخشی از مبدل نوری الکترون است که روشنایی تصویر را بیش از 5000 برابر افزایش می دهد. رادیولوژیست توانست در نور روز کار کند. تصویر به دست آمده توسط مانیتور بازتولید می شود و می توان آن را روی فیلم، ضبط ویدئو، دیسک مغناطیسی یا نوری ضبط کرد. فلوروسکوپی غیرمستقیم برای مطالعه فرآیندهای پویا، مانند فعالیت انقباضی قلب، جریان خون از طریق عروق استفاده می شود.

 *معاینه پیشگیرانه (سالی یک بار فلوروگرافی برای حذف خطرناک ترین آسیب شناسی ریه انجام می شود) * موارد مصرف
*معاینه پیشگیرانه (سالی یک بار فلوروگرافی برای حذف خطرناک ترین آسیب شناسی ریه انجام می شود) * موارد مصرف




 *بیماری های متابولیک و غدد درون ریز (پوکی استخوان، نقرس، دیابت شیرین، پرکاری تیروئید و ...) *موارد مصرف
*بیماری های متابولیک و غدد درون ریز (پوکی استخوان، نقرس، دیابت شیرین، پرکاری تیروئید و ...) *موارد مصرف
 *بیماری های کلیوی (پیلونفریت، سنگ کلیه و غیره) که در این موارد رادیوگرافی با کنتراست سمت راست انجام می شود. پیلونفریت حاد* موارد مصرف
*بیماری های کلیوی (پیلونفریت، سنگ کلیه و غیره) که در این موارد رادیوگرافی با کنتراست سمت راست انجام می شود. پیلونفریت حاد* موارد مصرف


 *بیماری های دستگاه گوارش (دیورتیکولوز روده، تومورها، تنگی ها، فتق هیاتال و ...). * موارد مصرف
*بیماری های دستگاه گوارش (دیورتیکولوز روده، تومورها، تنگی ها، فتق هیاتال و ...). * موارد مصرف
 * بارداری - احتمال وجود دارد تاثیر منفیتابش بر رشد جنین * خونریزی، زخم های باز. با توجه به اینکه رگ ها و سلول های مغز استخوان قرمز نسبت به تابش بسیار حساس هستند، ممکن است بیمار دچار اختلال در جریان خون در بدن شود. *وضعیت وخیم عمومی بیمار به گونه ای که باعث تشدید وضعیت بیمار نشود. * موارد منع مصرف
* بارداری - احتمال وجود دارد تاثیر منفیتابش بر رشد جنین * خونریزی، زخم های باز. با توجه به اینکه رگ ها و سلول های مغز استخوان قرمز نسبت به تابش بسیار حساس هستند، ممکن است بیمار دچار اختلال در جریان خون در بدن شود. *وضعیت وخیم عمومی بیمار به گونه ای که باعث تشدید وضعیت بیمار نشود. * موارد منع مصرف
 *سن. اشعه ایکس برای کودکان زیر 14 سال توصیه نمی شود، زیرا بدن انسان قبل از بلوغ بیش از حد در معرض اشعه ایکس قرار می گیرد. *چاقی این یک منع مصرف نیست، اما اضافه وزن فرآیند تشخیص را پیچیده می کند. * موارد منع مصرف
*سن. اشعه ایکس برای کودکان زیر 14 سال توصیه نمی شود، زیرا بدن انسان قبل از بلوغ بیش از حد در معرض اشعه ایکس قرار می گیرد. *چاقی این یک منع مصرف نیست، اما اضافه وزن فرآیند تشخیص را پیچیده می کند. * موارد منع مصرف

 * در سال 1880، فیزیکدانان فرانسوی، برادران پیر و پل کوری، متوجه شدند که وقتی یک کریستال کوارتز فشرده شده و در دو طرف کشیده می شود، بارهای الکتریکی. این پدیده پیزوالکتریک نامیده شد. لانژوین سعی کرد چهرههای کریستال کوارتز را با الکتریسیته از یک مولد جریان متناوب فرکانس بالا شارژ کند. در همان زمان، او متوجه شد که کریستال در زمان با تغییر ولتاژ نوسان می کند. برای تقویت این ارتعاشات، دانشمند نه یک، بلکه چندین صفحه را بین صفحات الکترود فولادی قرار داد و به تشدید رسید - افزایش شدید دامنه ارتعاشات. این مطالعات لانژوین امکان ایجاد فرکانسهای مختلف فرکانسهای مختلف را فراهم کرد. بعدها، قطره چکان های مبتنی بر تیتانات باریم و همچنین کریستال ها و سرامیک های دیگر، که می توانند به هر شکل و اندازه ای باشند، ظاهر شدند.
* در سال 1880، فیزیکدانان فرانسوی، برادران پیر و پل کوری، متوجه شدند که وقتی یک کریستال کوارتز فشرده شده و در دو طرف کشیده می شود، بارهای الکتریکی. این پدیده پیزوالکتریک نامیده شد. لانژوین سعی کرد چهرههای کریستال کوارتز را با الکتریسیته از یک مولد جریان متناوب فرکانس بالا شارژ کند. در همان زمان، او متوجه شد که کریستال در زمان با تغییر ولتاژ نوسان می کند. برای تقویت این ارتعاشات، دانشمند نه یک، بلکه چندین صفحه را بین صفحات الکترود فولادی قرار داد و به تشدید رسید - افزایش شدید دامنه ارتعاشات. این مطالعات لانژوین امکان ایجاد فرکانسهای مختلف فرکانسهای مختلف را فراهم کرد. بعدها، قطره چکان های مبتنی بر تیتانات باریم و همچنین کریستال ها و سرامیک های دیگر، که می توانند به هر شکل و اندازه ای باشند، ظاهر شدند.
 * تحقیقات اولتراسونیک تشخیص اولتراسوند در حال حاضر گسترده است. اصولاً هنگام تشخیص تغییرات پاتولوژیک در اندام ها و بافت ها از سونوگرافی با فرکانس 500 کیلوهرتز تا 15 مگاهرتز استفاده می شود. امواج صوتی با این فرکانس توانایی عبور از بافتهای بدن را دارند و از تمام سطوحی که روی مرز بافتهایی با ترکیب و چگالی متفاوت قرار دارند منعکس میشوند. سیگنال دریافتی توسط یک دستگاه الکترونیکی پردازش می شود، نتیجه به شکل یک منحنی (اکوگرام) یا یک تصویر دو بعدی (به اصطلاح سونوگرافی - اسنوگرام اولتراسوند) تولید می شود.
* تحقیقات اولتراسونیک تشخیص اولتراسوند در حال حاضر گسترده است. اصولاً هنگام تشخیص تغییرات پاتولوژیک در اندام ها و بافت ها از سونوگرافی با فرکانس 500 کیلوهرتز تا 15 مگاهرتز استفاده می شود. امواج صوتی با این فرکانس توانایی عبور از بافتهای بدن را دارند و از تمام سطوحی که روی مرز بافتهایی با ترکیب و چگالی متفاوت قرار دارند منعکس میشوند. سیگنال دریافتی توسط یک دستگاه الکترونیکی پردازش می شود، نتیجه به شکل یک منحنی (اکوگرام) یا یک تصویر دو بعدی (به اصطلاح سونوگرافی - اسنوگرام اولتراسوند) تولید می شود.
 * مسائل ایمنی معاینات سونوگرافی در سطح انجمن بین المللی تشخیص اولتراسوند در مامایی و زنان بررسی می شود. امروزه به طور کلی پذیرفته شده است که سونوگرافی هیچ اثر منفی ندارد. * استفاده از روش تشخیص اولتراسوند بدون درد و عملاً بی ضرر است، زیرا باعث واکنش بافتی نمی شود. بنابراین هیچ گونه منع مصرفی برای معاینه اولتراسوند وجود ندارد. روش اولتراسوند به دلیل بی ضرری و سادگی، تمامی مزیت ها را در معاینه کودکان و زنان باردار دارد. * آیا سونوگرافی مضر است؟
* مسائل ایمنی معاینات سونوگرافی در سطح انجمن بین المللی تشخیص اولتراسوند در مامایی و زنان بررسی می شود. امروزه به طور کلی پذیرفته شده است که سونوگرافی هیچ اثر منفی ندارد. * استفاده از روش تشخیص اولتراسوند بدون درد و عملاً بی ضرر است، زیرا باعث واکنش بافتی نمی شود. بنابراین هیچ گونه منع مصرفی برای معاینه اولتراسوند وجود ندارد. روش اولتراسوند به دلیل بی ضرری و سادگی، تمامی مزیت ها را در معاینه کودکان و زنان باردار دارد. * آیا سونوگرافی مضر است؟
 *درمان اولتراسوند در حال حاضر درمان با ارتعاشات اولتراسونیک بسیار گسترده شده است. سونوگرافی با فرکانس 22 تا 44 کیلوهرتز و از 800 کیلوهرتز تا 3 مگاهرتز عمدتا استفاده می شود. عمق نفوذ اولتراسوند به بافت در طول درمان با اولتراسوند از 20 تا 50 میلی متر است، در حالی که سونوگرافی دارای اثر مکانیکی، حرارتی، فیزیکی و شیمیایی است، تحت تأثیر آن فرآیندهای متابولیک و واکنش های ایمنی فعال می شوند. ویژگی های اولتراسوند مورد استفاده در درمان دارای اثر ضد درد، ضد اسپاسم، ضد التهابی، ضد حساسیت و تونیک عمومی است، گردش خون و لنف را تحریک می کند، همانطور که قبلا ذکر شد، فرآیندهای بازسازی. تروفیسم بافت را بهبود می بخشد. به لطف این، درمان اولتراسوند کاربرد گسترده ای در کلینیک بیماری های داخلی، آرترولوژی، پوست، گوش و حلق و بینی و غیره پیدا کرده است.
*درمان اولتراسوند در حال حاضر درمان با ارتعاشات اولتراسونیک بسیار گسترده شده است. سونوگرافی با فرکانس 22 تا 44 کیلوهرتز و از 800 کیلوهرتز تا 3 مگاهرتز عمدتا استفاده می شود. عمق نفوذ اولتراسوند به بافت در طول درمان با اولتراسوند از 20 تا 50 میلی متر است، در حالی که سونوگرافی دارای اثر مکانیکی، حرارتی، فیزیکی و شیمیایی است، تحت تأثیر آن فرآیندهای متابولیک و واکنش های ایمنی فعال می شوند. ویژگی های اولتراسوند مورد استفاده در درمان دارای اثر ضد درد، ضد اسپاسم، ضد التهابی، ضد حساسیت و تونیک عمومی است، گردش خون و لنف را تحریک می کند، همانطور که قبلا ذکر شد، فرآیندهای بازسازی. تروفیسم بافت را بهبود می بخشد. به لطف این، درمان اولتراسوند کاربرد گسترده ای در کلینیک بیماری های داخلی، آرترولوژی، پوست، گوش و حلق و بینی و غیره پیدا کرده است.
 روش های سونوگرافیبا توجه به شدت سونوگرافی استفاده شده و مدت زمان انجام عمل دوز می شود. معمولاً از شدت سونوگرافی کم (0.05 - 0.4 W/cm2) و کمتر متوسط (0.5 - 0.8 W/cm2) استفاده می شود. درمان اولتراسوند را می توان در حالت ارتعاش اولتراسونیک مداوم و پالسی انجام داد. حالت مستمر نوردهی بیشتر مورد استفاده قرار می گیرد. در حالت پالس، اثر حرارتی و شدت کلی اولتراسوند کاهش می یابد. حالت پالس برای درمان بیماری های حاد و همچنین برای درمان اولتراسوند در کودکان و افراد مسن مبتلا به بیماری های همزمان سیستم قلبی عروقی توصیه می شود. سونوگرافی تنها بر قسمت محدودی از بدن با مساحت 100 تا 250 سانتی متر مربع تأثیر می گذارد، این مناطق بازتاب زا یا ناحیه آسیب دیده هستند.
روش های سونوگرافیبا توجه به شدت سونوگرافی استفاده شده و مدت زمان انجام عمل دوز می شود. معمولاً از شدت سونوگرافی کم (0.05 - 0.4 W/cm2) و کمتر متوسط (0.5 - 0.8 W/cm2) استفاده می شود. درمان اولتراسوند را می توان در حالت ارتعاش اولتراسونیک مداوم و پالسی انجام داد. حالت مستمر نوردهی بیشتر مورد استفاده قرار می گیرد. در حالت پالس، اثر حرارتی و شدت کلی اولتراسوند کاهش می یابد. حالت پالس برای درمان بیماری های حاد و همچنین برای درمان اولتراسوند در کودکان و افراد مسن مبتلا به بیماری های همزمان سیستم قلبی عروقی توصیه می شود. سونوگرافی تنها بر قسمت محدودی از بدن با مساحت 100 تا 250 سانتی متر مربع تأثیر می گذارد، این مناطق بازتاب زا یا ناحیه آسیب دیده هستند.
 مایعات داخل سلولی هدایت الکتریکی و اسیدیته را تغییر می دهند، نفوذپذیری تغییر می کند غشای سلولی. درمان اولتراسوند خون تا حدی بینشی در مورد این رویدادها می دهد. پس از چنین درمانی، خون خواص جدیدی به دست می آورد - دفاع بدن فعال می شود، مقاومت آن در برابر عفونت ها، تشعشعات و حتی استرس افزایش می یابد. آزمایشات روی حیوانات نشان می دهد که اولتراسوند اثر جهش زا یا سرطان زایی روی سلول ها ندارد - زمان و شدت قرار گرفتن در معرض آن به قدری ناچیز است که چنین خطری عملاً به صفر می رسد. و با این وجود، پزشکان بر اساس تجربه چندین ساله در استفاده از اولتراسوند، برخی موارد منع مصرف برای درمان اولتراسوند ایجاد کرده اند. اینها مسمومیت های حاد، بیماری های خونی، بیماری عروق کرونر قلب با آنژین صدری، ترومبوفلبیت، تمایل به خونریزی، فشار خون پایین، بیماری های ارگانیک سیستم عصبی مرکزی، اختلالات عصبی شدید و غدد درون ریز هستند. پس از سال ها بحث، پذیرفته شد که درمان اولتراسوند نیز در دوران بارداری توصیه نمی شود.
مایعات داخل سلولی هدایت الکتریکی و اسیدیته را تغییر می دهند، نفوذپذیری تغییر می کند غشای سلولی. درمان اولتراسوند خون تا حدی بینشی در مورد این رویدادها می دهد. پس از چنین درمانی، خون خواص جدیدی به دست می آورد - دفاع بدن فعال می شود، مقاومت آن در برابر عفونت ها، تشعشعات و حتی استرس افزایش می یابد. آزمایشات روی حیوانات نشان می دهد که اولتراسوند اثر جهش زا یا سرطان زایی روی سلول ها ندارد - زمان و شدت قرار گرفتن در معرض آن به قدری ناچیز است که چنین خطری عملاً به صفر می رسد. و با این وجود، پزشکان بر اساس تجربه چندین ساله در استفاده از اولتراسوند، برخی موارد منع مصرف برای درمان اولتراسوند ایجاد کرده اند. اینها مسمومیت های حاد، بیماری های خونی، بیماری عروق کرونر قلب با آنژین صدری، ترومبوفلبیت، تمایل به خونریزی، فشار خون پایین، بیماری های ارگانیک سیستم عصبی مرکزی، اختلالات عصبی شدید و غدد درون ریز هستند. پس از سال ها بحث، پذیرفته شد که درمان اولتراسوند نیز در دوران بارداری توصیه نمی شود.
 *در طول 10 سال گذشته، تعداد زیادی از جدید داروها، به صورت آئروسل تولید می شود. آنها اغلب برای بیماری های تنفسی، آلرژی های مزمن و واکسیناسیون استفاده می شوند. ذرات آئروسل در اندازه های 0.03 تا 10 میکرون برای استنشاق برونش ها و ریه ها و برای درمان محل استفاده می شود. آنها با استفاده از سونوگرافی به دست می آیند. اگر چنین ذرات آئروسل در یک میدان الکتریکی باردار شوند، آئروسلهای پراکندهتر (به اصطلاح بسیار پراکنده) ظاهر میشوند. درمان اولتراسونیک محلول های داروییامولسیون ها و سوسپانسیون هایی به دست آورید که برای مدت طولانی از هم جدا نمی شوند و خواص دارویی خود را حفظ می کنند. *سونوگرافی برای کمک به فارماکولوژیست ها.
*در طول 10 سال گذشته، تعداد زیادی از جدید داروها، به صورت آئروسل تولید می شود. آنها اغلب برای بیماری های تنفسی، آلرژی های مزمن و واکسیناسیون استفاده می شوند. ذرات آئروسل در اندازه های 0.03 تا 10 میکرون برای استنشاق برونش ها و ریه ها و برای درمان محل استفاده می شود. آنها با استفاده از سونوگرافی به دست می آیند. اگر چنین ذرات آئروسل در یک میدان الکتریکی باردار شوند، آئروسلهای پراکندهتر (به اصطلاح بسیار پراکنده) ظاهر میشوند. درمان اولتراسونیک محلول های داروییامولسیون ها و سوسپانسیون هایی به دست آورید که برای مدت طولانی از هم جدا نمی شوند و خواص دارویی خود را حفظ می کنند. *سونوگرافی برای کمک به فارماکولوژیست ها.
 *انتقال لیپوزومها، میکروکپسولهای چربی پر از دارو، به بافتهایی که از قبل با اولتراسوند درمان شده بودند نیز بسیار امیدوارکننده بود. در بافت هایی که توسط اولتراسوند تا دمای 42 - 45 * C گرم می شوند، لیپوزوم ها از بین می روند و ماده دارویی از طریق غشاهایی که تحت تأثیر امواج فراصوت نفوذپذیر شده اند وارد سلول ها می شود. انتقال لیپوزومی در درمان برخی از بیماریهای التهابی حاد و همچنین در شیمیدرمانی تومور بسیار مهم است، زیرا داروها فقط در یک منطقه خاص متمرکز میشوند و تأثیر کمی بر سایر بافتها ندارند. *سونوگرافی برای کمک به فارماکولوژیست ها.
*انتقال لیپوزومها، میکروکپسولهای چربی پر از دارو، به بافتهایی که از قبل با اولتراسوند درمان شده بودند نیز بسیار امیدوارکننده بود. در بافت هایی که توسط اولتراسوند تا دمای 42 - 45 * C گرم می شوند، لیپوزوم ها از بین می روند و ماده دارویی از طریق غشاهایی که تحت تأثیر امواج فراصوت نفوذپذیر شده اند وارد سلول ها می شود. انتقال لیپوزومی در درمان برخی از بیماریهای التهابی حاد و همچنین در شیمیدرمانی تومور بسیار مهم است، زیرا داروها فقط در یک منطقه خاص متمرکز میشوند و تأثیر کمی بر سایر بافتها ندارند. *سونوگرافی برای کمک به فارماکولوژیست ها.


 *رادیوگرافی کنتراست مجموعه ای کامل از روش های معاینه اشعه ایکس است که ویژگی بارز آن استفاده از عوامل رادیوپاک در طول مطالعه برای افزایش ارزش تشخیصی تصاویر است. اغلب از کنتراست برای مطالعه اندام های توخالی استفاده می شود، زمانی که لازم است مکان و حجم آنها، ویژگی های ساختاری دیواره های آنها و ویژگی های عملکردی ارزیابی شود.
*رادیوگرافی کنتراست مجموعه ای کامل از روش های معاینه اشعه ایکس است که ویژگی بارز آن استفاده از عوامل رادیوپاک در طول مطالعه برای افزایش ارزش تشخیصی تصاویر است. اغلب از کنتراست برای مطالعه اندام های توخالی استفاده می شود، زمانی که لازم است مکان و حجم آنها، ویژگی های ساختاری دیواره های آنها و ویژگی های عملکردی ارزیابی شود.
 این روش ها به طور گسترده ای در معاینه اشعه ایکس از دستگاه گوارش، اندام های دستگاه ادراری (اوروگرافی)، ارزیابی موضع و وسعت مجاری فیستول (فیستولوگرافی)، ویژگی های ساختاری سیستم عروقی و کارایی جریان خون استفاده می شود. آنژیوگرافی) و غیره
این روش ها به طور گسترده ای در معاینه اشعه ایکس از دستگاه گوارش، اندام های دستگاه ادراری (اوروگرافی)، ارزیابی موضع و وسعت مجاری فیستول (فیستولوگرافی)، ویژگی های ساختاری سیستم عروقی و کارایی جریان خون استفاده می شود. آنژیوگرافی) و غیره
 * هنگامی که ماده حاجب به داخل حفره بدن (عضلانی، داخل وریدی، داخل شریانی) با آسیب به پوست، غشاهای مخاطی یا غیر تهاجمی وارد حفره بدن میشود، کنتراست میتواند تهاجمی باشد. از طریق سایر مسیرهای طبیعی
* هنگامی که ماده حاجب به داخل حفره بدن (عضلانی، داخل وریدی، داخل شریانی) با آسیب به پوست، غشاهای مخاطی یا غیر تهاجمی وارد حفره بدن میشود، کنتراست میتواند تهاجمی باشد. از طریق سایر مسیرهای طبیعی
 * عوامل کنتراست اشعه ایکس (داروها) دسته ای از عوامل تشخیصی هستند که در توانایی آنها در جذب تابش اشعه ایکس از بافت های بیولوژیکی متفاوت است. آنها برای شناسایی ساختار اندام ها و سیستم هایی استفاده می شوند که توسط رادیوگرافی معمولی، فلوروسکوپی و توموگرافی کامپیوتری تشخیص داده نمی شوند یا به خوبی شناسایی نمی شوند. * مواد حاجب اشعه ایکس به دو گروه تقسیم می شوند. گروه اول شامل داروهایی است که تابش اشعه ایکس را ضعیف تر از بافت های بدن جذب می کنند (اشعه ایکس منفی)، گروه دوم شامل داروهایی هستند که تابش اشعه ایکس را به میزان بسیار بیشتری نسبت به بافت های بیولوژیکی جذب می کنند (اشعه ایکس مثبت).
* عوامل کنتراست اشعه ایکس (داروها) دسته ای از عوامل تشخیصی هستند که در توانایی آنها در جذب تابش اشعه ایکس از بافت های بیولوژیکی متفاوت است. آنها برای شناسایی ساختار اندام ها و سیستم هایی استفاده می شوند که توسط رادیوگرافی معمولی، فلوروسکوپی و توموگرافی کامپیوتری تشخیص داده نمی شوند یا به خوبی شناسایی نمی شوند. * مواد حاجب اشعه ایکس به دو گروه تقسیم می شوند. گروه اول شامل داروهایی است که تابش اشعه ایکس را ضعیف تر از بافت های بدن جذب می کنند (اشعه ایکس منفی)، گروه دوم شامل داروهایی هستند که تابش اشعه ایکس را به میزان بسیار بیشتری نسبت به بافت های بیولوژیکی جذب می کنند (اشعه ایکس مثبت).
 *مواد منفی اشعه ایکس گازها هستند: دی اکسید کربن (CO 2)، اکسید نیتروژن (N 2 O)، هوا، اکسیژن. آنها برای کنتراست مری، معده، دوازدهه و کولون به تنهایی یا در ترکیب با مواد مثبت اشعه ایکس (به اصطلاح کنتراست مضاعف)، برای تشخیص آسیب شناسی تیموس و مری (پنومو مدیاستینوم)، و برای رادیوگرافی مفاصل بزرگ استفاده می شوند. پنوموآرتروگرافی).
*مواد منفی اشعه ایکس گازها هستند: دی اکسید کربن (CO 2)، اکسید نیتروژن (N 2 O)، هوا، اکسیژن. آنها برای کنتراست مری، معده، دوازدهه و کولون به تنهایی یا در ترکیب با مواد مثبت اشعه ایکس (به اصطلاح کنتراست مضاعف)، برای تشخیص آسیب شناسی تیموس و مری (پنومو مدیاستینوم)، و برای رادیوگرافی مفاصل بزرگ استفاده می شوند. پنوموآرتروگرافی).

 *سولفات باریم بیشترین کاربرد را در مطالعات پرتوپاک در دستگاه گوارش دارد. به شکل سوسپانسیون آبی استفاده می شود که به آن تثبیت کننده ها، مواد ضد کف و برنزه کننده و مواد طعم دهنده نیز اضافه می شود تا پایداری سوسپانسیون، چسبندگی بیشتر به غشای مخاطی و بهبود طعم را افزایش دهد.
*سولفات باریم بیشترین کاربرد را در مطالعات پرتوپاک در دستگاه گوارش دارد. به شکل سوسپانسیون آبی استفاده می شود که به آن تثبیت کننده ها، مواد ضد کف و برنزه کننده و مواد طعم دهنده نیز اضافه می شود تا پایداری سوسپانسیون، چسبندگی بیشتر به غشای مخاطی و بهبود طعم را افزایش دهد.
 *در صورت مشکوک بودن جسم خارجی در مری از خمیر غلیظ سولفات باریم استفاده می شود که به بیمار داده می شود تا آن را ببلعد. به منظور تسریع در عبور سولفات باریم، به عنوان مثال هنگام معاینه روده کوچک، آن را به صورت سرد مصرف می کنند یا به آن لاکتوز اضافه می کنند.
*در صورت مشکوک بودن جسم خارجی در مری از خمیر غلیظ سولفات باریم استفاده می شود که به بیمار داده می شود تا آن را ببلعد. به منظور تسریع در عبور سولفات باریم، به عنوان مثال هنگام معاینه روده کوچک، آن را به صورت سرد مصرف می کنند یا به آن لاکتوز اضافه می کنند.
 *در میان عوامل پرتوپاک حاوی ید، عمدتاً از ترکیبات ید آلی محلول در آب و روغن های یددار استفاده می شود. * بیشترین استفاده از ترکیبات ید آلی محلول در آب، به ویژه وروگرافین، اوروگرافین، یدامید، تریومبلاست. وقتی این داروها به صورت داخل وریدی تجویز می شوند، عمدتاً از طریق کلیه ها دفع می شوند که اساس تکنیک اوروگرافی است که به فرد امکان می دهد تصویر واضحی از کلیه ها، مجاری ادراری و مثانه به دست آورد.
*در میان عوامل پرتوپاک حاوی ید، عمدتاً از ترکیبات ید آلی محلول در آب و روغن های یددار استفاده می شود. * بیشترین استفاده از ترکیبات ید آلی محلول در آب، به ویژه وروگرافین، اوروگرافین، یدامید، تریومبلاست. وقتی این داروها به صورت داخل وریدی تجویز می شوند، عمدتاً از طریق کلیه ها دفع می شوند که اساس تکنیک اوروگرافی است که به فرد امکان می دهد تصویر واضحی از کلیه ها، مجاری ادراری و مثانه به دست آورد.
 * مواد حاجب حاوی ید آلی محلول در آب نیز برای انواع اصلی آنژیوگرافی، مطالعات اشعه ایکس سینوس های ماگزیلاری (فک بالا)، مجرای پانکراس، مجاری دفعی استفاده می شود. غدد بزاقی، فیستولوگرافی
* مواد حاجب حاوی ید آلی محلول در آب نیز برای انواع اصلی آنژیوگرافی، مطالعات اشعه ایکس سینوس های ماگزیلاری (فک بالا)، مجرای پانکراس، مجاری دفعی استفاده می شود. غدد بزاقی، فیستولوگرافی
 * ترکیبات ید آلی مایع مخلوط با حامل های ویسکوزیته (پرابرودیل، یدورون B، پروپیلیودون، کیتراست) که نسبتاً سریع از درخت برونش آزاد می شود، برای برونشوگرافی، ترکیبات یدی ارگانیک برای لنفوگرافی و همچنین برای ایجاد تضاد فضاهای مننژ استفاده می شود. نخاع و بطن شناسی
* ترکیبات ید آلی مایع مخلوط با حامل های ویسکوزیته (پرابرودیل، یدورون B، پروپیلیودون، کیتراست) که نسبتاً سریع از درخت برونش آزاد می شود، برای برونشوگرافی، ترکیبات یدی ارگانیک برای لنفوگرافی و همچنین برای ایجاد تضاد فضاهای مننژ استفاده می شود. نخاع و بطن شناسی


 *مواد آلی حاوی ید مخصوصاً محلول در آب عوارض جانبی ایجاد می کند (تهوع، استفراغ، کهیر، خارش، اسپاسم برونش، ادم حنجره، ادم کوئینکه، فروپاشی، آریتمی قلبی و غیره) که شدت آن تا حد زیادی مشخص می شود. روش، محل و سرعت مصرف، دوز دارو، حساسیت فردی بیمار و عوامل دیگر *عوامل مدرن رادیوپاک ساخته شدهاند که عوارض جانبی بسیار کمتری دارند. اینها ترکیبات جایگزین ید آلی محلول در آب دیمری و غیر یونی (iopamidol، iopromide، omnipaque و غیره) نامیده می شوند که عوارض کمتری به خصوص در طول آنژیوگرافی ایجاد می کنند.
*مواد آلی حاوی ید مخصوصاً محلول در آب عوارض جانبی ایجاد می کند (تهوع، استفراغ، کهیر، خارش، اسپاسم برونش، ادم حنجره، ادم کوئینکه، فروپاشی، آریتمی قلبی و غیره) که شدت آن تا حد زیادی مشخص می شود. روش، محل و سرعت مصرف، دوز دارو، حساسیت فردی بیمار و عوامل دیگر *عوامل مدرن رادیوپاک ساخته شدهاند که عوارض جانبی بسیار کمتری دارند. اینها ترکیبات جایگزین ید آلی محلول در آب دیمری و غیر یونی (iopamidol، iopromide، omnipaque و غیره) نامیده می شوند که عوارض کمتری به خصوص در طول آنژیوگرافی ایجاد می کنند.
 استفاده از داروهای حاوی ید در بیماران مبتلا به حساسیت به ید، اختلال شدید عملکرد کبد و کلیه و بیماری های عفونی حاد منع مصرف دارد. در صورت بروز عوارض در نتیجه استفاده از عوامل رادیو کنتراست، اقدامات ضد حساسیت اضطراری نشان داده می شود - آنتی هیستامین هاآماده سازی کورتیکواستروئید، تجویز داخل وریدی محلول تیوسولفات سدیم، در صورت کاهش فشار خون - درمان ضد شوک.
استفاده از داروهای حاوی ید در بیماران مبتلا به حساسیت به ید، اختلال شدید عملکرد کبد و کلیه و بیماری های عفونی حاد منع مصرف دارد. در صورت بروز عوارض در نتیجه استفاده از عوامل رادیو کنتراست، اقدامات ضد حساسیت اضطراری نشان داده می شود - آنتی هیستامین هاآماده سازی کورتیکواستروئید، تجویز داخل وریدی محلول تیوسولفات سدیم، در صورت کاهش فشار خون - درمان ضد شوک.



 *توموگرافی رزونانس مغناطیسی * میدان کم (قدرت میدان مغناطیسی 0.02 - 0.35 T) * میدان میانی (قدرت میدان مغناطیسی 0.35 - 1.0 T) * میدان بالا (قدرت میدان مغناطیسی 1.0 T و بالاتر - معمولاً بیش از 1.5 ت)
*توموگرافی رزونانس مغناطیسی * میدان کم (قدرت میدان مغناطیسی 0.02 - 0.35 T) * میدان میانی (قدرت میدان مغناطیسی 0.35 - 1.0 T) * میدان بالا (قدرت میدان مغناطیسی 1.0 T و بالاتر - معمولاً بیش از 1.5 ت)
 *اسکنرهای تصویربرداری تشدید مغناطیسی *مگنتی که یک میدان مغناطیسی ثابت با شدت بالا ایجاد می کند (برای ایجاد اثر NMR) * سیم پیچ فرکانس رادیویی که پالس های فرکانس رادیویی (سطحی و حجمی) تولید و دریافت می کند * سیم پیچ گرادیان (برای کنترل) میدان مغناطیسیبه منظور اخذ مقاطع MR) *واحد پردازش اطلاعات (کامپیوتر)
*اسکنرهای تصویربرداری تشدید مغناطیسی *مگنتی که یک میدان مغناطیسی ثابت با شدت بالا ایجاد می کند (برای ایجاد اثر NMR) * سیم پیچ فرکانس رادیویی که پالس های فرکانس رادیویی (سطحی و حجمی) تولید و دریافت می کند * سیم پیچ گرادیان (برای کنترل) میدان مغناطیسیبه منظور اخذ مقاطع MR) *واحد پردازش اطلاعات (کامپیوتر)
 * اسکنرهای تصویربرداری تشدید مغناطیسی انواع آهنربا مزایا 1) مصرف انرژی کم 2) هزینه های عملیاتی کم هزینه های ثابت 3) میدان کوچک دریافت نامشخص 1) هزینه کم مقاومت 2) جرم کم (الکترومغناطیس 3) توانایی کنترل nit) میدان 1) قدرت میدان بالا Superwire 2) یکنواختی میدان بالا 3) مصرف برق کم معایب 1) قدرت میدان محدود (تا 0.3 T) 2) جرم زیاد 3) عدم امکان کنترل میدان 1) مصرف برق بالا 2) قدرت میدان محدود (تا 0.3 T) 0.2 T) 3) میدان بزرگ پذیرش نامشخص 1) هزینه بالا 2) هزینه های بالا 3) پیچیدگی فنی
* اسکنرهای تصویربرداری تشدید مغناطیسی انواع آهنربا مزایا 1) مصرف انرژی کم 2) هزینه های عملیاتی کم هزینه های ثابت 3) میدان کوچک دریافت نامشخص 1) هزینه کم مقاومت 2) جرم کم (الکترومغناطیس 3) توانایی کنترل nit) میدان 1) قدرت میدان بالا Superwire 2) یکنواختی میدان بالا 3) مصرف برق کم معایب 1) قدرت میدان محدود (تا 0.3 T) 2) جرم زیاد 3) عدم امکان کنترل میدان 1) مصرف برق بالا 2) قدرت میدان محدود (تا 0.3 T) 0.2 T) 3) میدان بزرگ پذیرش نامشخص 1) هزینه بالا 2) هزینه های بالا 3) پیچیدگی فنی


 *تصاویر وزنی T 1 و T 2 T 1 -تصویر وزنی: مایع مغزی نخاعی کم فشار T 2 -تصویر وزنی: مایع مغزی نخاعی با شدت بالا
*تصاویر وزنی T 1 و T 2 T 1 -تصویر وزنی: مایع مغزی نخاعی کم فشار T 2 -تصویر وزنی: مایع مغزی نخاعی با شدت بالا



 *عوامل کنتراست برای MRI *پارامغناطیس - شدت سیگنال MR را با کوتاه کردن زمان آرامش T1 افزایش می دهند و عوامل "مثبت" برای کنتراست - خارج سلولی (ترکیبات DTPA، EDTA و مشتقات آنها - با منگنز و Gd) - درون سلولی (Mn-) هستند. DPDP، Mn. Cl 2) - گیرنده *عوامل سوپرپارامغناطیس - شدت سیگنال MR را با افزایش زمان آرامش T2 کاهش می دهد و عوامل "منفی" برای کنتراست - مجتمع ها و تعلیق Fe 2 O 3 هستند.
*عوامل کنتراست برای MRI *پارامغناطیس - شدت سیگنال MR را با کوتاه کردن زمان آرامش T1 افزایش می دهند و عوامل "مثبت" برای کنتراست - خارج سلولی (ترکیبات DTPA، EDTA و مشتقات آنها - با منگنز و Gd) - درون سلولی (Mn-) هستند. DPDP، Mn. Cl 2) - گیرنده *عوامل سوپرپارامغناطیس - شدت سیگنال MR را با افزایش زمان آرامش T2 کاهش می دهد و عوامل "منفی" برای کنتراست - مجتمع ها و تعلیق Fe 2 O 3 هستند.

 *مزایای تصویربرداری رزونانس مغناطیسی * بالاترین وضوح در بین تمام روش های تصویربرداری پزشکی * * بدون قرار گرفتن در معرض اشعه * قابلیت های اضافی (MR آنژیوگرافی، بازسازی سه بعدی، MRI با کنتراست و ...) امکان گرفتن تصاویر تشخیصی اولیه در سطوح مختلف (محوری) ، فرونتال، ساژیتال و غیره)
*مزایای تصویربرداری رزونانس مغناطیسی * بالاترین وضوح در بین تمام روش های تصویربرداری پزشکی * * بدون قرار گرفتن در معرض اشعه * قابلیت های اضافی (MR آنژیوگرافی، بازسازی سه بعدی، MRI با کنتراست و ...) امکان گرفتن تصاویر تشخیصی اولیه در سطوح مختلف (محوری) ، فرونتال، ساژیتال و غیره)
 *معایب تصویربرداری رزونانس مغناطیسی *در دسترس بودن کم، هزینه بالا *زمان طولانی اسکن MR (مشکل در مطالعه سازه های متحرک) *ناتوانی در مطالعه بیماران با برخی سازه های فلزی (فرو و پارامغناطیس) *مشکل در ارزیابی حجم زیادی از اطلاعات بصری مرز بین نرمال و پاتولوژیک)
*معایب تصویربرداری رزونانس مغناطیسی *در دسترس بودن کم، هزینه بالا *زمان طولانی اسکن MR (مشکل در مطالعه سازه های متحرک) *ناتوانی در مطالعه بیماران با برخی سازه های فلزی (فرو و پارامغناطیس) *مشکل در ارزیابی حجم زیادی از اطلاعات بصری مرز بین نرمال و پاتولوژیک)

 یکی از روش های مدرن برای تشخیص بیماری های مختلف، توموگرافی کامپیوتری (CT، انگلس، ساراتوف) است. توموگرافی کامپیوتری روشی برای اسکن لایه به لایه نواحی مورد مطالعه بدن است. بر اساس داده های مربوط به جذب بافتی اشعه ایکس، کامپیوتر تصویری از اندام مورد نیاز در هر صفحه انتخاب شده ایجاد می کند. این روش برای مطالعه دقیق اندام های داخلی، رگ های خونی، استخوان ها و مفاصل استفاده می شود.
یکی از روش های مدرن برای تشخیص بیماری های مختلف، توموگرافی کامپیوتری (CT، انگلس، ساراتوف) است. توموگرافی کامپیوتری روشی برای اسکن لایه به لایه نواحی مورد مطالعه بدن است. بر اساس داده های مربوط به جذب بافتی اشعه ایکس، کامپیوتر تصویری از اندام مورد نیاز در هر صفحه انتخاب شده ایجاد می کند. این روش برای مطالعه دقیق اندام های داخلی، رگ های خونی، استخوان ها و مفاصل استفاده می شود.

 سی تی میلوگرافی روشی است که ترکیبی از قابلیت های سی تی و میلوگرافی است. این روش به عنوان یک روش تصویربرداری تهاجمی طبقه بندی می شود، زیرا نیاز به وارد کردن ماده حاجب به فضای زیر عنکبوتیه دارد. برخلاف میلوگرافی اشعه ایکس، سی تی میلوگرافی به مقدار کمتری ماده حاجب نیاز دارد. در حال حاضر از سی تی میلوگرافی استفاده می شود شرایط بستریبرای تعیین باز بودن فضاهای مایع مغزی نخاعی نخاع و مغز، فرآیندهای انسدادی، انواع مختلفلیکوره بینی، فرآیندهای کیستیک محلی سازی داخل جمجمه و مهره-پاراورتبرال را تشخیص می دهد.
سی تی میلوگرافی روشی است که ترکیبی از قابلیت های سی تی و میلوگرافی است. این روش به عنوان یک روش تصویربرداری تهاجمی طبقه بندی می شود، زیرا نیاز به وارد کردن ماده حاجب به فضای زیر عنکبوتیه دارد. برخلاف میلوگرافی اشعه ایکس، سی تی میلوگرافی به مقدار کمتری ماده حاجب نیاز دارد. در حال حاضر از سی تی میلوگرافی استفاده می شود شرایط بستریبرای تعیین باز بودن فضاهای مایع مغزی نخاعی نخاع و مغز، فرآیندهای انسدادی، انواع مختلفلیکوره بینی، فرآیندهای کیستیک محلی سازی داخل جمجمه و مهره-پاراورتبرال را تشخیص می دهد.

 آنژیوگرافی کامپیوتری از نظر محتوای اطلاعاتی نزدیک به آنژیوگرافی معمولی است و بر خلاف آنژیوگرافی معمولی، بدون اعمال جراحی پیچیده همراه با قرار دادن کاتتر داخل عروقی به اندام مورد بررسی انجام می شود. مزیت سی تی تانژیوگرافی این است که امکان انجام مطالعه به صورت سرپایی در مدت 40 تا 50 دقیقه را فراهم می کند، خطر عوارض ناشی از عمل جراحی را به طور کامل از بین می برد، قرار گرفتن در معرض اشعه را برای بیمار کاهش می دهد و هزینه مطالعه را کاهش می دهد.
آنژیوگرافی کامپیوتری از نظر محتوای اطلاعاتی نزدیک به آنژیوگرافی معمولی است و بر خلاف آنژیوگرافی معمولی، بدون اعمال جراحی پیچیده همراه با قرار دادن کاتتر داخل عروقی به اندام مورد بررسی انجام می شود. مزیت سی تی تانژیوگرافی این است که امکان انجام مطالعه به صورت سرپایی در مدت 40 تا 50 دقیقه را فراهم می کند، خطر عوارض ناشی از عمل جراحی را به طور کامل از بین می برد، قرار گرفتن در معرض اشعه را برای بیمار کاهش می دهد و هزینه مطالعه را کاهش می دهد.
 وضوح بالای CT مارپیچی امکان ساخت مدل های حجمی (3D) از سیستم عروقی را فراهم می کند. با بهبود تجهیزات، سرعت تحقیق به طور مداوم در حال کاهش است. بنابراین، زمان ثبت داده ها در طول سی تی آنژیوگرافی عروق گردن و مغز در یک اسکنر 6 مارپیچی از 30 تا 50 ثانیه و در یک اسکنر 16 مارپیچی - 15-20 ثانیه طول می کشد. در حال حاضر، این تحقیق، از جمله پردازش سه بعدی، تقریباً به صورت بلادرنگ انجام می شود.
وضوح بالای CT مارپیچی امکان ساخت مدل های حجمی (3D) از سیستم عروقی را فراهم می کند. با بهبود تجهیزات، سرعت تحقیق به طور مداوم در حال کاهش است. بنابراین، زمان ثبت داده ها در طول سی تی آنژیوگرافی عروق گردن و مغز در یک اسکنر 6 مارپیچی از 30 تا 50 ثانیه و در یک اسکنر 16 مارپیچی - 15-20 ثانیه طول می کشد. در حال حاضر، این تحقیق، از جمله پردازش سه بعدی، تقریباً به صورت بلادرنگ انجام می شود.

 * معاینه اندام های شکمی (کبد، کیسه صفرا، پانکراس) با معده خالی انجام می شود. * نیم ساعت قبل از مطالعه، کنتراست حلقه های روده کوچک برای مشاهده بهتر سر پانکراس و ناحیه کبد صفراوی انجام می شود (شما باید از یک تا سه لیوان محلول ماده حاجب بنوشید). * هنگام معاینه اندام های لگن، انجام دو تنقیه پاک کننده ضروری است: 8-6 ساعت و 2 ساعت قبل از معاینه. قبل از معاینه، بیمار باید مقدار زیادی مایع بنوشد تا ظرف یک ساعت مثانه پر شود. *آماده سازی
* معاینه اندام های شکمی (کبد، کیسه صفرا، پانکراس) با معده خالی انجام می شود. * نیم ساعت قبل از مطالعه، کنتراست حلقه های روده کوچک برای مشاهده بهتر سر پانکراس و ناحیه کبد صفراوی انجام می شود (شما باید از یک تا سه لیوان محلول ماده حاجب بنوشید). * هنگام معاینه اندام های لگن، انجام دو تنقیه پاک کننده ضروری است: 8-6 ساعت و 2 ساعت قبل از معاینه. قبل از معاینه، بیمار باید مقدار زیادی مایع بنوشد تا ظرف یک ساعت مثانه پر شود. *آماده سازی
 *سی تی اسکن با اشعه ایکس، بیمار را دقیقاً مانند اشعه ایکس معمولی در معرض اشعه ایکس قرار می دهد، اما دوز کلی تشعشع معمولاً بیشتر است. بنابراین، RCT باید فقط به دلایل پزشکی انجام شود. انجام RCT در دوران بارداری و بدون نیاز خاص برای کودکان خردسال توصیه نمی شود. * قرار گرفتن در معرض پرتوهای یونیزان
*سی تی اسکن با اشعه ایکس، بیمار را دقیقاً مانند اشعه ایکس معمولی در معرض اشعه ایکس قرار می دهد، اما دوز کلی تشعشع معمولاً بیشتر است. بنابراین، RCT باید فقط به دلایل پزشکی انجام شود. انجام RCT در دوران بارداری و بدون نیاز خاص برای کودکان خردسال توصیه نمی شود. * قرار گرفتن در معرض پرتوهای یونیزان

 *اتاق های اشعه ایکس برای اهداف مختلف باید دارای مجموعه ای اجباری از تجهیزات حفاظتی متحرک و شخصی در برابر تشعشع باشد که در ضمیمه 8 San. پی. N 2. 6. 1. 1192 -03 "الزامات بهداشتی برای طراحی و بهره برداری از اتاق های اشعه ایکس، دستگاه ها و انجام معاینات اشعه ایکس."
*اتاق های اشعه ایکس برای اهداف مختلف باید دارای مجموعه ای اجباری از تجهیزات حفاظتی متحرک و شخصی در برابر تشعشع باشد که در ضمیمه 8 San. پی. N 2. 6. 1. 1192 -03 "الزامات بهداشتی برای طراحی و بهره برداری از اتاق های اشعه ایکس، دستگاه ها و انجام معاینات اشعه ایکس."
 *اتاق های اشعه ایکس باید به طور مرکزی در محل اتصال بیمارستان و درمانگاه در موسسات پزشکی قرار گیرند. قرار دادن این گونه دفاتر در الحاقات ساختمانهای مسکونی و در طبقات همکف مجاز است.
*اتاق های اشعه ایکس باید به طور مرکزی در محل اتصال بیمارستان و درمانگاه در موسسات پزشکی قرار گیرند. قرار دادن این گونه دفاتر در الحاقات ساختمانهای مسکونی و در طبقات همکف مجاز است.
 * برای حفاظت از پرسنل، الزامات بهداشتی زیر استفاده می شود: برای عسل. برای پرسنل، متوسط دوز موثر سالانه 20 متر مکعب ولت (0.02 سیورت) یا دوز موثر در یک دوره کاری (50 سال) 1 سیورت است.
* برای حفاظت از پرسنل، الزامات بهداشتی زیر استفاده می شود: برای عسل. برای پرسنل، متوسط دوز موثر سالانه 20 متر مکعب ولت (0.02 سیورت) یا دوز موثر در یک دوره کاری (50 سال) 1 سیورت است.
 * برای افراد تقریباً سالم، دوز موثر سالانه هنگام انجام معاینات پیشگیرانه با اشعه ایکس پزشکی نباید از 1 متر مکعب ولت (0.001 سیورت) تجاوز کند.
* برای افراد تقریباً سالم، دوز موثر سالانه هنگام انجام معاینات پیشگیرانه با اشعه ایکس پزشکی نباید از 1 متر مکعب ولت (0.001 سیورت) تجاوز کند.
 محافظت در برابر تابش اشعه ایکس به شما امکان می دهد فقط هنگام استفاده از دستگاه در موسسات پزشکی از شخص محافظت کنید. امروزه انواع مختلفی از تجهیزات حفاظتی وجود دارد که به گروه هایی تقسیم می شوند: تجهیزات حفاظتی جمعی، آنها دارای دو نوع فرعی هستند: ثابت و متحرک. به معنی در برابر اشعه های بلااستفاده مستقیم؛ دستگاه ها برای پرسنل خدماتی; تجهیزات حفاظتی در نظر گرفته شده برای بیماران
محافظت در برابر تابش اشعه ایکس به شما امکان می دهد فقط هنگام استفاده از دستگاه در موسسات پزشکی از شخص محافظت کنید. امروزه انواع مختلفی از تجهیزات حفاظتی وجود دارد که به گروه هایی تقسیم می شوند: تجهیزات حفاظتی جمعی، آنها دارای دو نوع فرعی هستند: ثابت و متحرک. به معنی در برابر اشعه های بلااستفاده مستقیم؛ دستگاه ها برای پرسنل خدماتی; تجهیزات حفاظتی در نظر گرفته شده برای بیماران
 * زمان صرف شده در کره منبع اشعه ایکس باید حداقل باشد. فاصله از منبع اشعه ایکس. برای مطالعات تشخیصی، حداقل فاصله بین فوکوس لوله اشعه ایکس و جسم مورد بررسی 35 سانتی متر (فاصله کانونی پوست) است. این فاصله به طور خودکار توسط طراحی دستگاه انتقال و ضبط تضمین می شود.
* زمان صرف شده در کره منبع اشعه ایکس باید حداقل باشد. فاصله از منبع اشعه ایکس. برای مطالعات تشخیصی، حداقل فاصله بین فوکوس لوله اشعه ایکس و جسم مورد بررسی 35 سانتی متر (فاصله کانونی پوست) است. این فاصله به طور خودکار توسط طراحی دستگاه انتقال و ضبط تضمین می شود.
 * دیوارها و پارتیشن ها از 2-3 لایه بتونه تشکیل شده است که با رنگ مخصوص طبی رنگ شده است. کف ها نیز لایه به لایه از مواد مخصوص ساخته شده اند.
* دیوارها و پارتیشن ها از 2-3 لایه بتونه تشکیل شده است که با رنگ مخصوص طبی رنگ شده است. کف ها نیز لایه به لایه از مواد مخصوص ساخته شده اند.
 * سقف ها ضد آب هستند، در 2-3 لایه ویژه گذاشته شده اند. مواد با سرب رنگ شده با رنگ طبی. نور کافی
* سقف ها ضد آب هستند، در 2-3 لایه ویژه گذاشته شده اند. مواد با سرب رنگ شده با رنگ طبی. نور کافی
 * درب اتاق اشعه ایکس باید فلزی با ورقه سرب باشد. رنگ (معمولا) سفید یا خاکستری با علامت "خطر" اجباری است. قاب های پنجره باید از همان مواد ساخته شوند.
* درب اتاق اشعه ایکس باید فلزی با ورقه سرب باشد. رنگ (معمولا) سفید یا خاکستری با علامت "خطر" اجباری است. قاب های پنجره باید از همان مواد ساخته شوند.
 * برای محافظت شخصی از موارد زیر استفاده می شود: پیش بند محافظ، یقه، جلیقه، دامن، عینک، کلاه، دستکش با پوشش اجباری سرب.
* برای محافظت شخصی از موارد زیر استفاده می شود: پیش بند محافظ، یقه، جلیقه، دامن، عینک، کلاه، دستکش با پوشش اجباری سرب.
 * تجهیزات محافظ متحرک شامل: صفحه نمایش های کوچک و بزرگ برای کارکنان و بیماران، صفحه یا پرده محافظ ساخته شده از فلز یا پارچه مخصوص با ورقه سرب.
* تجهیزات محافظ متحرک شامل: صفحه نمایش های کوچک و بزرگ برای کارکنان و بیماران، صفحه یا پرده محافظ ساخته شده از فلز یا پارچه مخصوص با ورقه سرب.
 هنگام کار با دستگاه ها در اتاق اشعه ایکس، همه چیز باید به درستی کار کند و با دستورالعمل های تنظیم شده برای استفاده از دستگاه ها مطابقت داشته باشد. علامت گذاری ابزار مورد استفاده الزامی است.
هنگام کار با دستگاه ها در اتاق اشعه ایکس، همه چیز باید به درستی کار کند و با دستورالعمل های تنظیم شده برای استفاده از دستگاه ها مطابقت داشته باشد. علامت گذاری ابزار مورد استفاده الزامی است.

 توموگرافی کامپیوتری با گسیل تک فوتون به طور گسترده ای در عمل قلب و اعصاب استفاده می شود. این روش مبتنی بر چرخش یک دوربین گاما معمولی در اطراف بدن بیمار است. ثبت تابش در نقاط مختلف دایره به فرد امکان می دهد یک تصویر مقطعی را بازسازی کند. * SPECT
توموگرافی کامپیوتری با گسیل تک فوتون به طور گسترده ای در عمل قلب و اعصاب استفاده می شود. این روش مبتنی بر چرخش یک دوربین گاما معمولی در اطراف بدن بیمار است. ثبت تابش در نقاط مختلف دایره به فرد امکان می دهد یک تصویر مقطعی را بازسازی کند. * SPECT

 SPECT در قلب، مغز و اعصاب، اورولوژی، ریه، برای تشخیص تومورهای مغزی، برای سینتی گرافی سرطان سینه، بیماری های کبد و سینتی گرافی اسکلتی استفاده می شود. این فناوری امکان تشکیل تصاویر سه بعدی را فراهم می کند، برخلاف سینتی گرافی، که از همان اصل ایجاد فوتون های گاما استفاده می کند، اما فقط یک طرح ریزی دو بعدی ایجاد می کند.
SPECT در قلب، مغز و اعصاب، اورولوژی، ریه، برای تشخیص تومورهای مغزی، برای سینتی گرافی سرطان سینه، بیماری های کبد و سینتی گرافی اسکلتی استفاده می شود. این فناوری امکان تشکیل تصاویر سه بعدی را فراهم می کند، برخلاف سینتی گرافی، که از همان اصل ایجاد فوتون های گاما استفاده می کند، اما فقط یک طرح ریزی دو بعدی ایجاد می کند.

 SPECT از رادیوداروهای برچسب گذاری شده با رادیو ایزوتوپ ها استفاده می کند که هسته های آنها در طول هر رویداد واپاشی رادیواکتیو فقط یک پرتو گاما (فوتون) ساطع می کنند (برای مقایسه، PET از رادیو ایزوتوپ هایی استفاده می کند که پوزیترون ساطع می کنند).
SPECT از رادیوداروهای برچسب گذاری شده با رادیو ایزوتوپ ها استفاده می کند که هسته های آنها در طول هر رویداد واپاشی رادیواکتیو فقط یک پرتو گاما (فوتون) ساطع می کنند (برای مقایسه، PET از رادیو ایزوتوپ هایی استفاده می کند که پوزیترون ساطع می کنند).
 *توموگرافی انتشار پوزیترون PET بر اساس استفاده از پوزیترون های ساطع شده توسط رادیونوکلئیدها است. پوزیترون ها که جرمی برابر با الکترون ها دارند، بار مثبت دارند. پوزیترون ساطع شده بلافاصله با یک الکترون مجاور برهمکنش می کند و در نتیجه دو فوتون پرتو گاما در جهت مخالف حرکت می کنند. این فوتون ها توسط آشکارسازهای مخصوص ثبت می شوند. سپس اطلاعات به کامپیوتر منتقل شده و به تصویر دیجیتال تبدیل می شود.
*توموگرافی انتشار پوزیترون PET بر اساس استفاده از پوزیترون های ساطع شده توسط رادیونوکلئیدها است. پوزیترون ها که جرمی برابر با الکترون ها دارند، بار مثبت دارند. پوزیترون ساطع شده بلافاصله با یک الکترون مجاور برهمکنش می کند و در نتیجه دو فوتون پرتو گاما در جهت مخالف حرکت می کنند. این فوتون ها توسط آشکارسازهای مخصوص ثبت می شوند. سپس اطلاعات به کامپیوتر منتقل شده و به تصویر دیجیتال تبدیل می شود.
 پوزیترون ها از واپاشی بتا پوزیترون یک رادیونوکلئید که بخشی از یک رادیودارو است که قبل از مطالعه وارد بدن می شود، به وجود می آیند.
پوزیترون ها از واپاشی بتا پوزیترون یک رادیونوکلئید که بخشی از یک رادیودارو است که قبل از مطالعه وارد بدن می شود، به وجود می آیند.
 PET امکان تعیین کمیت غلظت پرتوزا و در نتیجه مطالعه فرآیندهای متابولیک در بافت ها را فراهم می کند.
PET امکان تعیین کمیت غلظت پرتوزا و در نتیجه مطالعه فرآیندهای متابولیک در بافت ها را فراهم می کند.
 انتخاب یک رادیودارو مناسب امکان مطالعه چنین دارویی را فراهم می کند فرآیندهای مختلفمانند متابولیسم، انتقال مواد، فعل و انفعالات لیگاند-گیرنده، بیان ژن، و غیره. استفاده از رادیوداروهای متعلق به کلاس های مختلف ترکیبات فعال بیولوژیکی، PET را به یک ابزار نسبتاً جهانی در پزشکی مدرن تبدیل می کند. بنابراین، توسعه رادیوداروهای جدید و روش های مؤثر برای سنتز داروهای قبلاً اثبات شده در حال حاضر به مرحله کلیدی در توسعه روش PET تبدیل شده است.
انتخاب یک رادیودارو مناسب امکان مطالعه چنین دارویی را فراهم می کند فرآیندهای مختلفمانند متابولیسم، انتقال مواد، فعل و انفعالات لیگاند-گیرنده، بیان ژن، و غیره. استفاده از رادیوداروهای متعلق به کلاس های مختلف ترکیبات فعال بیولوژیکی، PET را به یک ابزار نسبتاً جهانی در پزشکی مدرن تبدیل می کند. بنابراین، توسعه رادیوداروهای جدید و روش های مؤثر برای سنتز داروهای قبلاً اثبات شده در حال حاضر به مرحله کلیدی در توسعه روش PET تبدیل شده است.

 *
*
 سینتی گرافی - (از لاتین scinti - sparkle و یونانی grapho - نشان دادن، نوشتن) روشی برای تجسم عملکردی که شامل وارد کردن ایزوتوپ های رادیواکتیو (RP) به بدن و به دست آوردن تصویری دو بعدی با تعیین تابش ساطع شده از آنها است.
سینتی گرافی - (از لاتین scinti - sparkle و یونانی grapho - نشان دادن، نوشتن) روشی برای تجسم عملکردی که شامل وارد کردن ایزوتوپ های رادیواکتیو (RP) به بدن و به دست آوردن تصویری دو بعدی با تعیین تابش ساطع شده از آنها است.
 ردیابهای رادیواکتیو از سال 1911 کاربرد خود را در پزشکی پیدا کردند؛ بنیانگذار آنها گیورگی دی هیوز بود که برای آن جایزه نوبل دریافت کرد. از دهه پنجاه، این زمینه به طور فعال شروع به توسعه کرد، رادیونوکلئیدها وارد عمل شدند و مشاهده تجمع آنها در اندام مورد نظر و توزیع در سراسر آن امکان پذیر شد. در نیمه دوم قرن بیستم، با توسعه فن آوری برای ایجاد کریستال های بزرگ، دستگاه جدیدی ایجاد شد - یک دوربین گاما، که استفاده از آن امکان به دست آوردن تصاویر - سینتیگرام را فراهم کرد. به این روش سینتی گرافی می گویند.
ردیابهای رادیواکتیو از سال 1911 کاربرد خود را در پزشکی پیدا کردند؛ بنیانگذار آنها گیورگی دی هیوز بود که برای آن جایزه نوبل دریافت کرد. از دهه پنجاه، این زمینه به طور فعال شروع به توسعه کرد، رادیونوکلئیدها وارد عمل شدند و مشاهده تجمع آنها در اندام مورد نظر و توزیع در سراسر آن امکان پذیر شد. در نیمه دوم قرن بیستم، با توسعه فن آوری برای ایجاد کریستال های بزرگ، دستگاه جدیدی ایجاد شد - یک دوربین گاما، که استفاده از آن امکان به دست آوردن تصاویر - سینتیگرام را فراهم کرد. به این روش سینتی گرافی می گویند.
 * ماهیت روش این روش تشخیصی به شرح زیر است: به بیمار، اغلب به صورت داخل وریدی، دارویی که از یک مولکول ناقل و یک مولکول نشانگر تشکیل شده است، تزریق می شود. یک مولکول بردار میل ترکیبی به یک اندام خاص یا کل سیستم. این اوست که مسئول اطمینان از اینکه نشانگر دقیقاً در جایی که لازم است متمرکز شده است. مولکول نشانگر توانایی انتشار پرتوهای γ را دارد که به نوبه خود توسط دوربین سوسوزن گرفته شده و به یک نتیجه قابل خواندن تبدیل می شود.
* ماهیت روش این روش تشخیصی به شرح زیر است: به بیمار، اغلب به صورت داخل وریدی، دارویی که از یک مولکول ناقل و یک مولکول نشانگر تشکیل شده است، تزریق می شود. یک مولکول بردار میل ترکیبی به یک اندام خاص یا کل سیستم. این اوست که مسئول اطمینان از اینکه نشانگر دقیقاً در جایی که لازم است متمرکز شده است. مولکول نشانگر توانایی انتشار پرتوهای γ را دارد که به نوبه خود توسط دوربین سوسوزن گرفته شده و به یک نتیجه قابل خواندن تبدیل می شود.
 *تصاویر به دست آمده ثابت هستند - نتیجه یک تصویر مسطح (دو بعدی) است. این روش اغلب استخوان ها، غده تیروئید و غیره را بررسی می کند. پویا - نتیجه افزودن چندین منحنی ثابت برای به دست آوردن منحنی های پویا (به عنوان مثال، هنگام مطالعه عملکرد کلیه ها، کبد، کیسه صفرا) مطالعه همگام با ECG - همگام سازی ECG امکان تجسم عملکرد انقباضی قلب در حالت توموگرافی را فراهم می کند.
*تصاویر به دست آمده ثابت هستند - نتیجه یک تصویر مسطح (دو بعدی) است. این روش اغلب استخوان ها، غده تیروئید و غیره را بررسی می کند. پویا - نتیجه افزودن چندین منحنی ثابت برای به دست آوردن منحنی های پویا (به عنوان مثال، هنگام مطالعه عملکرد کلیه ها، کبد، کیسه صفرا) مطالعه همگام با ECG - همگام سازی ECG امکان تجسم عملکرد انقباضی قلب در حالت توموگرافی را فراهم می کند.
 سینتی گرافی گاهی اوقات به عنوان یک روش مرتبط، توموگرافی کامپیوتری با انتشار تک فوتون (SPECT) نامیده می شود، که به فرد امکان می دهد توموگرام (تصاویر سه بعدی) به دست آورد. اغلب قلب (میوکارد) و مغز از این طریق مورد بررسی قرار می گیرند
سینتی گرافی گاهی اوقات به عنوان یک روش مرتبط، توموگرافی کامپیوتری با انتشار تک فوتون (SPECT) نامیده می شود، که به فرد امکان می دهد توموگرام (تصاویر سه بعدی) به دست آورد. اغلب قلب (میوکارد) و مغز از این طریق مورد بررسی قرار می گیرند
 * استفاده از روش سینتی گرافی برای مشکوک بودن به برخی آسیب شناسی، برای یک بیماری موجود و قبلاً شناسایی شده، برای روشن شدن میزان آسیب اندام، فعالیت عملکردی کانون پاتولوژیک و ارزیابی اثربخشی درمان نشان داده شده است.
* استفاده از روش سینتی گرافی برای مشکوک بودن به برخی آسیب شناسی، برای یک بیماری موجود و قبلاً شناسایی شده، برای روشن شدن میزان آسیب اندام، فعالیت عملکردی کانون پاتولوژیک و ارزیابی اثربخشی درمان نشان داده شده است.
 *موضوعات مطالعه غدد درون ریز، سیستم خون ساز، نخاع و مغز (تشخیص بیماری های عفونی مغز، بیماری آلزایمر، پارکینسون) سیستم لنفاویسیستم قلبی عروقی ریه (بررسی انقباض میوکارد، تشخیص کانون های ایسکمیک، تشخیص ترومبوآمبولی) شریان ریوی) اندام های گوارشی، اندام های سیستم دفعی، سیستم اسکلتی (تشخیص شکستگی، التهاب، عفونت، تومورهای استخوانی)
*موضوعات مطالعه غدد درون ریز، سیستم خون ساز، نخاع و مغز (تشخیص بیماری های عفونی مغز، بیماری آلزایمر، پارکینسون) سیستم لنفاویسیستم قلبی عروقی ریه (بررسی انقباض میوکارد، تشخیص کانون های ایسکمیک، تشخیص ترومبوآمبولی) شریان ریوی) اندام های گوارشی، اندام های سیستم دفعی، سیستم اسکلتی (تشخیص شکستگی، التهاب، عفونت، تومورهای استخوانی)
 ایزوتوپ ها مختص یک اندام خاص هستند، بنابراین از رادیوداروهای مختلف برای تشخیص آسیب شناسی اندام های مختلف استفاده می شود. برای مطالعه قلب، از تالیم-201، تکنسیوم-99 متر، غده تیروئید - ید-123، ریه ها - تکنتیوم-99 متر، ید-111، کبد - تکنتیوم-97 متر و غیره استفاده می شود.
ایزوتوپ ها مختص یک اندام خاص هستند، بنابراین از رادیوداروهای مختلف برای تشخیص آسیب شناسی اندام های مختلف استفاده می شود. برای مطالعه قلب، از تالیم-201، تکنسیوم-99 متر، غده تیروئید - ید-123، ریه ها - تکنتیوم-99 متر، ید-111، کبد - تکنتیوم-97 متر و غیره استفاده می شود.
 *معیار انتخاب رادیودارو ملاک اصلی انتخاب نسبت ارزش تشخیصی به حداقل تابش است که می تواند در موارد زیر نمایان شود: دارو باید سریعاً به اندام مورد مطالعه برسد، به طور یکنواخت در آن توزیع شود و همچنین سریع و کامل باشد. از بدن دفع می شود. نیمه عمر بخش رادیواکتیو مولکول باید به اندازه کافی کوتاه باشد تا رادیونوکلئید هیچ آسیبی به سلامتی بیمار وارد نکند. تشعشعی که مشخصه یک داروی معین است باید برای ثبت راحت باشد. رادیوداروها نباید حاوی ناخالصی های سمی برای انسان باشند و نباید محصولات پوسیدگی تولید کنند زمان طولانیتجزیه
*معیار انتخاب رادیودارو ملاک اصلی انتخاب نسبت ارزش تشخیصی به حداقل تابش است که می تواند در موارد زیر نمایان شود: دارو باید سریعاً به اندام مورد مطالعه برسد، به طور یکنواخت در آن توزیع شود و همچنین سریع و کامل باشد. از بدن دفع می شود. نیمه عمر بخش رادیواکتیو مولکول باید به اندازه کافی کوتاه باشد تا رادیونوکلئید هیچ آسیبی به سلامتی بیمار وارد نکند. تشعشعی که مشخصه یک داروی معین است باید برای ثبت راحت باشد. رادیوداروها نباید حاوی ناخالصی های سمی برای انسان باشند و نباید محصولات پوسیدگی تولید کنند زمان طولانیتجزیه
 * نیاز به تحقیق آموزش ویژه 1. مطالعه عملکردیغده تیروئید با استفاده از یدید سدیم 131. به مدت 3 ماه قبل از مطالعه، بیماران از انجام یک مطالعه کنتراست اشعه ایکس منع می شوند. مصرف داروهای حاوی ید؛ 10 روز قبل از مطالعه، آرامبخشهای حاوی ید در غلظتهای بالا حذف میشوند و بیمار صبحها با معده خالی به بخش تشخیص رادیوایزوتوپ فرستاده میشود. 30 دقیقه پس از مصرف ید رادیواکتیو، بیمار می تواند صبحانه بخورد
* نیاز به تحقیق آموزش ویژه 1. مطالعه عملکردیغده تیروئید با استفاده از یدید سدیم 131. به مدت 3 ماه قبل از مطالعه، بیماران از انجام یک مطالعه کنتراست اشعه ایکس منع می شوند. مصرف داروهای حاوی ید؛ 10 روز قبل از مطالعه، آرامبخشهای حاوی ید در غلظتهای بالا حذف میشوند و بیمار صبحها با معده خالی به بخش تشخیص رادیوایزوتوپ فرستاده میشود. 30 دقیقه پس از مصرف ید رادیواکتیو، بیمار می تواند صبحانه بخورد
 2. سینتی گرافی غده تیروئید با استفاده از یدید 131 سدیم بیمار صبح ناشتا به بخش اعزام می شود. 30 دقیقه پس از مصرف ید رادیواکتیو به بیمار یک صبحانه معمولی داده می شود. سینتی گرافی تیروئید 24 ساعت پس از مصرف دارو انجام می شود. 3. سینتی گرافی میوکارد با استفاده از 201 تالیم کلرید با معده خالی انجام می شود. 4. سینتی گرافی دینامیک مجاری صفراوی با هیدا مطالعه با معده خالی انجام می شود. یک پرستار بیمارستان 2 تخم مرغ خام را به بخش تشخیص رادیوایزوتوپ می آورد. 5. سینتی گرافی سیستم اسکلتی با پیروفسفات بیمار با همراهی یک پرستار صبح برای تزریق داخل وریدی دارو به بخش تشخیص ایزوتوپ فرستاده می شود. مطالعه پس از 3 ساعت انجام می شود. قبل از شروع مطالعه، بیمار باید مثانه را تخلیه کند.
2. سینتی گرافی غده تیروئید با استفاده از یدید 131 سدیم بیمار صبح ناشتا به بخش اعزام می شود. 30 دقیقه پس از مصرف ید رادیواکتیو به بیمار یک صبحانه معمولی داده می شود. سینتی گرافی تیروئید 24 ساعت پس از مصرف دارو انجام می شود. 3. سینتی گرافی میوکارد با استفاده از 201 تالیم کلرید با معده خالی انجام می شود. 4. سینتی گرافی دینامیک مجاری صفراوی با هیدا مطالعه با معده خالی انجام می شود. یک پرستار بیمارستان 2 تخم مرغ خام را به بخش تشخیص رادیوایزوتوپ می آورد. 5. سینتی گرافی سیستم اسکلتی با پیروفسفات بیمار با همراهی یک پرستار صبح برای تزریق داخل وریدی دارو به بخش تشخیص ایزوتوپ فرستاده می شود. مطالعه پس از 3 ساعت انجام می شود. قبل از شروع مطالعه، بیمار باید مثانه را تخلیه کند.
 *مطالعاتی که نیاز به آماده سازی خاصی ندارد سینتی گرافی کبد بررسی رادیومتری تومورهای پوستی. رنوگرافی و سینتی گرافی کلیه ها آنژیوگرافی کلیه ها و آئورت شکمی، عروق گردن و مغز سینتی گرافی پانکراس. سینتی گرافی ریه. BCC (تعیین حجم خون در گردش) مطالعه انتقال - انتشار قلب، ریه و عروق بزرگ سینتی گرافی غده تیروئید با استفاده از پرتکنیت فلبوگرافی لنفوگرافی تعیین کسر جهشی
*مطالعاتی که نیاز به آماده سازی خاصی ندارد سینتی گرافی کبد بررسی رادیومتری تومورهای پوستی. رنوگرافی و سینتی گرافی کلیه ها آنژیوگرافی کلیه ها و آئورت شکمی، عروق گردن و مغز سینتی گرافی پانکراس. سینتی گرافی ریه. BCC (تعیین حجم خون در گردش) مطالعه انتقال - انتشار قلب، ریه و عروق بزرگ سینتی گرافی غده تیروئید با استفاده از پرتکنیت فلبوگرافی لنفوگرافی تعیین کسر جهشی
 *موارد منع مصرف یک کنترااندیکاسیون مطلق حساسیت به مواد موجود در رادیودارو مورد استفاده است. منع مصرف نسبی بارداری است. معاینه بیمار شیرده مجاز است، اما مهم است که شیردهی زودتر از 24 ساعت پس از معاینه یا بهتر است بگوییم پس از تجویز دارو از سر گرفته نشود.
*موارد منع مصرف یک کنترااندیکاسیون مطلق حساسیت به مواد موجود در رادیودارو مورد استفاده است. منع مصرف نسبی بارداری است. معاینه بیمار شیرده مجاز است، اما مهم است که شیردهی زودتر از 24 ساعت پس از معاینه یا بهتر است بگوییم پس از تجویز دارو از سر گرفته نشود.
 *اثرات جانبیواکنش های آلرژیک به مواد رادیواکتیو افزایش یا کاهش موقت فشار خون نیاز مکرر به ادرار کردن
*اثرات جانبیواکنش های آلرژیک به مواد رادیواکتیو افزایش یا کاهش موقت فشار خون نیاز مکرر به ادرار کردن
 * جنبه های مثبت مطالعه توانایی تعیین نه تنها ظاهر اندام، بلکه اختلال عملکرد، که اغلب خود را خیلی زودتر از ضایعات ارگانیک نشان می دهد. با چنین مطالعه ای، نتیجه نه به صورت یک تصویر دو بعدی ایستا، بلکه در قالب منحنی های پویا، توموگرام یا الکتروکاردیوگرام ثبت می شود. بر اساس اولین نکته، مشخص می شود که سینتی گرافی امکان کمی سازی آسیب به یک عضو یا سیستم را فراهم می کند. این روش عملاً به هیچ آمادگی از جانب بیمار نیاز ندارد. اغلب، فقط توصیه می شود از یک رژیم غذایی خاص پیروی کنید و مصرف داروهایی را که ممکن است در تجسم اختلال ایجاد کنند، متوقف کنید
* جنبه های مثبت مطالعه توانایی تعیین نه تنها ظاهر اندام، بلکه اختلال عملکرد، که اغلب خود را خیلی زودتر از ضایعات ارگانیک نشان می دهد. با چنین مطالعه ای، نتیجه نه به صورت یک تصویر دو بعدی ایستا، بلکه در قالب منحنی های پویا، توموگرام یا الکتروکاردیوگرام ثبت می شود. بر اساس اولین نکته، مشخص می شود که سینتی گرافی امکان کمی سازی آسیب به یک عضو یا سیستم را فراهم می کند. این روش عملاً به هیچ آمادگی از جانب بیمار نیاز ندارد. اغلب، فقط توصیه می شود از یک رژیم غذایی خاص پیروی کنید و مصرف داروهایی را که ممکن است در تجسم اختلال ایجاد کنند، متوقف کنید
 *
*
 رادیولوژی مداخله ای شاخه ای از رادیولوژی پزشکی است که مبانی علمی و کاربرد بالینی روش های درمانی و تشخیصی را که تحت کنترل تحقیقات پرتویی انجام می شود، توسعه می دهد. تشکیل R. و. با معرفی الکترونیک، اتوماسیون، تلویزیون و فناوری کامپیوتر به پزشکی امکان پذیر شد.
رادیولوژی مداخله ای شاخه ای از رادیولوژی پزشکی است که مبانی علمی و کاربرد بالینی روش های درمانی و تشخیصی را که تحت کنترل تحقیقات پرتویی انجام می شود، توسعه می دهد. تشکیل R. و. با معرفی الکترونیک، اتوماسیون، تلویزیون و فناوری کامپیوتر به پزشکی امکان پذیر شد.
 مداخلات جراحی انجام شده با استفاده از رادیولوژی مداخله ای را می توان به گروه های زیر تقسیم کرد: * ترمیم مجرای ساختارهای لوله ای باریک (شریان ها، مجاری صفراوی، قسمت های مختلف دستگاه گوارش). * تخلیه تشکیلات حفره در اندام های داخلی؛ *انسداد مجرای عروق خونی *هدف کاربرد
مداخلات جراحی انجام شده با استفاده از رادیولوژی مداخله ای را می توان به گروه های زیر تقسیم کرد: * ترمیم مجرای ساختارهای لوله ای باریک (شریان ها، مجاری صفراوی، قسمت های مختلف دستگاه گوارش). * تخلیه تشکیلات حفره در اندام های داخلی؛ *انسداد مجرای عروق خونی *هدف کاربرد
 اندیکاسیون های روش های مداخله ای بسیار گسترده است، که با انواع مشکلاتی که می توان با استفاده از روش های رادیولوژی مداخله ای حل کرد، همراه است. موارد منع عمومی وضعیت شدید بیمار، حاد است بیماری های عفونی، اختلالات روانی، جبران عملکردهای سیستم قلبی عروقی، کبد، کلیه ها، هنگام استفاده از مواد رادیو کنتراست حاوی ید - افزایش حساسیت به آماده سازی ید. * نشانه ها
اندیکاسیون های روش های مداخله ای بسیار گسترده است، که با انواع مشکلاتی که می توان با استفاده از روش های رادیولوژی مداخله ای حل کرد، همراه است. موارد منع عمومی وضعیت شدید بیمار، حاد است بیماری های عفونی، اختلالات روانی، جبران عملکردهای سیستم قلبی عروقی، کبد، کلیه ها، هنگام استفاده از مواد رادیو کنتراست حاوی ید - افزایش حساسیت به آماده سازی ید. * نشانه ها
 توسعه رادیولوژی مداخله ای مستلزم ایجاد دفتر تخصصی در بخش رادیولوژی بود. اغلب، این یک اتاق آنژیوگرافی برای مطالعات داخل حفره ای و داخل عروقی است که توسط یک تیم جراحی اشعه ایکس، که شامل جراح اشعه ایکس، متخصص بیهوشی، متخصص سونوگرافی، پرستار عمل، تکنسین اشعه ایکس، یک پرستار خدمات رسانی می شود. و یک دستیار آزمایشگاه عکس. کارکنان تیم جراحی اشعه ایکس باید در روش های مراقبت های ویژه و احیا مهارت داشته باشند.
توسعه رادیولوژی مداخله ای مستلزم ایجاد دفتر تخصصی در بخش رادیولوژی بود. اغلب، این یک اتاق آنژیوگرافی برای مطالعات داخل حفره ای و داخل عروقی است که توسط یک تیم جراحی اشعه ایکس، که شامل جراح اشعه ایکس، متخصص بیهوشی، متخصص سونوگرافی، پرستار عمل، تکنسین اشعه ایکس، یک پرستار خدمات رسانی می شود. و یک دستیار آزمایشگاه عکس. کارکنان تیم جراحی اشعه ایکس باید در روش های مراقبت های ویژه و احیا مهارت داشته باشند.

 مداخلات درون عروقی اشعه ایکس که بیشترین شناخت را دریافت کرده اند، روش های تشخیصی و درمانی داخل عروقی هستند که تحت کنترل اشعه ایکس انجام می شوند. انواع اصلی آنها اتساع داخل عروقی اشعه ایکس یا آنژیوپلاستی، پروتزهای درون عروقی اشعه ایکس و انسداد درون عروقی اشعه ایکس است.
مداخلات درون عروقی اشعه ایکس که بیشترین شناخت را دریافت کرده اند، روش های تشخیصی و درمانی داخل عروقی هستند که تحت کنترل اشعه ایکس انجام می شوند. انواع اصلی آنها اتساع داخل عروقی اشعه ایکس یا آنژیوپلاستی، پروتزهای درون عروقی اشعه ایکس و انسداد درون عروقی اشعه ایکس است.
 مداخلات مداخله ای خارج واژال شامل دستکاری های اندوبرونشیال، اندوبیلیاری، اندو مری، غدد درون ریز و غیره است. مداخلات درون برونشی اشعه ایکس شامل کاتتریزاسیون درخت برونش است که تحت کنترل روشنایی تلویزیون با اشعه ایکس انجام می شود تا موادی برای مطالعات مورفولوژیکی از مناطق غیرقابل دسترس برونکوسکوپ به دست آید. با تنگی های پیشرونده نای، با نرم شدن غضروف نای و برونش ها، اندو پروتز با استفاده از پروتزهای فلزی و نیتینول موقت و دائمی انجام می شود.
مداخلات مداخله ای خارج واژال شامل دستکاری های اندوبرونشیال، اندوبیلیاری، اندو مری، غدد درون ریز و غیره است. مداخلات درون برونشی اشعه ایکس شامل کاتتریزاسیون درخت برونش است که تحت کنترل روشنایی تلویزیون با اشعه ایکس انجام می شود تا موادی برای مطالعات مورفولوژیکی از مناطق غیرقابل دسترس برونکوسکوپ به دست آید. با تنگی های پیشرونده نای، با نرم شدن غضروف نای و برونش ها، اندو پروتز با استفاده از پروتزهای فلزی و نیتینول موقت و دائمی انجام می شود.
 * در سال 1986، رونتگن نوع جدیدی از تشعشعات را کشف کرد و در همان سال دانشمندان با استعداد موفق شدند رگ های اندام های مختلف یک جسد را شفاف کنند. با این حال، توانایی های فنی محدود، توسعه آنژیوگرافی عروقی را برای مدتی با مشکل مواجه کرده است. * در حال حاضر، آنژیوگرافی عروقی یک روش نسبتا جدید، اما به سرعت در حال توسعه با تکنولوژی بالا برای تشخیص بیماری های مختلف عروق خونی و اندام های انسان است.
* در سال 1986، رونتگن نوع جدیدی از تشعشعات را کشف کرد و در همان سال دانشمندان با استعداد موفق شدند رگ های اندام های مختلف یک جسد را شفاف کنند. با این حال، توانایی های فنی محدود، توسعه آنژیوگرافی عروقی را برای مدتی با مشکل مواجه کرده است. * در حال حاضر، آنژیوگرافی عروقی یک روش نسبتا جدید، اما به سرعت در حال توسعه با تکنولوژی بالا برای تشخیص بیماری های مختلف عروق خونی و اندام های انسان است.  * در اشعه ایکس استاندارد، دیدن شریانها، سیاهرگها، عروق لنفاوی و مویرگهای بسیار کمتر غیرممکن است، زیرا آنها پرتوها را مانند بافتهای نرم اطراف خود جذب میکنند. بنابراین برای اینکه بتوان رگ ها را بررسی کرد و وضعیت آنها را ارزیابی کرد، از روش های خاص آنژیوگرافی با معرفی مواد رادیوپاک مخصوص استفاده می شود.
* در اشعه ایکس استاندارد، دیدن شریانها، سیاهرگها، عروق لنفاوی و مویرگهای بسیار کمتر غیرممکن است، زیرا آنها پرتوها را مانند بافتهای نرم اطراف خود جذب میکنند. بنابراین برای اینکه بتوان رگ ها را بررسی کرد و وضعیت آنها را ارزیابی کرد، از روش های خاص آنژیوگرافی با معرفی مواد رادیوپاک مخصوص استفاده می شود.
 بسته به محل ورید آسیب دیده، چندین نوع آنژیوگرافی متمایز می شود: 1. آنژیوگرافی مغزی - مطالعه عروق مغزی. 2. آئورتوگرافی توراسیک - مطالعه آئورت و شاخه های آن. 3. آنژیوگرافی ریه – تصویری از عروق ریوی. 4. آئورتوگرافی شکمی – معاینه آئورت شکمی. 5. آرتریوگرافی کلیه - تشخیص تومورها، صدمات کلیه و سنگ کلیه. 6. آرتریوگرافی محیطی - ارزیابی وضعیت شریان های اندام در آسیب ها و بیماری های انسدادی. 7. پورتوگرافی - تحقیق ورید پورتالکبد. 8. فلبوگرافی مطالعه عروق اندام ها برای تعیین ماهیت جریان خون وریدی است. 9. آنژیوگرافی فلورسین مطالعه عروق خونی مورد استفاده در چشم پزشکی است. *انواع آنژیوگرافی
بسته به محل ورید آسیب دیده، چندین نوع آنژیوگرافی متمایز می شود: 1. آنژیوگرافی مغزی - مطالعه عروق مغزی. 2. آئورتوگرافی توراسیک - مطالعه آئورت و شاخه های آن. 3. آنژیوگرافی ریه – تصویری از عروق ریوی. 4. آئورتوگرافی شکمی – معاینه آئورت شکمی. 5. آرتریوگرافی کلیه - تشخیص تومورها، صدمات کلیه و سنگ کلیه. 6. آرتریوگرافی محیطی - ارزیابی وضعیت شریان های اندام در آسیب ها و بیماری های انسدادی. 7. پورتوگرافی - تحقیق ورید پورتالکبد. 8. فلبوگرافی مطالعه عروق اندام ها برای تعیین ماهیت جریان خون وریدی است. 9. آنژیوگرافی فلورسین مطالعه عروق خونی مورد استفاده در چشم پزشکی است. *انواع آنژیوگرافی
 آنژیوگرافی برای تشخیص آسیب شناسی رگ های خونی اندام تحتانی، به ویژه تنگی (تنگی) یا انسداد (انسداد) شریان ها، سیاهرگ ها و مجاری لنفاوی استفاده می شود. این روش برای: * شناسایی تغییرات آترواسکلروتیک در جریان خون، * تشخیص بیماری قلبی، * ارزیابی عملکرد کلیه استفاده می شود. * تشخیص تومورها، کیست ها، آنوریسم ها، لخته های خون، شانت های شریانی وریدی؛ * تشخیص بیماری های شبکیه؛ * معاینه قبل از عمل جراحی در مغز یا قلب باز. * نشانه هایی برای مطالعه
آنژیوگرافی برای تشخیص آسیب شناسی رگ های خونی اندام تحتانی، به ویژه تنگی (تنگی) یا انسداد (انسداد) شریان ها، سیاهرگ ها و مجاری لنفاوی استفاده می شود. این روش برای: * شناسایی تغییرات آترواسکلروتیک در جریان خون، * تشخیص بیماری قلبی، * ارزیابی عملکرد کلیه استفاده می شود. * تشخیص تومورها، کیست ها، آنوریسم ها، لخته های خون، شانت های شریانی وریدی؛ * تشخیص بیماری های شبکیه؛ * معاینه قبل از عمل جراحی در مغز یا قلب باز. * نشانه هایی برای مطالعه
 این روش برای موارد زیر منع مصرف دارد: * ونوگرافی ترومبوفلبیت. * بیماری های عفونی و التهابی حاد؛ * بیماری های روانی؛ * واکنش های آلرژیک به داروهای حاوی ید یا مواد حاجب. * نارسایی شدید کلیه، کبد و قلب؛ * وضعیت جدی بیمار؛ * اختلال در عملکرد تیروئید؛ * بیماری های مقاربتی. این روش برای بیماران مبتلا به اختلالات خونریزی و همچنین برای زنان باردار به دلیل اثرات منفی اشعه یونیزان بر روی جنین منع مصرف دارد. * موارد منع مصرف
این روش برای موارد زیر منع مصرف دارد: * ونوگرافی ترومبوفلبیت. * بیماری های عفونی و التهابی حاد؛ * بیماری های روانی؛ * واکنش های آلرژیک به داروهای حاوی ید یا مواد حاجب. * نارسایی شدید کلیه، کبد و قلب؛ * وضعیت جدی بیمار؛ * اختلال در عملکرد تیروئید؛ * بیماری های مقاربتی. این روش برای بیماران مبتلا به اختلالات خونریزی و همچنین برای زنان باردار به دلیل اثرات منفی اشعه یونیزان بر روی جنین منع مصرف دارد. * موارد منع مصرف
 1. آنژیوگرافی عروقی یک روش تهاجمی است که نیاز به نظارت پزشکی بر وضعیت بیمار قبل و بعد از روش تشخیصی دارد. با توجه به این ویژگی ها، بستری شدن بیمار در بیمارستان و انجام آن ضروری است تحقیقات آزمایشگاهی: آزمایش خون عمومی، آزمایش ادرار، آزمایش خون بیوشیمیایی، تعیین گروه خونی و فاکتور Rh و تعدادی آزمایش دیگر بر اساس اندیکاسیون. به فرد توصیه می شود چند روز قبل از عمل، مصرف برخی از داروهایی که بر سیستم انعقاد خون تأثیر می گذارند (مثلا آسپرین) را متوقف کند. *آمادگی برای مطالعه
1. آنژیوگرافی عروقی یک روش تهاجمی است که نیاز به نظارت پزشکی بر وضعیت بیمار قبل و بعد از روش تشخیصی دارد. با توجه به این ویژگی ها، بستری شدن بیمار در بیمارستان و انجام آن ضروری است تحقیقات آزمایشگاهی: آزمایش خون عمومی، آزمایش ادرار، آزمایش خون بیوشیمیایی، تعیین گروه خونی و فاکتور Rh و تعدادی آزمایش دیگر بر اساس اندیکاسیون. به فرد توصیه می شود چند روز قبل از عمل، مصرف برخی از داروهایی که بر سیستم انعقاد خون تأثیر می گذارند (مثلا آسپرین) را متوقف کند. *آمادگی برای مطالعه
 2. به بیمار توصیه می شود 6-8 ساعت قبل از شروع اقدامات تشخیصی از خوردن غذا خودداری کند. 3. خود عمل با استفاده از بی حس کننده های موضعی انجام می شود و معمولاً در آستانه آزمایش داروهای آرامبخش (آرام بخش) برای فرد تجویز می شود. 4. قبل از آنژیوگرافی، هر بیمار از نظر واکنش آلرژیک به داروهای مورد استفاده در مقابل آزمایش می شود. *آمادگی برای مطالعه
2. به بیمار توصیه می شود 6-8 ساعت قبل از شروع اقدامات تشخیصی از خوردن غذا خودداری کند. 3. خود عمل با استفاده از بی حس کننده های موضعی انجام می شود و معمولاً در آستانه آزمایش داروهای آرامبخش (آرام بخش) برای فرد تجویز می شود. 4. قبل از آنژیوگرافی، هر بیمار از نظر واکنش آلرژیک به داروهای مورد استفاده در مقابل آزمایش می شود. *آمادگی برای مطالعه
 * پس از انجام پیش درمان با محلول های ضد عفونی کننده با توجه به بی حسی موضعییک برش کوچک روی پوست ایجاد می شود و شریان مورد نیاز پیدا می شود. با سوزن مخصوص سوراخ می شود و یک هادی فلزی از طریق این سوزن تا سطح مورد نظر وارد می شود. یک کاتتر مخصوص در امتداد این هادی به یک نقطه معین وارد می شود و هادی به همراه سوزن خارج می شود. تمام دستکاری هایی که در داخل رگ انجام می شود کاملاً تحت کنترل تلویزیون اشعه ایکس رخ می دهد. یک ماده رادیوپاک از طریق کاتتر به داخل رگ تزریق می شود و در همان لحظه یک سری عکسبرداری با اشعه ایکس گرفته می شود و در صورت لزوم وضعیت بیمار را تغییر می دهد. *تکنیک آنژیوگرافی
* پس از انجام پیش درمان با محلول های ضد عفونی کننده با توجه به بی حسی موضعییک برش کوچک روی پوست ایجاد می شود و شریان مورد نیاز پیدا می شود. با سوزن مخصوص سوراخ می شود و یک هادی فلزی از طریق این سوزن تا سطح مورد نظر وارد می شود. یک کاتتر مخصوص در امتداد این هادی به یک نقطه معین وارد می شود و هادی به همراه سوزن خارج می شود. تمام دستکاری هایی که در داخل رگ انجام می شود کاملاً تحت کنترل تلویزیون اشعه ایکس رخ می دهد. یک ماده رادیوپاک از طریق کاتتر به داخل رگ تزریق می شود و در همان لحظه یک سری عکسبرداری با اشعه ایکس گرفته می شود و در صورت لزوم وضعیت بیمار را تغییر می دهد. *تکنیک آنژیوگرافی
 *پس از اتمام عمل، کاتتر برداشته می شود و یک باند استریل بسیار محکم روی ناحیه سوراخ زده می شود. ماده وارد شده به رگ در عرض 24 ساعت از طریق کلیه ها از بدن خارج می شود. خود عمل حدود 40 دقیقه طول می کشد. *تکنیک آنژیوگرافی
*پس از اتمام عمل، کاتتر برداشته می شود و یک باند استریل بسیار محکم روی ناحیه سوراخ زده می شود. ماده وارد شده به رگ در عرض 24 ساعت از طریق کلیه ها از بدن خارج می شود. خود عمل حدود 40 دقیقه طول می کشد. *تکنیک آنژیوگرافی
 * وضعیت بیمار پس از عمل * برای بیمار استراحت در بستر به مدت 24 ساعت تجویز می شود. سلامت بیمار توسط پزشک معالج کنترل می شود که دمای بدن را اندازه گیری می کند و ناحیه مداخله تهاجمی را بررسی می کند. روز بعد پانسمان برداشته می شود و در صورتی که وضعیت فرد مساعد باشد و در ناحیه سوراخ شده خونریزی نداشته باشد، به منزل فرستاده می شود. * برای اکثریت قریب به اتفاق افراد، آنژیوگرافی هیچ خطری ندارد. طبق داده های موجود، خطر عوارض در حین آنژیوگرافی از 5% تجاوز نمی کند.
* وضعیت بیمار پس از عمل * برای بیمار استراحت در بستر به مدت 24 ساعت تجویز می شود. سلامت بیمار توسط پزشک معالج کنترل می شود که دمای بدن را اندازه گیری می کند و ناحیه مداخله تهاجمی را بررسی می کند. روز بعد پانسمان برداشته می شود و در صورتی که وضعیت فرد مساعد باشد و در ناحیه سوراخ شده خونریزی نداشته باشد، به منزل فرستاده می شود. * برای اکثریت قریب به اتفاق افراد، آنژیوگرافی هیچ خطری ندارد. طبق داده های موجود، خطر عوارض در حین آنژیوگرافی از 5% تجاوز نمی کند.
 *عوارض در میان عوارض، شایع ترین آنها عبارتند از: * واکنش های آلرژیک به مواد حاجب اشعه ایکس (به ویژه آنهایی که حاوی ید هستند، زیرا بیشتر مورد استفاده قرار می گیرند) * احساسات دردناکتورم و هماتوم در محل قرار دادن کاتتر * خونریزی بعد از سوراخ * اختلال در عملکرد کلیه تا ایجاد نارسایی کلیه * ضربه به عروق یا بافت قلب * اختلال در ریتم قلب * ایجاد نارسایی قلبی عروقی * حمله قلبی یا سکته مغزی
*عوارض در میان عوارض، شایع ترین آنها عبارتند از: * واکنش های آلرژیک به مواد حاجب اشعه ایکس (به ویژه آنهایی که حاوی ید هستند، زیرا بیشتر مورد استفاده قرار می گیرند) * احساسات دردناکتورم و هماتوم در محل قرار دادن کاتتر * خونریزی بعد از سوراخ * اختلال در عملکرد کلیه تا ایجاد نارسایی کلیه * ضربه به عروق یا بافت قلب * اختلال در ریتم قلب * ایجاد نارسایی قلبی عروقی * حمله قلبی یا سکته مغزی