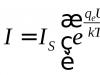هر دو مفهوم در سال 1926 معرفی شدند. O. Vogtبرای توصیف تنوع در فنوتیپ های جهش یافته.
بیانگر بودن- این درجه تجلیصفت جهش یافته در فنوتیپ به عنوان مثال، جهش بی چشمدر مگس سرکه باعث کاهش چشم می شود که درجه آن در افراد مختلف متفاوت است.
نفوذ -این فرکانس،یا احتمال وقوعفنوتیپ جهش یافته در بین تمام افراد حامل این جهش. به عنوان مثال، نفوذ 100٪ یک جهش مغلوب به این معنی است که در همه افراد هموزیگوت در فنوتیپ ظاهر می شود. اگر از نظر فنوتیپی فقط در نیمی از افراد تشخیص داده شود، نفوذ جهش 50٪ است.
جهش های شرطی
این جهش ها تنها زمانی ظاهر می شوند که شرایط خاصی برآورده شود.
جهش های حساس به دما. جهش یافته های این نوع به طور معمول در زیر یک ( سهل گیر) دما و تشخیص انحراف در دیگری ( محدود کننده). به عنوان مثال، مگس سرکه به سرما حساس است (در دمای 18 درجه سانتیگراد) ts جهش (حساس به دما) و حساس به گرما (در دمای 29 درجه سانتیگراد) ts -جهش در دمای 25 درجه سانتی گراد فنوتیپ طبیعی باقی می ماند.
جهش های حساسیت به استرس. در در این موردجهش یافته ها رشد می کنند و اگر تحت تأثیر استرس قرار نگیرند، ظاهراً طبیعی به نظر می رسند. بله، جهش یافته ها sesB (حساس به استرس) مگس سرکه در شرایط عادیهیچ انحرافی نشان ندهید
با این حال، اگر لوله آزمایش را به شدت تکان دهید، مگس ها شروع به تشنج کرده و قادر به حرکت نیستند.
جهش های اکسوتروفیک در باکتری ها. آنها فقط در محیط کامل یا در حداقل محیط زنده می مانند، اما با افزودن یک یا آن ماده (اسید آمینه، نوکلئوتید و غیره).
روش های محاسبه جهش
ویژگی های روش های حسابداری جهش. روش های تشخیص جهش باید بسته به نحوه تولید مثل ارگانیسم متفاوت باشد. قابل مشاهده است تغییرات مورفولوژیکیبه راحتی در نظر گرفته می شوند؛ تعیین تغییرات فیزیولوژیکی و بیوشیمیایی در آن دشوارتر است موجودات چند سلولی. ساده ترین تشخیص غالب قابل مشاهدهتجزیه و تحلیل جهش هایی که ممکن است در نسل اول هتروزیگوت به نظر برسند دشوارتر است جهش های مغلوب، ضروری هستند هموزیگوت ارائه کنید.
برای اشیایی که از نظر ژنتیکی به خوبی مورد مطالعه قرار گرفته اند (مگس سرکه، ذرت، تعدادی از میکروارگانیسم ها)، مطالعه یک جهش جدید بسیار آسان است. به عنوان مثالروش های خاصی برای در نظر گرفتن فراوانی جهش ها برای مگس سرکه ایجاد شده است.
روش СlВ. مولریک خط مگس میوه ایجاد کرد СlВ (سی ال بی) که دارای یکی از X- کروموزوم توسط یک ژن غالب مشخص می شود نوار (B) و وارونگی، به نام با . این وارونگی مانع از عبور و مرور می شود و مغلوب است. اثر کشنده – ل. به همین دلیل این خط نامگذاری شده است СlВ .
زنان از این خط آنالایزربا مردان نمونه مورد مطالعه تلاقی یافت. اگر نرها از جمعیت طبیعی، سپس می توانیم تعداد پروازها را در آن تخمین بزنیم. یا نر می گیرند، با موتاژن درمان می شود. در این حالت فراوانی جهش های کشنده ناشی از این جهش زا تخمین زده می شود.
در F 1زنان را انتخاب کنید СlВ/+، هتروزیگوت برای جهش نوار، و متقاطع به صورت جداگانه (هر ماده در یک لوله جداگانه با یک نر از نوع وحشی). اگر در کروموزوم مورد آزمایش قرار گیرد بدون جهشسپس فرزندان دارای دو طبقه ماده و یک طبقه نر خواهند بود ( B+) از نرها СlВبه دلیل وجود پرواز می میرند ل ، یعنی تقسیم جنسیتی عمومی خواهد بود 2:1 (تصویر را ببینید).
اگر در کروموزوم آزمایشی یک جهش کشنده وجود دارد l m ، سپس در F 2 فقط ماده خواهد بود، از آنجایی که نرهای هر دو کلاس خواهند مرد - در یک مورد، به دلیل وجود پرواز در داخل X-کروموزوم СlВ، در دیگری - به دلیل وجود پرواز l m در تجربی X-کروموزوم (شکل را ببینید). تعریف نسبت عددی Xکروموزوم ها (لوله های آزمایش با تلاقی های فردی) که در آنها کشنده ایجاد شد، به تعداد کل مورد مطالعه X-کروموزوم ها (لوله های آزمایش)، فراوانی جهش های کشنده را در یک گروه خاص محاسبه می کنند.
مولر بارها روش خود را برای شناسایی کشنده ها تغییر داد X- کروموزوم مگس سرکه، در نتیجه ظاهر چنین خطوط - تجزیه و تحلیل، چگونه Mu-5 ، و بعد - خطوط - متعادل کننده ها Basc, بیننو غیره
روش Cy L/PM . برای محاسبه جهش های کشنده در اتوزوم هامگس میوه از خطوط استفاده می کند کشنده های متعادل. برای اینکه یک جهش کشنده مغلوب در اتوزوم ظاهر شود، لازم است که وجود داشته باشد در حالت هموزیگوت. برای انجام این کار، باید دو ضربدر ایجاد کرد و سوابق فرزندان را در آن نگه داشت F 3. برای تشخیص پرواز دومخط استفاده از کروموزوم Cy L/PM (CyLP Em) (تصویر را ببینید).
مگس های این خط دارند کروموزوم دومدو جهش غالب وجود دارد Cy (فرفری - بال های خمیده ) و L (لوب – چشم های لوبولی کوچک ) که هر کدام در حالت هموزیگوت باعث ایجاد اثر کشنده می شود. جهش ها گسترده هستند وارونگی هادر بازوهای مختلف کروموزوم هر دوی آنها قفل شده است» عبور از روی. کروموزوم همولوگ همچنین حاوی یک جهش غالب - وارونگی است بعد از ظهر (آلو – چشم های قهوه ای). نر مورد تجزیه و تحلیل با یک ماده از خط تلاقی می شود CyL/PM (همه طبقات نواده در شکل نشان داده نشده اند).
در F 1مردان را انتخاب کنید Cy L/PM + و به صورت جداگانهآنها را با ماده های خط اصلی عبور دهید Cy L/PM . در F 2نر و ماده را انتخاب کنید Cy L ، که در آن کروموزوم همولوگ کروموزوم آزمایشی است. در نتیجه تلاقی آنها با یکدیگر سه طبقه اولاد به دست می آید. یکی از آنها به دلیل هموزیگوسیتی برای جهش می میرد Cy و L ، دسته دیگری از فرزندان هتروزیگوت ها هستند Cy L/PM +, و همچنین کلاس هموزیگوت ها برای کروموزوم آزمایش شده. نتیجه نهایی مگس است Cy L و Cy+L+ در نسبت 2:1 .
اگر کروموزوم آزمایشی داشته باشد جهش کشنده، فرزندان از آخرین عبور خواهد شد فقط پرواز می کند Cy L . با استفاده از این روش می توان فراوانی جهش های کشنده مغلوب را در نظر گرفت در کروموزوم دوم مگس سرکه.
محاسبه جهش در اشیاء دیگر. روش های مشابهسیستم های تشخیص جهش نیز برای اشیاء دیگر توسعه یافته است. آنها بر اساس همان اصول هستند:
1) کشف کنید مغلوبجهش را می توان به همو-یا همزیگوتایالت،
2) می توان به دقت فراوانی جهش های رخ داده را فقط تحت شرایط در نظر گرفت عدم عبور از رویدر افراد هتروزیگوت
برای پستانداران(موش، خرگوش، سگ، خوک و غیره) روشی برای ثبت فراوانی وقوع ایجاد شده است. کشنده غالبجهش ها فراوانی جهش ها با تفاوت بین تعداد مورد قضاوت قرار می گیرد بدن های زرد در تخمدان و در حال رشد جنین هادر یک زن باردار کالبد شکافی
با در نظر گرفتن فراوانی جهش ها در انسانبا این حال بسیار دشوار است تجزیه و تحلیل شجره نامه ، یعنی تجزیه و تحلیل شجره نامه به ما امکان می دهد تا وقوع جهش های جدید را تعیین کنیم. اگر صفت خاصی در شجره نامه همسران برای چندین نسل یافت نشد، اما در یکی از فرزندان ظاهر شد و شروع به انتقال به نسل های بعدی کرد، آنگاه جهش در گامت یکی از این همسران ایجاد شد.
محاسبه جهش در میکروارگانیسم ها. مطالعه جهش در میکروارگانیسم ها بسیار راحت است، زیرا آنها همه ژن ها را دارند V مفرد و جهش ها در حال حاضر ظاهر می شوند نسل اول.
جهش یافته ها به راحتی قابل تشخیص هستند روش اثر انگشت، یا ماکت ها، که توسط همسران پیشنهاد شد E.و جی. لدربرگ.
برای شناسایی جهشهای مقاومت به باکتریوفاژ T1 در E. coli، باکتریها را روی نوترینت آگار کاشته میشوند تا کلونیهای جداگانه تشکیل دهند. سپس، با استفاده از یک ماکت مخملی، این مستعمرات بر روی صفحات پوشش داده شده با سوسپانسیون ذرات فاژ T1 دوباره چاپ می شوند. اکثر سلولهای حساس اصلی ( تن ) فرهنگ ها کلونی تشکیل نمی دهند، زیرا توسط باکتریوفاژ لیز می شوند. فقط مستعمرات جهش یافته منفرد رشد خواهند کرد ( TonR ) به فاژ مقاوم است. با شمارش تعداد کلنیها در واریانتهای شاهد و آزمایشی (مثلاً پس از تابش نور ماوراء بنفش) به راحتی میتوان فراوانی جهشهای القایی را تعیین کرد.
نفوذ بسامد بیان یک ژن است. این بر اساس درصد افراد در جمعیت حامل ژنی که در آن خود را نشان می دهد تعیین می شود. با نفوذ کامل، یک آلل مغلوب غالب یا هموزیگوت در هر فرد و با نفوذ ناقص در برخی افراد ظاهر می شود.
بیانگر درجه تظاهرات فنوتیپی یک ژن به عنوان معیاری برای قدرت عمل آن است که با درجه توسعه صفت تعیین می شود. بیان می تواند تحت تأثیر ژن های اصلاح کننده و عوامل محیطی قرار گیرد. در جهش یافته با نفوذ ناقص، بیان اغلب تغییر می کند. نفوذ یک پدیده کیفی است، بیان کمی است.
در پزشکی، نفوذ به نسبت افراد دارای یک ژنوتیپ مشخص است که حداقل یک علامت از یک بیماری را دارند (به عبارت دیگر، نفوذ احتمال یک بیماری را تعیین می کند، اما شدت آن را تعیین نمی کند). برخی معتقدند که نفوذ با افزایش سن تغییر می کند، مانند بیماری هانتینگتون، اما تفاوت در سن شروع معمولاً به بیان متغیر نسبت داده می شود. گاهی اوقات نفوذ به عواملی بستگی دارد محیط زیستبه عنوان مثال، با کمبود G-6-PD.
نفوذ ممکن است در مشاوره ژنتیک پزشکی در مورد بیماری های اتوزومال غالب مهم باشد. یک فرد سالم که یکی از والدینش از بیماری مشابهی رنج می برد، از نظر وراثت کلاسیک نمی تواند ناقل ژن جهش یافته باشد. با این حال، اگر احتمال نفوذ ناقص را در نظر بگیریم، تصویر کاملاً متفاوت است: ظاهرا فرد سالمممکن است یک ژن جهش یافته شناسایی نشده داشته باشد و آن را به کودکان منتقل کند.
روشهای تشخیص ژن این امکان را فراهم میکند که مشخص شود آیا یک فرد دارای ژن جهش یافته است یا خیر و یک ژن طبیعی را از یک ژن جهشیافته تشخیصنشده تشخیص دهد.
در عمل، تعیین میزان نفوذ اغلب به کیفیت روش های تحقیق بستگی دارد، به عنوان مثال، MRI می تواند علائم بیماری را که قبلاً شناسایی نشده بود، تشخیص دهد.
از نقطه نظر پزشکی، اگر انحرافات عملکردی از هنجار شناسایی شود، یک ژن حتی در یک بیماری بدون علامت نیز ظاهر می شود. از نقطه نظر بیولوژیکی، اگر ژنی در عملکرد بدن اختلال ایجاد کند، بیان می شود.
اگرچه صحبت در مورد نفوذ و بیان بیماری های اتوزومال غالب رایج است، اما همین اصول در مورد بیماری های کروموزومی، اتوزومال مغلوب، مرتبط با X و چند ژنی صدق می کند.
رشد جنین از طریق تعامل مداوم ارثی و عوامل خارجی. در فرآیند چنین روابطی، فنوتیپی شکل می گیرد که در واقع نتیجه اجرای برنامه ارثی را در شرایط محیطی خاص منعکس می کند. با وجود این واقعیت که رشد داخل رحمی جنین در پستانداران در یک محیط نسبتا ثابت در شرایط بهینهتأثیر عوامل نامطلوب خارجی در این دوره به ویژه با افزایش روزافزون تجمع آنها در محیط به دلیل پیشرفت فنی به هیچ وجه منتفی نیست. در حال حاضر فرد در تمام دوره های زندگی خود در معرض عوامل شیمیایی، فیزیکی، بیولوژیکی و روانی قرار دارد.
مطالعات تجربی در مورد رشد حیوانات منجر به ایده دوره های به اصطلاح بحرانی در رشد موجودات شد. این اصطلاح به دورههایی اطلاق میشود که جنین به اثرات مخرب عوامل مختلفی که میتوانند رشد طبیعی را مختل کنند، حساسترین است. این دوره ها کمترین مقاومت جنین در برابر عوامل محیطی است.
| مواد قبلی: |
نفوذ (نفوذ، لات. penetrantis- نافذ، رسیدن) - فراوانی یا احتمال تظاهرات یک آلل یک ژن خاص در افراد مختلف یک گروه مرتبط از ارگانیسم ها (درجه تجلی آلل در یک فرد را بیان می گویند). بین کامل (آلل در همه افراد ظاهر می شود) و نفوذ ناقص (الل در برخی افراد ظاهر می شود) تفاوت قائل می شود. بیشتر آلل های جهش یافته با نفوذ ناقص مشخص می شوند. نفوذ به درصد بیان می شود (نفوذ کل - 100٪). اصطلاح "نفوذ" توسط N.V. Timofeev-Resovsky در سال 1927 پیشنهاد شد.
تعاریف موجود از این اصطلاح مبهم هستند و اغلب اشتباه می شوند. در پزشکی، نفوذ به نسبت افراد دارای یک ژنوتیپ مشخص است که حداقل یک علامت از یک بیماری را دارند (به عبارت دیگر، نفوذ احتمال یک بیماری را تعیین می کند، اما شدت آن را تعیین نمی کند). برخی معتقدند که نفوذ با افزایش سن تغییر می کند، مانند بیماری هانتینگتون، با این حال تفاوت در سن شروع به طور کلی به بیان متغیر نسبت داده می شود. نفوذ گاهی تحت تأثیر عوامل محیطی مانند کمبود G6PD قرار می گیرد.
نفوذ ممکن است در مشاوره ژنتیک پزشکی در مورد بیماری های اتوزومال غالب مهم باشد. یک فرد سالم که یکی از والدینش از بیماری مشابهی رنج می برد، از نظر وراثت کلاسیک، نمی تواند ناقل ژن جهش یافته باشد. با این حال، اگر احتمال نفوذ ناقص را در نظر بگیریم، تصویر کاملاً متفاوت است: یک فرد به ظاهر سالم می تواند یک ژن جهش یافته کشف نشده داشته باشد و آن را به فرزندان خود منتقل کند.
روشهای تشخیص ژن این امکان را فراهم میآورند که مشخص شود آیا یک فرد دارای ژن جهش یافته است یا خیر و یک ژن طبیعی را از یک ژن جهشیافته شناسایی نشده تشخیص دهد.
در عمل، تعیین میزان نفوذ اغلب به کیفیت روش های تحقیق بستگی دارد، به عنوان مثال، MRI می تواند علائم بیماری را که قبلاً شناسایی نشده بود، تشخیص دهد.
از نقطه نظر پزشکی، اگر انحرافات عملکردی از هنجار شناسایی شود، یک ژن حتی در یک بیماری بدون علامت نیز ظاهر می شود. از نقطه نظر بیولوژیکی، اگر یک ژن در عملکرد بدن اختلال ایجاد کند، بیان می شود.
اگرچه صحبت از نفوذ و بیان در بیماریهای اتوزوم غالب رایج است، اما همین اصول در مورد بیماریهای کروموزومی، اتوزومال مغلوب، مرتبط با X و بیماریهای چند ژنی صدق میکند.
نفوذ یک آلل فراوانی وقوع آن در یک جمعیت است. بیان یک آلل، شدت تجلی آن در یک فرد است. با نفوذ کامل آلل، این صفت در تمام افراد جمعیت مشاهده می شود. با نفوذ ناقص، این صفت در همه افراد مشاهده نمی شود.
نفوذ در ژنتیک عبارت است از نسبت افراد با یک ژنوتیپ معین که از نظر فنوتیپی در آنها ظاهر می شود. اگر این بیماری در همه افراد ژنوتیپ مربوطه ظاهر نشود، آنها از نفوذ ناقص ژن صحبت می کنند.
یک ژن موجود در ژنوتیپ به مقدار لازم برای تجلی (1 آلل برای صفات غالب و 2 آلل برای صفات مغلوب) می تواند خود را به عنوان یک صفت به درجات مختلف در موجودات مختلف (بیان بودن) نشان دهد یا اصلاً خود را نشان ندهد (نفوذ). دلایل:
- تغییرپذیری اصلاح (تأثیر شرایط محیطی)
- تنوع ترکیبی (تأثیر سایر ژن های ژنوتیپ).
بیانگر بودن- درجه تظاهرات فنوتیپی آلل. به عنوان مثال، آلل های گروه خونی AB0 در انسان دارای بیان ثابت هستند (همیشه 100٪ بیان می شوند) و آلل هایی که رنگ چشم را تعیین می کنند دارای بیان متغیر هستند. یک جهش مغلوب که تعداد وجوه چشم را در مگس سرکه کاهش میدهد، تعداد وجوه چشم را به روشهای مختلف در افراد مختلف تا فقدان کامل آنها کاهش میدهد.
نفوذ- احتمال بروز فنوتیپی یک صفت در حضور ژن مربوطه. به عنوان مثال، نفوذ دررفتگی مادرزادی لگن در انسان 25 درصد است. تنها 1/4 هموزیگوت های مغلوب از این بیماری رنج می برند. اهمیت پزشکی- ژنتیکی نفوذ: یک فرد سالم که یکی از والدینش از بیماری با نفوذ ناقص رنج میبرد، ممکن است یک ژن جهش یافته کشف نشده داشته باشد و آن را به فرزندان خود منتقل کند.
تجلی عمل یک ژن دارای ویژگی های خاصی است.
یک ژن جهش یافته می تواند اثر خود را به روش های مختلف در موجودات مختلف نشان دهد. این به دلیل ژنوتیپ یک ارگانیسم معین و شرایط محیطی است که تحت آن انتوژنز آن اتفاق می افتد.
تظاهرات فنوتیپی یک ژن می تواند با توجه به میزان بیان صفت متفاوت باشد. این یک پدیده N.
در سال 1927، V. Timofeev-Resovsky پیشنهاد کرد که آن را بیان ژن نامیده شود. عمل یک ژن می تواند کم و بیش ثابت، در تظاهرات آن پایدار، یا ناپایدار، متغیر باشد. ما در واقع اغلب با تنوع در تظاهرات یک ژن جهش یافته در موجودات مختلف مواجه می شویم. مگس سرکه دارای یک فرم جهش یافته "بدون چشم" (بی چشم) با تعداد بسیار کم وجوه است. با نگاه کردن به فرزندان یک جفت والدین، می توان متوجه شد که در برخی مگس ها چشم ها تقریباً به طور کامل فاقد جنبه هستند، در حالی که در برخی دیگر تعداد وجوه در چشم به نصف تعداد طبیعی می رسد.
همین پدیده در اجرای بسیاری از شخصیت ها در حیوانات و گیاهان دیگر مشاهده می شود.
همان ویژگی جهش یافته ممکن است در برخی افراد ظاهر شود و در سایر افراد یک گروه مرتبط ظاهر نشود. این پدیده توسط N.V. Timofeev-Resovsky نامیده شد نفوذتظاهرات ژن نفوذ با درصد افراد یک جمعیت که دارای فنوتیپ جهش یافته هستند اندازه گیری می شود.
با نفوذ کامل (100%)، ژن جهش یافته اثر خود را در هر فردی که آن را دارد نشان می دهد. با نفوذ ناقص (کمتر از 100%)، ژن اثر فنوتیپی خود را در همه افراد نشان نمی دهد.
بیانگر بودنهمانند نفوذ، برهمکنش ژنها در ژنوتیپ و واکنشهای متفاوت ژنوتیپ به عوامل محیطی تعیین میشود. بیان و نفوذ، تظاهرات فنوتیپی یک ژن را مشخص می کند. نفوذ ناهمگونی خطوط و جمعیت ها را نه بر اساس ژن اصلی که یک صفت خاص را تعیین می کند، بلکه بر اساس ژن های اصلاح کننده ای که محیط ژنوتیپی برای بیان ژن ایجاد می کند، منعکس می کند.
بیانگر واکنش ژنوتیپ های مشابه به محیط است. هر دوی این پدیده ها ممکن است برای زندگی ارگانیسم و جمعیت اهمیت تطبیقی داشته باشند و بنابراین بیان و نفوذ بیان ژن حفظ می شود. انتخاب طبیعی. این دو پدیده در انتخاب مصنوعی بسیار مهم هستند.
بیان ژن در رشد به عملکرد عوامل محیطی بستگی دارد.
در حال حاضر ساده ترین راه ردیابی تأثیر عوامل خارجی مختلف بر روی ژن های جهش یافته است. بنابراین، در ذرت ژنهای جهش یافتهای وجود دارد که کوتولگی گیاه، ژئوتروپیسم مثبت (گیاهان تکیهدار) و غیره را تعیین میکنند. عملکرد این ژنها بر اساس تغییرات بیوشیمیایی مربوطه است. به عنوان مثال، مشخص است که برای رشد طبیعی گیاه، مواد رشدی مانند اکسین ضروری است. در شکل کوتوله جهش یافته ذرت، اکسین به طور معمول تولید می شود، اما ژن کوتوله از تشکیل آنزیمی که اکسین را اکسید می کند، جلوگیری می کند و در نتیجه فعالیت اکسین کاهش می یابد که منجر به مهار رشد گیاه می شود.
اگر چنین گیاهی در طول رشد در معرض اسید جیبرلیک قرار گیرد، گیاه رشد را تسریع می کند و از نظر فنوتیپی از نرمال قابل تشخیص نیست.
به نظر می رسد افزودن اسید جیبرلیک آن چیزی را که یک آلل طبیعی ژن کوتوله تولید می کند جبران می کند.
تاثیر اسید جیبرلیک بر رشد ذرت
از این مثال مشخص می شود که ژن تشکیل آنزیم خاصی را کنترل می کند که الگوی رشد گیاه را تغییر می دهد. بنابراین با دانستن مکانیسم عمل ژن جهش یافته، می توان عیوب ایجاد شده را اصلاح و عادی کرد.
به یاد بیاورید که رنگ هیمالیا یک خرگوش توسط یک عضو از یک سری آلل های متعدد - c11 تعیین می شود.
تظاهرات فنوتیپی معمول این ژن است دمای معمولی(حدود 20 درجه) با این واقعیت مشخص می شود که با رنگ پوشش سفید عمومی، نوک پنجه ها، گوش ها، بینی و دم خرگوش سیاه می شود.

تغییر فنوتیپی در رنگ خز خرگوش هیمالیا تحت تأثیر دماهای مختلف
این رنگ هم به واکنشهای بیوشیمیایی خاصی که در پوست رخ میدهد و هم به دمای محیط بستگی دارد.
همین شکل نشان می دهد که خرگوشی که در دمای بالای 30 درجه بزرگ شده است، سفید جامد است. اگر ناحیه کوچکی از پشم سفید را بچینید و سپس به طور سیستماتیک آن را خنک کنید، پشم سیاه روی آن رشد می کند. در این حالت، اثر دما بر بیان ژن تأثیر می گذارد و بر تولید آنزیم های خاص تأثیر می گذارد.
گیاه پامچال دارای ژن رنگ گل است که بسته به دما نیز اثر خود را نشان می دهد.
اگر گیاهان در دمای 30-35 درجه و رطوبت بالا رشد کنند، گلها سفید و در دماهای پایین تر - قرمز می شوند.
در سال 1935، F.A. Smirnov کار بر روی مطالعه تعداد جهش های القا شده در مگس سرکه: کشنده، نیمه کشنده و جهش با قابلیت زنده ماندن افزایش یافته و طبیعی انجام داد و نسبت متفاوتی از این طبقات را در شرایط دمایی مختلف کشف کرد.
بعدها، این موضوع در جمعیتهای مگس سرکه مگس سرکه نیز تایید شد. جهش یافته ها از جمعیت وحشی این گونه جدا شدند که به طور معمول در دمای 16.5 درجه رشد می کردند، در 21 درجه نیمه قانونی و در 25 درجه کاملاً کشنده بودند. این نوع تحقیقات در حال حاضر بر روی جهش میکروارگانیسم ها انجام می شود.
به این جهش ها جهش کهربایی می گویند.
ژن کلیه (k) در ichneumon ichneumon Habrobracon hebitor شناخته شده است. تقریباً 100٪ نفوذ دارد و در دمای 30 درجه سانتیگراد کشنده است و در دمای پایین توسعه تقریباً ظاهر نمی شود. این نوع وابستگی نفوذ به شرایط محیطی برای اکثر جهش ها در همه حیوانات، گیاهان و میکروارگانیسم ها شناخته شده است.
عمل یک عامل محیطی بر ژن های مختلف به روش های مختلف تأثیر می گذارد و عوامل مختلفبر بیان یک ژن به روش های مختلف تأثیر می گذارد.
مطالعه تأثیر عوامل محیطی نشان داده است که برخی از ژنهای مغلوب که در شرایط عادی از نظر فنوتیپی در حالت هتروزیگوت ظاهر نمیشوند، میتوانند در شرایط تغییر یافته خود را نشان دهند.
اگر خطایی پیدا کردید، لطفاً یک متن را انتخاب کنید و Ctrl+Enter را فشار دهید.
همکلاسی ها
هیچ صفتی به ارث نمی رسد. صفات بر اساس تعامل ژنوتیپ و محیط رشد می کنند. فقط ژنوتیپ ارثی است، یعنی. مجموعه ای از ژن ها که هنجار واکنش بیولوژیکی بدن را تعیین می کند و تظاهرات و شدت علائم را تغییر می دهد. شرایط مختلفمحیط زیست
بنابراین، بدن به خواص محیط خارجی واکنش نشان می دهد. گاهی اوقات همان ژن، بسته به ژنوتیپ و شرایط محیطی، یک صفت را به طور متفاوت نشان می دهد یا کامل بودن بیان را تغییر می دهد.
درجه تجلی فنوتیپ - بیانب به طور تصویری می توان آن را با شدت بیماری در آن مقایسه کرد عمل بالینی. بیان از قوانین توزیع گاوسی تبعیت می کند (برخی در مقادیر کم یا متوسط).
تنوع در بیان بر اساس عوامل ژنتیکی و محیطی است. بیان بسیار است شاخص مهمتظاهرات فنوتیپی ژن درجه آن با استفاده از یک شاخص آماری تعیین می شود.
بیانگر بودنهمچنین شاخصی است که تظاهرات فنوتیپی اطلاعات ارثی را مشخص می کند.
درجه بیان یک صفت را مشخص می کند و از یک طرف به دوز آلل ژن مربوطه در وراثت تک ژنی یا به دوز کل آلل های ژن غالب در وراثت چند ژنی بستگی دارد و از طرف دیگر به عوامل محیطی بستگی دارد. . به عنوان مثال، شدت رنگ قرمز گل های زیبایی شب است که در سری ژنوتیپ های AA، Aa، aa کاهش می یابد یا شدت رنگدانه پوست در انسان که با افزایش تعداد آلل های غالب در پلی ژن افزایش می یابد. سیستم از 0 تا 8 (نگاه کنید به
برنج 3.80). تأثیر عوامل محیطی بر بیان یک صفت با افزایش درجه رنگدانه پوست در انسان تحت تابش اشعه ماوراء بنفش، هنگامی که برنزه ظاهر می شود، یا افزایش ضخامت خز در برخی از حیوانات، بسته به شرایط، نشان داده می شود. تغییر دهید رژیم دمادر فصول مختلف سال
این ویژگی ژنتیکی حتی ممکن است در برخی موارد ظاهر نشود.
اگر ژنی در ژنوتیپ باشد، اما اصلاً ظاهر نشود، نفوذ میکند. (دانشمند روسی تیموفیف-ریوسوفسکی 1927). نفوذ- تعداد افراد (٪) که یک ژن معین را در فنوتیپ نشان می دهند، در رابطه با تعداد افرادی که این ویژگی می تواند در آنها ظاهر شود.
نفوذ مشخصه بیان بسیاری از ژن ها است. اصل مهم "همه یا هیچ" است - یا خود را نشان می دهد یا نمی کند.
پانکراتیت ارثی - 80٪
– دررفتگی مفصل ران – 25%
- نقص رشد چشم
- رتینوبلاستوما - 80٪
- اتواسکلروز - 40٪
- کما - 10٪
— نفوذنشان دهنده فراوانی تظاهرات فنوتیپی اطلاعات موجود در ژنوتیپ است.
این مربوط به درصد افرادی است که در آنها آلل غالب یک ژن در یک صفت در رابطه با همه حاملان این آلل خود را نشان می دهد.
نفوذ ناقص آلل غالب یک ژن ممکن است به دلیل سیستم ژنوتیپی باشد که این آلل در آن عمل می کند و محیط منحصر به فردی برای آن است. برهمکنش ژنهای غیر آللی در طول تشکیل یک صفت میتواند با ترکیب خاصی از آللهای آنها منجر به عدم تجلی آلل غالب یکی از آنها شود.
کریه هانتینگتون خود را به صورت تکان دادن غیرارادی سر نشان می دهد. اندام، به تدریج پیشرفت می کند و منجر به مرگ می شود.
ممکن است در اوایل دوره پس از جنین ظاهر شود، در سن بالغیا اصلا ظاهر نمیشه هم بیان و هم نفوذپذیری توسط انتخاب طبیعی حفظ میشوند، یعنی.
ژن هایی که علائم پاتولوژیک را کنترل می کنند ممکن است بیان و نفوذ متفاوتی داشته باشند: همه ناقلان ژن بیمار نمی شوند و در افراد بیمار درجه تظاهرات متفاوت خواهد بود.
تظاهر یا تظاهر ناقص یک صفت، و همچنین عدم وجود آن، به محیط و اثر اصلاح کننده ژن های دیگر بستگی دارد.
ژن می تواند عمل کند پلیوتروپیک(جمع) یعنی به طور غیرمستقیم بر روند واکنش های مختلف و ایجاد بسیاری از علائم تأثیر می گذارد. ژن ها می توانند سایر صفات را تحت تاثیر قرار دهند مراحل مختلفآنتوژنز
اگر ژن در اواخر انتوژنز روشن شود، اثر ناچیز وجود دارد. اگر روشن است مراحل اولیه- تغییرات قابل توجه تر است.
فنیل کتانوریا بیماران دارای جهشی هستند که آنزیم فنیل آلانین هیدرولاز را خاموش می کند. بنابراین فنیل آلانین به تیروزین تبدیل نمی شود. در نتیجه میزان فنیل آلانین در خون افزایش می یابد. اگر این آسیب شناسی زود تشخیص داده شود (قبل از 1 ماهگی) و کودک به رژیم غذایی دیگری تغییر یابد، اگر بعداً اندازه مغز کاهش یابد، رشد طبیعی پیش می رود. عقب ماندگی ذهنی، به طور معمول رشد نمی کنند، هیچ رنگدانه ای وجود ندارد، توانایی های ذهنی حداقل است.
Pleiotropy منعکس کننده ادغام ژن ها و صفات است.
یک فرد دارای یک ژن غیر طبیعی است که منجر به سندرم فانکونی می شود (ناهنجاری یا عدم وجود آن). انگشت شست، نقص یا کمبود شعاع، توسعه نیافتگی کلیه ها، لکه های رنگدانه قهوه ای، کمبود سلول های خونی).
یک ژن مرتبط با کروموزوم X وجود دارد.
مصونیت در برابر عفونت ها و کمبود سلول های خونی.
یک ژن غالب مرتبط با کروموزوم X پیلونفریت، کم شنوایی هزارتویی است.
سندرم مارفانی – انگشتان عنکبوتی، دررفتگی عدسی چشم، نقص قلبی.
ژنوکپی(یونانی
مفهوم نفوذ و بیان ژن ها.
جنس جنس، مبدأ + لات. مجموعه کپی) - این اصطلاح در سال 1957 پیشنهاد شد
ژنتیک آلمانی H. Nachtsheim به تغییرات مشابه در یک صفت تحت تأثیر ژنهای غیر آللی مختلف اشاره میکند که گاهی اوقات ژنهای تقلیدی یک گروه ناهمگن نامیده میشوند.
ژنوکپی ها- کپی ژن
تغییرات یکسان در فنوتیپ ناشی از آللهای ژنهای مختلف، و همچنین تغییراتی که در نتیجه فعل و انفعالات ژنی مختلف یا اختلال در مراحل مختلف یک فرآیند بیوشیمیایی با توقف سنتز محصول نهایی ایجاد میشوند - به عنوان مثال، در مگس سرکه تعدادی جهش های ژن های غیر آللی شناخته شده است که باعث ایجاد فنوتیپ "چشم های قرمز" می شود (سنتز رنگدانه قهوه ای مختل می شود).
42.تغییرپذیری.
اشکال تنوع: اصلاح و ژنوتیپی، اهمیت آنها در رویتوژنز و تکامل.
تغییرپذیری
یکی از نشانه های زندگی تغییرپذیری است.
هر موجود زنده ای با سایر اعضای گونه خود متفاوت است
تغییرپذیری- خاصیت موجودات زنده برای وجود اشکال مختلف. گروه و فردی تنوع - طبقه بندی بر اساس اهمیت تکاملی.
تغییرپذیری که توسط گروهی از موجودات محقق می شود گروه نامیده می شود، در حالی که در یک موجود یا گروهی از سلول های آن فردی است.
- فنوتیپی
- تصادفی
- اصلاح
- ژنوتیپی
- جسمی
- زایشی (جهشی، ترکیبی)
الف) ژنتیکی
ب) کروموزومی
ج) ژنومی
تغییرپذیری اصلاح
فنوکپی ها. فنوکپی ها- تغییرات فنوتیپی ناشی از شرایط محیطی که از صفات ژنتیکی تقلید می کنند.
تنوع می تواند ارثی (نامحدود، ژنوتیپی فردی) و غیر ارثی (معین، گروهی، اصلاحی) باشد. تنوع ارثی با تغییر در ژنوتیپ همراه است، تنوع غیر ارثی با تغییر فنوتیپ تحت تأثیر شرایط محیطی همراه است.
مقدار Mod.meas:سازگاری - سازگاری با شرایط محیطی داده شده
به معنی ژنوتیپ
تغییر: مواد برای انتخاب طبیعی و مصنوعی، گسترش تغییرات ارثی جدید در جمعیت.
43. تنوع فنوتیپی و انواع آن. تغییرات و ویژگی های آنها.
هنجار واکنش یک صفت. فنوکپی ها طبیعت تطبیقیاصلاحات
با توجه به ماهیت تغییرات در علائم و مکانیسم:
- فنوتیپی
- تصادفی
- اصلاح
تغییرپذیری اصلاحمنعکس کننده تغییر در فنوتیپ تحت تأثیر عوامل محیطی (تقویت و توسعه توده عضلانی و استخوانی در ورزشکاران، افزایش اریتروپوئیز در کوه های مرتفع و شمال دور) است.
یک مورد خاص از تنوع فنوتیپی - فنوکپی ها. فنوکپی ها- تغییرات فنوتیپی ناشی از شرایط محیطی که ویژگی های ژنتیکی را تقلید می کنند. تحت تاثیر شرایط خارجیاز نظر ژنتیکی بدن معمولیویژگی های یک ژنوتیپ کاملا متفاوت کپی می شود.
تظاهرات کوررنگی می تواند تحت تأثیر تغذیه، ساختار ذهنی ضعیف و افزایش تحریک پذیری رخ دهد.
یک فرد مبتلا به بیماری ویتیلیگو (1٪ از افراد) - اختلال رنگدانه پوست است. 30 درصد مبتلایان دارای نقص ژنتیکی هستند، بقیه مبتلا به ویتیلیگوی شغلی (قرار گرفتن در معرض مواد شیمیایی خاص و مواد سمی روی بدن) هستند. 15 سال پیش در آلمان کودکانی با فکوملیا به دنیا آمدند - بازوهای کوتاه و باله مانند. معلوم شد. تولد چنین کودکانی در صورتی اتفاق میافتد که مادر از Telidomide (یک آرامبخش برای زنان باردار استفاده کند).
در نتیجه، ژنوتیپ غیر جهش یافته نرمال یک جهش دریافت کرد.
فنوکپی ها در اکثر موارد تحت تأثیر محیط خارجی در مراحل اولیه جنین زایی ظاهر می شوند که منجر به بیماری های مادرزادینقص های رشدی
وجود فنوکپی تشخیص بیماری ها را دشوار می کند.
تاریخ انتشار : 1394/10/26; خواندن: 3805 | نقض حق چاپ صفحه
studopedia.org - Studopedia.Org - 2014-2018 (0.003 s)…
بیانگر بودن
بیانگر: بیان یکسان یک ویژگی در بین افرادی که آن ویژگی را نشان می دهند نیست. درجه تظاهرات فنوتیپی جهش.
به عنوان مثال تظاهر جهش لوب است که چشم مگس سرکه را تغییر می دهد. جهش غالب است، اما اگر افراد هتروزیگوت را مقایسه کنیم، با وجود ژنوتیپ یکسان، تظاهرات آن بسیار متفاوت است - از غیبت کاملچشم تا چشم درشت نوع تقریبا وحشی.
در این بین، افراد با همه ملاقات می کنند گزینه های ممکنچشم این یک مورد از بیان متغیر است. در ساده ترین حالت، اگر آلل کد کننده این صفت نافذ باشد، می توان از تجلی قوی و ضعیف یک صفت صحبت کرد. نفوذ یک ویژگی کیفی است که فقط تجلی یا عدم تجلی یک ویژگی را در نظر می گیرد. بیانگر جنبه کمی تجلی یک صفت را در صورت تجلی آن در نظر می گیرد.
بیانگر ماهیت و شدت علائم و همچنین سن شروع بیماری است.
نمونه بارز چنین تنوعی MEN نوع I است.
بیمارانی از یک خانواده با یک جهش ممکن است هیپرپلازی یا نئوپلازی یک یا تمام بافت های غدد درون ریز از جمله پانکراس، غدد پاراتیروئید، غده هیپوفیز و بافت چربی داشته باشند. در نتیجه، تصویر بالینی بیماری بسیار متنوع است: در بیمارانی از همان خانواده می توان آن را یافت زخم معده، هیپوگلیسمی، سنگ کلیهیا تومورهای هیپوفیز
5.8. رسا بودن و نافذ بودن. ژنوکپی ها
گاهی اوقات، در بیماری های غالب که با تشکیل تومور مشخص می شوند، تفاوت در بیان به دلیل جهش های اضافی در ژن های سرکوبگر تومور ایجاد می شود.
بیماری هایی مانند بیماری هانتینگتون و بیماری کلیه پلی کیستیک خود را نشان می دهند در سنین مختلف، اغلب فقط در بزرگسالان، با وجود این واقعیت که ژن جهش یافته در بیماران از بدو تولد وجود دارد.
کاملاً مشخص نیست که آیا تغییر در سن شروع باید نتیجه بیان متغیر در نظر گرفته شود. از یک طرف، برای اثبات نفوذ ناقص لازم است معاینه کاملاعضای خانواده و پیگیری در طول زندگی آنها.
از سوی دیگر، عدم وجود بیان را می توان به عنوان حداقل بیان ژن در نظر گرفت.
اگر فردی که از یک بیماری غالب رنج می برد، بخواهد بداند که این بیماری در فرزندش که جهش را به ارث برده است، چقدر شدید خواهد بود، سؤال بیانگر را مطرح می کند. با استفاده از تشخیص ژن، می توان جهشی را شناسایی کرد که حتی خود را نشان نمی دهد، اما نمی توان محدوده بیان جهش را در یک خانواده معین پیش بینی کرد.
بیان متغیر، تا عدم وجود کامل بیان ژن، می تواند به دلایل زیر باشد:
- تأثیر ژن های واقع در همان مکان یا مکان های دیگر.
- قرار گرفتن در معرض عوامل خارجی و تصادفی.
به عنوان مثال، شدت اوالوسیتوز ارثی ناشی از نقص در آلفا اسپکترین به درجه بیان ژن بستگی دارد. در هتروزیگوت ها، بیان کم آلل جهش یافته بیماری را کاهش می دهد، در حالی که بیان کم آلل همولوگ (ترانس آلل) آن را تشدید می کند.
در فیبروز کیستیک، شدت جهش R117H (جایگزینی آرژنین با هیستیدین در موقعیت 117 پروتئین تنظیم کننده رسانایی غشایی) به عمل سیس پلی مورفیسم در محل اتصال بستگی دارد که غلظت mRNA طبیعی را تعیین می کند.
ژن های واقع در جایگاه های دیگر نیز بر تظاهرات جهش تأثیر می گذارند. بنابراین، شدت کم خونی سلول داسی به ژنوتیپ جایگاه زنجیره آلفا گلوبین و هیپرلیپوپروتئینمی تک ژنی به ژنوتیپ چندین جایگاه بستگی دارد.
شدت هیپرلیپوپروتئینمی مونوژنیک، پورفیری و هموکروماتوز به رژیم غذایی، مصرف الکل، سیگار کشیدن و فعالیت بدنی. نمونه ای از تأثیر عوامل تصادفی - درجات مختلفشدت و وسعت ضایعات در دوقلوهای همسان مبتلا به رتینوبلاستوما، نوروفیبروماتوز یا توبروس اسکلروزیس.
عوامل تصادفی تفاوت در غیرفعال شدن کروموزوم X را در دختران دوقلو هتروزیگوت یکسان با بیماری مرتبط با X یا بازآرایی ژن ها و جهش ها در طول بلوغ ژن های ایمونوگلوبولین و گیرنده های تشخیص آنتی ژن لنفوسیت های T تعیین می کنند.
اگرچه صحبت در مورد نفوذ و بیان بیماری های اتوزومال غالب رایج است، اما همین اصول در مورد بیماری های کروموزومی، اتوزومال مغلوب، مرتبط با X و چند ژنی صدق می کند.
پیوندها:
این مفاهیم اولین بار در سال 1926 توسط N.V. Timofeev Ressovsky و 0. Vogt برای توصیف تظاهرات متفاوت صفات و ژن هایی که آنها را کنترل می کنند. بیانگر بودندرجه بیان (تغییر) یک صفت در افراد مختلف است که دارای ژن کنترل کننده این صفت هستند. بیان کم و زیاد مشاهده می شود. برای مثال، شدت متفاوت رینیت (آبریزش بینی) در سه بیمار مختلف (A، B و C) با تشخیص مشابه RVI را در نظر بگیرید.
در بیمار A، رینیت در بیان می شود درجه خفیف("بوییدن")، که به شما امکان می دهد با یک دستمال در طول روز از پس آن بربیایید. در بیمار B، رینیت به طور متوسط بیان می شود (2-3 دستمال روزانه). بیمار C دارای درجه بالایی از شدت رینیت است (5-6 دستمال).
وقتی پزشکان در مورد آشکار بودن یک علامت واحد، بلکه در کل بیماری صحبت می کنند، اغلب وضعیت بیمار را رضایت بخش یا با شدت متوسط یا شدید ارزیابی می کنند.
در این مورد، مفهوم بیان شبیه مفهوم "شدت بیماری" است.
نفوذ- این احتمال بروز یک صفت در افراد مختلف است که دارای ژن کنترل کننده این صفت هستند. نفوذ به عنوان درصد افراد دارای یک صفت خاص از تعداد کل افرادی که ناقل ژن کنترل کننده این صفت هستند اندازه گیری می شود.
0 می تواند ناقص یا کامل باشد.
نمونه ای از بیماری با نفوذ ناقص همان رینیت با 0RVI است. بنابراین، می توانیم فرض کنیم که بیمار A رینیت ندارد (اما علائم دیگری از بیماری وجود دارد)، در حالی که بیماران B و C دارای رینیت هستند.
7. انواع وراثت صفات، ویژگی های آنها. رسا بودن و نافذ بودن.
بنابراین، در این مورد، نفوذ رینیت 66.6٪ است.
نمونه ای از بیماری با نفوذ کامل اتوزومال غالب است. کریه هانتینگتون(4p16). 0na عمدتاً در افراد 31-55 ساله (77٪ موارد) ظاهر می شود، در حالی که در سایر بیماران - در سنین دیگر: هم در سال های اول زندگی و هم در 65، 75 سال و بیشتر. لازم به ذکر است: اگر ژن این بیماری از یکی از والدین به نوادگان منتقل شود، بیماری لزوماً خود را نشان می دهد که همان نفوذ کامل است.
درست است، بیمار همیشه زنده نیست تا تظاهرات کریه هانتینگتون را ببیند، زیرا به دلیل دیگری می میرد.
ژن کپی و دلایل آن
ژنوکپی ها (لات.
ژنوکپی) فنوتیپ های مشابهی هستند که تحت تأثیر ژن های غیر آللی مختلف تشکیل می شوند.
تعدادی مشابه تجلی بیرونیعلائم، از جمله بیماری های ارثی، می تواند توسط ژن های مختلف غیر آللی ایجاد شود. این پدیده ژنوکپی نامیده می شود.
ماهیت بیولوژیکی کپی های ژن در این واقعیت نهفته است که سنتز مواد یکسان در یک سلول در برخی موارد به روش های مختلف انجام می شود.
در آسیب شناسی ارثی انسان، فنوکپی ها - تغییر دهنده تغییرات - نیز نقش مهمی ایفا می کنند.
آنها به این دلیل هستند که در طول توسعه، تحت تأثیر عوامل خارجی، یک صفت بسته به یک ژنوتیپ خاص می تواند تغییر کند. در این مورد، ویژگی های مشخصه ژنوتیپ دیگر کپی می شود.
یعنی اینها تغییرات یکسانی در فنوتیپ هستند که توسط آلل های ژن های مختلف ایجاد می شوند و همچنین در نتیجه برهم کنش های ژنی مختلف یا اختلال در مراحل مختلف یک فرآیند بیوشیمیایی با توقف سنتز رخ می دهند.
خود را به عنوان اثر جهش های خاصی نشان می دهد که عملکرد ژن ها یا تعامل آنها را کپی می کند.
یک صفت (گروه صفات) می تواند به دلایل ژنتیکی مختلف (یا ناهمگنی) ایجاد شود. این اثر، به پیشنهاد ژنتیک آلمانی H. Nachtheim، در اواسط دهه 40 قرن بیستم به دست آمد.
نام کپی ژنسه گروه از دلایل شناخته شده برای کپی ژن وجود دارد.
دلایل گروه اولناهمگونی ناشی از پلی لوکوس یا عملکرد ژن های مختلف واقع در مکان های مختلف روی کروموزوم های مختلف را ترکیب می کند. به عنوان مثال، در میان بیماری های ارثی متابولیسم قندهای پیچیده - گلیکوزامینوگلیکان ها، 19 نوع (زیرگروه) موکوپلی ساکاریدوز شناسایی شده است. همه نوع خصوصیات
با نقص در آنزیم های مختلف مشخص می شوند، اما خود را با علائم مشابه (یا مشابه) نشان می دهند بدشکلی گرگویلیکیا فنوتیپ زنگوله کوازیمودو - شخصیت اصلی رمان "کلیسای جامع نوتردام" اثر کلاسیک ادبیات فرانسوی ویکتور هوگو.
یک فنوتیپ مشابه اغلب در موکولیپیدوزها (اختلالات متابولیسم چربی) مشاهده می شود.
نمونه دیگری از پلی لوکوس، فنیل کتونوری است. حالا نه تنها او نوع کلاسیک، ناشی از کمبود فنیل آلانین 4 هیدروکسیلاز (12q24.2) و همچنین سه اشکال غیر معمولیکی از آنها ناشی از کمبود دی هیدروپتریدین ردوکتاز (4p15.1) و دو مورد دیگر ناشی از کمبود آنزیمهای پیروویل تتراهیدروپترین سنتتاز و تتراهیدروبیوپترین است (ژنهای مربوطه هنوز شناسایی نشدهاند).
نمونه های اضافی پلی لوکوس: گلیکوژنوز (10 ژنوکپی)، سندرم الرز-دانلوس (8)، نوروفیبراماتوز رکلینهاوزن (6)، کم کاری تیروئید مادرزادی (5)، کم خونی همولیتیک(5)، بیماری آلزایمر (5)، سندرم باردت بیدل (3)، سرطان غده پستانی (2).
دلایل گروه دومبا ناهمگنی درون لوکوس متحد شده است.
یا به دلیل آللیسم چندگانه (به فصل 2 مراجعه کنید) یا به دلیل وجود ایجاد می شود ترکیبات ژنتیکی،یا هتروزیگوت های مضاعف، دارای دو آلل پاتولوژیک یکسان در مکان های یکسان کروموزوم های همولوگ. نمونه ای از دومی تالاسمی بتا هتروزیگوت است (11p15.5) که در نتیجه حذف دو ژن کد کننده زنجیره بتا گلوبین ها ایجاد می شود که منجر به افزایش سطح هموگلوبین HbA2 و افزایش (یا طبیعی) سطح هموگلوبین می شود. هموگلوبین HbF.
دلایل گروه سومناهمگونی ناشی از جهش در نقاط مختلف یک ژن را ترکیب می کند.
یک مثال فیبروز کیستیک (7q31-q32) است که به دلیل وجود تقریباً 1000 جهش نقطه ای در ژن مسئول بیماری ایجاد می شود.
با توجه به طول کل ژن فیبروز کیستیک (250 هزار جفت باز)، انتظار می رود تا 5000 جهش از این دست در آن یافت شود. این ژن پروتئینی را کد می کند که مسئول انتقال غشایی یون های کلرید است که منجر به افزایش ویسکوزیته ترشحات غدد برون ریز (عرق، بزاقی، زیرزبانی و غیره) و انسداد مجاری آنها می شود.
مثال دیگر فنیل کتونوری کلاسیک است که به دلیل وجود 50 جهش نقطه ای در ژن کد کننده فنیل آلانین 4-هیدروکسیلاز (12q24.2) ایجاد می شود. در مجموع انتظار می رود بیش از 500 جهش نقطه ای این ژن در این بیماری شناسایی شود.
بیشتر آنها از چندشکلی در طول قطعه محدود (RFLP) یا تعداد تکرارهای پشت سر هم (VNTP) ناشی می شوند. نصب شده: جهش عمدهژن فنیل کتونوری در جمعیت های اسلاو - R408 W/
اثر پلیوتروپی
ابهام فوق در ماهیت روابط بین ژن ها و صفات نیز در اثر پلیوتروپییا عمل پلیوتروپیک، زمانی که یک ژن باعث تشکیل تعدادی از صفات می شود.
به عنوان مثال، ژن اتوزومال مغلوب آتاکسی تلانژکتازی، یا سندرم لویی بار(11q23.2) مسئول آسیب همزمان حداقل به شش سیستم بدن (سیستم عصبی و ایمنی، پوست، غشاهای مخاطی دستگاه تنفسی و دستگاه گوارشو همچنین ملتحمه چشم).
مثال های دیگر: ژن سندرم باردت بیدل(16q21) باعث زوال عقل، پلی داکتیلی، چاقی، دژنراسیون رنگدانه شبکیه می شود. ژن کم خونی فانکونی (20q13.2-13.3) که فعالیت توپوایزومراز I را کنترل می کند، باعث کم خونی، ترومبوسیتوپنی، لکوپنی، میکروسفالی، آپلازی رادیوس، هیپوپلازی استخوان متاکارپ انگشت اول، ناهنجاری های قلب و کلیه ها می شود. هیپوسپادیاس، لکه های رنگدانه ای پوست، افزایش شکنندگی کروموزوم ها.
پلیوتروپی اولیه و ثانویه وجود دارد.
پلیوتروپی اولیهناشی از مکانیسم های بیوشیمیایی عمل پروتئین آنزیم جهش یافته است (به عنوان مثال، کمبود فنیل آلانین-4-هیدروکسیلاز در فنیل کتونوری).
پلیوتروپی ثانویهناشی از عوارض فرآیند پاتولوژیک است که در نتیجه پلیوتروپی اولیه ایجاد شده است.
به عنوان مثال، به دلیل افزایش خون سازی و هموسیدروز اندام های پارانشیمی، ضخیم شدن استخوان های جمجمه و سندرم کبدی در بیمار مبتلا به تالاسمی رخ می دهد.
بسیاری بیماری های ژنتیکی به وضوح در خانواده تعریف شده است؛ آن ها فنوتیپ غیر طبیعی به راحتی از یک فنوتیپ معمولی تشخیص داده می شود. از تجربه بالینیبا این حال، مشخص است که برخی از بیماری ها ممکن است خود را نشان ندهند حتی اگر فرد دارای همان ژنوتیپ باشد که باعث ایجاد بیماری در سایر اعضای خانواده می شود. در موارد دیگر، همان بیماری ممکن است از نظر شدت بالینی، دامنه علائم یا سن شروع تظاهرات بسیار متفاوتی داشته باشد.
بیان فنوتیپی ژنوتیپ غیر طبیعیممکن است توسط اثرات پیری، سایر مکان های ژنتیکی یا عوامل محیطی اصلاح شود. تفاوت در بیان اغلب می تواند منجر به مشکلاتی در تفسیر تشخیص و شجره نامه شود. دو مکانیسم مختلف وجود دارد که می تواند تفاوت در بیان را توضیح دهد: کاهش نفوذ و بیان متغیر.
نفوذ- احتمال اینکه ژن تظاهرات فنوتیپی داشته باشد. اگر بسامد بیان فنوتیپ کمتر از 100٪ باشد، به عنوان مثال. افرادی هستند که ژنوتیپ مربوطه را بدون هیچ یک از تظاهرات آن دارند و می گویند که این ژن دارای نفوذ ناقص است. نفوذ یک مفهوم همه یا هیچ است. این درصد افراد دارای ژنوتیپ پاتولوژیک و تظاهرات آن حداقل تا حدودی است.
بیانگر بودن- شدت بیان فنوتیپ در افراد با یک ژنوتیپ پاتولوژیک. هنگامی که شدت بیماری در بین افراد دارای ژنوتیپ یکسان متفاوت است، فنوتیپ بیانگر متغیری است. حتی در یک شجره نامه، دو فرد حامل ژن های جهش یافته یکسان ممکن است برخی از علائم و نشانه های مشابه را داشته باشند و سایر تظاهرات بیماری ممکن است بسته به بافت ها و اندام های آسیب دیده متفاوت باشد.
بعضی ها مشکلاتدر درک وراثت فنوتیپ های بیماری که در نتیجه نفوذ وابسته به سن و بیان متغیر ایجاد می شوند، می توان مثالی از نوروفیبروماتوز اتوزومال غالب NF1 را در نظر گرفت. نوروفیبروماتوز نوع 1 - بیماری مکرر سیستم عصبیچشم و پوست، تقریباً در 1 در 3500 تولد رخ می دهد. تفاوت معنی داری در بروز بیماری در بین گروه های قومی وجود ندارد.
نمونه ای از وراثت نوروفیبروماتوز نوع 1 - NF1نوروفیبروماتوز نوع 1(NF1) با رشد تومورهای توده ای خوش خیم متعدد، نوروفیبروم، در پوست مشخص می شود. وجود لکههای مسطح و رنگدانههای نامنظم پوست که به عنوان لکههای قهوه یا لکههای قهوهای شناخته میشوند. رشد تومورهای خوش خیم کوچک (هامارتوما) در عنبیه چشم (ندول های لیش)؛ گاهی اوقات عقب ماندگی ذهنی، تومورهای سیستم عصبی مرکزی، نوروفیبروم های پلکسی فرم منتشر و ایجاد تومورهای بدخیم سیستم عصبی یا ماهیچه ها. بنابراین، این بیماری دارای یک فنوتیپ پلیوتروپیک است.
نوع 1(NF1) اولین بار توسط پزشک فون ریکلینهاوزن در سال 1882 به طور کامل توصیف شد، اما این بیماری احتمالاً از زمان های قدیم شناخته شده است. اگرچه هتروزیگوت های بالغ تقریباً همیشه شواهدی از بیماری دارند (یعنی نفوذ 100٪ در بزرگسالان)، برخی ممکن است فقط دارای لکه های قهوه، کک و مک، ناحیه زیر بغلو گره های Lisch، در حالی که دیگران ممکن است داشته باشند تهدید کننده زندگی تومورهای خوش خیم، تأثیر می گذارد نخاعیا سارکوم های بدخیم اندام ها.
بنابراین وجود دارد بیان متغیر; حتی در یک شجره نامه، برخی از بیماران به شدت تحت تأثیر قرار می گیرند، در حالی که برخی دیگر فقط اندکی تحت تأثیر قرار می گیرند. تشخیص در کودکان دشوارتر می شود زیرا علائم به تدریج با افزایش سن ایجاد می شوند. به عنوان مثال، در دوره نوزادی، کمتر از نیمی از افراد مبتلا حداقل بیشترین میزان را دارند علامت خفیفبیماری ها، لکه های "قهوه". بنابراین نفوذ به سن بستگی دارد.
در ژن NF1بسیاری از جهش های مختلف کشف شده اند که باعث کاهش عملکرد محصول ژن، نوروفیبرومین می شوند. حدود نیمی از موارد NF1 به جای جهش ارثی ناشی از یک جهش جدید است.
مشکل اصلی ژنتیکی با مشاوره خانواده بیماران مبتلا به NF1- نیاز به انتخاب بین دو احتمال یکسان: بیماری پروباند پراکنده است، یعنی. یک جهش جدید، یا بیمار شکل بالینی قابل توجهی از بیماری را از والدینی که ژن در آنها وجود دارد، به ارث برده است، اما خود را ضعیف نشان می دهد. اگر پروباند نقص را به ارث ببرد، خطر این که هر یک از خواهر و برادرهای او نیز این عیب را به ارث ببرند 50٪ است. اما اگر پروباند جهش جدیدی داشته باشد، خطر برای خواهر و برادر بسیار کم است.
مهم است که در هر دو مورد خطر انتقال ژن توسط بیمار وجود داشته باشد آیندگان، 50 درصد است. با توجه به این عدم قطعیت، خانواده های بیماران مبتلا به NF1 باید بدانند که این بیماری را می توان به صورت پیش از علامت و حتی قبل از تولد با استفاده از آزمایش ژنتیک مولکولی تشخیص داد. متأسفانه، تشخیص مولکولی معمولاً فقط می تواند به این سؤال پاسخ دهد که آیا بیماری ایجاد می شود، اما نمی تواند شدت آن را تعیین کند. به استثنای ارتباط حذف کامل ژن با دیسمورفی، عقب ماندگی ذهنی و تعداد زیادی نوروفیبروم در سن پایینهیچ ارتباطی بین شدت فنوتیپ و جهش های خاص در ژن NF1 یافت نشد.
نمونه دیگری از ناهنجاری اتوزومال غالب با نفوذ ناقص است نقض جداسازی دست مانند اکتروداکتیلی. این ناهنجاری در هفته ششم یا هفتم رشد، زمانی که دست ها و پاها تشکیل می شوند، رخ می دهد. این بیماری ناهمگونی مکان را نشان می دهد. حداقل پنج جایگاه شناسایی شده است، اگرچه ژن واقعی مسئول تنها در تعداد کمی از آنها تایید شده است. نفوذ ناقص در شجره نامه های دارای نقص دست می تواند منجر به حذف نسل ها شود و این امر مشاوره ژنتیکی را پیچیده می کند زیرا فردی با دست های طبیعی ممکن است ژن بیماری را منتقل کند و در نتیجه کودکان را تحت تاثیر قرار دهد.
اگر چه به طور کلی قواعد ارث بیماری های تک ژنیرا می توان به راحتی به عنوان اتوزومال یا وابسته به X و غالب یا مغلوب طبقه بندی کرد، وراثت در یک شجره نامه فردی می تواند توسط عوامل مختلف دیگری که تفسیر الگوی وراثت را دشوار می کند، پنهان شود.
مشکلات تشخیصی ممکن است ناشی از ناقص بودن باشد نفوذیا بیان متغیر بیماری؛ بیان ژن می تواند تحت تأثیر سایر ژن ها و عوامل محیطی قرار گیرد. برخی از ژنوتیپ ها تا زمان تولد زنده نمی مانند. ممکن است اطلاعات دقیقی در مورد وجود بیماری در بستگان یا در مورد آن وجود نداشته باشد روابط خانوادگی; بیماری های غالب و مرتبط با X می توانند جهش های جدیدی ایجاد کنند. و در نهایت، با خانواده کوچکی که امروزه در اکثر کشورهای توسعه یافته معمول است، بیمار ممکن است به طور تصادفی تنها بیمار در خانواده باشد که تصمیم گیری در مورد نوع وراثت را بسیار دشوار می کند.
بیماری ژنتیکیمی تواند در هر زمانی در طول زندگی فرد ظاهر شود، از اوایل شروع رشد داخل رحمیتا پیری برخی ممکن است در داخل رحم کشنده باشند، برخی دیگر ممکن است تداخل داشته باشند توسعه طبیعیجنین و قبل از تولد تشخیص داده شده است (به عنوان مثال، سونوگرافی)، اما سازگار با تولد زنده. برخی دیگر را فقط پس از تولد می توان شناسایی کرد. (بیماری های ژنتیکی و مادرزادی اغلب با هم اشتباه گرفته می شوند.