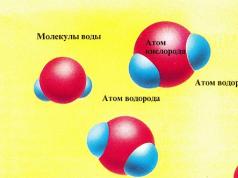
Хүний генийн эмчилгээ нь өргөн утгаараа удамшлын согогийг засахын тулд функциональ идэвхтэй генийг эсүүдэд нэвтрүүлэх явдал юм. Удамшлын өвчнийг эмчлэх хоёр арга бий. Эхний тохиолдолд соматик эсүүд (үр хөврөлийн эсээс бусад эсүүд) генетикийн өөрчлөлтөд ордог. Энэ тохиолдолд генетикийн согогийг засах нь тодорхой эрхтэн, эд эсээр хязгаарлагддаг. Хоёр дахь тохиолдолд үр хөврөлийн эсүүд (үр эр бэлгийн эс эсвэл өндөг) эсвэл бордсон өндөгний (зигот) генотип өөрчлөгддөг тул тэдгээрээс үүссэн бүх эсүүд "зассан" гентэй байдаг. Үр хөврөлийн эсийг ашиглан генийн эмчилгээ хийснээр генетикийн өөрчлөлт нь үеэс үед дамждаг.
Генийн эмчилгээний бодлого соматик эсүүд.
1980 онд АНУ-ын католик, протестант, еврей нийгэмлэгүүдийн төлөөлөгчид Ерөнхийлөгчид хандан генийн инженерчлэлийг хүнтэй холбоотой ашиглах талаар өөрсдийн үзэл бодлоо илэрхийлсэн нээлттэй захидал бичжээ. Энэхүү асуудлын ёс зүй, нийгмийн талыг үнэлэхийн тулд Ерөнхийлөгчийн комисс, Конгрессын комиссыг байгуулсан. Тэд маш их байсан чухал санаачлагууд, АНУ-д олон нийтийн ашиг сонирхлыг хөндсөн хөтөлбөрүүдийг батлах нь ихэвчлэн ийм комиссын зөвлөмжийн үндсэн дээр хийгддэг. Хоёр комиссын эцсийн дүгнэлт нь соматик эсийн генийн эмчилгээ ба үр хөврөлийн эсийн генийн эмчилгээ хоёрын хооронд тодорхой ялгааг харуулсан. Соматик эсийн генийн эмчилгээг стандарт арга гэж ангилдаг эмнэлгийн оролцооэрхтэн шилжүүлэн суулгахтай адил биед. Үүний эсрэгээр үр хөврөлийн эсийн генийн эмчилгээ нь технологийн хувьд хэтэрхий хэцүү бөгөөд ёс зүйн хувьд нэн даруй хэрэгжүүлэхэд хэцүү гэж үздэг. Соматик эсийн генийн эмчилгээний чиглэлээр судалгаа хийх тодорхой дүрмийг боловсруулах шаардлагатай байна гэж дүгнэв; Үр хөврөлийн эсийн генийн эмчилгээтэй холбоотой ижил төстэй баримт бичгийг боловсруулах нь эрт байна гэж үзсэн. Бүх хууль бус үйл ажиллагааг зогсоохын тулд үр хөврөлийн эсийн генийн эмчилгээний чиглэлээр хийсэн бүх туршилтыг зогсоохоор шийдсэн.
1985 он гэхэд тэд "Соматик эсийн генийн эмчилгээний чиглэлээр туршилт хийх өргөдөл гаргах, бэлтгэх журам" нэртэй баримт бичгийг боловсруулжээ. Энэ нь хүний соматик эсийн генийн эмчилгээг турших зөвшөөрөл авах өргөдөлд ямар өгөгдөл оруулах ёстой талаар бүх мэдээллийг агуулсан байв. Рекомбинант ДНХ бүхий лабораторийн судалгааг зохицуулах дүрмээс үндэслэсэн; тэдгээрийг зөвхөн биоанагаах ухааны зорилгоор дасан зохицсон.
Биоанагаахын хууль тогтоомжийг 1970-аад онд шинэчилж, өргөжүүлсэн. 1972 онд Алабама дахь Үндэсний эрүүл мэндийн алба тэмбүүтэй 400 гаруй бичиг үсэг үл мэдэгч Африк гаралтай америкчуудад хийсэн 40 жилийн туршилтын үр дүнг нийтэлсэнтэй холбогдуулан. Энэхүү туршилтыг бэлгийн замын халдварт өвчний байгалийн хөгжлийг судлах зорилгоор хийсэн бөгөөд ямар ч эмчилгээ хийгээгүй. Мэдээлэлгүй хүмүүст ийм аймшигт явдал тохиолдсон тухай мэдээ АНУ-д олон хүнийг цочирдуулав. Конгресс тэр даруй туршилтаа зогсоож, дахин ийм судалгаа хийхийг хориглосон хууль батлав.
Соматик эсийн генийн эмчилгээний чиглэлээр туршилт хийх зөвшөөрөл хүссэн хүмүүст хандсан асуултуудын дунд дараахь зүйлс байв.
- 1. Ямар өвчнийг эмчлэх ёстой вэ?
- 2. Хэр ноцтой вэ?
- 3. Өөр эмчилгээ байдаг уу?
- 4. Санал болгож буй эмчилгээ нь өвчтөнд хэр аюултай вэ?
- 5. Эмчилгээ амжилттай болох магадлал хэд вэ?
- 6. Өвчтөнүүдийг хэрхэн сонгох вэ Эмнэл зүйн туршилт?
- 7. Энэ сонгон шалгаруулалт нь нэг талыг барьсан, төлөөллийнх байх уу?
- 8. Туршилтын талаар өвчтөнд хэрхэн мэдэгдэх вэ?
- 9. Тэдэнд ямар мэдээлэл өгөх ёстой вэ?
- 10. Тэдний зөвшөөрлийг хэрхэн авах вэ?
- 11. Өвчтөн болон судалгааны талаарх мэдээллийн нууцлалыг хэрхэн хангах вэ?
Генийн эмчилгээний туршилтууд анх эхлэхэд эмнэлзүйн туршилтад хамрагдах өргөдлийг хүний генийн эмчилгээний дэд хороонд шилжүүлэхээс өмнө тухайн байгууллагын Ёс зүйн хороо анхлан хянадаг байсан. Сүүлийнх нь өргөдлийг шинжлэх ухаан, эмнэлгийн ач холбогдол, одоогийн дүрэмд нийцсэн байдал, аргументуудын үнэмшилтэй байдлын үүднээс үнэлэв. Өргөдөлөөс татгалзсан тохиолдолд шаардлагатай тайлбартай буцаасан. Саналыг зохиогчид уг саналыг хянаж үзээд дахин боловсруулж болно. Өргөдөл батлагдсан тохиолдолд Генийн эмчилгээний дэд хороо ижил шалгуураар олон нийтийн хэлэлцүүлгээр хэлэлцсэн. Энэ түвшний өргөдлийг баталсны дараа Дэд хорооны захирал үүнийг зөвшөөрч, эмнэлзүйн туршилт хийх зөвшөөрөлд гарын үсэг зурсан бөгөөд үүнгүйгээр эхлүүлэх боломжгүй юм. Энэ сүүлчийн тохиолдолд Онцгой анхааралБүтээгдэхүүнийг олж авах арга, түүний цэвэр байдалд чанарын хяналт тавих аргууд, түүнчлэн бүтээгдэхүүний аюулгүй байдлыг хангахын тулд эмнэлзүйн өмнөх ямар туршилтуудыг явуулсан зэрэг асуудлыг хөндсөн.
Гэвч цаг хугацаа өнгөрөх тусам өргөдлийн тоо нэмэгдэж, генийн эмчилгээ нь нэг тайлбарлагчийн хэлснээр "анагаах ухаанд ялалтын тасалбар" болсон тул анхны өргөдлийг батлах үйл явц нь шаардлагагүй цаг хугацаа шаардсан, шаардлагагүй гэж үзсэн. Үүний дагуу 1997 оноос хойш Генийн эмчилгээний дэд хороо нь хүний генийн эмчилгээний судалгааг хянадаг агентлагуудын нэг байхаа больсон. Хэрэв Дэд хороо байгаа бол хүний генийн эмчилгээтэй холбоотой ёс зүйн асуудлыг хэлэлцэх форум зохион байгуулах магадлалтай. Энэ хооронд генийн эмчилгээний бүх хэрэглээг олон нийтэд хэлэлцүүлэх шаардлагыг цуцалсан. Биологийн бүтээгдэхүүний үйлдвэрлэл, ашиглалтын хяналтыг хариуцдаг агентлаг нь үйлдвэрлэгчдийн өмчийн эрхийг хүндэтгэхийн тулд шаардлагатай бүх үнэлгээг нууцаар хийдэг. Одоогийн байдлаар хүний генийн эмчилгээ нь тийм ч үр дүнтэй биш боловч аюулгүй эмчилгээний арга гэж тооцогддог. Өмнө нь хэлж байсан санаа зовнил арилж, хүний өвчнийг эмчлэх гол шинэ арга барилуудын нэг болсон.
Ихэнх мэргэжилтнүүд АНУ-д хүний соматик эсийн генийн эмчилгээний туршилтыг батлах үйл явцыг хангалттай гэж үздэг; Энэ нь тодорхой өвчтөнүүд болон нийт хүн амд хохирол учруулахгүйгээр өвчтөнийг шударгаар сонгох, тэдний ухамсарыг хангах, түүнчлэн бүх заль мэхийг зохих ёсоор хэрэгжүүлэх баталгаа юм. Бусад улс орнууд одоогоор генийн эмчилгээний туршилт хийх журмыг боловсруулж байна. АНУ-д үүнийг санал бүрийг сайтар нягталж үзсэний үндсэн дээр хийсэн. 1989 оны 1-р сард Генийн эмчилгээний дэд хорооны сонсголд оролцогчдын нэг Доктор Уолтерс хэлэхдээ: "Би генийн эмчилгээ шиг ийм өргөн хүрээтэй хяналтанд хамрагдсан биоанагаахын шинжлэх ухаан, технологийг би мэдэхгүй."
Ирээдүй хойч үедээ гэмтэлтэй генийн хуримтлал.
Соматик эсийн генийн эмчилгээг ашиглан удамшлын өвчнийг эмчлэх нь хүний популяцийн удмын сан муудах нь гарцаагүй гэсэн үзэл бодол байдаг. Энэ нь генийн эмчилгээ нь урьд нь үр удмаа гаргаж чадахгүй байсан, эсхүл үр удмаа гаргаж чадахгүй байсан хүмүүсээс хойч үедээ мутант генийг шилжүүлэхэд хувь нэмэр оруулдаг тул популяцид гажигтай генийн давтамж үеэс үед нэмэгдэнэ гэсэн санаан дээр үндэслэсэн болно. насанд хүртлээ амьд үлдэх. Гэсэн хэдий ч энэ таамаг буруу болж хувирав. Хүн амын генетикийн дагуу, үр дүнтэй эмчилгээний үр дүнд хор хөнөөлтэй эсвэл үхэлд хүргэдэг генийн давтамж мэдэгдэхүйц нэмэгдэхэд хэдэн мянган жил шаардлагатай байдаг. Тэгэхээр 100,000 амьд төрөлтөд 1-д удамшлын ховор өвчин тохиолдвол үр дүнтэй генийн эмчилгээг нэвтрүүлснээс хойш ойролцоогоор 2000 жилийн дараа өвчний тохиолдол хоёр дахин нэмэгдэж, 50,000-д 1 болно.
Үхлийн генийн давтамж нь үеэс үед бараг өсдөггүйгээс гадна хэрэгцээтэй хүн бүрийг удаан хугацаагаар эмчилсний үр дүнд хувь хүмүүсийн генотип өөрчлөгдөөгүй хэвээр байна. Энэ санааг хувьслын түүхийн жишээгээр тайлбарлаж болно. Приматууд, түүний дотор хүмүүс амин чухал витамин С-ийг нийлэгжүүлж чаддаггүй тул түүнийг гадны эх үүсвэрээс авах ёстой. Тиймээс бид бүгдээрээ энэхүү амин чухал бодисын генийн хувьд генетикийн хувьд гажигтай гэж хэлж болно. Үүний эсрэгээр хоёр нутагтан, хэвлээр явагчид, шувууд болон примат бус хөхтөн амьтад С витаминыг нийлэгжүүлдэг. Гэсэн хэдий ч С витаминыг биосинтез хийх чадваргүй болсон генетикийн согог нь приматуудын амжилттай хувьслаас олон сая жилийн турш "сэргийлэгдээгүй" юм. Үүний нэгэн адил бусад удамшлын согогийг засч залруулах нь хойч үедээ "эрүүл бус" генийг их хэмжээгээр хуримтлуулахад хүргэхгүй.
Үр хөврөлийн эсийн генийн эмчилгээ.
Хүний үр хөврөлийн эсийн генийн эмчилгээний чиглэлээр туршилт хийхийг одоо хатуу хориглосон боловч зарим генетикийн өвчнийг зөвхөн ийм аргаар эмчлэх боломжтой гэдгийг хүлээн зөвшөөрөх ёстой. Хүний үр хөврөлийн эсийн генийн эмчилгээний арга зүй хараахан хангалттай боловсруулагдаагүй байна. Гэсэн хэдий ч амьтдад удамшлын заль мэх хийх аргуудыг хөгжүүлж, суулгацын өмнөх үр хөврөлийг оношлох туршилт хийснээр энэ цоорхойг нөхөх болно гэдэгт эргэлзэхгүй байна. Түүгээр ч зогсохгүй соматик эсийн генийн эмчилгээ тогтмол болохын хэрээр энэ нь хүний үр хөврөлийн генийн эмчилгээнд хандах хүмүүсийн хандлагад нөлөөлж, цаг хугацаа өнгөрөх тусам үүнийг туршиж үзэх шаардлагатай болно. Тэр үед хүний үр хөврөлийн эсийн генийн эмчилгээний үр дагавартай холбоотой бүх асуудал, тэр дундаа нийгэм, биологийн асуудлууд шийдэгдэнэ гэж найдаж болно.
Хүний генийн эмчилгээ нь эмчилгээнд тусалдаг гэж үздэг ноцтой өвчин. Үнэн хэрэгтээ энэ нь олон тооны бие махбодийн болон сэтгэцийн эмгэгийг засах боломжтой боловч нийгэмд генийн эмчилгээний ийм хэрэглээг хүлээн зөвшөөрөх эсэх нь тодорхойгүй хэвээр байна. Аливаа шинэ анагаах ухааны салбарын нэгэн адил хүний үр хөврөлийн эсийн генийн эмчилгээ нь олон асуултыг бий болгодог, үүнд:
- 1. Хүний үр хөврөлийн эсийн генийн эмчилгээний аргыг боловсруулж, хэрэгжүүлэхэд ямар зардал гарах вэ?
- 2. Төрөөс анагаах ухааны судалгааны тэргүүлэх чиглэлийг тогтоох ёстой юу?
- 3. Үр хөврөлийн эсийн генийн эмчилгээг нэн тэргүүнд хөгжүүлэх нь бусад эмчилгээний аргыг олох хүчин чармайлтыг багасгахад хүргэх үү?
- 4. Шаардлагатай бүх өвчтөнд хүрэх боломжтой юу?
- 5. Хувь хүн эсвэл компани генийн эмчилгээг ашиглан тодорхой өвчнийг эмчлэх онцгой эрхийг авах боломжтой юу?
Хүний клончлол.
1960-аад онд мэлхий, бах дээр холбогдох туршилт хийсний дараа хүнийг хувилах боломжийн талаархи олон нийтийн сонирхол үүссэн. Эдгээр судалгаагаар бордсон өндөгний цөм нь ялгагдаагүй эсийн цөмөөр солигдож, үр хөврөл хэвийн хөгждөг болохыг харуулсан. Тиймээс зарчмын хувьд организмын ялгагдаагүй эсээс цөмийг тусгаарлаж, тэдгээрийг нэг организмын бордсон өндөг рүү оруулж, эцэг эхтэйгээ ижил генотиптэй үр удам гаргах боломжтой. Өөрөөр хэлбэл, удамшлын организм бүрийг анхны донор организмын генетик клон гэж үзэж болно. 1960-аад онд Техникийн боломж хомс байсан ч мэлхийн клончлолын үр дүнг хүмүүст экстраполяци хийх нь тийм ч хэцүү биш юм шиг санагдсан. Энэ сэдвээр олон нийтлэл хэвлэлд гарч, шинжлэх ухааны уран зөгнөлт зохиол хүртэл бичсэн. Түүхүүдийн нэг нь урвагчаар алагдсан АНУ-ын Ерөнхийлөгч Жон Кеннедигийн клончлолын тухай байсан ч илүү алдартай сэдэв нь хорон санаатнуудыг хувилах явдал байв. Хүний хувилах тухай бүтээлүүд нь үнэмшилгүй байсан төдийгүй хүний зан чанар, зан чанар болон бусад шинж чанарууд нь зөвхөн түүний генотипээр тодорхойлогддог гэсэн алдаатай, маш аюултай санааг сурталчилсан. Үнэн хэрэгтээ хүн бол түүний ген, хүрээлэн буй орчны нөхцөл байдал, ялангуяа соёлын уламжлалын нөлөөн дор бий болдог. Жишээлбэл, Гитлерийн номлосон хорлонтой арьс өнгөөр ялгаварлан гадуурхах үзэл нь аль нэг ген эсвэл тэдгээрийн хослолоор тодорхойлогддоггүй зан үйлийн олж авсан чанар юм. Өөр өөр соёлын онцлогтой орчинд "клончлогдсон Гитлер" жинхэнэ Гитлертэй төстэй хүн болж төлөвших албагүй. Үүний нэгэн адил "Тереза эхийн клон" нь Калькуттагийн ядуу, өвчтэй хүмүүст туслахын тулд амьдралаа зориулсан эмэгтэйг "хийх" албагүй.
Хөхтөн амьтдын нөхөн үржихүйн биологийн аргууд хөгжиж, төрөл бүрийн трансген амьтдыг бий болгохын хэрээр хүний хувилах нь тийм ч холгүй ирээдүйн асуудал болох нь улам бүр тодорхой болсон. Энэ таамаг 1997 онд Долли хэмээх хонийг хувилснаар бодит болсон юм. Үүний тулд донор хониноос ялгагдах эсийн цөмийг ашигласан. Доллиг "бүтээхэд" ашигласан арга зүйн арга нь зарчмын хувьд аливаа хөхтөн амьтдын, түүний дотор хүний клоныг авахад тохиромжтой. Хэдийгээр бусад хөхтөн амьтдын хувьд энэ нь сайн үр дүнд хүрэхгүй байсан ч тохиромжтой аргыг боловсруулахын тулд хэт их туршилт хийх шаардлагагүй байх. Үүний үр дүнд хүний клончлол нь генетик, биологийн анагаах ухааны ёс зүйн асуудалтай холбоотой аливаа хэлэлцүүлгийн сэдэв болно.
Хүний хувилах нь эргэлзээгүй, төвөгтэй бөгөөд маргаантай асуудал юм. Зарим хүмүүсийн хувьд туршилтын аргаар аль хэдийн байгаа хувь хүний хуулбарыг бий болгох санаа нь хүлээн зөвшөөрөгдөхгүй мэт санагддаг. Насны зөрүүгээс үл хамааран хувилсан хувь хүн ижил ихэртэй адилхан гэж бусад хүмүүс үздэг тул клончлох нь угаасаа хортой биш ч гэсэн тийм ч шаардлагагүй байж магадгүй юм. Клонжуулалт нь онцгой тохиолдлуудад түүний хэрэгжилтийг зөвтгөдөг эмнэлгийн болон нийгэмд эерэг нөлөө үзүүлдэг. Жишээлбэл, өвчтэй хүүхдийн эцэг эхийн хувьд энэ нь амин чухал байж болох юм. Хүний хувилах туршилтын хариуцлагыг олон оронд хуулиар зохицуулдаг бөгөөд хүний хувилахтай холбоотой бүх судалгааг хориглодог. Ийм хязгаарлалт нь хүнийг хувилах боломжийг үгүйсгэхэд хангалттай юм. Гэсэн хэдий ч хүн хувилах нь гарцаагүй гэсэн асуулт гарч ирэх нь дамжиггүй.
Энэ үгийн өргөн утгаараа генийн эмчилгээ гэдэг нь өвчтөний эд эс эсэд семантик ДНХ-ийн дарааллыг нэвтрүүлэх замаар эмчилгээг хэлнэ. Эхэндээ генийн эмчилгээг генийн согогийг засах арга гэж үздэг байсан.
Цаашдын судалгаа эдгээр санааг зассан. Энэ нь генийн согогийг засах биш, харин өвчтөний биед бүрэн ажиллагаатай генийг нэвтрүүлэх замаар залруулга хийх нь илүү хялбар болох нь тогтоогдсон. Генийн эмчилгээг зөвхөн соматик эдэд хийх ёстой; үр хөврөл, үр хөврөлийн эсийн түвшинд генийн эмчилгээ хийх нь маш асуудалтай бөгөөд бодитой бус юм. Үүний шалтгаан нь хүсээгүй хиймэл генийн бүтцээр генийн санг бөглөх, эсвэл хүн төрөлхтний ирээдүйд урьдчилан таамаглах аргагүй үр дагавартай мутаци нэвтрүүлэх бодит аюул юм (Фр. Андерсон, Т. Каски, Фр. Коллинз гэх мэт). Эцэст нь генийн эмчилгээний практик арга зүй нь зөвхөн моногенийг эмчлэхэд тохиромжтой болох нь батлагдсан удамшлын өвчин, гэхдээ хорт хавдар зэрэг өргөн тархсан өвчин, хүнд хэлбэрүүд вируст халдварууд, ДОХ, зүрх судасны болон бусад өвчин.
Генийн эмчилгээний анхны эмнэлзүйн туршилтыг 1989 оны 5-р сарын 22-нд хийсэн бөгөөд энэ нь дэвшилтэт меланома дахь хавдрын нэвчдэст лимфоцитыг генетикийн хувьд тэмдэглэх зорилготой юм. Генийн эмчилгээний аргыг хэрэглэсэн анхны моноген удамшлын өвчин бол аденозин деаминазын генийн мутацийн улмаас үүссэн удамшлын дархлал хомсдол байв. Энэ өвчний үед 2-дезоксиаденозин нь өндөр концентрацитай өвчтөнүүдийн цусанд хуримтлагддаг бөгөөд энэ нь Т ба В лимфоцитуудад хортой нөлөө үзүүлдэг бөгөөд энэ нь хүнд хэлбэрийн хавсарсан дархлал хомсдол үүсгэдэг. 1990 оны 9-р сарын 14-нд Бетезда (АНУ) энэ нэн ховор өвчнөөр шаналж буй 4 настай охинд (1:100,000) өмнө нь ADA гентэй (ADA ген + маркер) ex vivo хувиргасан өөрийн лимфоцитоор шилжүүлэн суулгажээ. ген PEO + ретровирусын вектор). Эмчилгээний үр нөлөө нь хэдэн сарын турш ажиглагдсан бөгөөд дараа нь процедурыг 3-5 сарын зайтай давтана. Эмчилгээний 3 жилийн хугацаанд нийт 23 удаа ADA хувирсан лимфоцитыг судсаар сэлбэсэн. Эмчилгээний үр дүнд өвчтөний биеийн байдал мэдэгдэхүйц сайжирсан.
Албан ёсоор батлагдсан протоколууд болон эмнэлзүйн туршилтууд хийгдсэн бусад моноген удамшлын өвчнүүд нь гэр бүлийн гиперхолестеролеми (1992), гемофили В (1992), цистик фиброз (1993), Гаучер өвчин (1993) зэрэгтэй холбоотой байдаг. 1993 он гэхэд зөвхөн АНУ-д 53 төслийг генийн инженерчлэлийн загварт эмнэлзүйн туршилт хийхээр зөвшөөрсөн байна. 1995 он гэхэд дэлхий даяар ийм төслийн тоо 100 болж нэмэгдэж, 400 гаруй өвчтөн эдгээр судалгаанд шууд хамрагдсан байна. Үүний зэрэгцээ, ген эсвэл рекомбинант ДНХ-ийг in vivo манипуляци хийх үр дагаврыг хангалттай судлаагүй гэдгийг өнөөдрийн генийн эмчилгээний судалгаа хүртэл харгалзан үздэг. Тиймээс генийн эмчилгээний хөтөлбөрийг боловсруулахдаа өвчтөн болон нийт хүн амын аль алинд нь эмчилгээний дэглэмийн аюулгүй байдал нь үндсэн чухал ач холбогдолтой юм.
Эмнэлзүйн туршилтанд зориулсан генийн эмчилгээний хөтөлбөрт дараахь хэсгүүд орно: генийн эмчилгээний курс явуулах нозологийг сонгох үндэслэл; генетикийн өөрчлөлтөд өртөх эсийн төрлийг тодорхойлох; экзоген ДНХ-ийг бүтээх схем; нэвтрүүлсэн генийн бүтцийн биологийн аюулгүй байдлын үндэслэл, түүний дотор эсийн өсгөвөр, загвар амьтдын туршилт; өвчтөний эсүүдэд шилжүүлэх журмыг боловсруулах; танилцуулсан генийн илэрхийлэлд дүн шинжилгээ хийх арга; эмнэлзүйн (эмчилгээний) үр нөлөөг үнэлэх; болзошгүй гаж нөлөө ба түүнээс урьдчилан сэргийлэх арга замууд.
Европт ийм протоколыг Европын орнуудын зөвлөмжийн дагуу боловсруулж, баталдаг ажлын хэсэгген шилжүүлэх, генийн эмчилгээний талаар. Генийн эмчилгээний хөтөлбөрийн хамгийн чухал элемент бол гүйцэтгэсэн процедурын үр дагаварт дүн шинжилгээ хийх явдал юм. Амжилттай генийн эмчилгээ хийх шийдвэрлэх нөхцөл бол гадаад генийг зорилтот эсэд үр дүнтэй хүргэх, өөрөөр хэлбэл трансфекция эсвэл дамжуулалт (вирусын векторыг ашиглан) эдгээр эсүүдэд удаан хугацаагаар хадгалагдах, бүрэн ажиллах нөхцлийг бүрдүүлэх явдал юм. , илэрхийлэл. Хүлээн авагчийн эсэд гадны ДНХ-г удаан хугацаагаар хадгалах гол түлхүүр нь геномд, өөрөөр хэлбэл эзэн ДНХ эсүүдэд нэгдэх явдал юм. Гадаад генийг эсэд хүргэх үндсэн аргуудыг химийн, физик, биологийн гэж хуваадаг. Вируст суурилсан векторуудыг бүтээх нь генийн эмчилгээний хамгийн сонирхолтой бөгөөд ирээдүйтэй салбар юм.
Геномын тодорхой хэсгүүдэд генетикийн мэдээллийн шинэ блокуудыг зорилтот түвшинд хүргэх, ген, тэдгээрийн хэсгүүдийг идэвхтэй удирдах боломжийг олгодог цоо шинэ технологиуд бий болсон нь биологи, анагаах ухаанд хувьсгал хийсэн. Энэ тохиолдолд ген өөрөө янз бүрийн өвчнийг эмчлэхэд ашигладаг эм болж эхэлдэг. Олон хүчин зүйлтэй өвчинтэй тэмцэхэд генийн эмчилгээг ашиглах нь тийм ч хол биш юм. Одоо хүний геномын талаарх бидний мэдлэгийн өнөөгийн түвшинд генийн шилжүүлэн суулгах замаар ийм өөрчлөлт хийх бүрэн боломжтой бөгөөд үүнийг бие махбодийн (жишээлбэл, өндөр), оюун ухаан, оюун ухааны олон үзүүлэлтийг сайжруулах зорилгоор хийж болно. Ийнхүү орчин үеийн хүний шинжлэх ухаан хөгжлийн шинэ шатандаа Английн нэрт генетикч Фр. Галтон ба түүний шавь нар.
21-р зуунд генийн эмчилгээ нь удамшлын болон удамшлын бус хүнд өвчнийг эмчлэх бодит аргуудыг санал болгоод зогсохгүй хурдацтай хөгжиж буйгаараа нийгэмд ойрын ирээдүйд шийдвэрлэх шаардлагатай шинэ асуудлуудыг бий болгож байна.
Анхаар!
Энэхүү бүтээл нь "Шилдэг тойм" төрөлд шинжлэх ухааны алдартай нийтлэлийн уралдаанд ирүүлсэн.
Үхлийн сарвуу
Хүн төрөлхтөн манай эриний өмнө ч энэ нууцлаг өвчинтэй тулгарч байсан. Дэлхийн янз бүрийн орны эрдэмтэд үүнийг ойлгож, эмчлэхийг оролдсон: Эртний Египетэд - Эберс, Энэтхэгт - Сушрута, Грек - Гиппократ. Тэд бүгдээрээ болон бусад олон эмч нар аюултай бөгөөд ноцтой дайсан болох хорт хавдрын эсрэг тэмцсэн. Хэдийгээр энэ тулаан өнөөг хүртэл үргэлжилж байгаа ч бүрэн бөгөөд эцсийн ялалт байгуулах боломж байгаа эсэхийг тодорхойлоход хэцүү байна. Эцсийн эцэст, бид өвчнийг судлах тусам илүү олон асуулт гарч ирдэг: хорт хавдрыг бүрэн эмчлэх боломжтой юу? Өвчин эмгэгээс хэрхэн сэргийлэх вэ? Эмчилгээг хурдан, хүртээмжтэй, зардал багатай болгох боломжтой юу?
Гиппократ ба түүний ажиглах чадварын ачаар (хавдар ба хорт хавдрын тэмтрүүл хоёрын ижил төстэй байдлыг тэр олж харсан) энэ нэр томъёо эртний анагаах ухааны зохиолуудад гарч ирэв. хорт хавдар(Грекийн carcinos) эсвэл хорт хавдар(лат. хорт хавдар). Эмнэлгийн практикт хорт хавдарыг өөр өөр байдлаар ангилдаг: хорт хавдар (эпителийн эдээс), саркома (холбогч, булчингийн эдээс), лейкеми (цус, ясны чөмөгт), лимфома (лимфийн системд) болон бусад (бусад хэлбэрээр хөгждөг). эсүүд, жишээлбэл, глиома - тархины хорт хавдар). Гэхдээ өдөр тутмын амьдралд "хорт хавдар" гэсэн нэр томъёо илүү түгээмэл байдаг бөгөөд энэ нь ямар ч гэсэн утгатай хорт хавдар.
Мутаци: үхэх үү, үүрд амьдрах уу?
Олон тооны генетикийн судалгаахорт хавдрын эсүүд үүсэх нь генетикийн өөрчлөлтийн үр дүн гэдгийг олж мэдсэн. ДНХ-ийн хуулбар (хуулбарлах) ба засварын (алдаа засах) алдаа нь генийн өөрчлөлт, түүний дотор эсийн хуваагдлыг хянадаг генийн өөрчлөлтөд хүргэдэг. Геномын гэмтэл, улмаар мутаци үүсэхэд нөлөөлдөг гол хүчин зүйлүүд нь эндоген (бодисын солилцооны явцад үүссэн чөлөөт радикалуудын довтолгоо, зарим ДНХ-ийн суурийн химийн тогтворгүй байдал) ба экзоген (ионжуулагч ба хэт ягаан туяа, химийн хорт хавдар үүсгэгчид) юм. Геномд мутаци үүсэх үед тэдгээр нь хэвийн эсийг хорт хавдрын эс болгон хувиргахад тусалдаг. Ийм мутаци нь ихэвчлэн эсийн хуваагдлыг өдөөдөг прото-онкогенуудад тохиолддог. Үүний үр дүнд ген нь байнга "асаалттай" байж болох ба митоз (хуваалт) зогсдоггүй бөгөөд энэ нь үнэндээ хорт хавдар гэсэн үг юм. Хэрэв идэвхигүйжүүлэх мутаци нь ихэвчлэн тархалтыг саатуулдаг генүүдэд (хавдар дарангуйлагч генүүд) тохиолдвол хуваагдах хяналт алдагдаж, эс "үхэшгүй" болдог (Зураг 1).

Зураг 1. Хорт хавдрын генетик загвар: бүдүүн гэдэсний хорт хавдар.Эхний алхам бол тав дахь хромосом дээрх APS генийн хоёр аллелийг алдах эсвэл идэвхгүйжүүлэх явдал юм. Хэзээ гэр бүлийн хорт хавдар(танил аденоматоз полипоз, FAP) APC генийн нэг мутаци удамшдаг. Хоёр аллелийн алдагдал нь хоргүй аденома үүсэхэд хүргэдэг. Хоргүй аденомын 12, 17, 18-р хромосомын генийн дараагийн мутаци нь хорт хавдар болж хувирдаг. Эх сурвалж: .
Зарим төрлийн хорт хавдрын хөгжилд эдгээр генийн ихэнх эсвэл бүр бүх өөрчлөлт ордог бөгөөд янз бүрийн хэлбэрээр тохиолдож болох нь тодорхой юм. Үүнээс үзэхэд хавдар бүрийг биологийн өвөрмөц объект гэж үзэх ёстой. Өнөөдөр хорт хавдрын тухай генетикийн мэдээллийн тусгай сан байдаг: Хорт хавдрын геномын атлас, каталог зэрэг 20 төрлийн хавдартай холбоотой 8207 эд эсийн дээжээс 1.2 сая мутацийн мэдээллийг агуулсан. соматик мутацихорт хавдрын үед (Catalog of Somatic Mutations in Cancer (COSMIC)).
Генийн үйл ажиллагааны доголдлын үр дүн нь эсийн хяналтгүй хуваагдал бөгөөд дараагийн үе шатанд метастаз үүсдэг. янз бүрийн эрхтэнмөн цусны болон лимфийн судсаар дамжин биеийн хэсгүүд. Энэ бол хэд хэдэн үе шатаас бүрдэх нэлээд төвөгтэй, идэвхтэй үйл явц юм. Хорт хавдрын бие даасан эсүүд нь анхдагч цэгээс тусгаарлагдаж, цусаар дамжин биеийн бүх хэсэгт тархдаг. Дараа нь тусгай рецепторуудыг ашиглан эндотелийн эсүүдэд хавсарч, матрицын уургийг задалж, суурийн мембранд нүх үүсгэдэг протеиназыг илэрхийлдэг. Эсийн гаднах матрицыг устгасны дараа хорт хавдрын эсүүд илүү гүн рүү шилждэг эрүүл эд. Автокрины өдөөлтөөс болж тэдгээр нь зангилаа (1-2 мм диаметртэй) үүсгэхээр хуваагддаг. Хоол тэжээлийн дутагдалтай үед зангилааны зарим эсүүд үхдэг бөгөөд ийм "унтаа" микрометастазууд нь эрхтэний эд эсэд удаан хугацаагаар нуугдаж болно. Тааламжтай нөхцөлд зангилаа ургаж, эсэд судасны эндотелийн өсөлтийн хүчин зүйл (VEGF) болон фибробласт өсөлтийн хүчин зүйл (FGFb) ген идэвхжиж, ангиогенез (үүсэлт) эхэлдэг. цусны судас) (Зураг 2).
Гэсэн хэдий ч эсүүд нь хавдар үүсэхээс хамгаалдаг тусгай механизмаар зэвсэглэсэн байдаг.
Уламжлалт аргууд ба тэдгээрийн сул талууд
Хэрэв биеийн хамгаалалтын систем бүтэлгүйтэж, хавдар хөгжиж эхэлбэл зөвхөн эмнэлгийн оролцоо л үүнийг аварч чадна. Удаан хугацааны туршид эмч нар гурван үндсэн "сонгодог" эмчилгээний аргыг хэрэглэж ирсэн.
- мэс заслын ( бүрэн арилгаххавдар). Хавдар нь жижиг, сайн нутагшсан тохиолдолд хэрэглэнэ. Хорт хавдартай хавьтах эд эсийн нэг хэсгийг мөн арилгадаг. Энэ аргыг үсэрхийлсэн тохиолдолд хэрэглэдэггүй;
- цацраг - хорт хавдрын эсийн хуваагдлыг зогсоох, урьдчилан сэргийлэхийн тулд цацраг идэвхт тоосонцор бүхий хавдрын цацраг туяа. Эрүүл эсүүд мөн энэ цацрагт мэдрэмтгий байдаг бөгөөд ихэвчлэн үхдэг;
- хими эмчилгээ - хурдан хуваагддаг эсийн өсөлтийг дарангуйлдаг эмүүдийг хэрэглэдэг. Мөн эм нь хэвийн эсэд сөрөг нөлөө үзүүлдэг.
Дээр дурдсан аргууд нь өвчтөнийг хорт хавдраас үргэлж аварч чадахгүй. Ихэнхдээ хэзээ мэс заслын эмчилгээХорт хавдрын нэг эсүүд үлдэж, хавдар дахин давтагдах боломжтой бөгөөд хими эмчилгээ, туяа эмчилгээ хийснээр гаж нөлөө (дархлаа буурах, цус багадалт, үс унах гэх мэт) үүсдэг бөгөөд энэ нь ноцтой үр дагаварт хүргэдэг бөгөөд ихэнхдээ өвчтөний үхэлд хүргэдэг. Гэсэн хэдий ч жил бүр уламжлалт эмчилгээ сайжирч, биологийн эмчилгээ, дааврын эмчилгээ, үүдэл эсийн хэрэглээ, ясны чөмөг шилжүүлэн суулгах, төрөл бүрийн дэмжих эмчилгээ зэрэг хорт хавдрыг ялах шинэ эмчилгээ бий болж байна. Генийн эмчилгээ нь хорт хавдрын үндсэн шалтгаан болох зарим генийн үйл ажиллагааны доголдлыг нөхөхөд чиглэгддэг тул хамгийн ирээдүйтэй гэж үздэг.
Генийн эмчилгээ нь хэтийн төлөв
PubMed-ийн мэдээлснээр хорт хавдрын генийн эмчилгээ (GT) сонирхол хурдацтай нэмэгдэж байгаа бөгөөд өнөөдөр GT нь хорт хавдрын эсүүд болон бие махбодид үйл ажиллагаа явуулдаг хэд хэдэн арга техникийг хослуулсан. Vivo-д) ба түүний гадна ( ex vivo) (Зураг 3).

Зураг 3. Хоёр үндсэн генийн эмчилгээний стратеги. Ex vivo- генетикийн материалыг векторын тусламжтайгаар өсгөвөрт ургасан эсүүдэд шилжүүлэн (дамжуулах), дараа нь трансген эсийг хүлээн авагчид нэвтрүүлдэг; Vivo-д- хүссэн гентэй векторыг тодорхой эд, эрхтэнд нэвтрүүлэх. Зураг.
Генийн эмчилгээ Vivo-дгенийн шилжүүлэг орно - хорт хавдрын эсүүд эсвэл хавдрыг хүрээлсэн эдэд генетикийн бүтцийг нэвтрүүлэх. Генийн эмчилгээ ex vivoӨвчтөнөөс хорт хавдрын эсийг тусгаарлах, эмчилгээний "эрүүл" генийг хорт хавдрын геномд оруулах, шилжүүлсэн эсийг өвчтөний биед буцааж оруулахаас бүрдэнэ. Ийм зорилгоор генийн инженерчлэлийн аргаар бүтээсэн тусгай векторуудыг ашигладаг. Дүрмээр бол эдгээр нь хорт хавдрын эсийг тодорхойлж, устгадаг вирусууд бөгөөд биеийн эрүүл эд эсэд хор хөнөөлгүй, эсвэл вирусын бус векторууд юм.
Вирусын векторууд
Ретровирусууд, аденовирусууд, адено-холбоотой вирусууд, лентивирусууд, герпес вирусууд болон бусад вирусыг вирусын дамжуулагч болгон ашигладаг. Эдгээр вирусууд нь дамжуулалтын үр ашиг, эсүүдтэй харилцах (таних, халдвар авах), ДНХ-тэй харилцан адилгүй байдаг. Гол шалгуур нь аюулгүй байдал, вирусын ДНХ-ийн хяналтгүй тархах эрсдэлгүй байх явдал юм: хэрэв генийг хүний геномд буруу газар оруулсан бол тэдгээр нь хортой мутаци үүсгэж, хавдрын хөгжлийг эхлүүлдэг. Зорилтот уургийн гиперсинтезийн үед бие махбодид үрэвсэл, дархлааны урвал үүсэхээс урьдчилан сэргийлэхийн тулд шилжүүлсэн генийн илэрхийллийн түвшинг харгалзан үзэх нь чухал юм (Хүснэгт 1).
| Вектор | Товч тодорхойлолт |
|---|---|
| Улаанбурханы вирус | хорт хавдрын эсүүдэд хамгаалалтын хариу урвал үүсгэдэггүй сөрөг РНХ дараалал агуулдаг |
| Энгийн герпес вирус (HSV-1) | Трансгенүүдийн урт дарааллыг тээж чаддаг |
| Лентивирус | ХДХВ-ээс гаралтай, генийг хуваагддаггүй эсүүдэд нэгтгэж чаддаг |
| ретровирус (RCR) | бие даасан хуулбарлах чадваргүй, гадны ДНХ-ийг геномд үр дүнтэй нэгтгэх, генетикийн өөрчлөлтийг үргэлжлүүлэх боломжийг олгодог. |
| Симиан хөөсөн вирус (SFV) | трансгенийг хавдар руу шилжүүлж, түүний илрэлийг өдөөдөг шинэ РНХ вектор |
| Рекомбинант аденовирус (rAdv) | үр дүнтэй дамжуулалтыг баталгаажуулдаг боловч хүчтэй дархлааны хариу урвал боломжтой |
| Рекомбинант адено-холбоотой вирус (rAAV) | олон төрлийн эсийг дамжуулах чадвартай |
Вирусын бус векторууд
Вирусын бус векторуудыг мөн трансген ДНХ шилжүүлэхэд ашигладаг. Полимер эм зөөгч - нано бөөмийн бүтэц нь бага молекул жинтэй, жишээлбэл, олигонуклеотид, пептид, siRNA зэрэг эмийг хүргэхэд ашиглагддаг. Жижиг хэмжээтэй тул нано хэсгүүд нь эсэд шингэж, хялгасан судсыг нэвт шингээж чаддаг бөгөөд энэ нь "эмийн" молекулуудыг биеийн хамгийн хүртээмжгүй хэсэгт хүргэхэд маш тохиромжтой. Энэ аргыг ихэвчлэн хавдрын ангиогенезийг дарангуйлахад ашигладаг. Гэхдээ ясны чөмөг гэх мэт бусад эрхтэнд бөөмс хуримтлагдах эрсдэлтэй бөгөөд энэ нь урьдчилан таамаглах аргагүй үр дагаварт хүргэдэг. Вирусын бус ДНХ дамжуулах хамгийн алдартай аргууд бол липосом ба электропораци юм.
Синтетик катион липосомуудОдоогийн байдлаар функциональ генийг дамжуулах ирээдүйтэй арга гэж хүлээн зөвшөөрөгдсөн. Бөөмийн гадаргуу дээрх эерэг цэнэг нь сөрөг цэнэгтэй эсийн мембрантай нэгдэхийг баталгаажуулдаг. Катион липосомууд нь ДНХ-ийн гинжин хэлхээний сөрөг цэнэгийг саармагжуулж, орон зайн бүтцийг илүү нягт болгож, үр дүнтэй конденсацийг дэмждэг. Плазмид-липосомын цогцолбор нь хэд хэдэн чухал давуу талтай: бараг хязгааргүй хэмжээтэй генетикийн бүтцийг багтааж чаддаг, репликаци, рекомбинаци үүсэх эрсдэлгүй, бие махбодид дархлааны хариу урвал үүсгэдэггүй. Энэ системийн сул тал нь эмчилгээний үр нөлөөний богино хугацаа бөгөөд давтан хэрэглэснээр гаж нөлөө илэрч болно.
Цахилгаан задралЭнэ нь маш энгийн бөгөөд дархлааны хариу урвал үүсгэдэггүй вирусын бус ДНХ хүргэх түгээмэл арга юм. Өдөөгдсөн цахилгаан импульсийн тусламжтайгаар эсийн гадаргуу дээр нүх сүв үүсч, плазмидын ДНХ нь эсийн доторх орон зайд амархан нэвтэрдэг. Генийн эмчилгээ Vivo-дэлектропорацийг ашиглах нь хулганы хавдар дээр хийсэн хэд хэдэн туршилтаар үр дүнтэй болохыг баталсан. Энэ тохиолдолд аливаа генийг шилжүүлж болно, жишээлбэл, цитокины ген (IL-12) ба цитотоксик ген (TRAIL) нь эмчилгээний өргөн хүрээний стратеги боловсруулахад хувь нэмэр оруулдаг. Нэмж дурдахад энэ арга нь үсэрхийлсэн болон анхдагч хавдрыг эмчлэхэд үр дүнтэй байж болно.
Технологийн сонголт
Хавдрын төрөл, түүний явцаас хамааран өвчтөнд хамгийн тохиромжтой эмчилгээг сонгоно. үр дүнтэй техникэмчилгээ. Өнөөдрийг хүртэл хорт хавдрын эсрэг генийн эмчилгээний шинэ ирээдүйтэй аргуудыг боловсруулж байна, үүнд онколитик вирусын HT, урьдчилсан эм HT (prodrug эмчилгээ), дархлаа эмчилгээ, үүдэл эсийг ашиглан HT.
Онколитик вирусын генийн эмчилгээ
Энэ техник нь тусгай генетикийн тусламжтайгаар онколитик болдог вирусыг ашигладаг - тэдгээр нь эрүүл эсүүдэд үржихээ больж, зөвхөн хавдрын эсүүдэд нөлөөлдөг. Сайн жишээИйм эмчилгээ нь ONYX-015, өөрчлөгдсөн аденовирүс бөгөөд E1B уургийг илэрхийлдэггүй. Энэ уураг байхгүй тохиолдолд вирус нь хэвийн p53 гентэй эсүүдэд үржиж чадахгүй. Энгийн герпес вирус (HSV-1) дээр үндэслэсэн хоёр вектор - G207 ба NV1020 нь зөвхөн хорт хавдрын эсүүдэд хуулбарлах хэд хэдэн генийн мутаци үүсгэдэг. Техникийн давуу тал нь судсаар тарих үед онколитик вирус нь цусаар дамжин бие махбодид дамждаг бөгөөд үсэрхийлэлтэй тэмцэх чадвартай байдаг. Вирустай ажиллахад үүсдэг гол бэрхшээлүүд болзошгүй эрсдэлхүлээн авагчийн биед дархлааны хариу урвал үүсэх, түүнчлэн генетикийн бүтцийг эрүүл эсийн геномд хяналтгүй нэгтгэх, үүний үр дүнд хорт хавдрын хавдар үүсэх.
Генийн зуучлагч ферментийн урьдчилсан эмийн эмчилгээ
Энэ нь хавдрын эдэд "амиа хорлох" генийг нэвтрүүлэхэд суурилдаг бөгөөд үүний үр дүнд хорт хавдрын эсүүд үхдэг. Эдгээр трансгенүүд нь эсийн доторх цитостатикууд, TNF рецепторууд болон апоптозыг идэвхжүүлэх бусад чухал бүрэлдэхүүн хэсгүүдийг идэвхжүүлдэг ферментүүдийг кодлодог. Амиа хорлох урьдчилсан эмийн генийн хослол нь дараах шаардлагыг хамгийн сайн хангасан байх ёстой: хяналттай генийн илэрхийлэл; сонгосон бэлдмэлийг хорт хавдрын эсрэг идэвхтэй бодис болгон зөв хувиргах; нэмэлт эндоген ферментгүйгээр урьдчилсан эмийг бүрэн идэвхжүүлэх.
Эмчилгээний сул тал нь хавдар нь бүгдийг агуулдаг хамгаалалтын механизмууд, эрүүл эсийн шинж чанар бөгөөд тэдгээр нь аажмаар хор хөнөөлтэй хүчин зүйл, эмэнд дасан зохицдог. Дасан зохицох үйл явц нь цитокин (автокрины зохицуулалт), эсийн мөчлөгийн зохицуулалтын хүчин зүйлүүд (хамгийн тэсвэртэй хорт хавдрын клоныг сонгох), MDR ген (зарим эмэнд мэдрэмтгий байдлыг хариуцдаг) -ийн илэрхийлэлээр хөнгөвчилдөг.
Дархлаа эмчилгээ
Генийн эмчилгээний ачаар дархлаа эмчилгээ сүүлийн үед идэвхтэй хөгжиж эхэлсэн - шинэ хандлагахавдрын эсрэг вакцин ашиглан хорт хавдрын эмчилгээнд. Аргын гол стратеги нь ген дамжуулах технологийг ашиглан хорт хавдрын эсрэгтөрөгч (TAA) эсрэг бие махбодийг идэвхтэй дархлаажуулах явдал юм [?18].
Рекомбинант вакцинуудын бусад эмүүдээс гол ялгаа нь өвчтөний дархлааны системд хорт хавдрын эсийг таньж, устгахад тусалдаг. Эхний үе шатанд хорт хавдрын эсийг хүлээн авагчийн биеэс (автолог эс) эсвэл тусгай эсийн шугамаас (аллоген эс) гаргаж аваад дараа нь in vitro-д ургуулдаг. Эдгээр эсийг дархлааны системд танихын тулд дархлааг идэвхжүүлэгч молекул (цитокин) эсвэл олон тооны эсрэгтөрөгч бүхий уураг үүсгэдэг нэг буюу хэд хэдэн генийг нэвтрүүлдэг. Эдгээр өөрчлөлтүүдийн дараа эсийг үргэлжлүүлэн өсгөвөрлөж, дараа нь задралд оруулж, эцсийн вакциныг авдаг.
Трансгенүүдийн олон төрлийн вирусын болон вирусын бус векторууд нь янз бүрийн төрлийн дархлааны эсүүд (жишээлбэл, цитотоксик Т эсүүд ба дендрит эсүүд) дээр хорт хавдрын эсийн дархлааны хариу урвал болон регрессийг дарангуйлах боломжийг олгодог. 1990-ээд онд хавдрын нэвчдэст лимфоцитууд (TILs) нь цитотоксик Т лимфоцитууд (CTLs) болон хорт хавдрын эсүүдийн байгалийн устгагч (NK) эсийн эх үүсвэр болдог гэж санал болгосон. Учир нь TIL-ийг хялбархан удирдах боломжтой ex vivo, тэд анхны генетикийн өөрчлөлттэй болсон дархлааны эсүүд, хорт хавдрын эсрэг дархлаа эмчилгээнд хэрэглэж байсан. Хорт хавдартай өвчтөний цуснаас хасагдсан Т эсүүдэд хорт хавдрын эсрэгтөрөгчийн рецепторыг илэрхийлэх үүрэгтэй генүүд өөрчлөгддөг. Өөрчлөгдсөн Т эсийг амьд үлдэх, хавдар руу илүү үр дүнтэй оруулахын тулд ген нэмж болно. Ийм заль мэхийн тусламжтайгаар хорт хавдрын эсийн өндөр идэвхтэй "алуурчид" үүсдэг.
Ихэнх хорт хавдар нь өвөрмөц эсрэгтөрөгчтэй бөгөөд өөрсдийн хамгаалалтын механизмыг бий болгох чадвартай болох нь батлагдсан үед хорт хавдрын эсийн дархлааны системийг блоклох нь хавдраас татгалзахад тусалдаг гэсэн таамаглал дэвшүүлсэн. Тиймээс ихэнх хавдрын эсрэг вакциныг үйлдвэрлэхийн тулд өвчтөний хавдрын эсүүд эсвэл тусгай алоген эсийг эсрэгтөрөгчийн эх үүсвэр болгон ашигладаг. Хавдрын дархлалын эмчилгээний гол асуудал бол өвчтөний бие махбодид аутоиммун урвал үүсэх магадлал, хавдрын эсрэг хариу үйлдэл үзүүлэхгүй байх, хавдрын өсөлтийг дархлаажуулах гэх мэт.
Үүдэл эсүүд
Генийн эмчилгээний хүчирхэг хэрэгсэл бол үүдэл эсийг эмчилгээний бодисууд - иммуностимулятор цитокинууд, амиа хорлох генүүд, нано хэсгүүд, антиангиоген уурагуудыг шилжүүлэх вектор болгон ашиглах явдал юм. Үүдэл эсүүд нь өөрийгөө шинэчлэх, ялгах чадвараас гадна бусад тээврийн системүүд (нанополимер, вирус) -тай харьцуулахад асар их давуу талтай байдаг: урьдчилсан эмийг идэвхжүүлэх нь хавдрын эдэд шууд явагддаг бөгөөд энэ нь системийн хордлогоос сэргийлдэг. трансген нь зөвхөн хорт хавдрын эсийг устгахад хувь нэмэр оруулдаг). Нэмэлт эерэг чанар бол аутологийн SC-ийн "давуу эрхтэй" байдал юм - ашигласан өөрийн эсүүд нь 100% нийцэж, процедурын аюулгүй байдлын түвшинг нэмэгдүүлдэг. Гэсэн хэдий ч эмчилгээний үр нөлөө нь зөв эмчилгээнээс хамаарна ex vivoөөрчлөгдсөн генийг SC руу шилжүүлэх, дараа нь хувиргасан эсийг өвчтөний биед шилжүүлэх. Нэмж дурдахад, эмчилгээг их хэмжээгээр хэрэглэхээс өмнө SC-ийг хорт хавдрын эс болгон хувиргах бүх боломжит аргуудыг нарийвчлан судалж, SC-ийн хорт хавдар үүсгэгч өөрчлөлтөөс урьдчилан сэргийлэх аюулгүй байдлын арга хэмжээг боловсруулах шаардлагатай.
Дүгнэлт
Дүгнэж хэлэхэд, хорт хавдартай өвчтөн бүрийн эмчилгээнд тодорхой үр дүнтэй эмчилгээг сонгох хувийн анагаах ухааны эрин үе ирж байна гэж бид итгэлтэйгээр хэлж чадна. Цаг тухайд нь, зөв тусламж үзүүлж, өвчтөний нөхцөл байдлыг мэдэгдэхүйц сайжруулахад хүргэдэг бие даасан эмчилгээний хөтөлбөрүүд аль хэдийн боловсруулагдаж байна. Геномын шинжилгээ, зорилтот эмийн үйлдвэрлэл, хорт хавдрын генийн эмчилгээ, биомаркер ашиглан молекулын оношлогоо зэрэг хувьслын онкологийн хувьслын аргууд аль хэдийн үр дүнгээ өгч байна.
Хорт хавдрыг эмчлэх онцгой ирээдүйтэй арга бол генийн эмчилгээ юм. Асаалттай Энэ мөчЭмнэлзүйн туршилтууд идэвхтэй явагдаж байгаа бөгөөд энэ нь хорт хавдрын эсрэг стандарт эмчилгээ - мэс засал, туяа эмчилгээ, хими эмчилгээ нь тус болохгүй тохиолдолд HT-ийн үр нөлөөг баталгаажуулдаг. Хөгжил шинэлэг техник GT (дархлаа эмчилгээ, онколитик вирус эмчилгээ, "амиа хорлох" эмчилгээ гэх мэт) нь хорт хавдраас үүдэлтэй нас баралтын өндөр асуудлыг шийдвэрлэх боломжтой бөгөөд магадгүй ирээдүйд хорт хавдрын оношлогоо нь цаазаар авах ял шиг сонсогдохгүй байх болно.
Хорт хавдар: өвчнийг таних, урьдчилан сэргийлэх, арилгах.
Уран зохиол
- Уильямс С.Клуг, Майкл Р.Камминг. Биологи, анагаах ухааны ертөнц. Генетикийн үндэс. Москва: Техносфер, 2007. - 726 х.;
- Биоинформатик: Том мэдээллийн баазууд Big P-ийн эсрэг;
- Куи Х., Круз-Корреа М. гэх мэт. (2003).
Оршил
Жил бүр онд шинжлэх ухааны сэтгүүлүүдТөрөл бүрийн генийг нэвтрүүлэхэд үндэслэсэн эмчилгээг ямар нэгэн байдлаар ашигласан эмнэлгийн эмнэлзүйн судалгааны талаархи нийтлэлүүд улам олон болж байна. Энэ чиглэл нь молекул генетик, биотехнологи зэрэг сайн хөгжиж буй биологийн салбаруудаас үүссэн.
Ихэнхдээ уламжлалт (консерватив) аргуудыг аль хэдийн туршиж үзсэн бол генийн эмчилгээ нь өвчтөнүүдийг амьд үлдэх, бүр бүрэн эдгэрэхэд тусалдаг. Жишээлбэл, энэ нь удамшлын моноген өвчин, өөрөөр хэлбэл нэг генийн согогоос үүдэлтэй өвчин, түүнчлэн бусад олон өвчинд хамаарна. Эсвэл жишээлбэл, генийн эмчилгээ нь цусны судасны хөндийг нарийсгасан өвчтөнүүдэд тусалж, мөчийг аварч чадна. доод мөчрүүдҮүний үр дүнд хүрээлэн буй эдүүдийн байнгын ишеми үүссэн, өөрөөр хэлбэл эдгээр эдүүд нь ихэвчлэн цусаар дамжин бие махбодид дамждаг шим тэжээл, хүчилтөрөгчийн дутагдалд ордог. Ийм өвчтөнүүдийг мэс заслын эмчилгээ, эмээр эмчлэх нь ихэвчлэн боломжгүй байдаг, гэхдээ хэрэв эсүүд шинэ судас үүсэх, соёололтод нөлөөлөх уургийн хүчин зүйлийг илүү ихээр ялгаруулахыг шаарддаг бол ишеми багасч, амьдрал нь улам бүр дордох болно. өвчтөнүүдэд илүү хялбар байдаг.
Генийн эмчилгээӨнөө үед генийн согогийг тусгайлан өөрчлөх эсвэл эсэд шинэ функц өгөх зорилгоор генийг өвчтөний эсэд нэвтрүүлэх замаар өвчнийг эмчлэх арга гэж тодорхойлж болно. Хорт хавдрыг оношлох зорилгоор генийн эмчилгээний аргуудын анхны клиник туршилтыг 1989 оны 5-р сарын 22-нд хийсэн. Генийн эмчилгээний аргыг хэрэглэсэн анхны удамшлын өвчин бол удамшлын дархлал хомсдол байв.
Жил бүр генийн эмчилгээг ашиглан янз бүрийн өвчнийг эмчлэх эмнэлзүйн туршилт амжилттай явагдаж байгаа бөгөөд 2014 оны 1-р сар гэхэд 2 мянгад хүрсэн байна.
Үүний зэрэгцээ, in орчин үеийн судалгаагенийн эмчилгээний хувьд ген эсвэл "холиулагдсан" (рекомбинант) ДНХ-ийн үйл ажиллагааны үр дагаврыг харгалзан үзэх шаардлагатай. Vivo-д(Латинаар "амьд") хангалттай судлагдаагүй байна. Энэ чиглэлээр судалгаа хамгийн өндөр түвшинд хийгдсэн орнуудад, ялангуяа АНУ-д мэдрэхүйн ДНХ-ийн дарааллыг ашигласан эмнэлгийн протоколыг холбогдох хороо, комисс заавал хянадаг. АНУ-д эдгээр нь Рекомбинант ДНХ-ийн зөвлөх хороо (RAC) ба Эмийн захиргаа юм. хүнсний бүтээгдэхүүн(Хүнс ба Эмийн Захиргаа, FDA) дараа нь төслийг захирал заавал батлуулах Үндэсний хүрээлэнгүүдэрүүл мэнд (Үндэсний эрүүл мэндийн хүрээлэн).
Тиймээс, хэрэв биеийн зарим эд эсэд бие даасан уургийн хүчин зүйл дутагдвал эдгээр эд эсэд уураг кодлодог харгалзах генийг нэвтрүүлэх замаар үүнийг засч залруулж, бүх зүйл улам ихсэх болно гэсэн үндсэн дээр бид энэхүү эмчилгээг хийхээр шийдсэн. гайхалтай бага. Уургийг өөрсдөө нэвтрүүлэх боломжгүй, учир нь бидний бие нэн даруй хүчтэй дархлааны хариу үйлдэл үзүүлэх бөгөөд үйл ажиллагааны үргэлжлэх хугацаа хангалтгүй байх болно. Одоо та генийг эсэд хүргэх аргыг шийдэх хэрэгтэй.
Трансфекция эсүүд
Нэгдүгээрт, зарим нэр томъёоны тодорхойлолтыг танилцуулах нь зүйтэй.
Генийн тээвэрлэлт нь ачаар хийгддэг векторнь удамшлын мэдээллийг эсэд зохиомлоор дамжуулах "тээврийн хэрэгсэл" болгон ашигладаг ДНХ молекул юм. Олон төрлийн векторууд байдаг: плазмид, вирус, түүнчлэн космид, фазмид, хиймэл хромосом гэх мэт. Векторууд (ялангуяа плазмидууд) тэдгээрийн онцлог шинж чанартай байх нь үндсэндээ чухал юм.
1. Хуулбарлах гарал үүсэл (ори)- ДНХ-ийн давхардал эхэлдэг нуклеотидын дараалал. Хэрэв вектор ДНХ давхар (хуулбарлах) боломжгүй бол шаардлагатай эдгээх нөлөөЭнэ нь эс доторх нуклеазын ферментийн нөлөөгөөр хурдан задарч, матриц байхгүйн улмаас маш цөөн тооны уургийн молекул үүсэх болно. Эдгээр цэгүүд нь биологийн төрөл бүрийн хувьд өвөрмөц байдаг гэдгийг тэмдэглэх нь зүйтэй, өөрөөр хэлбэл вектор ДНХ-ийг бактерийн өсгөвөрт үржүүлэх замаар (зөвхөн химийн нийлэгжилтээр бус, ихэвчлэн илүү үнэтэй байдаг) олж авах ёстой гэж үзвэл хоёр хуулбарлах тусдаа гарал үүсэл шаардлагатай болно - хүн ба бактерийн хувьд;
2. Хязгаарлалтын сайтууд- тусгай ферментээр (хязгаарлалтын эндонуклеазууд) хүлээн зөвшөөрөгдсөн тодорхой богино дараалал (ихэвчлэн палиндромик) бөгөөд тэдгээрээр тодорхой аргаар таслагдах - "наалдамхай төгсгөл" үүсэх (Зураг 1).
Зураг.1 Рестрикт ферментийн оролцоотойгоор "наалдамхай үзүүр" үүсэх
Эдгээр сайтууд нь вектор ДНХ-ийг (энэ нь үндсэндээ "хоосон") хүссэн эмчилгээний генүүдтэй нэг молекул болгон нийлүүлэхэд зайлшгүй шаардлагатай. Хоёр ба түүнээс дээш хэсгүүдээс холбосон ийм молекулыг "рекомбинант" гэж нэрлэдэг;
3. Бид рекомбинант ДНХ молекулын сая сая хуулбарыг авахыг хүсч байгаа нь ойлгомжтой. Дахин хэлэхэд, хэрэв бид бактерийн эсийн өсгөвөртэй харьцаж байгаа бол энэ ДНХ-ийг тусгаарлах шаардлагатай. Асуудал нь бүх бактери бидэнд хэрэгтэй молекулыг залгиж чадахгүй, зарим нь үүнийг хийхгүй. Эдгээр хоёр бүлгийг ялгахын тулд тэд оруулдаг сонгомол тэмдэглэгээ- тодорхой химийн бодисуудад тэсвэртэй газар; Хэрэв та эдгээр бодисыг хүрээлэн буй орчинд нэмбэл тэдгээрт тэсвэртэй нь л амьд үлдэж, бусад нь үхэх болно.
Эдгээр гурван бүрэлдэхүүн хэсгийг хамгийн анхны зохиомлоор нийлэгжүүлсэн плазмид (Зураг 2) ажиглаж болно.

Зураг 2
Плазмид векторыг тодорхой эсүүдэд нэвтрүүлэх процессыг нэрлэдэг дамжуулалт. Плазмид нь нянгийн эсийн цитоплазмд байдаг нэлээд богино бөгөөд ихэвчлэн дугуй хэлбэртэй ДНХ молекул юм. Плазмидууд нь бактерийн хромосомтой холбоогүй, тэдгээр нь бие даан үржиж, нянгаар хүрээлэн буй орчинд ялгарч, эсвэл эсрэгээр шингээж чаддаг (шингээх үйл явц нь хувиргалт). Плазмидын тусламжтайгаар бактери нь генетикийн мэдээллийг солилцож, жишээлбэл, зарим антибиотикт тэсвэртэй байдлыг дамжуулж чаддаг.
Плазмидууд нь бактериудад байдаг. Гэвч судлаачийг өөрт хэрэгтэй шинж чанартай плазмидыг зохиомлоор нийлэгжүүлэх, түүнд ген оруулах, эсэд нэвтрүүлэхэд хэн ч саад болж чадахгүй. Нэг плазмид өөр өөр оруулга оруулж болно .
Генийн эмчилгээний аргууд
Зорилтот эсийн шинж чанараараа ялгаатай хоёр үндсэн арга байдаг:
1. Гадны ДНХ нь хөгжлийн эхний үе шатанд зигота (бордсон өндөг) эсвэл үр хөврөлд нэвтэрсэн ураг; Энэ тохиолдолд нэвтрүүлсэн материал нь хүлээн авагчийн бүх эсүүдэд (тэр ч байтугай үр хөврөлийн эсүүд) нэвтэрч, улмаар дараагийн үе рүү дамжих болно гэж найдаж байна. Манай улсад энэ нь үнэндээ хориотой;
2. Соматик, удамшлын материал нь аль хэдийн төрсөн хүний нөхөн үржихүйн бус эсүүдэд нэвтэрч, үр хөврөлийн эсүүдэд дамждаггүй.
Генийн эмчилгээ Vivo-дЭнэ нь өвчтөний тодорхой эд эсэд клонжуулсан (үржүүлсэн) болон савласан ДНХ-ийн дарааллыг тодорхой аргаар шууд нэвтрүүлэхэд суурилдаг. Ялангуяа генийн өвчнийг in vivo эмчлэх ирээдүйтэй зүйл бол аэрозол эсвэл тарилгын вакцин ашиглан генийг нэвтрүүлэх явдал юм. Аэрозольжуулсан генийн эмчилгээг ихэвчлэн эмчилгээнд зориулж боловсруулж байна уушигны өвчин(цистик фиброз, уушигны хорт хавдар).
Генийн эмчилгээний хөтөлбөрийг боловсруулахад олон үе шат байдаг. Үүнд харгалзах генийн эд эсийн өвөрмөц илэрхийлэлд нарийвчилсан дүн шинжилгээ хийх (өөрөөр хэлбэл тодорхой эд дэх зарим уургийн генийн матриц дээр нийлэгжих), биохимийн анхдагч согогийг тодорхойлох, бүтэц, үйл ажиллагааг судлах зэрэг орно. болон түүний уургийн бүтээгдэхүүний эсийн доторх тархалт, түүнчлэн эмгэг процессын биохимийн шинжилгээ. Тохирох эмнэлгийн протоколыг боловсруулахдаа эдгээр бүх өгөгдлийг харгалзан үздэг.
Генийн залруулга хийх схемийг боловсруулахдаа эсийн өсгөвөрлөлийн нөхцөлд трансфекцийн үр ашиг, биохимийн анхдагч согогийг засах зэргийг үнэлэх нь чухал юм. in vitro,"in vitro") ба хамгийн чухал нь Vivo-дамьтны биологийн загвар дээр. Үүний дараа л эмнэлзүйн туршилтын хөтөлбөр эхлэх боломжтой .
Эмчилгээний генийн шууд дамжуулалт ба эсийн тээвэрлэгчид
Гадаад ДНХ-ийг эукариот эсэд нэвтрүүлэх олон арга байдаг: зарим нь физик боловсруулалтаас (электропораци, соронзон фракц гэх мэт), бусад нь тээвэрлэгч болгон ашигладаг химийн материал эсвэл биологийн тоосонцор (жишээлбэл, вирус) ашиглахаас хамаардаг. Тэр химийн бодисыг нэн даруй дурдах нь зүйтэй физик аргууд(жишээ нь электропораци + липосом бүхий ДНХ-г бүрхэх)
Шууд аргууд
1. Химийн бодист суурилсан трансфекцийг хэд хэдэн төрөлд ангилж болно: циклодекстрин бодис, полимер, липосом эсвэл нано бөөмс (химийн болон вирусын үйл ажиллагаатай, эсхүл гадаргуугийн өөрчлөлт) ашиглах.
a) Хамгийн хямд аргуудын нэг бол кальцийн фосфатыг ашиглах явдал юм. Энэ нь ДНХ-ийг эсэд оруулах үр ашгийг 10-100 дахин нэмэгдүүлдэг. ДНХ нь кальцитай хүчтэй нэгдэл үүсгэдэг бөгөөд энэ нь түүний үр дүнтэй шингээлтийг баталгаажуулдаг. Сул тал - ДНХ-ийн ердөө 1-10% нь цөмд хүрдэг. Хэрэглэсэн арга in vitroхүний эсэд ДНХ шилжүүлэх (Зураг 3);

Зураг 3
б) Өндөр салаалсан органик молекулуудыг ашиглах - дендример, ДНХ-ийг холбож, эс рүү шилжүүлэх (Зураг 4);
Зураг 4
в) Маш үр дүнтэй аргаДНХ-ийг трансфекцлэхийн тулд үүнийг липосомоор дамжуулан нэвтрүүлдэг - липидийн давхар давхарга болох эсийн цитоплазмын мембрантай (CPM) нэгдэж чаддаг жижиг, мембранаар хүрээлэгдсэн биетүүд. Эукариот эсийн хувьд трансфекция нь катион липосомыг ашиглан илүү үр дүнтэй байдаг, учир нь эсүүд тэдгээрт илүү мэдрэмтгий байдаг. Уг процесс нь өөрийн гэсэн нэртэй байдаг - lipofection. Энэ аргыг өнөөдөр хамгийн аюулгүй гэж үздэг. Липосомууд нь хоргүй, дархлаа үүсгэдэггүй. Гэсэн хэдий ч липосомыг ашиглан ген шилжүүлэх үр ашиг хязгаарлагдмал байдаг, учир нь тэдний эсэд оруулсан ДНХ нь ихэвчлэн лизосомоор шууд баригдаж, устдаг. Липосом ашиглан хүний эсэд ДНХ нэвтрүүлэх нь өнөөдрийн эмчилгээний гол арга зам юм. Vivo-д(Зураг 5);

Зураг 5
d) Өөр нэг арга бол диэтиламиноэтил декстран эсвэл полиэтиленимин зэрэг катион полимеруудыг ашиглах явдал юм. Сөрөг цэнэгтэй ДНХ молекулууд эерэг цэнэгтэй поликатионуудтай холбогддог ба энэ цогцолбор нь эндоцитозоор эсэд нэвтэрдэг. DEAE-декстран нь физик шинж чанарыг өөрчилдөг плазмын мембранмөн энэ цогцолборыг эсэд шингээх үйл явцыг идэвхжүүлдэг. Аргын гол сул тал нь DEAE-декстран нь өндөр концентрацид хортой байдаг. Энэ арга нь генийн эмчилгээнд өргөн тархаагүй;
e) Гистон болон бусад цөмийн уургийн тусламжтайгаар. Олон тооны эерэг цэнэгтэй амин хүчлүүд (Lys, Arg) агуулсан эдгээр уургууд нь байгалийн нөхцөлд ДНХ-ийн урт гинжийг харьцангуй жижиг эсийн цөмд нягт нямбай оруулахад тусалдаг.
2. Физик аргууд:
a) Электропораци нь маш алдартай арга юм; Эсүүд богино хугацаанд хүчтэй нөлөөлөлд өртдөг тул мембраны нэвчилт нэн даруй нэмэгддэг. цахилгаан орон. Тохиромжтой нөхцөлд хувиргагчдын тоо амьд үлдсэн эсийн 80% -д хүрч болохыг харуулсан. Энэ нь одоогоор хүмүүст ашиглагддаггүй (Зураг 6).

Зураг 6
б) "Эсийг шахах" аргыг 2013 онд зохион бүтээсэн бөгөөд эсийн мембраныг "зөөлөн шахаж" эсэд молекулуудыг хүргэх боломжийг олгодог. Энэ арга нь гадны материал эсвэл цахилгаан талбарт тулгуурладаггүй тул хоруу чанар, буруу зорилтыг арилгадаг;
в) Сонопораци гэдэг нь гадны ДНХ-ийг хэт авиан шинжилгээнд оруулах замаар эсэд зохиомлоор шилжүүлэх, эсийн мембран дахь нүх сүвийг нээх арга юм;
d) Оптик дамжуулалт - мембранд (ойролцоогоор 1 мкм диаметртэй) жижиг нүх гаргах арга нь өндөр фокустай лазераар;
e) Гидродинамик трансфекция - генетикийн бүтэц, уураг гэх мэтийг дамжуулах арга. хялгасан судас ба эс хоорондын шингэний даралтын хяналттай өсөлтөөр эсийн мембраны нэвчилт богино хугацаанд нэмэгдэж, тэдгээрт түр зуурын нүх үүсдэг. Энэ нь эдэд хурдан тарих замаар хийгддэг бөгөөд хүргэх нь өвөрмөц бус байдаг. Араг ясны булчингийн хүргэх үр ашиг - 22-60% ;
е) ДНХ-ийн бичил тарилга - нимгэн шилэн микротубул (d=0.1-0.5 мкм) ашиглан амьтны эсийн цөмд нэвтрүүлэх. Сул тал нь аргын нарийн төвөгтэй байдал, цөм эсвэл ДНХ-ийг устгах магадлал өндөр байдаг; хязгаарлагдмал тооны эсийг хувиргах боломжтой. Хүний хэрэгцээнд зориулагдаагүй.
3. Бөөмд суурилсан аргууд.
a) Трансфекци хийх шууд арга бол генийн буу бөгөөд ДНХ нь идэвхгүй хатуу бодис (ихэвчлэн алт, вольфрам) бүхий нано бөөмс болгон нэгтгэж, дараа нь зорилтот эсийн цөм рүү чиглүүлдэг. Энэ аргыг хэрэглэж байна in vitroТэгээд Vivo-дгенийг ялангуяа булчингийн эд эсэд нэвтрүүлэх, жишээлбэл, Дюшений булчингийн дистрофи зэрэг өвчний үед. Алтны ширхэгийн хэмжээ 1-3 микрон (Зураг 7).

Зураг 7
б) Magnetofection нь соронзлолын хүчийг ашиглан ДНХ-ийг зорилтот эсүүдэд хүргэх арга юм. Нэгдүгээрт, нуклейн хүчил (NA) нь соронзон нано бөөмстэй холбоотой бөгөөд дараа нь нөлөөн дор байдаг. соронзон орон, тоосонцор нь эс рүү шилждэг. Үр нөлөө нь бараг 100%, илт хоргүй шинж тэмдэг илэрдэг. 10-15 минутын дотор тоосонцор эсэд бүртгэгддэг - энэ нь бусад аргуудаас хамаагүй хурдан юм.
в) Импалефекци; "дуулга", "дуулга" + "халдвар") - нүүрстөрөгчийн нано хоолой, нано шилэн зэрэг наноматериалуудыг ашиглан хүргэх арга. Энэ тохиолдолд эсүүд шууд утгаараа нанофибрилүүдийн давхаргаар цоолдог. “Нано” угтвар нь тэдний маш жижиг хэмжээг (метрийн тэрбумын дотор) илэрхийлэхэд хэрэглэгддэг (Зураг 8).

Зураг 8
РНХ-ийн трансфекция гэх мэт аргыг тусад нь онцлон тэмдэглэх нь зүйтэй: энэ нь эсэд дамждаг ДНХ биш, харин РНХ молекулууд - уургийн биосинтезийн гинжин хэлхээнд тэдний " залгамжлагч "; Энэ тохиолдолд РНХ-ийг богино хэсгүүдэд хуваасан тусгай уураг идэвхждэг. жижиг хөндлөнгийн РНХ (siRNA). Эдгээр хэсгүүд нь бусад уурагуудтай холбогддог бөгөөд эцэст нь энэ нь эсийн харгалзах генийг илэрхийлэхийг саатуулдаг. Ингэснээр тухайн үед сайнаас илүү хор хөнөөл учруулж болзошгүй эсэд байгаа тэдгээр генүүдийн үйлдлийг хаах боломжтой. РНХ-ийн трансфекция нь ялангуяа онкологийн салбарт өргөн хэрэглэгддэг.
Плазмид вектор ашиглан ген дамжуулах үндсэн зарчмуудыг авч үзсэн. Одоо бид вирусын аргуудыг авч үзэж болно. Вирусууд эсийн бус хэлбэрүүдамьдрал, ихэнхдээ уургийн бүрхүүлд ороосон нуклейн хүчлийн молекулыг (ДНХ эсвэл РНХ) төлөөлдөг. Хэрэв та вирусын удамшлын материалаас өвчин үүсгэдэг бүх дарааллыг хасвал вирусыг бүхэлд нь бидний генийн "тээврийн хэрэгсэл" болгон амжилттай болгож чадна.
Вирусээр дамжсан ДНХ-ийг эсэд нэвтрүүлэх үйл явцыг гэнэ дамжуулалт.
Практикт хамгийн түгээмэл хэрэглэгддэг нь ретровирус, аденовирус, адено-холбоотой вирус (AAV) юм. Нэгдүгээрт, вирусын халдвар дамжих хамгийн тохиромжтой нэр дэвшигч нь юу байх ёстойг олж мэдэх нь зүйтэй. Шалгуур нь дараахь байх ёстой.
Тогтвортой;
. багтаамжтай, өөрөөр хэлбэл хангалттай хэмжээний ДНХ-ийг багтаах;
. эсийн бодисын солилцооны замтай холбоотой идэвхгүй;
. нарийн - хамгийн тохиромжтой нь геномоо эзэн цөмийн геномын тодорхой байршилд нэгтгэх ёстой гэх мэт.
Бодит амьдрал дээр дор хаяж хэд хэдэн цэгийг нэгтгэх нь маш хэцүү байдаг тул ихэвчлэн тохиолдол бүрийг тусад нь авч үзэх үед сонголт хийдэг (Зураг 9).

Зураг 9
Жагсаалтад орсон хамгийн их хэрэглэгддэг гурван вирусын дотроос хамгийн аюулгүй бөгөөд нэгэн зэрэг үнэн зөв нь AAV юм. Тэдний бараг цорын ганц сул тал бол харьцангуй бага хүчин чадал (ойролцоогоор 4800 bp) юм, гэхдээ энэ нь олон генийн хувьд хангалттай юм. .
Жагсаалтад дурдсан аргуудаас гадна генийн эмчилгээг ихэвчлэн эсийн эмчилгээтэй хослуулан хэрэглэдэг: эхлээд хүний тодорхой эсийн өсгөвөрийг шим тэжээлийн орчинд тарьж, дараа нь шаардлагатай генийг эсэд ямар нэг байдлаар нэвтрүүлж, тариалдаг. хэсэг хугацаанд дахин дахин эзний биед шилжүүлэн суулгасан. Үүний үр дүнд эсүүд хэвийн шинж чанартаа буцаж ирдэг. Тиймээс, жишээлбэл, хүний цагаан эсийг (лейкоцит) лейкемийн хувьд өөрчилсөн (Зураг 10).

Зураг 10
Энэ нь эсэд нэвтэрсний дараа генийн хувь заяа
Вирусын векторуудын хувьд генийг эцсийн зорилго болох цөмд илүү үр дүнтэй хүргэх чадвартай тул бүх зүйл тодорхой, бага байдаг тул бид плазмидын векторын хувь заяаны талаар ярих болно.
Энэ үе шатанд бид ДНХ нь анхны том саад болох эсийн цитоплазмын мембраныг давж чадсан юм.
Цаашилбал, бусад бодисуудтай хослуулан бүрхүүлтэй эсэхээс үл хамааран түүнд хүрэх шаардлагатай эсийн цөмтусгай фермент - РНХ полимераза нь ДНХ-ийн загвар дээр элч РНХ (мРНХ) молекулыг нэгтгэдэг (энэ үйл явцыг гэж нэрлэдэг). транскрипци). Үүний дараа л мРНХ цитоплазмд ялгарч, рибосомтой нэгдэл үүсгэж, удамшлын кодын дагуу полипептид нийлэгждэг - жишээлбэл, судасны өсөлтийн хүчин зүйл (VEGF) нь тодорхой эмчилгээний функцийг гүйцэтгэж эхэлдэг. Энэ тохиолдолд ишемитэй эдэд судас салаалж үүсэх процесс эхэлнэ).
Оруулсан генийг шаардлагатай эсийн төрөлд илэрхийлэх тухайд энэ асуудлыг транскрипцийн зохицуулалтын элементүүдийн тусламжтайгаар шийддэг. Экспресс үүсэх эдийг ихэвчлэн эд эсийн өвөрмөц сайжруулагчийг ("сайжруулах" дараалал) тусгай дэмжигчтэй (РНХ полимеразын синтезийг эхлүүлдэг нуклеотидын дараалал) хослуулан тодорхойлдог. . Генийн үйл ажиллагааг өөрчлөх боломжтой гэдгийг мэддэг Vivo-дгадаад дохио, сайжруулагч нь ямар ч гентэй ажиллах боломжтой тул тусгаарлагчийг векторуудад нэвтрүүлж, сайжруулагчийн байрлалаас үл хамааран ажиллахад тусалдаг ба генүүдийн хооронд функциональ саад болж чаддаг. Өсгөгч бүр нь уургийн хүчин зүйлийг идэвхжүүлэх эсвэл дарангуйлах зориулалттай холбох газруудыг агуулдаг. Промоторуудыг мөн генийн илэрхийлэлийн түвшинг зохицуулахад ашиглаж болно. Жишээлбэл, металлотионеин эсвэл температурт мэдрэмтгий промоторууд байдаг; гормоноор хянагддаг дэмжигчид.
Генийн илэрхийлэл нь геном дахь байрлалаас хамаарна. Ихэнх тохиолдолд одоо байгаа вирусын аргууд нь зөвхөн генийг геном руу санамсаргүй байдлаар оруулахад хүргэдэг. Ийм хамаарлыг арилгахын тулд векторуудыг бүтээхдээ генийг нуклеотидын мэдэгдэж буй дарааллаар хангадаг бөгөөд энэ нь генийг геномд оруулсан газраас үл хамааран илэрхийлэх боломжийг олгодог.
Трансгений илэрхийлэлийг зохицуулах хамгийн энгийн арга бол глюкозын ялгаралт эсвэл гипокси зэрэг физиологийн дохионд мэдрэмтгий индикатор дэмжигчээр хангах явдал юм. Ийм "эндоген" хяналтын систем нь инсулины үйлдвэрлэлийг глюкозоос хамааралтай хянах гэх мэт зарим тохиолдолд ашигтай байж болно. Эмийн жижиг молекулыг нэвтрүүлэх замаар генийн илэрхийлэлийг фармакологийн аргаар удирддаг "экзоген" хяналтын систем нь илүү найдвартай бөгөөд түгээмэл байдаг. Одоогийн байдлаар 4 үндсэн хяналтын системийг мэддэг - тетрациклин (Тет), шавьжны стероид, экдизон эсвэл түүний аналогууд, антипрогестин эм майфпристон (RU486), рапамицин ба түүний аналог зэрэг химийн димеризаторуудаар зохицуулагддаг. Эдгээр нь бүгд хүссэн генийг удирдан чиглүүлдэг гол промотер руу транскрипцийг идэвхжүүлэх домэйны эмээс хамааралтай таталцлыг агуулдаг боловч энэ таталтын механизмын хувьд ялгаатай байдаг. .
Дүгнэлт
Мэдээллийн тойм нь дэлхийн олон лабораторийн хүчин чармайлтыг үл харгалзан бүх зүйл аль хэдийн мэдэгдэж, туршиж үзсэн гэсэн дүгнэлтэд хүрэх боломжийг олгодог. Vivo-дТэгээд in vitroвектор системүүд нь төгс биш юм . Гадаадын ДНХ-г хүргэх асуудал гарвал in vitroпрактикт шийдэгдэж, янз бүрийн эд эсийн зорилтот эсүүдэд хүргэх Vivo-дамжилттай шийдэгдсэн (голчлон рецепторын уураг, түүний дотор тодорхой эдэд өвөрмөц антиген агуулсан бүтцийг бий болгосноор), одоо байгаа вектор системийн бусад шинж чанарууд - интеграцийн тогтвортой байдал, зохицуулалттай илэрхийлэл, аюулгүй байдал - ноцтой сайжруулалтыг шаарддаг.
Юуны өмнө энэ нь интеграцийн тогтвортой байдалд хамаатай. Өнөөг хүртэл геномд нэгтгэх нь зөвхөн ретровирус эсвэл адено-холбоотой векторуудыг ашиглан хийгдсэн. Тогтвортой интеграцийн үр ашгийг рецептороор дамждаг систем гэх мэт генийн бүтцийг сайжруулах эсвэл хангалттай тогтвортой эписомын векторуудыг (өөрөөр хэлбэл бөөм дотор удаан хугацаагаар оршин суух чадвартай ДНХ-ийн бүтэц) бий болгох замаар нэмэгдүүлэх боломжтой. Сүүлийн үед хөхтөн амьтдын хиймэл хромосом дээр суурилсан векторуудыг бий болгоход онцгой анхаарал хандуулж байна. Энгийн хромосомын үндсэн бүтцийн элементүүд байдаг тул ийм мини хромосомууд нь эсэд удаан хугацаагаар хадгалагдаж, зөв ажиллахад шаардлагатай бүрэн хэмжээний (геном) генүүд болон тэдгээрийн байгалийн зохицуулалтын элементүүдийг авч явах чадвартай байдаг. ген, зөв эдэд, зөв цагт.
Ген, эсийн эмчилгээ нь алдагдсан эс, эдийг нөхөн сэргээх, эрхтнүүдийн генийн инженерчлэлийн дизайны гайхалтай хэтийн төлөвийг нээж өгдөг бөгөөд энэ нь биоанагаах ухааны судалгааны аргуудын арсеналыг ихээхэн өргөжүүлж, хүний амьдралыг хадгалах, уртасгах шинэ боломжийг бий болгох нь дамжиггүй.
Нэмж дурдахад та генийн эмчилгээний ололттой танилцсанаар хромосомын эмгэгийг эмчлэх орчин үеийн анагаахын шинжлэх ухааны чадавхитай танилцах боломжтой. Энэ чиглэл нь төрөл бүрийн аргуудыг ашиглан генийг зорилтот эсүүд гэж нэрлэгдэх тохиолдолд хүний биед генетикийн материалыг шилжүүлэхэд суурилдаг.
Хэрэглэх заалт
Өвчин эмгэгийг нарийн тодорхойлсон тохиолдолд л удамшлын өвчний эмчилгээг хийдэг. Үүний зэрэгцээ, эмчилгээний арга хэмжээг томилохын өмнө эмийн хамгийн үр дүнтэй тунг сонгохын тулд ямар даавар болон бусад бодисууд бие махбодид илүүдэл үүсч, аль нь хангалтгүй хэмжээгээр үйлдвэрлэгдэж байгааг тодорхойлохын тулд хэд хэдэн шинжилгээ хийдэг.
Эм уухдаа өвчтөний нөхцөл байдлыг байнга хянаж, шаардлагатай бол эмчилгээний явцад өөрчлөлт оруулдаг.
Дүрмээр бол ийм өвчтөнүүд насан туршдаа эсвэл удаан хугацааны туршид (жишээлбэл, биеийн өсөлтийн үйл явц дуусах хүртэл) эм уух ёстой бөгөөд хоолны дэглэмийн зөвлөмжийг хатуу, байнга дагаж мөрдөх ёстой.
Эсрэг заалтууд
Эмчилгээний курс боловсруулахдаа хэрэглэхэд бие даасан эсрэг заалтуудыг харгалзан үзэж, шаардлагатай бол зарим эмийг бусад эмээр солино.
Зарим удамшлын өвчний үед эрхтэн, эд эсийг шилжүүлэн суулгах шийдвэр гаргахдаа мэс заслын дараах сөрөг үр дагаврыг харгалзан үзэх шаардлагатай.
Генийн эмчилгээ нь эрүүл генийг бие махбодид нэвтрүүлэх замаар хүнийг эмчилдэг анагаах ухааны хурдацтай хөгжиж буй салбаруудын нэг юм. Түүгээр ч барахгүй эрдэмтдийн үзэж байгаагаар генийн эмчилгээний тусламжтайгаар дутуу генийг нэмж, засч залруулах, орлуулах боломжтой бөгөөд ингэснээр эсийн түвшинд биеийн үйл ажиллагааг сайжруулж, өвчтөний нөхцөл байдлыг хэвийн болгодог.
Эрдэмтдийн үзэж байгаагаар одоогоор манай гаригийн 200 сая хүн генийн эмчилгээнд хамрагдах боломжтой бөгөөд энэ тоо тогтмол өсч байна. Хэдэн мянган өвчтөн үргэлжилсэн туршилтын хүрээнд эдгэршгүй өвчнийг аль хэдийн эмчлүүлсэн нь маш таатай байна.
Энэ нийтлэлд бид генийн эмчилгээ нь ямар үүрэг даалгавар өгдөг, ямар өвчнийг энэ аргаар эмчлэх боломжтой, эрдэмтэд ямар асуудал тулгардаг талаар ярих болно.
Генийн эмчилгээг хаана хэрэглэдэг вэ?
Генийн эмчилгээг анх Хантингтоны өвчин, цистик фиброз зэрэг удамшлын хүнд өвчинтэй тэмцэх зорилгоор зохион бүтээжээ. Халдварт өвчин. Гэсэн хэдий ч 1990 онд эрдэмтэд согогтой генийг залруулж, өвчтөний биед нэвтрүүлснээр цистик фиброзыг дарж чадсан нь генийн эмчилгээний салбарт үнэхээр хувьсгал болсон юм. Дэлхий даяар сая сая хүмүүс урьд өмнө эдгэршгүй гэж үздэг өвчнийг эмчлэх итгэл найдварыг олж авав. Хэдийгээр ийм эмчилгээ нь хөгжлийнхөө эхэнд байгаа ч шинжлэх ухааны ертөнцөд ч түүний чадавхийг гайхшруулж байна.
Жишээлбэл, цистик фиброзоос гадна орчин үеийн эрдэмтэд гемофили, энзимопати, дархлал хомсдол зэрэг удамшлын эмгэгийн эсрэг тэмцэлд ахиц дэвшил гаргасан. Түүгээр ч барахгүй генийн эмчилгээ нь зарим онкологийн өвчин, түүнчлэн зүрхний эмгэг, мэдрэлийн тогтолцооны өвчин, тэр байтугай гэмтэл, жишээлбэл мэдрэлийн гэмтэлтэй тэмцэх боломжтой болгодог. Тиймээс генийн эмчилгээ нь эрт нас баралтад хүргэдэг маш хүнд өвчнийг авч үздэг бөгөөд ихэвчлэн генийн эмчилгээнээс өөр эмчилгээ байдаггүй.
Генийн эмчилгээний зарчим
гэх мэт идэвхтэй бодисЭмч нар удамшлын мэдээлэл, тодорхой хэлбэл ийм мэдээллийг зөөгч молекулуудыг ашигладаг. Үүний тулд РНХ-ийн нуклейн хүчлийг ихэвчлэн ашигладаг бөгөөд ДНХ эсийг ихэвчлэн ашигладаг.
Ийм эс бүр нь "хувилагч" гэж нэрлэгддэг механизмтай байдаг бөгөөд энэ нь генетикийн мэдээллийг уураг болгон хувиргадаг механизм юм. Зөв гентэй, хувилагч нь доголдолгүй ажилладаг эс нь генийн эмчилгээний үүднээс эрүүл эс юм. Эрүүл эс бүр нь бүхэл бүтэн организмын зөв, эв найртай ажиллахад ашигладаг анхны генийн бүхэл бүтэн номын сантай байдаг. Гэсэн хэдий ч ямар нэг шалтгаанаар чухал ген алга болвол ийм алдагдлыг сэргээх боломжгүй юм.
Энэ нь Duchenne булчингийн дистрофи гэх мэт ноцтой удамшлын өвчин үүсэх шалтгаан болдог (үүнтэй хамт өвчтөн булчингийн саажилт үүсгэдэг бөгөөд ихэнх тохиолдолд тэр 30 нас хүрдэггүй, амьсгалын замын баривчлагдаж үхдэг). Эсвэл үхлийн аюул багатай нөхцөл байдал. Жишээлбэл, тодорхой генийн "эвдрэл" нь уураг нь үүргээ гүйцэтгэхээ болино. Мөн энэ нь гемофили үүсэх шалтгаан болдог.
Бүртгэгдсэн тохиолдлын аль нэгэнд генийн эмчилгээ нь аврах ажилд ирдэг бөгөөд түүний үүрэг бол генийн хэвийн хуулбарыг өвчтэй эсэд хүргэж, эсийн "хувилагч" -д байрлуулах явдал юм. Энэ тохиолдолд эсийн үйл ажиллагаа сайжирч, магадгүй бүх биеийн үйл ажиллагаа сэргэж, үүний ачаар хүн хүнд өвчнөөс ангижирч, амьдралаа уртасгах боломжтой болно.

Генийн эмчилгээ ямар өвчнийг эмчлэх боломжтой вэ?
Генийн эмчилгээ нь хүнд хэр их тусалдаг вэ? Эрдэмтдийн үзэж байгаагаар дэлхий дээр генийн буруу үйл ажиллагааны үр дүнд үүсдэг 4200 орчим өвчин байдаг. Үүнтэй холбогдуулан анагаах ухааны энэ чиглэлийн боломж үнэхээр гайхалтай юм. Гэсэн хэдий ч эмч нар өнөөг хүртэл ямар үр дүнд хүрсэн нь илүү чухал юм. Мэдээжийн хэрэг, энэ замд маш их бэрхшээл тулгарч байгаа ч өнөөдөр орон нутгийн хэд хэдэн ялалтыг тодорхойлж болно.
Жишээлбэл, орчин үеийн эрдэмтэд зүрхний титэм судасны өвчнийг генээр дамжуулан эмчлэх аргыг боловсруулж байна. Гэхдээ энэ бол олон хүмүүст нөлөөлдөг гайхалтай нийтлэг өвчин юм илүү олон хүнтөрөлхийн эмгэгээс илүү. Эцсийн эцэст хүнтэй тулгарсан титэм судасны өвчин, генийн эмчилгээ нь түүний цорын ганц аврал болох нөхцөл байдалд өөрийгөө олдог.
Түүнээс гадна өнөөдөр төв мэдрэлийн тогтолцооны гэмтэлтэй холбоотой эмгэгийг генийн тусламжтайгаар эмчилдэг. Эдгээр нь амиотрофийн хажуугийн склероз, Альцгеймерийн өвчин эсвэл Паркинсоны өвчин зэрэг өвчин юм. Сонирхолтой нь эдгээр өвчнийг эмчлэхийн тулд мэдрэлийн системд халддаг вирусыг ашигладаг. Тиймээс герпес вирусын тусламжтайгаар цитокинууд болон өсөлтийн хүчин зүйлсийг мэдрэлийн системд хүргэж, өвчний хөгжлийг удаашруулдаг. Энэ нь ихэвчлэн өвчин үүсгэдэг эмгэг төрүүлэгч вирусыг лабораторид боловсруулж, өвчин үүсгэгч уургийг нь салгаж, эдгээх бодисыг мэдрэлд хүргэж, улмаар хүний эрүүл мэндэд тустай, уртасгах үйлчилгээ үзүүлдэг гайхалтай жишээ юм. амьдрал.
Өөр нэг ноцтой удамшлын өвчин бол хүний бие холестерины хэмжээг зохицуулах чадваргүй болж, улмаар биед өөх тос хуримтлагдаж, зүрхний шигдээс, цус харвалт үүсэх эрсдэл нэмэгддэг холестеринеми юм. Энэ асуудлыг даван туулахын тулд мэргэжилтнүүд өвчтөний элэгний хэсгийг салгаж, гэмтсэн генийг засч залруулж, цусан дахь холестерины цаашдын хуримтлалыг зогсооно. Дараа нь залруулсан генийг саармагжуулсан гепатитын вируст байрлуулж, элэг рүү буцааж илгээдэг.
Мөн уншина уу:
ДОХ-ын эсрэг тэмцэлд эерэг өөрчлөлтүүд гарч байна. ДОХ нь хүний дархлал хомсдолын вирусээр үүсгэгддэг бөгөөд энэ нь дархлааг устгаж, бие махбодид үхлийн аюултай өвчний үүд хаалгыг нээж өгдөг нь нууц биш юм. Орчин үеийн эрдэмтэд генийг хэрхэн өөрчлөхийг аль хэдийн мэддэг бөгөөд ингэснээр дархлааны системийг сулруулж, вирусыг эсэргүүцэхийн тулд үүнийг бэхжүүлж эхэлдэг. Ийм генийг цусаар дамжуулан цус сэлбэх замаар нэвтрүүлдэг.
Генийн эмчилгээ нь хорт хавдрын эсрэг, ялангуяа арьсны хорт хавдрын эсрэг (меланома) үр дүнтэй байдаг. Ийм өвчтөнүүдийн эмчилгээ нь хавдрын үхжилийн хүчин зүйл бүхий генийг нэвтрүүлэх явдал юм. хавдрын эсрэг уураг агуулсан генүүд. Түүгээр ч зогсохгүй өнөөдөр тархины хорт хавдрыг эмчлэх туршилтууд хийгдэж байгаа бөгөөд өвчтэй өвчтөнүүдэд хорт хавдрын эсүүдийн хэрэглэж буй эмэнд мэдрэмтгий байдлыг нэмэгдүүлэхийн тулд мэдээлэл агуулсан генийг тарьдаг.
Гаучерын өвчин бол глюкоцереброзидаза хэмээх тусгай ферментийн үйлдвэрлэлийг дарангуйлдаг генийн мутациас үүдэлтэй удамшлын хүнд өвчин юм. Энэхүү эдгэшгүй өвчнөөр шаналж буй хүмүүсийн дэлүү, элэг томорч, өвчин даамжрах тусам яс нь муудаж эхэлдэг. Эрдэмтэд ийм өвчтөнүүдийн биед энэ ферментийн үйлдвэрлэлийн талаархи мэдээллийг агуулсан генийг нэвтрүүлэх туршилтанд аль хэдийн амжилтанд хүрсэн.
Өөр нэг жишээ энд байна. Хараагүй хүн амьдралынхаа туршид харааны дүрсийг мэдрэх чадваргүй болдог нь нууц биш юм. Төрөлхийн харалган байдлын нэг шалтгаан нь Леберийн хатингиршил гэж нэрлэгддэг бөгөөд энэ нь үндсэндээ юм. генийн мутаци. Өнөөдрийг хүртэл эрдэмтэд "ажилладаг" генийг нүдний эдэд хүргэдэг өөрчлөгдсөн аденовирүсийн тусламжтайгаар 80 хараагүй хүний харааны чадварыг сэргээжээ. Дашрамд дурдахад, хэдэн жилийн өмнө эрдэмтэд амьтны нүдний торлог бүрхэвчинд хүний эрүүл генийг нэвтрүүлснээр туршилтын сармагчны өнгөний харалган байдлыг эмчилж чадсан юм. Саяхан ийм мэс засал нь анхны өвчтөнүүдэд өнгөт харалган байдлыг эмчлэх боломжийг олгосон.
Ерөнхийдөө вирусыг ашиглан генетикийн мэдээллийг дамжуулах арга нь хамгийн оновчтой байдаг, учир нь вирусууд бие махбоддоо зорилтот байр сууриа олдог (герпес вирус нь мэдрэлийн эсийг олох болно, гепатитын вирус нь элэгийг олох болно). Гэсэн хэдий ч генийг дамжуулах энэ арга нь мэдэгдэхүйц сул талтай байдаг - вирусууд нь дархлаа үүсгэгч шинж чанартай байдаг бөгөөд энэ нь бие махбодид орохдоо дархлааны систем нь ажиллах цаг гарахаас өмнө устгадаг, эсвэл бүр бие махбодоос хүчтэй дархлааны хариу урвал үүсгэдэг гэсэн үг юм. зөвхөн эрүүл мэндийн байдлыг улам дордуулж байна.
Генийн материалыг хүргэх өөр нэг арга бий. Энэ нь дугуй хэлбэртэй ДНХ молекул буюу плазмид юм. Энэ нь маш сайн эргэлдэж, маш нягт болж, эрдэмтэд үүнийг химийн полимерт "савлаж", эсэд нэвтрүүлэх боломжийг олгодог. Вирусаас ялгаатай нь плазмид нь үүсгэдэггүй дархлааны урвалбие. Гэсэн хэдий ч, энэ арга нь бага тохиромжтой, учир нь 14 хоногийн дараа плазмид эсээс салж, уургийн үйлдвэрлэл зогсдог. Өөрөөр хэлбэл, энэ аргаар генийг эс "сэргээх" хүртэл удаан хугацаанд нэвтрүүлэх ёстой.
Тиймээс орчин үеийн эрдэмтэд "өвчтэй" эсүүдэд генийг дамжуулах хоёр хүчирхэг аргыг ашигладаг бөгөөд вирусыг ашиглах нь илүү дээр юм шиг санагддаг. Ямар ч тохиолдолд нэг эсвэл өөр аргыг сонгох эцсийн шийдвэрийг өвчтөний биеийн хариу үйлдэл дээр үндэслэн эмч гаргадаг.
Генийн эмчилгээнд тулгарч буй бэрхшээлүүд
Бид генийн эмчилгээ нь олон тооны бүтэлгүйтэл, гэмтэлтэй холбоотой анагаах ухааны сайн судлагдаагүй салбар гэж тодорхой дүгнэлт хийж болно. сөрөг нөлөө, мөн энэ нь түүний том сул тал юм. Гэсэн хэдий ч ёс зүйн асуудал бас бий, учир нь олон эрдэмтэд хүний биеийн генетикийн бүтцэд хөндлөнгөөс оролцохыг эрс эсэргүүцдэг. Тийм ч учраас өнөөдөр олон улсын хэмжээнд үр хөврөлийн эс, мөн суулгацын өмнөх үр хөврөлийн эсийг генийн эмчилгээнд хэрэглэхийг хориглосон байдаг. Энэ нь бидний үр удамд хүсээгүй генийн өөрчлөлт, мутаци үүсэхээс урьдчилан сэргийлэх зорилгоор хийгдсэн.
Үгүй бол генийн эмчилгээ нь ямар ч ёс зүйн хэм хэмжээг зөрчөөгүй, учир нь энэ нь ноцтой, эдгэршгүй өвчинтэй тэмцэх зорилготой юм. албан ёсны эмзүгээр л хүчгүй. Мөн энэ нь генийн эмчилгээний хамгийн чухал давуу тал юм.
Өөртөө анхаарал тавиарай!
“Таны хүүхэд удамшлын өвчтэй” гэдэг өгүүлбэр шиг сонсогддог. Гэхдээ ихэнхдээ генетикчид өвчтэй хүүхдэд ихээхэн тусалж, зарим өвчнийг бүрэн нөхөж чаддаг. ПБСК-ийн Покровскийн эрүүл мэндийн төвийн мэдрэл судлаач-генетикч Мария Алексеевна Булатникова орчин үеийн эмчилгээний аргуудын талаар ярьж байна.
Удамшлын өвчин хэр түгээмэл байдаг вэ?
Молекулын оношилгоо өргөн хүрээтэй болохын хэрээр удамшлын өвчлөл урьд өмнө төсөөлж байснаас хамаагүй их байгааг олж мэдсэн. Зүрхний олон өвчин, хөгжлийн гажиг, мэдрэлийн эмгэгүүд нь удамшлын шалтгаантай байдаг. Энэ тохиолдолд би удамшлын өвчин (урьдчилан таамаглал биш), тухайлбал нэг буюу хэд хэдэн генийн мутаци (эвдрэл) -ээс үүдэлтэй нөхцөл байдлын тухай ярьж байна. Статистикийн мэдээгээр, АНУ-д мэдрэлийн өвчтэй хүмүүсийн гуравны нэг нь генетикийн эмгэгийн улмаас эмнэлэгт хэвтдэг. Ийм дүгнэлтийг молекул генетикийн хурдацтай хөгжил, генетикийн шинжилгээний чадавхи төдийгүй MRI гэх мэт мэдрэлийн дүрслэлийн шинэ аргууд гарч ирснээр хүргэсэн. MRI ашиглан тархины аль хэсэгт гэмтэл учруулж, хүүхдэд тохиолддог эмгэгийг тодорхойлох боломжтой бөгөөд ихэвчлэн төрсний гэмтэл гэж сэжиглэх үед бид хүүхэд төрүүлэх явцад гэмтэх боломжгүй бүтцийн өөрчлөлтийг илрүүлдэг. Дараа нь өвчний генетик шинж чанар, эрхтнүүдийн зохисгүй үүсэх талаархи таамаглал гарч ирдэг. Сүүлийн үеийн судалгааны үр дүнгээс харахад генетикийн бүрэн бүтэн байдал, хүнд хэцүү төрөлтүүдийн нөлөөг амьдралын эхний жилүүдэд нөхөж болно.
Өвчний генетик шинж чанарын талаархи мэдлэг юу өгдөг вэ?
Өвчний удамшлын шалтгаануудын талаархи мэдлэг нь ашиггүй зүйл биш юм - энэ нь цаазаар авах ял биш, харин эмгэгийг эмчлэх, засах зөв замыг олох арга зам юм. Өнөөдөр олон өвчнийг амжилттай эмчилдэг бол бусад хүмүүсийн хувьд генетикчид илүү ихийг санал болгож чадна үр дүнтэй арга замуудхүүхдийн амьдралын чанарыг эрс сайжруулдаг эмчилгээ. Мэдээжийн хэрэг, эмч нарын хараахан даван туулж чадахгүй байгаа эмгэгүүд байдаг, гэхдээ шинжлэх ухаан зогсохгүй, эмчилгээний шинэ аргууд өдөр бүр гарч ирдэг.
Миний практикт нэг маш энгийн тохиолдол байсан. 11 настай хүүхэд тархины саажилтын талаар мэдрэлийн эмчид хандсан. Хамаатан саднаа шалгаж, байцаахад өвчний удамшлын шинж чанарын талаар сэжиг төрж, энэ нь батлагдсан. Аз болоход энэ хүүхдийн хувьд илэрсэн өвчнийг энэ насанд ч эмчлэх боломжтой бөгөөд эмчилгээний тактикийг өөрчилснөөр хүүхдийн нөхцөл байдлыг мэдэгдэхүйц сайжруулах боломжтой болсон.
Одоогийн байдлаар удамшлын өвчлөлийн тоо, түүний илрэлийг нөхөн төлж болохуйц тоо байнга нэмэгдэж байна. Хамгийн сайн мэддэг жишээ бол фенилкетонури юм. Энэ нь хөгжлийн саатал, оюун ухааны хомсдол хэлбэрээр илэрдэг. Хэрэв фенилаланингүй хоолны дэглэмийг цаг тухайд нь зааж өгвөл хүүхэд бүрэн эрүүл өсч, 20 жилийн дараа хоолны дэглэмийн ноцтой байдлыг бууруулж болно. (Хэрэв та төрөх эмнэлэг, эмнэлгийн төвд хүүхэд төрүүлсэн бол таны хүүхэд амьдралын эхний өдрүүдэд фенилкетонури илрүүлэх шинжилгээнд хамрагдана).
Ийм өвчний тоо эрс нэмэгдсэн. Мөн лейциноз нь бодисын солилцооны өвчний бүлэгт багтдаг. Энэ өвчний үед эмчилгээг амьдралын эхний саруудад зааж өгөх ёстой (хоцрохгүй байх нь маш чухал), учир нь бодисын солилцооны эмгэгийн хортой бүтээгдэхүүн нь фенилкетонуриас илүү мэдрэлийн эдийг хурдан гэмтээдэг. Харамсалтай нь, хэрэв гурван сартайдаа өвчин илэрсэн бол түүний илрэлийг бүрэн нөхөх боломжгүй боловч хүүхдийн амьдралын чанарыг сайжруулах боломжтой болно. Мэдээж энэ өвчнийг урьдчилан сэргийлэх үзлэгт хамруулаасай гэж хүсч байна.
Мэдрэлийн эмгэгийн шалтгаан нь ихэвчлэн нэлээд олон төрлийн генетикийн гэмтэлүүд байдаг бөгөөд тэдгээр нь маш олон байдаг тул мэдэгдэж байгаа бүх өвчнийг цаг тухайд нь илрүүлэх скрининг хөтөлбөрийг бий болгох нь маш хэцүү байдаг.
Эдгээрт Помпын өвчин, Гроверын өвчин, Фелидбахерын өвчин, Ретийн синдром гэх мэт өвчин багтана.Өвчний хөнгөн явцтай олон тохиолдол байдаг.
Өвчний удамшлын мөн чанарыг ойлгох нь зөвхөн өвчнийг нөхөх төдийгүй эмгэгийн шалтгааныг эмчлэхэд чиглүүлэх боломжийг олгодог бөгөөд энэ нь олон тохиолдолд ноцтой амжилтанд хүрэх, тэр ч байтугай хүүхдийг эмчлэх боломжийг олгодог.
Ямар шинж тэмдгүүд нь өвчний генетик шинж чанарыг илтгэж болох вэ?
Юуны өмнө, энэ нь хүүхдийн хөгжлийн хоцрогдол, түүний дотор умай (зарим тооцоогоор 50-70%), миопати, аутизмыг эмчлэх боломжгүй юм. эпилепсийн уналт, дотоод эрхтний аливаа гажиг. Тархины саажилтын шалтгаан нь генетикийн эмгэг байж болно, ихэвчлэн ийм тохиолдолд эмч нар өвчний хэвийн бус явцын талаар ярьдаг. Хэрэв таны эмч генетикийн шинжилгээ хийлгэхийг зөвлөж байгаа бол үүнийг хойшлуулж болохгүй, энэ тохиолдолд цаг хугацаа маш үнэ цэнэтэй юм. Жирэмслэлтээс хоцорсон, дахин давтагдсан зулбалт, түүний дотор хамаатан садан нь генетикийн гажиг үүсэх магадлалыг илтгэнэ. Өвчин нь хэтэрхий оройтож, засч залруулах боломжгүй болсон үед маш их урам хугардаг.
Хэрэв өвчнийг эмчлэх боломжгүй бол эцэг эхчүүд энэ талаар мэдэх шаардлагатай юу?
Хүүхдийн өвчний генетик шинж чанарын талаархи мэдлэг нь энэ гэр бүлийн бусад өвчтэй хүүхдүүдийн дүр төрхөөс зайлсхийх боломжийг олгодог. Хэрэв хүүхдүүдийн аль нэг нь хөгжлийн гажигтай эсвэл ноцтой өвчтэй бол жирэмслэлтийг төлөвлөх үе шатанд генетикийн зөвлөгөө авах нь зүйтэй гэсэн гол шалтгаан нь энэ байж магадгүй юм. Орчин үеийн шинжлэх ухаан нь тохиолдох эрсдэлтэй өвчний талаар мэдээлэл байгаа бол төрөхийн өмнөх болон суулгацын генетикийн оношлогоог хийх боломжтой болгодог. Энэ үе шатанд бүх боломжит удамшлын өвчнийг нэн даруй шалгах боломжгүй юм. Аав, ээж хоёр нь ямар ч өвчний талаар сонсож байгаагүй эрүүл гэр бүл хүртэл удамшлын гажигтай хүүхдүүдийн дүр төрхөөс ангид байдаггүй. Рецессив генүүд хэдэн арван удамд дамждаг бөгөөд та хоёр дахь хагастайгаа уулзах болно (зураг харна уу).
Та үргэлж генетикчтэй зөвлөлдөх хэрэгтэй юу?
Хэрэв та эсвэл таны эмч сэжигтэй байгаа бол асуудал байгаа эсэхийг үндэслэн генетикийн шинжилгээ хийлгэх шаардлагатай. Шалгах шаардлагагүй эрүүл хүүхэдтохиолдолд. Олон хүмүүс жирэмсэн байх хугацаандаа бүх шинжилгээнд хамрагдаж, бүх зүйл сайхан байсан гэж ярьдаг, гэхдээ энд ... Энэ тохиолдолд скрининг шинжилгээ нь хамгийн түгээмэл генетикийн өвчлөлийг тодорхойлох (мөн маш үр дүнтэй) зорилготой гэдгийг ойлгох хэрэгтэй - Даун, Патау, Эдвардсийн өвчин, дээр дурдсан бие даасан генийн мутаци нь ийм үзлэгийн явцад илрээгүй.
Танай төвийн давуу тал юу вэ?
Генетикийн төв бүр өөрийн гэсэн мэргэшилтэй байдаг бөгөөд үүнд ажиллаж буй эмч нар мэргэшсэн байдаг. Жишээлбэл, би хүүхдийн мэдрэлийн эмч мэргэжилтэй. Жирэмсний асуудалд мэргэшсэн генетикчийг бид бас хардаг. Төлбөртэй төвийн давуу тал нь эмч өвчтөндөө илүү их цаг зарцуулах чадвар юм (хурал хоёр цаг үргэлжилдэг бөгөөд асуудлын шийдлийг хайх нь ихэвчлэн дараа ч үргэлжилдэг). Генетикчээс айх шаардлагагүй, тэр бол зүгээр л найдваргүй мэт өвчнийг эмчлэх боломжийг олгодог оношийг гаргаж чаддаг мэргэжилтэн юм.
“Ирээдүйн эцэг эхчүүдэд зориулсан эрүүл мэндийн сэтгүүл”, 2014 оны №3 (7)
Израильд генетик хурдацтай хөгжиж, удамшлын өвчнийг оношлох, эмчлэх дэвшилтэт аргууд гарч ирж байна. Мэргэшсэн судалгааны цар хүрээ байнга өргөжиж, лабораторийн бааз нэмэгдэж, эмнэлгийн ажилтнууд ур чадвараа дээшлүүлж байна. Оношийг аль болох эрт хийж, удамшлын эмгэгийн цогц эмчилгээг эхлэх чадвар нь Израильд хүүхдүүдэд зориулсан эмчилгээг хамгийн алдартай, үр дүнтэй болгодог.
Генетик өвчний оношлогоо
Удамшлын өвчний эмчилгээ нь радикал, хөнгөвчлөх боломжтой боловч эхлээд үнэн зөв онош тавих ёстой. Хамгийн сүүлийн үеийн техникийг ашигласны ачаар Тель-Авивын мэргэжилтнүүд эмнэлгийн төвСоураскийн нэрэмжит (Ичиловын клиник) оношилгоог амжилттай хийж, үнэн зөв онош тавьж, цаашдын эмчилгээний төлөвлөгөөний талаар иж бүрэн зөвлөмж өгдөг.
Хэрэв радикал хөндлөнгийн оролцоо боломжгүй бол эмч нарын хүчин чармайлт нь жижиг өвчтөний амьдралын чанарыг сайжруулахад чиглэгддэг гэдгийг ойлгох хэрэгтэй. нийгмийн дасан зохицох, амин чухал үйл ажиллагааг сэргээх, гадны согогийг засах гэх мэт. Шинж тэмдгийг арилгах, цаашдын үйл ажиллагааны зураглалыг гаргах, эрүүл мэндийн дараагийн өөрчлөлтийг урьдчилан таамаглах - энэ бүхэн оношлогдсоны дараа боломжтой юм. үнэн зөв оношлох. Та цаг алдалгүй үзлэгт хамрагдаж, Ичиловын эмнэлэгт генетикийн эмгэг байгаа эсэхийг баталгаажуулах боломжтой бөгөөд үүний дараа өвчтөнд илэрсэн өвчний цогц эмчилгээг зааж өгнө.
Sourasky төв нь зөвхөн хүүхдүүдэд төдийгүй ирээдүйн эцэг эх, жирэмсэн эмэгтэйчүүдэд зориулсан шинжилгээ, шинжилгээг санал болгодог. Ийм судалгааг хувийн болон гэр бүлийн нарийн төвөгтэй түүхтэй хүмүүст онцгойлон зааж өгдөг. Судалгаагаар эрүүл хүүхэд төрөх магадлалыг харуулах бөгөөд үүний дараа эмч цаашдын эмчилгээний арга хэмжээг тодорхойлно. Хамгийн сүүлийн үеийн технологийг ашиглан удамшлын эмгэгийг хүүхдэд дамжуулах аюулыг аль болох нарийвчлалтай тогтоодог.
Удамшлын эмгэгтэй хүүхдүүд, удамшлын эмгэгтэй хүүхэд төрүүлэх гэж буй хосуудад анамнез цуглуулах, оношлох үе шатанд нарийн төвөгтэй эмчилгээг зааж өгсөн байдаг.
Ичилов дахь хүүхдийн генетикийн оношлогоо
Нярайн 6 хүртэлх хувь нь удамшлын хөгжлийн гажигтай байдаг бол зарим хүүхдүүдэд генетикийн эмгэгийн шинж тэмдэг хожуу илэрдэг. Заримдаа хүүхдэд аюултай нөхцөл байдлаас зайлсхийхийн тулд эцэг эхчүүд одоо байгаа аюулын талаар мэдэхэд хангалттай байдаг. Израилийн тэргүүлэх мэргэжилтнүүдтэй генетикийн зөвлөгөө өгөх нь эмгэгийг эрт үе шатанд илрүүлж, эмчилгээг цаг тухайд нь эхлүүлэхэд тусалдаг.
Үүнд хүүхдийн дараахь өвчин орно.
- гажиг эсвэл олон тооны гажиг, гажиг (мэдрэлийн хоолойн гажиг, сэтэрхий уруул, зүрхний гажиг);
- сэтгэцийн хомсдол, тухайлбал, аутизм, үл мэдэгдэх гарал үүслийн бусад хөгжлийн бэрхшээл, хүүхдийн сурах хоцрогдол;
- бүтцийн төрөлхийн гажигтархи;
- мэдрэхүйн болон бодисын солилцооны эмгэг;
- удамшлын эмгэг, оношлогдсон, үл мэдэгдэх;
- хромосомын эмгэг.
дунд төрөлхийн өвчинТэд үеэс үед дамждаг тодорхой генийн мутацийг тусгаарладаг. Үүнд талассеми, цистик фиброз, миопатийн зарим хэлбэрүүд орно. Бусад тохиолдолд удамшлын эмгэг нь хромосомын тоо, бүтцийн өөрчлөлтөөс үүдэлтэй байдаг. Ийм мутаци нь эцэг эхийн аль нэгээс хүүхэд өвлөн авах эсвэл үе шатанд аяндаа үүсдэг. умайн доторх хөгжил. Хромосомын эмгэгийн тод жишээ бол Дауны өвчин эсвэл ретинобластома юм.
Ичиловын нэрэмжит эмнэлгийн төвд хүүхдийн удамшлын эмгэгийг эрт оношлоход ашигладаг янз бүрийн аргалабораторийн судалгаа:
- ургийн дотоод хөгжлийн үе шатанд ДНХ-ийн хазайлтыг тогтоох боломжийг олгодог молекул;
- цитогенетик, янз бүрийн эдэд хромосомыг шалгадаг;
- бие махбод дахь бодисын солилцооны эмгэгийг тодорхойлдог биохимийн;
- Эмнэлзүйн шинж чанар нь үүссэн шалтгааныг тогтоох, эмчилгээ, урьдчилан сэргийлэхэд тусалдаг.
Эмч нарын даалгавар бол нарийн төвөгтэй эмчилгээг томилж, генетикийн өвчний явцыг хянахаас гадна ирээдүйд өвчин үүсэхийг урьдчилан таамаглах явдал юм.
Хүүхдэд генетикийн өвчний эмчилгээ
Израиль дахь хүүхдүүдийн эмчилгээ нь бүхэл бүтэн үйл ажиллагаанаас бүрддэг. Юуны өмнө анхан шатны оношийг батлах эсвэл тогтоохын тулд лабораторийн шинжилгээ хийдэг. Эцэг эхчүүдэд генетикийн мутацийг тодорхойлох технологийн хөгжлийн хамгийн шинэлэг аргуудыг санал болгоно.
Шинжлэх ухаан одоогоор нийтдээ 600 генетикийн эмгэгийг мэддэг тул хүүхдийг цаг тухайд нь илрүүлэх нь өвчнийг тодорхойлж, зохих эмчилгээг эхлэх боломжийг олгоно. Генетикийн шинжилгээнярай хүүхэд бол эмэгтэйчүүд Ичиловын клиникт (Сураски) төрөхийг илүүд үздэг шалтгаануудын нэг юм.
Сүүлийн үед удамшлын өвчнийг эмчлэх нь дэмий ажил гэж үздэг байсан тул удамшлын өвчнийг цаазаар авах ял гэж үздэг байв. Одоогийн байдлаар мэдэгдэхүйц ахиц дэвшил гарч, шинжлэх ухаан зогсохгүй байгаа бөгөөд Израилийн генетикчид хүүхдийн хөгжилд ийм хазайлтыг эмчлэх хамгийн сүүлийн үеийн эмчилгээний горимыг санал болгож байна.
Генетик өвчин нь маш олон төрлийн шинж чанартай байдаг тул эмчилгээг өвчтөний клиник илрэл, бие даасан үзүүлэлтүүдийг харгалзан үздэг. Ихэнх тохиолдолд хэвтүүлэн эмчлэхийг илүүд үздэг. Эмч нар жижиг өвчтөнд хамгийн өргөн хүрээтэй үзлэг хийх боломжтой байх ёстой эмийн дэглэм, хэрэв заасан бол мэс засал хийх.
Гормоны болон дархлааны эмчилгээг зөв сонгохын тулд өвчтөнд иж бүрэн үзлэг хийж, сайтар хянах шаардлагатай. Эмчилгээний томилгооны цаг нь мөн хувь хүн бөгөөд хүүхдийн нөхцөл байдал, наснаас хамаарна. Зарим тохиолдолд эцэг эх нь цаашдын үйл ажиллагаа, өвчтөнийг хянах нарийвчилсан төлөвлөгөөг авдаг. Хүүхдийг сонгосон эмөвчний шинж тэмдгийг арилгах, хоолны дэглэм, физик эмчилгээ хийх.
Соураскийн төвийн эмчилгээний үйл явцын үндсэн чиглэлүүд
Хүүхдэд удамшлын эмгэгийг эмчлэх нь нарийн төвөгтэй, урт процесс юм. Заримдаа ийм өвчнийг бүрэн эмчлэх боломжгүй байдаг ч эмчилгээг үндсэн гурван чиглэлээр явуулдаг.
- Этиологийн арга нь эрүүл мэндийн асуудлын шалтгааныг арилгахад чиглэсэн хамгийн үр дүнтэй арга юм. Генийн залруулга хийх хамгийн шинэ арга нь ДНХ-ийн гэмтсэн хэсгийг тусгаарлаж, клончлох, эрүүл бүрэлдэхүүн хэсгийг анхны газарт нь оруулах явдал юм. Энэ бол удамшлын эрүүл мэндийн асуудалтай тэмцэх хамгийн ирээдүйтэй, шинэлэг арга юм. Өнөөдөр даалгавар нь маш хэцүү гэж тооцогддог боловч хэд хэдэн заалтад аль хэдийн ашиглагдаж байна.
- Эмгэг төрүүлэх арга нь нөлөөлдөг дотоод үйл явцбиед тохиолддог. Энэ тохиолдолд эмгэгийн геном нөлөөлж, өвчтөний физиологи, биохимийн төлөвийг бүх боломжит аргаар тохируулдаг.
- Нөлөөллийн шинж тэмдгийн арга нь өвдөлт, сөрөг нөхцөл байдлыг арилгах, саад тотгорыг бий болгоход чиглэгддэг. Цаашдын хөгжилөвчин. Энэ чиглэлийг бие даан эсвэл бусад төрлийн эмчилгээтэй хослуулан хэрэглэдэг боловч генийн эмгэг илэрсэн тохиолдолд үүнийг үргэлж зааж өгдөг. Эм зүй нь өвчний илрэлийг хөнгөвчлөх олон төрлийн эмийн эмийг санал болгодог. Эдгээр нь таталтын эсрэг, өвдөлт намдаах, тайвшруулах эм болон бусад эмүүд бөгөөд зөвхөн эмчийн зааврын дагуу хүүхдэд өгөх ёстой.
- Заримдаа хүүхдийн биеийн гаднах гажиг, дотоод гажиг засах мэс заслын арга шаардлагатай байдаг. Мэс заслын үйл ажиллагааны заалтыг маш болгоомжтой зааж өгдөг. Заримдаа жижиг өвчтөнийг мэс засалд бэлтгэхийн тулд урт хугацааны урьдчилсан үзлэг, эмчилгээ шаардлагатай байдаг.
Израилийн хүүхдүүдийн эмчилгээний эерэг жишээ болгон бид нийтлэг генетикийн өвчин болох аутизмын статистикийг дурдаж болно. Ичилов-Сураскигийн эмнэлэгт эрт илрүүлэхгажиг (амьдралын зургаан сараас) ийм хүүхдүүдийн 47% нь ирээдүйд хэвийн хөгжих боломжийг олгосон. Эмч нар үзлэгт хамрагдсан үлдсэн хүүхдүүдэд илэрсэн эмгэг нь ач холбогдолгүй, эмчилгээний оролцоо шаарддаггүй гэж үзсэн.
Эцэг эхчүүдэд түгшүүрийн шинж тэмдэг илэрвэл эсвэл хүүхдийн эрүүл мэндэд илт хазайлт илэрвэл сандрахгүй байхыг зөвлөж байна. Эмнэлэгтэй аль болох хурдан холбоо барьж, цаашдын үйл ажиллагааны талаар зөвлөмж, иж бүрэн зөвлөгөө авахыг хичээ.
Нүүр хуудас" Төрсний дараах үе » Генетик өвчний эмчилгээ. Генийн эмчилгээ: удамшлын өвчнийг хэрхэн эмчлэх вэ Удамшлын өвчнийг эмчлэх боломжтой юу?